曼尼希碱缓蚀剂的合成及其缓蚀效果
2023-08-20王紫旋艾俊哲
王紫旋,池 伸,柳 杰,高 强,艾俊哲
(长江大学化学与环境工程学院,荆州 434023)
石油是我国最重要的能源之一,油气田酸化压裂增产技术是提高油气产量的常用技术,但注入的酸液会腐蚀设备、管线、储罐等[1-4],这不但会增加经济成本,影响生产效率,甚至会对管线周围的生态环境造成严重的破坏与污染[5-8]。酸化缓蚀剂是解决酸液腐蚀最有效的方法之一,具有效果好、用量少、成本低、适用范围广等优点[9-11]。目前,我国主要使用的缓蚀剂有季铵盐、咪唑啉、席夫碱、曼尼希碱等,其中曼尼希碱类缓蚀剂性能优良,在酸化作业中被广泛使用[12-14]。近年来,国内外针对曼尼希碱酸化缓蚀剂的研究多集中在缓蚀性能方面,对缓蚀机理的关注较少[15-16]。量子化学和分子动力学(MD)模拟已逐渐应用于研究分子结构与缓蚀性能之间的关系,并成为探索缓蚀机理的重要方法[17]。专业缓蚀剂的开发需要明确其作用机制,因此对酸液缓蚀剂缓蚀机理的深入探讨显得尤为重要[18]。
笔者以甲醛、苄叉丙酮、对甲基苯胺为原材料,合成了曼尼希碱缓蚀剂,采用正交试验优化了制备条件,确定了曼尼希碱缓蚀剂的最佳配方。采用电化学测试、扫描电镜(SEM)、原子力显微镜(AFM)、分子动力学模拟等方法,探究了缓蚀剂的缓蚀行为及其在碳钢表面的吸附行为,以期为高效缓蚀剂的研究提供理论指导,并提高酸化作业的系统安全性。
1 试验
1.1 试验材料
试验所用试剂包括甲醛、苄叉丙酮、对甲基苯胺、蒸馏水、37%(质量分数)浓盐酸、无水乙醇、丙酮。
采用有机合成法,以甲醛、苄叉丙酮、对甲基苯胺为原料,制备了曼尼希碱缓蚀剂(以下简称MHX),其反应过程见图1。

图1 MHX反应过程
采用正交试验法对缓蚀剂MHX的制备条件进行优化,设置反应温度(因素A)、反应时间(因素B)、反应pH(因素C)以及反应物醛:酮:胺的摩尔比(因素D)为正交试验因素,使用腐蚀速率作为评价标准,采用4因素3水平正交表[19],因素水平表见表1。

表1 正交试验因素水平
1.2 试验方法
1.2.1 失重法
基体材料为N80钢片,其化学成分见表2。采用静态失重法,在90 ℃条件下,对N80钢试片在添加1%MHX的20%(质量分数)HCl溶液中的腐蚀速率和缓蚀剂的缓蚀率进行分析。

表2 N80钢片的化学成分
1.2.2 电化学试验
在上海晨华CHI660C电化学工作站进行极化曲线和电化学阻抗谱(EIS)测试。采用三电极体系,饱和甘汞电极为参比电极(RE),铂电极为辅助电极(CE),环氧树脂密封的N80钢(工作面积1 cm2)为工作电极(WE),腐蚀介质为添加不同量( 0,0.5%、1%)缓蚀剂的常温20%HCl溶液。极化曲线的扫描范围为-0.2~0.2 V,扫描速率为5 mV·s-1,电化学阻抗谱测量频率范围为0.1~100.0 kHz,交流激励信号幅值为5 mV。
1.2.3 扫描电镜及能谱分析
采用Quanta 200型扫描式电子显微镜(SEM),对在90 ℃下添加不同量( 0,0.5%,1%)缓蚀剂的20%HCl溶液中腐蚀前后的N80钢片的表面形貌进行观察,工作电压为10 kV,放大倍数为500倍;采用配套的能谱仪(EDS)对缓蚀前后试样表面的元素分布进行分析。
1.2.4 原子力学显微图像扫描分析
采用auniontech NT-MDT型原子力显微镜(AFM),分析N80钢在添加和未添加缓蚀剂的20%HCl溶液中腐蚀前后的表面形貌及表面粗糙度。
1.2.5 分子动力学模拟
为了进一步研究MHX的缓蚀机理,采用量子化学方法对其进行活性分析。在分析化学吸附的螯合过程中,最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)是研究重点。EHOMO表示分子提供电子的能力,EHOMO越大,分子越容易把电子传送至轨道较低或有空轨道的分子;ELUMO表示分子接受电子的能力,ELUMO越小,电子进入该轨道后体系需要降低的能量越多[20]。
采用Accelrys有限公司开发的MaterialsStudio 2017程序包中的Visualizer可视化模块,构建酸化缓蚀剂分子的初始结构模型,然后用Dmol3模块计算缓蚀剂分子的前线轨道。通过使用Forcite模块,优化吸附模型的几何结构,使吸附模型保持在能量最低的状态。在模拟过程中,利用COMPASS力场对体系进行优化,再通过Discover模块实现正则系统( NVT)的MD模拟。缓蚀剂分子在金属表面的吸附能(Eadsorption)的计算公式见式(1)。
Eadsorption=Etotal-(Emolecule+Esurface)
(1)
式中:Eadsorption为吸附能;Etotal为自由分子总能量;Emolecule为未吸附分子的晶束表面能量;Esurface为金属表面体系和分子的总能量。
2 结果与讨论
2.1 缓蚀剂的合成优化与腐蚀质量损失
由表3可见:4种因素对缓蚀率的影响大小顺序依次为反应温度、反应时间、反应pH、反应物摩尔比。依据k的大小,确定了制备缓蚀剂的最佳试验条件为A2B2C2D3,即反应温度为90 ℃、反应时间为8 h、反应pH为2、摩尔比为1…1…1.5。在此条件下制备缓蚀剂,试验后N80钢的腐蚀速率为2.6 g·m-2·h-1,缓蚀率为99.63%。

表3 MHX制备的正交试验结果
2.2 电化学测试
2.2.1 极化曲线
由图2 和表4可见:腐蚀电流密度(Jcorr)随着缓蚀剂浓度的增加而减小,MHX对腐蚀的抑制效果明显[21];随着MHX浓度的增加,阳极和阴极极化曲线的Tafel斜率增大,说明MHX能有效抑制阳极和阴极过程,且对阳极过程的抑制作用更加明显。因此,MHX是一种主要抑制阳极过程的混合型缓蚀剂。

表4 极化曲线的拟合参数

图2 N80钢片在添加不同量MHX的20%HCl溶液中的极化曲线
2.2.2 电化学阻抗谱
图3为N80钢片在添加不同量MHX的20%HCl溶液中的电化学阻抗谱,其等效电路[22][R(QR)]如图4所示。其中:Rs为溶液电阻;CPEdl为常相位角元件;Rct为电荷转移电阻。用ZsimpWin软件对阻抗谱进行数据模拟,相关参数见表5。

表5 N80钢片在添加不同量MHX的20%HCl溶液中电化学阻抗谱的拟合参数
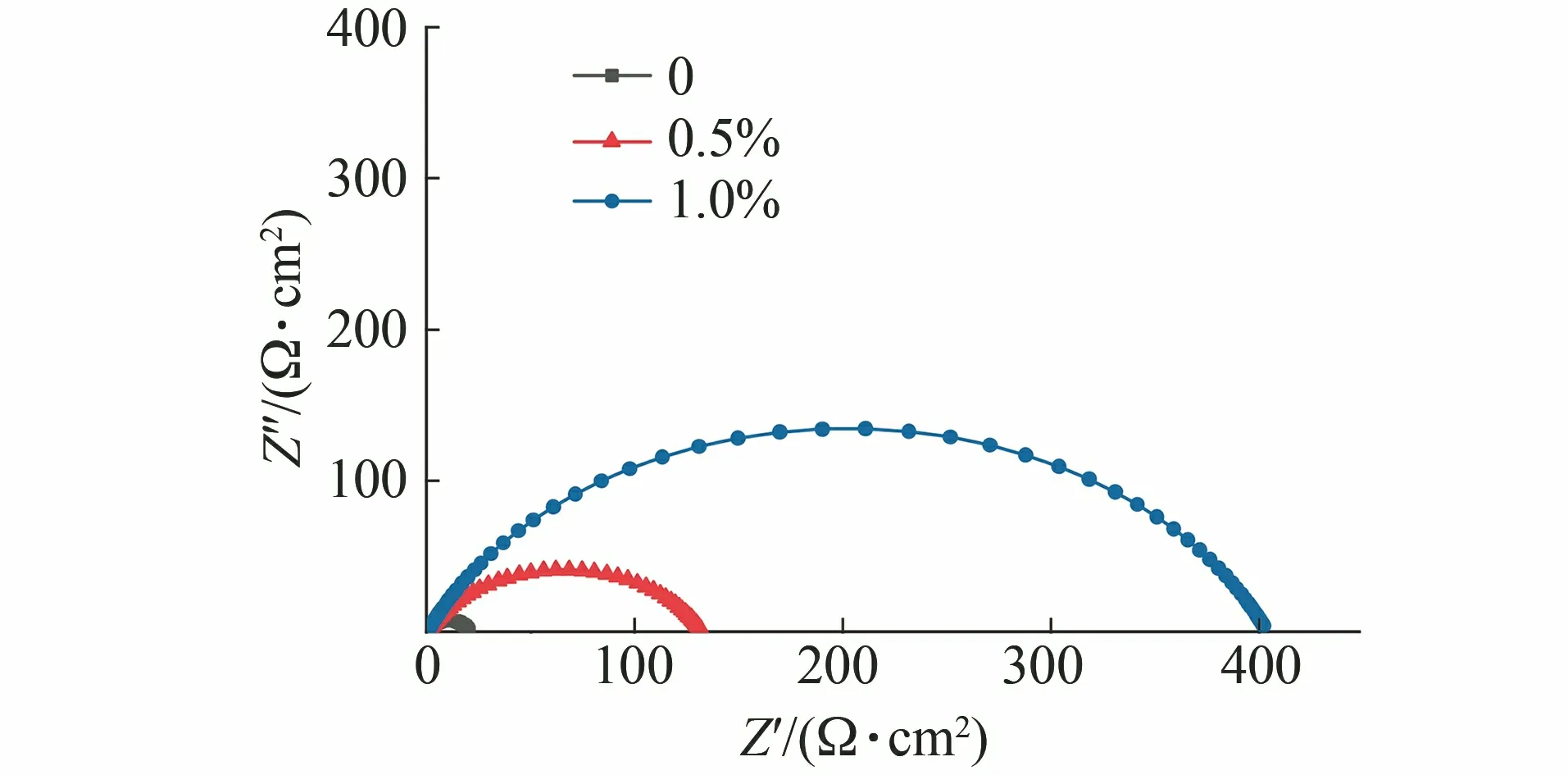
图3 N80钢片在添加不同量MHX的20%HCl溶液中的电化学阻抗谱

图4 N80钢片在添加不同量MHX的20%HCl溶液中电化学阻抗谱的等效电路
由图3和表5可见:随着缓蚀剂添加量的增大,容抗弧的半径相应增大,但溶液电阻Rs在添加缓蚀剂前后的变化不大,说明MHX的添加没有改变HCl溶液的性质;随着MHX添加量的增大,CPEdl值逐渐下降,表明在N80钢片表面,缓蚀剂分子会代替介电常数高的水分子,电荷转移电阻Rct逐渐增大说明电荷传递的阻力持续增大,随着缓蚀剂添加量的增加,Rct增大,电极的反应变得困难,即缓蚀率提高。
2.3 腐蚀产物形貌
2.3.1 SEM-EDS分析
由图5可见:未腐蚀的N80钢片表面较为平整,有打磨过的痕迹;在未添加缓蚀剂的情况下,N80钢片在HCl溶液中腐蚀后,其表面发生全面腐蚀,部分区域出现孔蚀,N80钢片原始表面形貌不复存在,说明N80钢片在未添加缓蚀剂的酸性溶液中发生了严重腐蚀;在添加缓蚀剂MHX后,钢片表面未发现明显腐蚀痕迹,且可见打磨痕迹,说明N80钢片表面形成了一层致密、均匀的吸附膜,阻止了酸液与N80钢片的接触,且缓蚀剂的疏水基团可以有效阻碍腐蚀介质在吸附层中的扩散,更好地起到缓蚀作用。

图5 N80钢片在未添加和添加缓蚀剂的20%HCl溶液中腐蚀前后的表面形貌
由表6可见:未腐蚀的N80钢片表面Fe、C元素含量很高,碳钢基体只含有微量的O、N等元素;在未添加缓蚀剂的情况下,N80钢片在HCl溶液中腐蚀后,其表面Fe含量从98.76%大幅下降到89.24 %,说明酸液与N80钢表面的Fe剧烈反应,大量Fe元素发生溶解;在添加缓蚀剂MHX的情况下腐蚀后,N80钢片表面Fe含量略有下降,说明缓蚀剂对N80钢片起到保护作用,有效抑制了Fe的腐蚀。由于缓蚀剂中存在C、N、O等元素,故扫描结果中C、N、O元素含量与未腐蚀的N80钢相比有所上升,说明缓蚀剂已在N80钢表面吸附成膜,能抑制金属的腐蚀。

表6 N80钢片在未添加和添加缓蚀剂的20%HCl溶液中腐蚀前后表面元素的EDS分析结果
2.3.2 原子力显微镜分析
由图6可见:与未腐蚀的N80钢片相比,在未添加缓蚀剂的盐酸溶液中浸泡后,钢片表面腐蚀严重,微观形貌呈现凹凸不平;当缓蚀剂添加量为1%时,可以明显观察到缓蚀剂附着在钢片表面,且缓蚀剂吸附膜十分致密。由表7可见:与未腐蚀的N80钢片相比,在未添加缓蚀剂的盐酸溶液中腐蚀后,钢片表面粗糙度显著增大;加入缓蚀剂后,钢片表面粗糙度明显下降,但仍明显比未腐蚀钢片的粗糙度大,说明缓蚀剂吸附在钢片表面,形成致密的保护膜隔绝了腐蚀介质,从而达到抑制腐蚀的作用。

表7 不同条件下N80钢的表面粗糙度
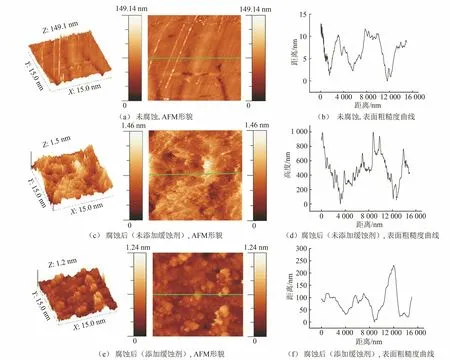
图6 N80钢片在未添加和添加缓蚀剂的20%HCl溶液中腐蚀前后的AFM形貌及表面粗糙度曲线
2.4 分子动力学模拟
2.4.1 量子化学计算
由图7可见,缓蚀剂MHX中的N原子存在孤电子对,具有强供电子能力,由于亚氨基的诱导效应,使苯环与其上的取代氨基形成推电子共轭效应,所以MHX的HOMO主要分布在N原子以及相连的苯环上;缓蚀剂MHX的LOMO主要分布在杂环上的-C=O-以及与之相连的亚甲基上。

图7 优化后MHX的分子结构
EHOMO和ELUMO两个指标并不能全面地反映缓蚀剂的反应活性,还需要通过对全局活性ΔE来综合考虑其得失电子的能力。ΔE表示HOMO和LOMO间的能隙,间隙越近,电子在能级的跃迁就越容易。ΔE越小,表明分子的反应活性越高,即缓蚀剂分子的吸附能力越强。经计算,缓蚀剂MHX的EHOMO为-4.104 eV,ELOMO为-2.709 eV,ΔE为1.395 eV。由此可见,缓蚀剂MHX的ΔE比较低,因此更易于进行反应。
2.4.2 分子动力学模拟
Fe晶体属于立方结构,其晶格常数a为0.286 6 nm,使用MS Morphology模块对吸附位面进行计算,得到Fe(110)面的能量较低,晶面较稳定,故选择Fe(110)面为吸附表面。模拟MHX分子在Fe(110)表面上的吸附过程,得到MHX分子在Fe(110)表面的平衡吸附模型,如图8所示。

图8 MHX分子的吸附模型
吸附能用来表示吸附物质与被吸附表面之间的结合强度。当吸附能为负时,说明吸附过程可以自发进行;吸附能的绝对值越大,物质与表面的结合强度越高,其吸附模型越稳定[23]。经计算,MHX分子的Eadsorption为-7.59 eV,H2O分子的Eadsorption为-0.21 eV。由此可知,MHX与H2O分子在真空环境中的吸附能都是负值,表明两者都可以自发地吸附在Fe(110)表面,但MHX和Fe(110)的吸附能绝对值比H2O分子要大得多,说明MHX分子可以取代H2O分子吸附在金属表面,从而更好地抑制金属腐蚀。
2.5 缓蚀机理
综合上述研究结果,在HCl溶液中,MHX分子可在金属表面吸附成膜,吸附中心主要为苯环、O原子与N原子。首先,缓蚀剂分子中的N、O原子提供孤对电子,而金属Fe原子含有空的3D轨道,他们相互结合形成较为牢固的化学键。其次,分子中未成键的N、O原子、含大π键的苯环和Fe原子通过配位等发生强烈的螯合作用,且该缓蚀剂分子的HOMO和LOMO间的能隙较小(仅为1.395 eV),吸附能力强,吸附强度大(吸附能高达-7.59 eV),可在金属表面形成了一层致密且保护作用很强的吸附膜。再者,缓蚀剂分子中的苯环和长链烷基具有较强的空间位阻效应和疏水性,使吸附膜的厚度、致密度得到提高,缓蚀能力进一步增强。另外,电化学测试结果表明,MHX抑制了碳钢腐蚀的阴、阳极过程,且对阳极过程的抑制作用更加显著,故其是一种以抑制阳极为主的混合型缓蚀剂。
因此,MHX缓蚀剂在酸液中主要通过化学吸附和螯合作用,在碳钢表面形成牢固、致密和疏水性强的缓蚀剂吸附膜层,隔离金属与腐蚀介质的接触,从而抑制腐蚀的阳极过程,进而达到有效的缓蚀效果。
3 结论
(1) 以甲醛、苄叉丙酮、对甲基苯胺为原材料,合成了曼尼希碱缓蚀剂,并采用正交试验优化了制备条件。当MHX添加量为1%时,N80钢片在90 ℃、20%HCl溶液中的腐蚀速率降为2.6 g·m-2·h-1,缓蚀率达99.63%。
(2) MHX缓蚀剂是一种阳极型缓蚀剂,添加缓蚀剂后,腐蚀电流密度明显降低,电荷转移电阻明显增大,MHX缓蚀剂能有效抑制N80钢片在HCl溶液中的腐蚀。
(3) 添加MHX缓蚀剂后,N80钢片表面没有明显腐蚀痕迹,粗糙度明显降低,达到93.81 nm,缓蚀剂在N80钢片表面形成了一层致密的保护膜。
(4) MHX缓蚀剂分子前线轨道的能差(1.395 eV)比较小,因而反应活性比较高,容易发生反应,且其吸附能(-7.59 eV)较高,MHX分子可以有效取代H2O分子吸附在金属表面,隔离金属与腐蚀介质的接触,从而起到缓蚀作用。
