氧化应激环境下LncRNA MALAT1 对内皮细胞TLR4/MyD88/NF-κB 信号通路的影响
2023-08-18纪海涛赵颖馨于锡巧柴强刘振东张丛丛
纪海涛,赵颖馨,于锡巧,柴强,刘振东,张丛丛
随着老龄化加重,动脉粥样硬化(atherosclerosis,AS)的发病率逐年升高,其病变部位主要是血管壁[1]。血管内壁是由内皮细胞组成的,而内皮细胞在机体器官中广泛分布[2];此外,其还可以充当血管壁的调剂器,释放血管活性物质,调节血管的舒张与收缩[3]。AS的主要病因是内皮细胞对氧化低密度脂蛋白胆固醇(oxidized low density lipoprotein,ox-LDL)的调控失衡[4],而ox-LDL是氧化应激刺激低密度脂蛋白产生的,所以氧化应激是引发AS的重要因素。研究表明,Toll样受体4(Toll-like receptor 4,TLR4)与AS的发生有关[5-6]。TLR4主要分布在内皮细胞表面,其被激活后可与髓样分化因子88(myeloid differentiation factor 88,MyD88)结合,从而激活MyD88依赖的信号通路,进而促进核因子κB(nuclear factor-kappa B,NF-κB)的活化及促炎因子的释放[7]。
近年来长链非编码RNA(long chain non-coding RNA,LncRNA)持续受到学者们的关注,而长链非编码RNA肺腺癌转移相关转录物1(long chain non-coding RNA metastasis-associated lung adenocarcinoma tran 1,LncRNA MALAT1)作为LncRNA家族的一员,在细胞核中表达,具有高度保守性[8]。研究发现,LncRNA MALAT1在血管疾病中发挥作用,可以促进血管生成[9],并且可以保护发生氧化损伤的内皮细胞[10]。但目前LncRNA MALAT1与TLR4/MyD88/NF-κB信号通路的关系尚不清楚。为此,本研究使用过氧化氢(hydrogen peroxide,H2O2)诱导氧化应激细胞模型,然后探究氧化应激环境下LncRNA MALAT1对内皮细胞TLR4/MyD88/NF-κB信号通路的影响,以期为研究氧化应激导致AS等心血管疾病的机制提供依据。
1 材料与方法
1.1 实验时间 本实验时间为2022年10—12月。
1.2 实验材料 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)由山东省医学科学院提供;LncRNA MALAT1的小干扰RNA(small interfering RNA,siRNA)购自上海吉码制药技术有限公司:TLR4抗体购自美国Abcam公司;MyD88抗体、NF-κB抗体购自美国Cell Signaling Technology公司;Actin、LncRNA MALAT1、TLR4、MyD88、NF-κB的引物购自铂尚生物技术(上海)有限公司;反转录试剂盒和q-PCR试剂盒购自苏州近岸蛋白质科技股份有限公司;蛋白凝胶购自武汉博士德生物工程有限公司;CCK-8试剂购自MCE公司。
1.3 实验方法
1.3.1 细胞培养 将HUVEC置于含5%胎牛血清、1%青霉素和链霉素的低糖DMEM培养液中,在37 ℃、5% CO2培养箱中培养2~3 d,待细胞贴壁且在培养皿中的覆盖率达80%左右时进行实验分组与处理。
1.3.2 H2O2诱导氧化应激细胞模型的最佳干预时间将HUVEC悬液接种在96孔板中(100 μl/孔),将培养板放在培养箱中预培养6~8 h,将其分为A、B、C、D组,分别使用600 μmol/L的H2O2处理0、6、8、10 h,随后采用CCK-8法测定细胞活性,具体方法为:用PBS清洗掉残留的培养液和H2O2,再向每孔加入10 μl CCK-8试剂与90 μl低糖DMEM培养液,将培养板置于培养箱内孵育1~4 h,采用酶标仪测定450 nm处的吸光度。以细胞活性为60%时的时间作为本实验的最佳干预时间,实验独立重复3次。
1.3.3 q-PCR检测LncRNA MALAT1表达水平 将密度为30×104/ml的HUVEC均匀接种至6孔板中,每孔加入2 ml,培养12 h,将其分为对照组(不做任何处理)、H2O2组(使用600 μmol/L的H2O2处理8 h以构建氧化应激细胞模型),采用q-PCR检测LncRNA MALAT1表达水平,具体方法为:弃去培养基,用PBS清洗1遍,加入500 μl的Trizol以提取细胞中的总RNA,将总RNA吸出并移至EP管,加入200 μl双重去离子水(double distilled water,ddH2O),放入常温离心机进行离心,条件为6 720 r/min、15 min(离心半径为6 cm);吸出上层清液(300~500 μl),加入等量异丙醇后再次离心,条件为6 720 r/min、10 min(离心半径为6 cm);弃去液体,用75%乙醇溶液清洗,再次离心,条件为4 480 r/min、3 min(离心半径为6 cm);弃去乙醇溶液后,加入ddH2O以溶解沉淀的LncRNA MALAT1。按照50 ℃ 15 min,75 ℃ 5 min的条件对提取出的LncRNA MALAT1进行反转录。以Actin为内参,使用PCR试剂盒对Actin、LncRNA MALAT1进行PCR扩增,加入0.4 μl上/下游引物、2.0 μl cDNA、10.0 μl PCR试剂,用ddH2O将总反应体系补齐到20.0 μl。PCR反应条件:94 ℃ 90 s,94 ℃ 20 s,57 ℃ 20 s,共30个循环;72 ℃ 5 min。Actin的上游引物序列为5'-GAAGAGCTACGAGCTGCCTGA-3',下游引物序列为5'-CAGACAGCACTGTGTTGGCG-3';Lnc RNA MALAT1 的上游引物序列为5'-GGATTCCAGGAAGGAGCGAG-3',下游引物序列为5'-ATTGCCGACCTCACGGATTT-3'。根据公式(ΔCt=Ct目的基因-Ct内参基因)计算LncRNA MALAT1表达水平。实验独立重复3次。
1.3.4 Western blot法检测TLR4、MyD88、NF-κB表达水平 将密度为30×104/ml的HUVEC均匀接种至6孔板中,每孔加入2 ml,培养12 h,将其分为对照组(不做任何处理)、H2O2组(使用600 μmol/L的H2O2处理8 h以构建氧化应激细胞模型)、H2O2+siRNA组(转染LncRNA MALAT1的siRNA后使用600 μmol/L的H2O2处理8 h以构建氧化应激细胞模型),采用Western blot法检测TLR4、MyD88、NF-κB表达水平,具体方法为:弃去培养基,用PBS清洗1遍,加入200~300 μl RIPA裂解液和蛋白酶抑制剂的混合液(1∶100),于冰上孵育5~10 min,用刮刀将细胞刮离六孔板并转移至EP管内,每个样本进行超声破碎3次,5 s/次;将其转移到4 ℃的离心机中,12 000 r/min离心15 min(离心半径为6 cm);用移液枪吸取上清液,采用BCA法测量蛋白浓度,加入5×Buffer(与提取蛋白样本量的比例为1∶4),置于干式恒温器煮蛋白(100 ℃ 10 min);添加10~15 μl的样品并将其置于蛋白凝胶中电泳1 h,电压保持在80 V;将蛋白转移到PVDF膜,转模方式为湿转,时间1 h,电压保持在100 V;将含有蛋白的PVDF膜用5%脱脂奶粉封闭90 min;用1×TBST清洗3次,5 min/次;加入TLR4、MyD88、NF-κB抗体(稀释比例分别为1∶500、1∶1 000、1∶1 000),于4 ℃孵育6~8 h;于室温下用1×TBST清洗3次,5 min/次;用相应种属二抗孵育1 h(稀释比例为1∶5 000),用1×TBST清洗3次,5 min/次;进行蛋白显影,分析目标蛋白表达水平。实验独立重复3次。
1.3.5 q-PCR检测TLR4、MyD88、NF-κB mRNA表达水平 将密度为30×104/ml的HUVEC均匀接种至6孔板中,每孔加入2 ml,培养12 h,将其分为对照组(不做任何处理)、H2O2组(使用600μmol/L的H2O2处理8 h以构建氧化应激细胞模型)、H2O2+siRNA组(转染LncRNA MALAT1的siRNA后使用600 μmol/L的H2O2处理8 h以构建氧化应激细胞模型),采用q-PCR检测TLR4、MyD88、NF-κB mRNA表达水平,方法同1.3.3。TLR4的上游引物序列为5'-TGGATCAAGGACCAGAGGCA-3',下游引物序列为5'-GAGGACCGACACACCAATGA-3';MyD88的上游引物序列为5'-AAGCGACTGATCCCCATCAAG-3',下游引物序列为5'-TCGCAGACAGTGATGAACCTC-3';NF-κB 的上游引物序列为5'-TCTTTGACAAT CGTGCCCCC-3',下游引物序列为5'-CAGCCIGGTC CCGTGAAATA-3'。
1.4 统计学方法 采用SPSS Statistics 26软件进行数据分析。计量资料以(±s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 H2O2诱导氧化应激细胞模型的最佳干预时间 A、B、C、D组细胞活性分别为(1.00±0.00)、(0.77±0.05)、(0.61±0.09)、(0.52±0.04)。四组细胞活性比较,差异有统计学意义(F=40.08,P=0.001);B、C、D组细胞活性均低于A组,差异有统计学意义(P<0.05)。C组细胞活性最接近60%,故H2O2诱导氧化应激细胞模型的最佳干预时间为8 h。
2.2 对照组与H2O2组LncRNA MALAT1表达水平比较H2O2组LncRNA MALAT1表达水平为(0.76±0.25),低于对照组的(1.28±0.38),差异有统计学意义(t=2.776,P=0.020)。
2.3 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB表达水平比较 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB表达水平比较,差异有统计学意义(P<0.05);H2O2+siRNA组TLR4、MyD88、NF-κB表达水平高于对照组,差异有统计学意义(P<0.05);H2O2+siRNA组MyD88、NF-κB表达水平高于H2O2组,差异有统计学意义(P<0.05),见表1、图1。

图1 Western blot法检测对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB表达水平的电泳图Figure 1 Electropherogram of TLR4,MyD88 and NF-κB expression levels in control group,H2O2 group and H2O2+siRNA group detected by Western blot method
表1 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB表达水平比较(±s,n=3)Table 1 Comparison of expression levels of TLR4,MyD88,NF- κB in control group,H2O2 group,H2O2+siRNA group
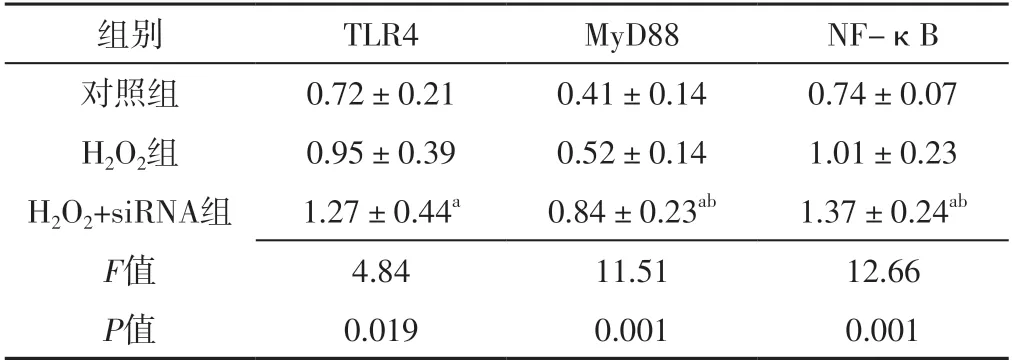
表1 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB表达水平比较(±s,n=3)Table 1 Comparison of expression levels of TLR4,MyD88,NF- κB in control group,H2O2 group,H2O2+siRNA group
注:H2O2=过氧化氢,siRNA=小干扰RNA,TLR4=Toll样受体4,MyD88=髓样分化因子88,NF-κB=核因子κB;a表示与对照组比较,P<0.05;b表示与H2O2组比较,P<0.05
组别TLR4MyD88NF-κB对照组0.72±0.210.41±0.140.74±0.07 H2O2组0.95±0.390.52±0.141.01±0.23 H2O2+siRNA组1.27±0.44a0.84±0.23ab1.37±0.24ab F值4.8411.5112.66 P值0.0190.0010.001
2.4 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平比较 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平比较,差异有统计学意义(P<0.05);H2O2组TLR4、MyD88 mRNA表达水平高于对照组,差异有统计学意义(P<0.05);H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平高于对照组、H2O2组,差异有统计学意义(P<0.05),见表2。
表2 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平比较(±s,n=3)Table 2 Comparison of mRNA expression levels of TLR4,MyD88,NFκB in control group,H2O2 group,H2O2+siRNA group
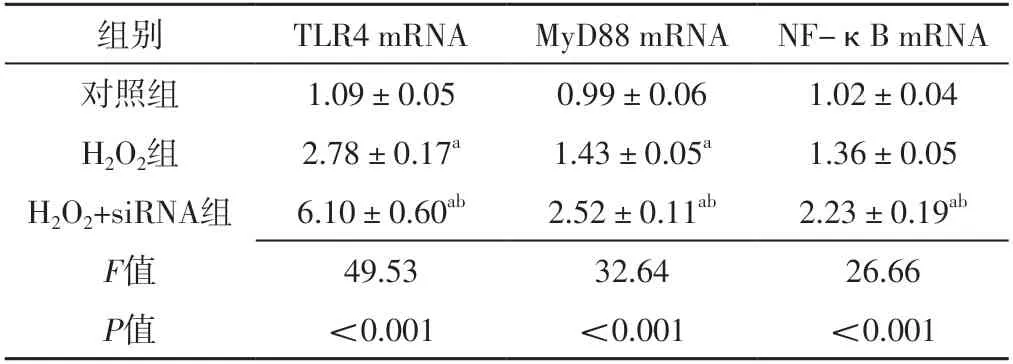
表2 对照组、H2O2组、H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平比较(±s,n=3)Table 2 Comparison of mRNA expression levels of TLR4,MyD88,NFκB in control group,H2O2 group,H2O2+siRNA group
注:a表示与对照组比较,P<0.05;b表示与H2O2组比较,P<0.05
组别TLR4 mRNAMyD88 mRNA NF-κB mRNA对照组1.09±0.050.99±0.061.02±0.04 H2O2组2.78±0.17a1.43±0.05a1.36±0.05 H2O2+siRNA组6.10±0.60ab2.52±0.11ab2.23±0.19ab F值49.5332.6426.66 P值<0.001<0.001<0.001
3 讨论
AS是目前比较常见的心血管疾病,能够导致血管内膜结构与功能发生变化,管壁增厚是其主要病理特点[1]。氧化应激是导致AS发生发展的主要因素之一,当内皮细胞受到氧化应激的刺激后,会引起低密度脂蛋白发生氧化,刺激黏附因子表达,导致细胞黏附性增加及细胞聚集,其还会促进NO的释放,造成血管功能障碍[11]。同时,慢性炎症也是造成AS加重的主要原因,研究表明,TLR4/MyD88/NF-κB信号通路在AS的炎症反应中发挥着重要作用,其中MyD88作为TLR4的衔接蛋白,起着关键的信号转导功能,其在接收到TLR4信号后可激活NF-κB[12]。
本研究构建氧化应激细胞模型前,首先探索合适的诱导条件。氧化应激细胞模型的诱导手段有很多,本研究选择H2O2,因为其应用较广泛,作用直接,性质稳定[13]。本研究结果显示,B、C、D组细胞活性均小于A组,且C组细胞活性最接近60%,故H2O2诱导氧化应激细胞模型的最佳干预时间为8 h。
LncRNA MALAT1定位于染色体11q13.1上,首次在非小细胞肺癌中被发现,其可以调控细胞增殖,影响肿瘤的发生[14]。研究显示,抑制LncRNA MALAT1可促进乳腺癌模型小鼠癌细胞迁移[15]。同时,LncRNA MALAT1在氧化应激引发的心血管疾病中也能发挥一定作用。LI等[16]研究发现,心肌梗死患者LncRNA MALAT1表达水平升高,LncRNA MALAT1可能成为预测心肌梗死的标志物。有研究者在高脂饮食诱导的AS模型小鼠中发现,过表达LncRNA MALAT1可以通过ox-LDL来调控Wnt/β环,从而促进AS的发生[17]。本研究结果显示,H2O2组LncRNA MALAT1表达水平低于对照组,与CHEN等[18]研究结果类似,该研究表明,靶向敲除LncRNA MALAT1后小鼠心脏微血管内皮细胞的氧化应激反应更加剧烈。但本研究结果与RADHAKRISHNAN等[19]研究结果不同,可能是所用细胞系及干预方式不同导致的,RADHAKRISHNAN等[19]选择的细胞系为视网膜内皮细胞,且使用高糖诱导氧化应激。
有研究者采用脂多糖诱导小鼠心肌细胞氧化应激,结果显示,心肌细胞中TLR4、MyD88、NF-κB表达水平升高[20]。研究显示,在中枢神经系统中,抑制小胶质细胞TLR4、MyD88、NF-κB的表达,可以减轻氧化应激,进而抑制神经元凋亡[21]。本研究结果显示,H2O2+siRNA组TLR4、MyD88、NF-κB表达水平高于对照组,MyD88、NF-κB表达水平高于H2O2组;H2O2组TLR4、MyD88 mRNA表达水平高于对照组,H2O2+siRNA组TLR4、MyD88、NF-κB mRNA表达水平高于对照组、H2O2组;提示在氧化应激环境下,LncRNA MALAT1表达水平降低,进而导致TLR4/MyD88/NF-κB信号通路被激活,这与既往研究结果[22]类似。但本研究结果与JIA等[23]研究结果存在差异,可能是采用的细胞和模拟的病理环境不同导致的,JIA等[23]使用人心肌细胞模拟心肌炎,结果显示,下调LncRNA MALAT1可抑制TLR4/MyD88/NF-κB信号通路的激活。
综上所述,氧化应激环境下,LncRNA MALAT1表达水平降低,进而导致内皮细胞TLR4/MyD88/NF-κB信号通路被激活,这为预防和治疗AS提供了新的理论依据。但本研究为细胞实验,且未进行动物实验,后期尚需要进行动物实验进一步验证本研究结论。此外,LncRNA MALAT1与多种微小RNA有关,SUN等[24]研究发现,LncRNA MALAT1与miR-503位点结合后可抑制下游JAK2/STAT3信号通路的激活,本研究组后续会对此展开研究。
作者贡献:纪海涛进行文章的撰写、数据分析;赵颖馨、柴强、刘振东进行文章的构思与设计;于锡巧、张丛丛进行文献的收集与整理;赵颖馨进行文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
