贝莱斯芽孢杆菌 F85对烟草炭疽病的生防作用研究
2023-08-18刘涵斐徐婷婷李锡宏邱梦娟张艺千郑露黄俊斌黎妍妍
刘涵斐 徐婷婷 李锡宏 邱梦娟 张艺千 郑露 黄俊斌 黎妍妍

摘要:為明确贝莱斯芽孢杆菌对烟草炭疽病的生防作用,通过贝莱斯芽孢杆菌 Bacillus velezensis F85和烟草炭疽病菌 Colletotrichum fructicola共培养试验,测定了不同浓度的 F85无菌发酵滤液(0.5%~20%)对C.fructicola的菌丝生长、分生孢子萌发及附着胞形成的影响,评价了 F85对活体叶片的烟草炭疽病的防治效果。结果表明:(1)贝莱斯芽孢杆菌 F85对 C. fructicola、C. kahawae、C. karstii、C. siamense均表现出较好的拮抗作用,具有广谱抑菌效果。(2)贝莱斯芽孢杆菌 F85可有效抑制烟草炭疽菌C.fructicola菌丝的生长,同时抑制炭疽菌分生孢子的萌发和附着孢形成。随 F85无菌发酵滤液浓度升高,对C.fructicola的抑制作用更明显。20% F85无菌发酵滤液处理C.fructicola菌丝干质量抑制率和分生孢子芽管畸形率均达100%。(3)5%浓度以上的贝莱斯芽孢杆菌 F85无菌发酵滤液对活体烟草炭疽病的防效高于70%。本研究丰富了烟草炭疽病生防菌资源,为开展烟草炭疽病的生物防治提供了理论依据。
关键词:烟草炭疽病;生物防治;贝莱斯芽孢杆菌
中图分类号: S435.72 文献标识码: A 文章编号:1007-5119(2023)03-0047-06
Study on the Biocontrol Effect of Bacillus velezensis F85 against Tobacco Anthracnose
LIU Hanfei1, XU Tingting1, LI Xihong2, QIU Mengjuan1, ZHANG Yiqian1, ZHENG Lu1, HUANG Junbin1, LI Yanyan2*
(1. College of Plant Science and Technology, Huazhong Agriculture University, Wuhan 430207, China;2. Tobacco Research Instituteof Hubei Province, Wuhan 430030, China)
Abstract: To determine the biocontrol effect of Bacillus velezensis F85 against tobacco anthracnose, co-culture experiments of B. velezensis F85 and C. fructicola were conducted. The effects of different concentrations of B. velezensis F85 aseptic fermentation filtrate (0.5%-20%) on mycelium growth, conidial germination and appressorium formation of C.fructicola were determined, and the effect of F85 on live leaf control of C. fructicola was evaluated. The results indicated that:(1) B. velezensis F85 showed good antagonism to C.fructicola, C. kahawae, C. karstiiand C. siamense, suggesting that B. velezensis F85 had broad spectrum antifungal property for Colletotrichum spp..(2) B. velezensis F85 could effectively inhibit the mycelium growth of C. fructicola, and inhibit the germination of conidia and appressorium formation of anthrax. With the increase of the concentration of sterile fermentation filtrate of F85, its inhibitory effect on C. fructicola was more obvious. The dry weight inhibition rate of C. fructicola mycelium and the malformation rate of conidial bud tube were both 100% when the filtrate ofF85 was 20%.(3) The control effect of B. velezensis F85(above 5%) on live leaf tobacco anthracnose was higher than 70%. This study enriched the biocontrol bacteria resources for tobacco anthracnose and provided theoretical basis for biological control of tobacco anthracnose.
Keywords: tobacco anthracnose; biological control; Bacillus velezensis
炭疽病是一种常见的叶部病害,炭疽菌(Colletotrichum spp.)寄主植物广泛,如葡萄、苹果、烟草、玉米、高粱、梨、茶树等[1]。烟草炭疽病是烟草上发生最为普遍的真菌病害之一,该病于1922年首次在巴西报道,之后在中国等多个亚洲国家相继报道[2]。该病害在烟叶上最初为水浸状黄绿色斑点,然后颜色变成深褐色,合并成较大的坏死斑,最后叶片萎蔫[3]。近年来,在我国四川省[3]、贵州省[5-6]、河南省[7]、湖南省[3]、海南省[8]等省份陆续报道了烟草炭疽病的为害。因此,炭疽病的有效防治在烟叶生产中显得尤为重要。
生物防治是目前植物病害防治的发展方向之一,因具有可利用资源丰富,选择范围广,对环境不会造成污染等众多优点而为植病学家所青睐[9-10]。近年来,前人已零星开展了烟草炭疽病的生防菌剂筛选。王静等[11]对一株短小芽孢杆菌 Bacillus pumilus AR03进行研究,发现该菌株对烟草炭疽病菌的抑制效果明显,AR03发酵液可以导致炭疽菌菌丝生长异常,使孢子萌发出现畸形,同时在室内盆栽烟草试验中也表现出较好的防治效果。原晨虹等[12] 研究表明,地衣芽孢杆菌 Bacillus licheniformis BL-24的发酵液和无菌发酵滤液对烟草炭疽病菌菌丝生长的抑制率分别达到66.67%和68.89%。总的来说,目前涉及烟草炭疽病的生物防治研究较少,需要进一步开展生防菌株的筛选及生防菌剂的研发。
本课题组前期筛选获得了一株贝莱斯芽孢杆菌 Bacillus velezensis F85,对烟草炭疽病具有较好的防治作用。本研究测定了 F85无菌发酵滤液对烟草炭疽病菌菌丝生长、分生孢子萌发及附着胞形成的影响,并评价其对烟草活体叶片的防效,探究贝莱斯芽孢杆菌 F85对烟草炭疽病的生防潜能,以期为开展烟草炭疽病的生物防治提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株和煙草供试生防菌株为贝莱斯芽孢杆菌(B. velezensis)F85;供试烟草炭疽病菌为C.fructicola、C. karstii、C. kahawae、C. siamense,由华中农业大学植物真菌病害研究室保藏。供试烟草品种为云烟87,由湖北省烟草科学研究院提供。
1.1.2 培养基马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂15 g ,纯水定容至1 L。马铃薯葡萄糖培养基(PDB):马铃薯200 g、葡萄糖20 g,纯水定容至1 L。Luria-Bertani 培养基(LB):胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g ,纯水定容至1 L。
1.2 试验方法
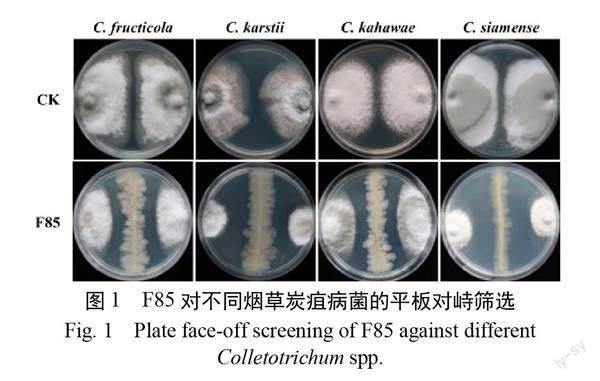
1.2.1 F85对不同烟草炭疽病菌的抑菌谱测定采用平板对峙法测定 F85对不同烟草炭疽病菌( C. fructicola、C. karstii、C. kahawae、C. siamense)的抑菌谱。取5μL F85菌液在 PDA 平板中央划线,同时在线两侧30 mm 处呈十字交叉接种供试炭疽菌的菌饼,以不接种 F85只接种病原菌丝块的培养基为对照,每个处理重复3次。7 d 后测定抑菌带大小,并计算抑制率。抑制率=[(对照组菌落半径-处理组菌落半径)/(对照组菌落半径-菌饼半径)]×100%。
1.2.2 烟草炭疽病菌的分生孢子液制备实验室前期将活化的 C. fructicola菌株的菌丝块接种到 PDA 平板上,28℃光照培养箱培养7 d,用棉签刮破表面菌丝,加入无菌水刮洗孢子并过滤,重复离心2次,弃上清液,制成孢子悬浮液备用。
1.2.3 F85无菌发酵滤液的制备挑取活化后的 F85单菌落接种于2 mL 液体培养基中,在37℃、180 r/min(下同)条件下振荡24 h。将摇培后的 F85菌株的菌液按0.5%( V/V,下同)的比例接种于200 mL 液体 LB 培养基中,振荡培养48 h。将发酵液于8000 r/min 离心15 min,用细菌过滤器过滤后获得上清液,即得 F85无菌发酵滤液。
1.2.4 F85对 C. fructicola菌丝生长的影响将贝莱斯芽孢杆菌 F85无菌发酵滤液加至 PDA 中混合至不同浓度(0.5%、1%、2.5%、5%、10%、20%);取直径为5 mm 的C.fructicola菌饼,分别接种于含不同浓度 F85无菌发酵滤液的 PDA 平板及 PDB 液体培养基中,以不添加无菌发酵滤液的 PDA(PDB)为对照,置于28℃恒温培养箱(PDB 培养基置于28℃、180 r/min 摇床)中培养,每个处理设置3 次重复。培养7 d 后用十字交叉法测量菌落直径;摇培菌丝在光学显微镜下进行观察后,过滤、烘干称量菌丝干质量,并计算 F85对 C. fructicola的菌落、菌丝抑制率。菌落抑制率=[(对照组菌落直径–处理组菌落直径)/(对照组菌落直径–菌饼直径)]?100%;菌丝抑制率=(对照组菌丝干质量–处理组菌丝干质量)/对照组菌丝干质量?100%。
1.2.5 烟草炭疽病菌分生孢子萌发及附着胞形成测定以0.025%的吐温20为溶剂,制备含有不同浓度(0.5%、1%、2.5%、5%、10%、20%)F85无菌发酵滤液和1×105 cfu/mL 的 C. fructicola分生孢子的混合液,将上述各处理的混合液分别接种到疏水玻片上。以不添加 F85无菌发酵滤液的 C. fructicola分生孢子液接种作为对照,每个处理设置3个重复,每个重复统计100个孢子。28℃恒温黑暗条件下保湿培养18 h ,在显微镜下观察 C. fructicola分生孢子、芽管及附着胞形成的情况,并计算孢子萌发率、芽管畸形率和附着孢形成率。
1.2.6 F85无菌发酵滤液对活体叶片炭疽病的防治效果评价按照1.2.5的方法制备各处理混合液,将各处理的混合液分别接种到活体云烟87烟草叶片上,每个处理设置3次重复,每个重复3个叶片。置于28℃恒温下黑暗培养48 h 后持续光照培养,保湿培养5 d 后观察发病情况,统计发病率和发病面积,并计算防治效果。防治效果=(对照组病斑面积–处理组病斑面积)/对照组病斑面积×100%。
2 结果
2.1 F85对烟草炭疽菌的拮抗作用测定
以烟草炭疽病4种病原菌 C. fructicola、C. karstii、C. kahawae、C. siamense作为指示菌,分别与贝莱斯芽孢杆菌 F85进行平板对峙培养(图1)。结果表明,贝莱斯芽孢杆菌 F85对4种烟草炭疽病菌的拮抗效果较好,抑菌带在16.33~22.66 mm 之间(表1)。
2.2 F85无菌发酵滤液对烟草炭疽菌菌丝生长的影响
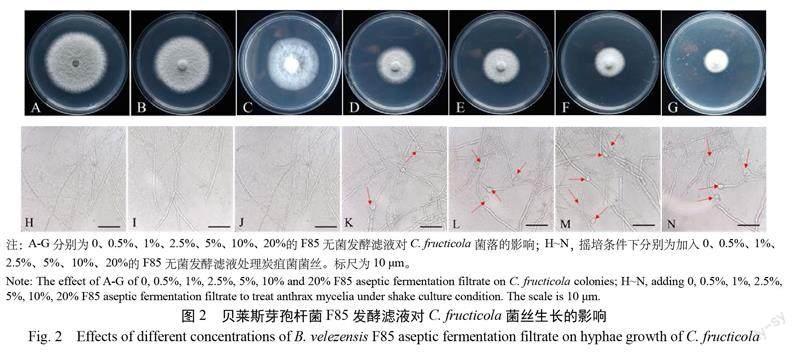
F85无菌发酵滤液对 C. fructicola菌落生长影响的测定结果表明,随着贝莱斯芽孢杆菌 F85发酵滤液浓度的增加,炭疽菌菌落直径显著减小(图2),当发酵液浓度为10%时,对菌落生长抑制效果可达50%以上(表2)。
F85无菌发酵滤液对 C. fructicola菌丝干质量影响的测定结果表明,0.5%发酵滤液对菌丝生长的抑制率达到69.67%;当使用10%及以上浓度的发酵滤液处理C.fructicola时,抑制率可达100%,显著高于其他浓度的处理(表2)。在摇培条件下,加入2.5%发酵滤液时,可以观察到菌丝出现膨大畸形现象,并且随着发酵滤液浓度的增加,C.fructicola菌丝出现膨大畸形的比例上升。
2.3 F85无菌发酵滤液对C.fructicola分生孢子萌发以及附着胞形成的影响
贝莱斯芽孢杆菌 F85无菌发酵滤液处理后,C. fructicola分生孢子萌发后生成的芽管形态异常,芽管出现畸形膨大现象,附着胞的生成也受到抑制(图3)。随着加入的F85无菌发酵滤液浓度的升高,芽管畸形的比例变大,附着胞形成的比例逐渐减小。当 F85无菌发酵滤液浓度为20%时, C. fructicola 生成的芽管全部畸形,附着胞形成的比例降至0.2%(表3)。
2.4 F85无菌发酵滤液对活体叶片上烟草炭疽病的防治效果
不同浓度贝莱斯芽孢杆菌F85无菌发酵滤液对活体叶片上烟草炭疽病的防治效果存在差异(图4)。0.5%无菌发酵滤液和1%无菌发酵滤液处理后,病斑面积均显著小于对照组,但发病率仍然达到100%(表4)。随着贝莱斯芽孢杆菌 F85无菌发酵滤液浓度从2.5%提高到20%,发病率从82.2%显著降为2%,无菌发酵滤液浓度为20%时,几乎不产生病斑。试验表明使用浓度高于5%的 F85无菌发酵滤液可有效防治活体烟草炭疽病。
3 讨论
贝莱斯芽孢杆菌(B. velezensis)在自然界分布广泛,为一种好氧杆状革兰氏阳性细菌。西班牙学者 Ruiz-García 等[13]于2005年在西班牙南部马赫拉加首次发现并对其命名。在农业生产中,贝莱斯芽孢杆菌具有广谱抗病性,具有广泛的应用前景[14]。在作物炭疽病防治中,贝莱斯芽孢杆菌也表现出明显抑菌活性。代亚锋等[15]、竺利红等[16]、王雨等[17]、冯江鹏等[18]、Choub等[19]分别探究了贝莱斯芽孢杆菌 X10-03、SM905、HN-2、JK3、CE100菌株对草莓、芒果、铁皮石斛等作物炭疽病菌的抑菌活性。本研究表明,贝莱斯芽胞杆菌 F85对4种烟草炭疽菌均表现出较好的抑制作用,具有广谱抑菌效果。
引起植物炭疽病的炭疽菌属(Colletotrichum spp.)共有14个复合种,每个复合种又包含不同的炭疽菌种[20],其中果生炭疽菌(C.fructicola)可引起杧果[21]、橡胶树[22]、苹果[23]、草莓[24]等多种作物炭疽病。据报道,C.fructicola也是引起烟草炭疽病的主要病原[5]。因此,C.fructicola在烟草上的传播、流行需要引起重视,C.fructicola的防控也势在必行。本研究重点分析了贝莱斯芽孢杆菌 F85对C.fructicola菌丝生长、分生孢子萌发及附着胞形成的影响,为由 C. fructicola侵染引起的烟草炭疽病的防控探寻了生物防治方向。随着 F85无菌发酵滤液浓度的增加,对 C. fructicola菌丝生长的抑制作用逐渐增强,分生孢子芽管畸形率逐渐增多,这与代亚锋等[13]研究结论一致。 F85无菌发酵滤液浓度高于5%时,对C.fructicola菌絲干质量的抑制率达78.00%以上,分生孢子芽管畸形率达72.00%以上; F85无菌发酵滤液浓度为20%时,对 C. fructicola菌丝干质量的抑制率和芽管畸形率均达到100.00%。在活体叶片上,5%以上浓度 F85无菌发酵滤液对烟草炭疽病的防效达70%以上。以上结果表明贝莱斯芽孢杆菌 F85抑制烟草炭疽病菌菌丝生长,造成炭疽病菌分生孢子萌发生成的芽管异常,从而有效防止烟草炭疽病的发生和扩展。这与Choub等[19]关于贝莱斯芽孢杆菌CE100抑制 C. gloeosporioides的作用机制一致。
目前,利用微生物活体及其代谢产物来防治烟草病害的方法已经日益成熟,然而使用微生物活体防治病害时受环境影响较大,且效果不稳定。通过微生物代谢产物来防治病害既符合农业绿色发展的要求,相比利用微生物活体防治又具有高效、安全、与环境相容度高等优势[25]。根据前人报道研究, B. velezensis产生的代谢产物中具有抑菌效果的物质主要有脂肽类、聚酮类化合物、芽胞杆菌溶素等抗生素[26]以及fengycin B, iturin A, surfactin A 等抗真菌代谢物[27]。本研究中 F85分泌的抑菌物质的种类需要进一步鉴定。
4 结论
结果表明,贝莱斯芽孢杆菌 F85对多种烟草炭疽菌具有较好的拮抗作用,可有效抑制烟草炭疽菌C.fructicola的菌丝生长,同时抑制炭疽菌分生孢子的萌发和附着孢形成,进而有效防治烟草炭疽病。 F85无菌发酵滤液浓度为5%时, C. fructicola菌丝干质量的抑制率和分生孢子的芽管畸形率分别为78.20%和72.40%,对活体叶片烟草炭疽病的防效可达70.00%;F85无菌发酵滤液浓度为20%时, C. fructicola菌丝干质量的抑制率和芽管畸形率均达到100.00%,对活体叶片烟草炭疽病的防效达100.00%。本研究为挖掘防治烟草炭疽病的生防菌资源及后续生防菌剂的研发和利用奠定了基础。
参考文献
[1] 黄彩霞.安徽菊花炭疽病病原菌的分离鉴定、致病性测定及防治药剂筛选[D].合肥:安徽农业大学,2022.
HUANG C X. Isolation and identification of the pathogen of chrysanthemum anthracnose in Anhui Province, pathogenicity determination and screening of control agents[D]. Hefei: Anhui Agricultural University, 2022.
[2] 贾玉.烟草炭疽病菌的分子检测与烟草品种抗病性研究[D].泰安:山东农业大学,2012.
JIA Y. Molecular detection of Colletotrichum destructivum and resistance reation of tobacco to C. destructivum[D]. Taian: Shandong Agricultural University, 2012.
[3] WANG Y R, HU Z, ZHONG J, et al. First report of Colletotrichum cliviicola causing leaf spot on tobacco (Nicotiana tabacum) in Hunan Province of China[J]. Plant Disease, 2022, 106(1):316.
[4] 任文清,夏文明,张再刚,等. 四川烟草炭疽病的鉴定及防治技术研究[J].安徽农业科学,2015,43(4):128-130.
REN W Q, XIA W M, ZHANG Z G, et al. ldentification and control of tobacco anthracnose in Sichuan[J]. Journal of Anhui Agricultural Sciences, 2015, 43(4):128-130.
[5] WANG H C, HUANG Y F, CHEN Q, et al. Anthracnose caused by Colletotrichum fructicola on tobacco (Nicotiana tabacum) in China[J]. Plant Disease, 2016, 100(6):1235.
[6] 李继业,王璟晶,杨露,等.烟草炭疽病原研究及拮抗链霉菌鉴定[J].浙江农业学报,2019,31(8):1337-1344.
LI J Y, WANG J J, YANG L, et al. ldentification of tobacco anthracnose and isolation of antagonistic Streptomyces[J]. Acta AgriculturaeZhejiangensis, 2019, 31(8):1337-1344.
[7] 李昊.许昌市襄城县大田烟草病虫害发生与防治情况调查[D].郑州:河南农业大学,2016.
LI H. Investigation on occurrence and control of tobacco diseasesand insect pests in field of Xiangcheng County, Xuchang City[D]. Zhengzhou: Henan Agricultural University, 2016.
[8] ZHAO Q, XIA C J, WANG J, et al. Sohail MA. First report of Colletotrichum karstii causing anthracnose on cigar tobacco in Hainan, China[J]. Plant Disease, 2020, 104(7):2025.
[9] 葉爱萍,林波,王平平,等.烟草赤星病拮抗菌 Q96的筛选鉴定及其防病效果研究[J].中国烟草科学,2022,43(5):56-60.
YE A P, LIN B, WANG P P, et al. Screening, identification and fermentation condition optimization of antagonistic bacterium q96 against Alternaria alternata[J]. Chinese Tobacco Science, 2022, 43(5):56-60.
[10] 王亚月,贾方方,李俊营,等.烟草黑胫病拮抗菌的筛选鉴定与防病促生作用研究[J].中国烟草科学,2022,4(6):60-67,75.
WANG Y Y, JIA FF, LI J Y, et al. Screening, identification of a bacterial strain against tobacco black shank and its growth-promoting effects[J]. Chinese Tobacco Science, 2022, 43(6):60-67, 75.
[11] 王静,孔凡玉,陈晓红,等.短小芽胞杆菌 AR03对烟草炭疽病的抑制作用[J].植物保护,2015,41(1):104-107,136.
WANG J, KONG F Y, CHEN X H, et al. The inhibitory effect of Bacillus pumilus AR03 against tobacco anthracnose[J]. Plant Protection, 2015, 41(1):104-107, 136.
[12] 原晨虹,任广伟,张家韬,等.地衣芽孢杆菌 BL-24对烟草炭疽病的生物防治研究[J].东北农业科学,2022,47(2):75-78.
YUAN C H, REN G W, ZHANG J T, et al. Study on the biological control of Bacillus licheniformis BL-24 to tobacco anthracnose[J]. Journal of Northeast Agricultural Sciences, 2022, 47(2):75-78.
[13] RUIZ-GARCIA C, BEJAR V, MARTINEZ-CHECA F, et al.Bacillusvelezensis sp. nov. a surfactant-producing bacterium isolated from the river Velez in Malaga, southern Spain[J]. Int J Syst EvolMicrobiol, 2005, 55(1):191-195.
[14] 张彩文,程坤,张欣,等. 贝莱斯芽胞杆菌(Bacillus velezensis)分类学及功能研究进展[J].食品与发酵工业,2019,45(17):258-265.
ZHANG C W, CHENG K, ZHANG X, et al. Taxonomy and functions of Bacillus velezensis: a review[J]. Food and Fermentation Industries, 2019, 45(17):258-265.
[15] 代亚锋,吴楠楠,郜振,等.茶树炭疽病拮抗内生细菌贝莱斯芽胞杆菌的筛选与鉴定[J].信阳师范学院学报(自然科学版),2021,34(2):201-207.
DAI Y F, WU N N, GAO Z, et al. Screening and identification of the endophytic bacteria Bacillus velezensis against tea anthracnose[J]. Journal of Xinyang Normal University(Natural Science Edition), 2021, 34(2):201-207.
[16] 竺利红,李孝辉,施跃峰.芽胞杆菌 SM905的鉴定及其对铁皮石斛胶孢炭疽菌的抑菌活性研究[J].中国生物防治学报,2022,38(2):469-475.
ZHU L L, LI X H, SHI Y F. ldentification of Bacillus sp. SM905 and its antifungal activity against Colletotrichum gloeosporioides[J]. Chinese Journal of Biological Control, 2022, 38(2):469-475.
[17] 王雨,譚峥,韦丹丹,等. 贝莱斯芽胞杆菌 HN-2的鉴定及对杭果炭疽菌的抑菌活性研究[J].中国生物防治学报,2020,36(2):220-230.
WANG Y, TAN Z, WEI D D, et al. ldentification of Bacillus HN-2 and analysis of its antifungal properties[J]. Chinese Journal of Biological Control, 2020, 36(2):220-230.
[18] 冯江鹏,邱莉萍,梁秀燕,等.草莓胶孢炭疽菌拮抗细菌贝莱斯芽孢杆菌 JK3的鉴定及其抗菌活性[J].浙江农业学报,2020,32(5):831-839.
FENG J P, QIU L P, LIANG X Y, et al. ldentification of antagonistic bacteria Bacillus velezensis JK3 against anthracnose of strawberry and its antipathogenic activity[J]. Acta AgriculturaeZhejiangensis, 2020, 32(5):831-839.
[19] CHOUB V, MAUNG C E H, WON S J, et al. Antifungal Activity ofCyclic Tetrapeptide from Bacillus velezensis CE 100 against Plant Pathogen Colletotrichum gloeosporioides[J]. Pathogens, 2021, 10(2):209-219.
[20] 刘丽萍,高洁,李玉.植物炭疽菌属 Colletotrichum 真菌研究进展[J].菌物研究,2020,18(4):266-281.
LIU L P, GAO J, LI Y. Advances in knowledge of the fungi referred to the genus Colletotrichum[J]. Journal of Fungal Research, 2020, 18(4):266-281.
[21] 覃丽萍,苏琴,谢玲,等.杭果炭疽病菌 Colletotrichum asianum和 C. fructicola的危害特征及对杀菌剂的敏感性初探[J].植物保护,2020,46(1):197-202.
QIN L P, SU Q, XIE L, et al. A preliminary study on the damage characteristics of mango anthracnose causal agents Colletotrichum asianum and C.fructicola and their sensitivity to fungicides[J]. Plant protection, 2020, 46(1):197-202.
[22] 林春花,楊欢,赵晓宇,等.海南橡胶树炭疽菌 Colletotrichum siamense和C.fructicola的鉴定及系统发育分析[J].热带作物学报,2018,39(1):129-136.
LIN C H, YANG H, ZHAO X Y, et al. Identification and phylogenetic analysis of anthracnose pathogen Colletotrichum siamense and C. fructicola isolated from rubber tree in Hainan[J]. Chinese Journal of Tropical Crops, 2018, 39(1):129-136.
[23] 白静科.果生炭疽菌 Colletotrichum fructicola与苹果不同抗性品种互作研究[D].杨凌:西北农林科技大学,2016.
BAI J K. Interaction between resistant and susceptible apple cultivarsand Colletotrichum fructicola[D]. Yangling: Northwest A & F University, 2016.
[24] 陈哲,黄静,赵佳,等.草莓应答炭疽菌侵染的转录组分析[J].植物保护,2020,46(3):138-146.
CHEN Z, HUANG J, ZHAO J, et al. Transcriptomics analysis of strawberry response to Colletotrichum theobromicola infection[J]. Plant Protection, 2020, 46(3):138-146.
[25] 范万泽,薛应钰,张树武,等.拮抗放线菌 ZZ-9菌株发酵液的抑菌谱及稳定性测定[J].西北农业学报,2017,26(3):463-470.
FAN W Z, XUE Y Y, ZHANG S W, et al. Antimicrobial spectrum and stability of fermentation broth produced by antagonistic actinomycetes strain ZZ-9[J]. Acta AgriculturaeBoreali-occidentalis Sinica, 2017, 26(3):463-470.
[26] BLOM J, RUECKERT C, NIU B, et al. The complete genome ofBacillusamyloliquefaciens subsp. Plantarum CAU B946 contains a gene cluster for nonribosomal synthesis of iturin A[J]. Journal of Bacteriology, 2012, 194(7):1845-1846.
[27] CHEN L, HENG J, QIN S, et al. A comprehensive understanding ofthe biocontrol potential of Bacillus velezensis LM2303 against Fusarium head blight[J]. Plos One, 2018, 13(6): e0198560.
