基于T2WI、DCE 磁共振影像组学对Luminal 型乳腺癌分子分型的预测价值研究
2023-08-17陆美秀李俊通信作者
陆美秀,李俊,韩 丹(通信作者)
(昆明医科大学第一附属医院影像科 云南 昆明 650032)
乳腺癌是女性好发的一种恶性肿瘤,其发病率及死亡率远远高于其他疾病,其预后也因其治疗方式不同而存在差异[1]。乳腺癌治疗方式的选择依赖于分子分型,Luminal A 型乳腺癌主要采用内分泌治疗,而Luminal B(HER-2 阴性)型乳腺癌需采用内分泌治疗结合化疗的治疗方式[2]。在判定分子分型的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)及Ki-67蛋白四个分子中,对于Luminal A 和Luminal B(HER-2 阴性)乳腺癌的区分主要根据Ki-67 的表达水平。Ki-67 在细胞增殖过程中出现,它可以准确反映肿瘤细胞的增殖活性[3]。上述分子的表达水平获得主要依靠免疫组织化学(immuno histo chemistry,IHC),通常这个操作需要对病灶组织进行穿刺活检或手术切除,为有创操作,且穿刺活检取材局限,不能全面获取肿瘤信息,因而对肿瘤的分子分型及预后评估存在局限性。影像组学通过计算机高通量提取影像图像中的特征及数据[4-5],这些特征及数据用于进一步建立统计模型以帮助人们提高对病变的诊断及评估,对疾病的精准治疗、临床决策提供更多帮助。目前用于乳腺疾病方面主要用于良恶性鉴别、不同分子类型乳腺癌鉴别等,本研究利用磁共振T2WI、DCE 序列,探讨影像组学模型对乳腺癌Luminal A 型、Luminal B(HER-2 阴性)型乳腺癌分子分型的预测价值。
1 资料与方法
1.1 一般资料
回顾性收集2018年1月—2021年10月昆明医科大学第一附属医院经病理证实为乳腺癌的140 例患者乳腺MRI 图像,均为女性,年龄26 ~77 岁,平均(50.89±11.62)岁。根据免疫组化指标对其进行分组:Luminal A 型(Ki-67 <14%)为低表达组(n=55),Luminal B 型(HER-2 阴性)型(Ki-67 ≥14%)为高表达组(n=85)。
纳入标准:①病理证实为单侧原发性乳腺癌且影像表现为肿块型;②活检或穿刺术前2 周内、新辅助治疗前行MRI;③乳腺MRI 图像完整(包含T2WI、DCE),图像质量清晰,不影响病灶分割及评估;④免疫组化检测Ki-67、ER、PR、HER-2,确定分子分型为Luminal A 型、Luminal B 型(HER-2 阴性)型乳腺癌。排除标准:①患者无法获得完整病理结果、免疫组化报告不完整;②男性患者。
本研究经昆明医科大学第一附属医院伦理委员会同意(2018 伦审L 第23 号),免除取得研究对象知情同意的要求。
1.2 方法
1.2.1 MRI 扫描
采用荷兰PHILIPS 公司ACHIEVA 3.0T 超导磁共振扫描仪及EWS 后处理工作站。采用乳腺专用线圈,患者俯卧位头先进,行双乳横断位T2WI 脂肪抑制扫描,经肘静脉高压注射器注入对比剂Gd-DTPA(钆喷酸胺,马根维显,德国Bayer 公司)行DCE 扫描,剂量0.2 mmol/kg,注射流率0.2 mL/s,注射完毕后追加15 mL 0.9%氯化钠溶液推注,选取增强后第一期图像进行研究。序列参数如下,T2WI:TR 5 000 ms,TE 60 ms,层厚4 mm,层间距1 mm。动态增强DCE:TR 4.l ms,TE 1.2 ms,层厚1 mm,层间隔0 mm。FOV 为350 mm×350 mm。
1.2.2 图像分析
①影像组学特征提取和降维:分别由2 名具有5年和15年影像诊断工作经验的医师在不知道病理结果的情况下,采用3D Slicer V4.11.2(https://WWW.slicer.org/)软件对T2WI、DCE(增强后第1 期)序列病灶进行逐层勾画(包含坏死、液化区域),并提取影像组学特征,选取30 例进行组间及组内一致性(ICC)分析,ICC >0.75 提示一致性好。通过t检验剔除两组间差异无统计学意义的参数,最后通过LASSO 筛选降维。②影像组学模型的训练、验证:研究集按照7:3 的比例随机分为训练集和测试集,通过单因素逻辑回归分别对T2WI、DCE序列影像组学特征建立模型进行训练及验证,根据AUC评估模型性能。
1.3 统计学方法
采用SPSS 26.0 软件和R 4.2.1 进行统计学分析。两独立样本t检验用于筛选组间差异无统计学意义的组学特征。采用受试者工作特征(ROC)曲线评价模型的效能,以ROC 曲线下面积(AUC)、准确率、灵敏度和特异度表示。P<0.05 为差异具有统计学意义。
2 结果
2.1 影像组学特征
影像组学特征筛选结果:T2WI、DCE(增强后第1 期)2 个序列最终分别筛选出15、3 个组学特征。
T2WI 序列降维后特征分别为:original_shape_MinorAxisLength、wavelet-LLH_glcm_Correlation、wavelet-LHL_glcm_Correlation、wavelet-LHH_glcm_Imc2、wavelet-LHH_gldm_DependenceVariance、wavelet-LHH_gldm_LargeDependenceLowGrayLevelEmphasis、wavelet-LHH_glrlm_LongRunLowGrayLevelEmphasis、wavelet-HLL_glcm_JointAverage、wavelet-HLL_ngtdm_Strength、wavelet-HLH_glcm_Correlation、wavelet-HLH_glrlm_LongRunEmphasis、wavelet-HLH_glrlm_ShortRunEmphasis、wavelet-HHL_firstorder_Minimum、wavelet-HHH_firstorder_Mea 、wavelet-HHH_glcm_Idn。
DCE 序列降维后特征分别为:wavelet-HLL_firstorder_Kurtosis、wavelet-HLL_gldm_SmallDepen denceLowGrayLevelEmphasis、wavelet-HHH_gldm_DependenceNonUniformity。
2.2 影像组学模型建立、训练及验证
通过逻辑回归对2 个序列影像组学特征建模、训练和验证。T2WI 训练集和测试集的AUC 分别为0.94、0.88,见图1;训练集灵敏度、特异度、准确度分别为0.83、0.87、0.85,测试集灵敏度、特异度、准确度分别为0.77、0.94、0.83。DCE 训练集和测试集的AUC分别为0.63、0.65,见图2;训练集灵敏度、特异度、准确度分别为0.85、0.26、0.61,测试集灵敏度、特异度、准确度分别为0.88、0.25、0.64。见表1。
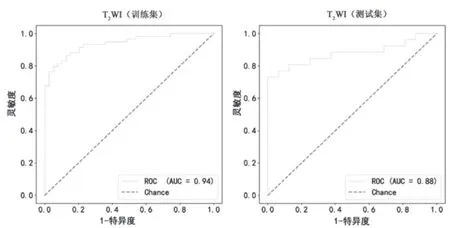
图1 T2WI 模型训练集、测试集的ROC 曲线
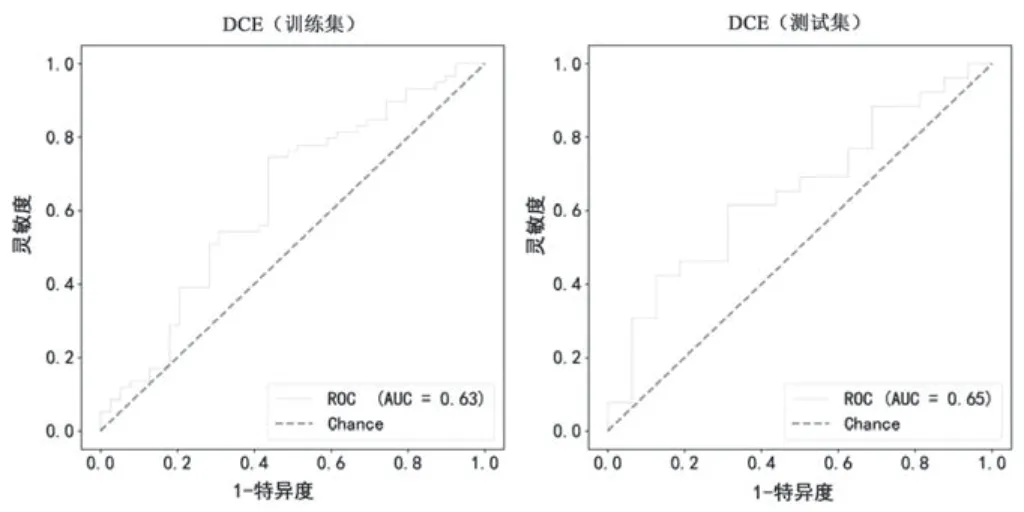
图2 DCE 模型训练集、测试集的ROC 曲线
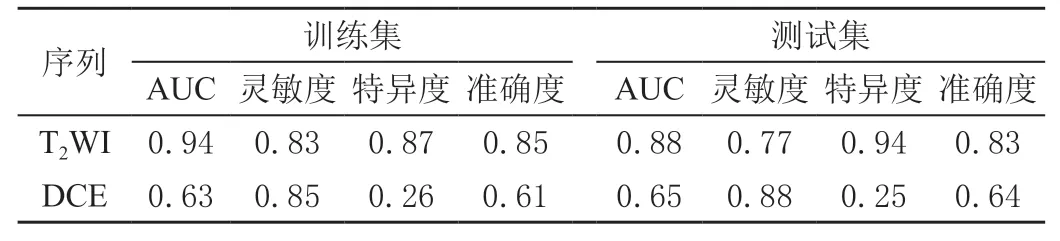
表1 T2WI、DCE 序列对Ki-67 表达的预测结果
3 讨论
乳腺癌的治疗是由肿瘤生物学行为决定的,对乳腺癌的精准分类就是精准治疗的前提。在临床中,IHC 对LuminalA 和Luminal B(HER-2 阴性)型乳腺癌分子分型有着重要作用,使用传统的IHC 方法检测乳腺癌组织分子的表达可能耗时,并且观察者之间容易产生差异[6]。影像组学则是一种高级定量方式,通过计算机挖掘常规图像中隐藏的结构信息即影像组学特征,能充分评估肿瘤的整体异质性,降低个人主观因素影响[7]。
本研究对T2WI、DCE 两个序列图像进行影像组学分析,并建立逻辑回归预测模型,结果显示T2WI、DCE 两个组学模型对Luminal A 和Luminal B(HER-2 阴性)型乳腺癌的分子分型进行预测均有一定效能,但T2WI 模型较DCE 模型更成功,且其特异度远高于DCE 模型。LEITHNER 等[8]对Luminal A 型乳腺癌与其他分型鉴别、吴佩琪等[9]研究将Luminal A 和Luminal B 分别从其他类型中区分,均采用DCE 模型且取得了良好的效能,优于本研究中的DCE 模型。也有研究建立DCE 组学模型对Luminal A 和Luminal B 型乳腺癌进行预测[10],结果AUC 为0.64、灵敏度0.78、特异度0.56、准确度 0.72,与本研究一致,并没有体现出较高的预测性能。对此结果说法不一可能是因为对具体分子分型预测的范围不同。本研究对Luminal 型乳腺癌进行更为细致的分子分型预测,T2WI 模型亦取得了较高的AUC,且准确度高达0.83。UMUTLU 等[11]利用DCE 建模对Luminal A 和Luminal B 型乳腺癌进行预测,准确率为92.3%,当加入了T2WI图像后准确率提高。对于T2WI 序列的影像组学模型,多用于多模态联合序列的预后研究,少有用于单序列研究及分子分型预测[12-13]。本研究T2WI 模型筛选出的组学特征中有能对Luminal A 和Luminal B(HER-2 阴性)型乳腺癌进行预测的特征,因其生物学特征不相同而产生了组学特征之间的差异,这些组学特征将成为分子分型预测的生物标志物。
本研究的局限性:①仅采用T2WI、DCE 序列建模,模型单一;②为回顾性研究,较小的样本量可能导致数据偏倚;③为单中心研究,缺乏多中心外部验证。下一步计划纳入多个序列、较大样本量、多中心的外部验证方式对模型进行进一步验证。
综上所述,本文研究基于T2WI、DCE 磁共振序列影像组学模型预测Luminal 型乳腺癌分子分型的价值,T2WI 序列模型展现出了很高的预测效能,但DCE 组学模型预测效能较低。磁共振影像组学模型有望发挥更大的潜力为临床提供术前分子分型的预测。
