老年动脉瘤性蛛网膜下腔出血介入栓塞术治疗患者血清miR-124、miR-27a-3p与预后的关系
2023-08-17李伦段建幸文利
李伦,段建,幸文利
遂宁市中心医院脑血管疾病科,四川遂宁 629000
动脉瘤性蛛网膜下腔出血(SAH)具有高病死率、高致残率等特点,即使成功施行颅内动脉瘤介入栓塞术,仍有部分患者尤其是老年患者会出现肿瘤破裂再出血,甚至死亡[1-2]。因此,探索能评估老年动脉瘤性SAH患者预后的相关因素对于临床确定防治措施及提高患者生存率具有重要意义。近年来新发现的微小RNA(miRNA)可介导转录后基因沉默,调节蛋白表达,参与脑梗死、SAH等神经系统疾病的发生发展[3-4]。miR-124是成人及胚胎脑组织中表达最丰富的miRNA,可通过抑制细胞增殖、促进细胞分化等途径参与脑缺血性疾病的发生发展[5]。miR-27a-3p主要分布于消化系统及神经系统,其表达在高血压脑出血患者中呈下降趋势[6]。但目前关于血清miR-124、miR-27a-3p水平与老年SAH经颅内动脉瘤介入栓塞术治疗患者预后的关系鲜见报道。为此,我们进行了如下研究。
1 资料与方法
1.1 临床资料 纳入标准:①符合动脉瘤性SAH诊断标准[7],结合颅脑CT及MRI检查确诊;②年龄≥60岁;③成功施行颅内动脉瘤介入栓塞术。排除标准:①合并急慢性感染;②合并严重心肝肾疾病;③存在出血倾向及凝血机制异常,或近期服用抗血小板药及抗凝药;④有心脑血管意外家族史;⑤颅内血肿明显需行开颅手术。选取2019年1月—2022年6月我院收治并符合上述标准的老年动脉瘤性SAH颅内动脉瘤介入栓塞术后患者200例,根据其术后28 d生存情况[8]分为生存组182例和死亡组18例。生存组男92例、女90例,年龄(70.51 ± 4.46)岁,破裂动脉瘤直径:≤5 mm 70例、>5~15 mm 98例、>15~25 mm 14例,发病至入院时间:≤6 h 136例,>6~24 h 46例,Fisher分级:1级29例、2级51例、3级84例、4级18例,Hunt-Hess分级:Ⅰ级35例、Ⅱ级56例、Ⅲ级61例、Ⅳ级30例,合并高脂血症28例、糖尿病20例、高血压26例,吸烟史56例。死亡组男9例、女9例,年龄(71.13 ± 4.05)岁,破裂动脉瘤直径:≤5 mm 7例、>5~15 mm 10例、>15~25 mm 1例,发病至入院时间:≤6 h 11例,>6~24 h 7例,Fisher分级:1级3例、2级5例、3级8例、4级2例,Hunt-Hess分级:Ⅰ级4例、Ⅱ级6例、Ⅲ级7例、Ⅳ级1例,合并高脂血症3例、糖尿病4例、高血压3例,吸烟史6例。两组上述资料均具有可比性(P均>0.05)。本研究通过医院伦理委员会审核,患者或家属均签署知情同意书。
1.2 血清miR-124、miR-27a-3p检测方法 采用实时荧光定量PCR法。两组于术前及术后3、7 d抽取外周静脉血3 mL,室温静置30 min,待血样凝结后,1 200 r/min离心15 min,取上清液。滴加焦炭酸二乙酯,-20 ℃冰箱保存待测。滴加TRIzol试剂提取总RNA,通过NanoDROP®ND-1000测定RNA浓度及纯度合格。取1 µL RNA根据反转录试剂盒进行逆转录反应,合成cDNA。PCR反应体系20 µL,反应条件:95 ℃、5 min,95 ℃、30 s,58 ℃、30 s,72 ℃、30 s,72 ℃、5 min,共40个循环[9]。以U6作为内参,采用2-ΔΔCt法计算miR-124、miR-27a-3p相对表达量。
1.3 统计学方法 采用SPSS22.0统计软件。计量资料采用S-W正态性检验,呈正态分布以表示,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,两组间比较采用秩和检验。计数资料以n(%)表示,组间比较采用χ2检验,等级资料采用Ridit检验。绘制术后3、7 d血清miR-124、miR-27a-3p预测患者死亡的受试者工作特征(ROC)曲线,计算曲线下面积(AUC)、截断值、敏感度及特异度,并分析AUC较大时的血清miR-124、miR-27a-3p联合预测患者死亡的价值。根据术后3、7 d血清miR-124、miR-27a-3p预测患者死亡的截断值,绘制不同血清miR-124、miR-27a-3p水平患者的生存曲线,并比较其28 d生存率。以患者是否死亡为因变量,以术后3、7 d血清miR-124、miR-27a-3p为自变量,进行影响患者死亡的多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组不同时间点血清miR-124、miR-27a-3p水平比较 与术前比较,两组术后3、7 d血清miR-124水平均升高、miR-27a-3p水平均降低,且死亡组变化更明显(P均<0.05)。见表1。
表1 两组不同时间点血清miR-124、miR-27a-3p水平比较()
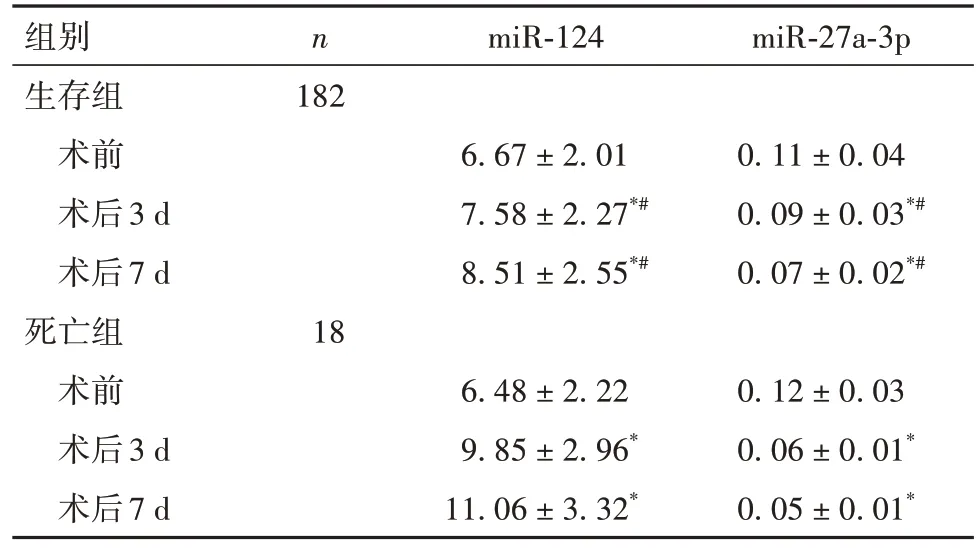
表1 两组不同时间点血清miR-124、miR-27a-3p水平比较()
注:与同组术前比较,*P<0.05;与死亡组同时间点比较,#P<0.05。
n miR-124组别生存组术前术后3 d术后7 d死亡组术前术后3 d术后7 d miR-27a-3p 182 6.67 ± 2.01 7.58 ± 2.27*#8.51 ± 2.55*#0.11 ± 0.04 0.09 ± 0.03*#0.07 ± 0.02*#18 0.12 ± 0.03 0.06 ± 0.01*0.05 ± 0.01*6.48 ± 2.22 9.85 ± 2.96*11.06 ± 3.32*
2.2 血清miR-124、miR-27a-3p预测患者死亡的ROC曲线分析结果 术后3、7 d血清miR-124、miR-27a-3p预测患者死亡的ROC曲线分析结果见表2及OSID码图1、2。术后3 d血清miR-124、miR-27a-3p预测患者死亡的AUC均小于术后7 d,术后7 d血清miR-124、miR-27a-3p联合预测患者死亡的AUC为0.906(95%CI:0.834~0.954),敏感度及特异度分别为94.44%、76.67%,见OSID码图3。
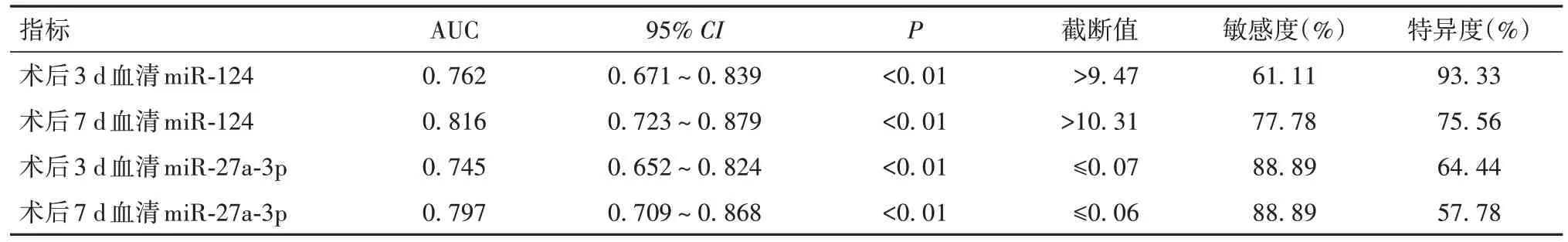
表2 术后3、7 d血清miR-124、miR-27a-3p预测患者死亡的ROC曲线分析结果
2.3 不同血清miR-124、miR-27a-3p水平患者的28 d生存率比较 以表2中ROC曲线分析结果的截断值进行分组,术后3、7 d血清miR-124分别>9.47、>10.31者为高危患者(n=57、55),其余为低危患者(n=51、53)。术后3、7 d血清miR-27a-3p分别≤0.07、≤0.06者为高危患者(n=52、58),其余为低危患者(n=56、50)。生存曲线分析结果显示,术后3 d miR-124、miR-27a-3p高危患者28 d生存率与低危患者比较差异均无统计学意义(P均>0.05);术后7 d miR-124、miR-27a-3p高危患者28 d生存率均低于低危患者(P均<0.05)。见OSID码图4~7。
2.4 术后3、7 d血清miR-124、miR-27a-3p与患者死亡的关系 术后3、7 d miR-124水平升高、miR-27a-3p水平降低均是患者死亡的独立影响因素(P均<0.05)。见表3。
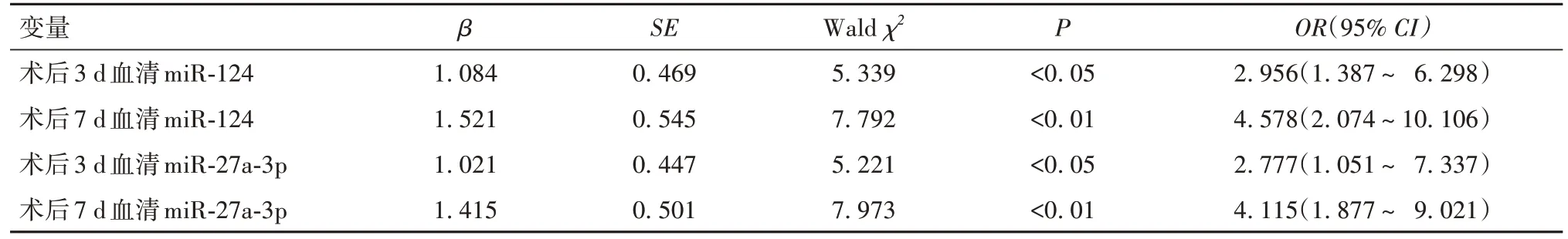
表3 术后3、7 d血清miR-124、miR-27a-3p影响患者死亡的多因素Logistic回归分析结果
3 讨论
据统计,SAH发病率占脑血管病的12%~20%,其中80%左右为脑动脉瘤破裂所致[10]。对于老年动脉瘤性SAH患者而言,颅内动脉瘤介入栓塞术是最为有效的治疗手段,然而动脉瘤所致原发性脑损伤及继发性病理生理改变会对患者的预后产生消极影响。目前国内外医疗机构对于老年动脉瘤性SAH的鉴别诊断多依赖于影像学手段,虽具有一定价值,但缺乏客观有效的评价指标,且无法判断患者预后恢复情况,故寻找有效的生物标志物对于评估老年动脉瘤性SAH的预后尤为重要。
miRNA属于高度保守的非编码小RNA,可通过促进mRNA降解、抑制mRNA翻译等途径参与转录后基因表达调控。传统观念认为,基因表达调控多发生于细胞内;新近研究显示,血清、脑脊液等细胞外液中存在稳定miRNA,并发现脑出血患者外周血与病灶组织存在几乎平行的miRNA表达谱[11]。miR-124属于脑组织特异性miRNA,最早发现于小鼠脑组织,随后发现其在果蝇、非洲爪蟾、人体大脑中均呈动态变化,在神经系统发育、损伤、修复等生理病理过程中起着重要作用,有可能成为药物治疗的作用靶点之一[12]。近年来越来越多的研究表明,miR-124水平变化与缺血性脑损伤有关[13-14]。体外实验发现,miR-124在大鼠脑组织缺血半影区的表达明显高于非缺血区,考虑原因与其可抑制细胞凋亡而发挥神经保护作用有关[15]。冯锦丽等[16]认为,血清miR-124与急性缺血性脑梗死患者梗死面积密切相关。杨剑宏[17]研究指出,血清miR-124在急性脑出血患者中呈高表达,特别是预后不良患者。但目前尚未见血清miR-124与动脉瘤性SAH、高血压脑出血等缺血性脑损伤疾病患者预后的关系。故本研究尝试分析其与动脉瘤性SAH术后患者预后的关系,结果显示生存组术后3、7 d的血清miR-124水平均低于死亡组,提示血清miR-124水平升高可能与患者预后不良有关。推测原因,可能是miR-124可调节下游靶基因Rho蛋白二磷酸鸟苷解离抑制因子(RhoGDIA),抑制血管内皮及血管平滑肌细胞迁移、增殖,损伤血管壁,引发脑出血;同时miR-124可下调神经元RhoG表达,中断ELMO/Dock180/Rac1信号通路,阻碍神经突向外生长,减少轴突及树突分支,增加脑出血量,加剧神经功能损伤,导致疾病恶化,甚至死亡[18]。
miR-27a是基因间miRNA,在多种细胞及血管丰富的组织中均有表达,可参与血管生成、炎症反应、糖脂代谢等病理生理过程。既往关于miR-27a的研究多集中于肿瘤,近年研究发现,miR-27a可通过上调脑组织Toll样受体4(TLR4)、p38蛋白磷酸化、释放炎症因子等,加剧脑缺血小鼠的脑组织损伤[19]。张秀萍等[20]指出,miR-27a可通过调节细胞周期基因、凋亡基因参与脑缺血损伤的病理生理过程。miR-27a-3p是miR-27a的剪切成熟体之一,包含B细胞淋巴瘤/白血病2基因Bcl-2相关转录因子1(BCLAF1)及Bcl-2结合成分3(BBC3)等靶基因,且两者均与凋亡基因Bcl-2密切相关。值得注意的是,脑出血疾病会增加Bcl-2表达,进而引起继发性脑损伤,若未及时诊治可加剧疾病进展,导致患者死亡[21]。但miR-27a-3p能否通过靶基因调控Bcl-2表达尚不得知。本研究结果显示,生存组术后3、7 d的血清miR-27a-3p水平均低高于死亡组,提示血清miR-27a-3p水平降低可能与患者预后不良有关。分析原因,可能是miR-27a-3p下调可增加BCLAF1、BBC3等靶基因表达,增强Bcl-2基因的促凋亡作用,加剧动脉瘤性SAH术后患者的继发性脑损伤,从而造成病情恶化[22]。
本研究进一步采取ROC及生存曲线分析发现,血清miR-124、miR-27a-3p对老年动脉瘤性SAH术后患者死亡的预测价值较高,特别是术后7 d的血清miR-124和miR-27a-3p,二者联合预测患者死亡的AUC为0.906,高于两项指标单独预测的AUC。本研究Logistic回归分析结果显示,术后3、7 d miR-124水平升高、miR-27a-3p水平降低是患者死亡的独立影响因素。
综上所述,老年动脉瘤性SAH经颅内动脉瘤介入栓塞术患者术后血清miR-124水平升高、miR-27a-3p水平降低,且死亡患者变化更明显,二者联合检测有助于评估患者的生存情况。因此,做好老年动脉瘤性SAH术后miR-124、miR-27a-3p的监测工作,对预测预后、指导临床治疗均具有重要意义。
