莪术油通过抑制铁死亡减轻博来霉素诱导的小鼠肺纤维化的机制研究
2023-08-17王殷彤王成功贾思凝俞文秀王方岩姜程曦程锦国
王殷彤,王成功,贾思凝,俞文秀,王方岩,姜程曦*,程锦国
莪术油通过抑制铁死亡减轻博来霉素诱导的小鼠肺纤维化的机制研究
王殷彤1, 2,王成功3,贾思凝3,俞文秀1,王方岩4,姜程曦3*,程锦国2*
1. 温州医科大学附属第二学院,浙江 温州 325000 2. 温州医科大学附属第一学院,浙江 温州 325000 3. 温州医科大学药学院,浙江 温州 325000 4. 温州医科大学基础医学院,浙江 温州 325000
探究莪术油是否通过抑制铁死亡减轻博来霉素诱导的小鼠肺纤维化及作用机制。40只雄性C57BL/6小鼠分为对照组、模型组和莪术油低、高剂量(3.25、13.00 mg/kg)组。小鼠气管插管注射博来霉素(3 mg/kg)制备肺纤维化模型,造模7 d后开始给药,给药组连续14 d隔日ip莪术油。给药结束后,通过各组小鼠体质量和肺干湿质量比评估小鼠一般情况;采用苏木素-伊红(HE)和Masson染色观察肺组织病理变化;检测血清中炎症因子水平和肺组织中羟脯氨酸(hydroxyproline,HYP)、氧化应激水平;Western blotting检测肺组织中肺纤维化和铁死亡相关蛋白表达。与模型组比较,莪术油组小鼠体质量增长(<0.05),肺水肿程度减轻,肺组织损伤情况好转,胶原纤维沉积减少;肺组织氧化产物丙二醛(malondialdehyde,MDA)及HYP水平减少(<0.05、0.01),还原酶谷胱甘肽(glutathione,GSH)活性增加(<0.05);血清中炎症因子水平明显降低(<0.01);肺组织纤维化相关蛋白I型胶原蛋白(collagen I)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和波形蛋白(vimentin)表达下调(<0.05、0.01),谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)蛋白表达上调(<0.01),转铁蛋白受体1(transferrin receptor 1,TFR1)和二价金属转运蛋白1(divalent metal transporter 1,DMT1)蛋白表达下调(<0.05、0.01)。莪术油能够通过抑制铁死亡,改善氧化应激,抑制炎症水平,减轻博来霉素诱导的小鼠肺纤维化。
肺纤维化;莪术油;铁死亡;氧化应激;炎症因子
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、高死亡率的间质性肺病,由于成纤维细胞过度积聚,细胞外基质(extracellular matrix,ECM)广泛沉积,最终导致肺泡结构受损,肺功能逐渐下降。IPF的预后较差,患者的生活质量受到严重的影响,并且由于继发性呼吸衰竭通常在诊断后2~5年内死亡[1-2]。吡非尼酮和尼达尼布在2014年被指南推荐用于IPF的临床治疗,但这2种药物的价格高昂,且无法彻底逆转纤维化[3-4]。因此探索经济并且可以有效延缓或治疗肺纤维化的药物尤为重要。
莪术油是莪术的提取物,价格经济实惠,其主要成分包括莪术醇、莪术二酮、莪术酮、榄香烯等,具有抗肿瘤、抗菌、抗血栓形成等多种药理作用[5-7]。研究表明,莪术醇可下调肺纤维化大鼠肺组织中转化生长因子-β1(transforming growth factor-β1,TGF-β1)和纤溶酶原激活剂抑制剂-1的表达,缓解博来霉素引起的大鼠肺纤维化[8],但其具体作用机制尚不明晰。铁死亡作为一种新的细胞死亡形式,与铁代谢紊乱、脂质过氧化积累、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、谷胱甘肽(glutathione,GSH)缺乏有关,参与了纤维化的形成[9-10]。研究表明,泛素样含PHD和环指域1(ubiquitin-like with PHD and ring finger domains 1,Uhrf1)可通过调节GPX4和铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)的水平,从而促进肺纤维化;通过使用铁死亡抑制剂,抑制铁的累积能够缓解由博来霉素诱导的小鼠肺纤维化,提示铁死亡在肺纤维化的发生发展中可能扮演着重要的角色[11-12]。本研究拟采用莪术油对博来霉素诱导的小鼠肺纤维化模型进行干预治疗,以明确莪术油对肺纤维化的疗效,并通过检测GPX4、转铁蛋白受体1(transferrin receptor 1,TFR1)、二价金属转运蛋白1(divalent metal transporter 1,DMT1)等铁死亡关键蛋白,进一步阐述其作用机制。
1 材料
1.1 动物
40只SPF级健康雄性C57BL/6小鼠,体质量20~25 g,6~8周龄,购自浙江维通利华实验动物技术有限公司,许可证号SYXK(浙)2021-0020。动物饲养于温州医科大学实验动物中心,温度20~25 ℃,相对湿度40%~70%,人工昼夜明暗交替12 h/ 12 h,自由进食饮水。动物实验通过温州医科大学实验动物伦理审查会审查(批准号wydw2022-0635)。
1.2 药品与试剂
莪术油(批号5190513)受赠于合肥未来药物开发有限公司,含牻牛儿酮(C15H22O)8.2%、呋喃二烯(C15H20O)10.5%,符合《中国药典》2020年版规定;博来霉素(批号410730,进口药品注册证号H20171103)由日本化药株式会社生产,购自温州医科大学附属第一医院;苏木素-伊红(HE)染色试剂盒(批号G1340)、Masson染色试剂盒(批号G1120)购自北京索莱宝科技有限公司;PVDF膜(批号IPVH00010、ISEQ00010)购自美国Millipore公司;兔抗β-actin抗体(批号ab8227)、兔抗Tubulin抗体(批号ab210797)、兔抗I型胶原蛋白(collagen I)抗体(批号ab260043)、兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号ab124964)、兔抗GPX4抗体(批号ab125066)、兔抗TFR1抗体(批号ab214039)、HRP标记的山羊抗兔二抗(批号ab205718)、Alexa Fluor®488标记的山羊抗兔IgG二抗(批号150077)、封固剂DAPI(批号ab104139)购自英国Abcam公司;兔抗波形蛋白(vimentin)抗体(批号5741)购自美国CST公司;兔抗DMT1(批号NBP1-91840)购自美国Novus公司;小鼠白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号JL20268)、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号JL10484)、小鼠IL-1β ELISA试剂盒(批号JL18442)购自上海江莱生物科技有限公司;GSH测定试剂盒(批号A006-1-1)、丙二醛(malondialdehyde,MDA)测定试剂盒(批号A003-1-2)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号A001-3-2)、羟脯氨酸(hydroxyproline,HYP)测定试剂盒(批号A030-2-1)购自南京建成生物工程研究所。
1.3 仪器
165-8001型电泳仪、转膜仪(美国Bio-Rad公司);JS-M6P型凝胶成像系统(上海培清科技生物公司);TGL-16gR型低温离心机(上海安亭科学仪器厂);BSA224S型电子分析天平(赛多利斯公司);SpectraMax 190型全波长酶标仪(美国Molecular Devices公司);80i型正置荧光显微镜(日本Nikon公司);HistoCore Arcadia型石蜡包埋机、RM2235型石蜡切片机(德国Leica公司)。
2 方法
2.1 动物分组、造模及给药
小鼠适应性喂养1周后,随机分为对照组(10只)和造模组(30只)。小鼠ip 2%戊巴比妥钠(45 mg/kg)麻醉,固定后灯光下寻找气管,插入留置针。造模组小鼠通过气管插管注射博来霉素(3 mg/kg)[13],对照组注射生理盐水。造模完成后立即旋转小鼠,使博来霉素或生理盐水可以均匀分布肺中。待小鼠苏醒后,观察一般情况。根据课题组前期研究,以莪术油推荐成人每日最佳使用量换算作为低剂量,为了更好评估有效剂量的范围,以4倍临床剂量作为高剂量。将30只造模组小鼠随机分为模型组和莪术油低、高剂量(3.25、13.00 mg/kg)组。造模7 d后开始给药,给药组连续14 d隔日ip莪术油,对照组和模型组ip等体积生理盐水,第21天处死小鼠。
2.2 样本收集
末次给药2 h后,腹主动脉采血后处死小鼠,取血清用于ELISA检测。小鼠乙醇局部消毒,沿前中线剪开胸腔,暴露气管和心肺器官。用手术线结扎右肺,取右肺上叶保存,余下置于液氮中保存用于后续实验。分离气管后,用眼科剪在气管上端剪一“Y”形小口,插入留置针,左肺中打入4%多聚甲醛固定液,直至左肺饱满,结扎左肺剪下,固定后进行石蜡包埋。
2.3 小鼠体质量及肺干湿质量比测定
每天记录小鼠体质量,给药结束后,取右肺上叶,称定质量后,80 ℃烘箱中烘烤72 h,直至质量恒定,称定质量,计算肺干湿质量比,用于反映肺组织含水量。
2.4 肺组织病理学观察
取固定后的肺组织,梯度乙醇脱水、透明、浸蜡后进行石蜡包埋,切片(厚度4 μm),脱蜡至水,进行HE和Masson染色,脱水,中性胶封片,于显微镜下观察肺组织病理变化。
2.5 免疫荧光法检测肺组织collagen I和GPX4蛋白表达
取固定后的肺组织,梯度乙醇脱水、透明、浸蜡后进行石蜡包埋,切片(厚4 μm),脱蜡至水,抗原修复后加入0.2%牛血清白蛋白,室温封闭30 min,滴加collagen I(1∶500)、GPX4(1∶200)抗体,4 ℃过夜孵育。室温复温1 h后,加入荧光二抗避光孵育1 h。DAPI复染10 min后,滴加防荧光淬灭剂封片。正置荧光显微镜下观察并拍照。DAPI紫外激发波长330~380 nm,发射波长420 nm,发蓝光;FITC激发波长465~495 nm,发射波长515~555 nm,发绿光。
2.6 肺组织中氧化应激指标及HYP含量测定
按照试剂盒说明书检测各组小鼠肺组织中GSH、MDA、SOD和HYP含量。
2.7 血清中炎症因子水平检测
按照试剂盒说明书检测各组小鼠血清中TNF-α、IL-1β、IL-6含量。
2.8 Western blotting检测肺组织collagen Ⅰ、α-SMA、vimentin、GPX4、TFR1、DMT1蛋白表达
取各组小鼠肺组织,按照50∶1的比例加入RIPA裂解液和蛋白酶抑制剂,提取组织蛋白。BCA法进行蛋白定量测定蛋白浓度,变性后的蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂奶粉,室温封闭1 h;分别加入collagen I抗体(1∶500)、α-SMA抗体(1∶10 000)、vimentin抗体(1∶1000)、GPX4抗体(1∶5000)、TFR1抗体(1∶5000)、DMT1抗体(1∶1000)、Tubulin抗体(1∶1000)和β-actin抗体(1∶1000),4 ℃孵育过夜;洗膜后,加入HRP标记山羊抗兔IgG抗体,室温孵育1 h,洗膜。滴加ECL曝光液,放入曝光机中成像,用Image J图像软件分析对条带灰度。
2.9 统计学分析
3 结果
3.1 莪术油缓解肺纤维化小鼠体质量减轻及肺水肿
如图1-A所示,造模7 d后,对照组小鼠体质量增加,造模组小鼠体质量均下降;给药后,与模型组比较,莪术油低剂量组小鼠体质量显著增长(<0.05)。如图1-B所示,与对照组比较,模型组小鼠肺干湿质量比显著升高(<0.01);与模型组比较,莪术油低剂量组小鼠肺干湿质量比显著降低(<0.05)。
3.2 莪术油减少肺纤维化小鼠肺组织纤维化改变和胶原沉积
如图2所示,HE染色结果表明,对照组小鼠肺组织结构清晰完整,肺泡和肺泡间隔正常,未见明显的病理性改变,未见胶原沉积。模型组小鼠的肺组织结构排列紊乱,肺泡壁显著增厚,肺泡不完整甚至不可见,肺泡腔内有大量的纤维组织团聚集,间质部分可见肌成纤维细胞增生,同时伴有炎性浸润。与模型组相比,莪术油组肺泡结构更加完整,炎性细胞浸润程度更轻,纤维化改变更少。Masson染色结果表明,与对照组相比,模型组小鼠肺组织中存在明显的间质内蓝色条索样胶原纤维沉积,伴随肺泡壁增厚和肺纹理紊乱。与模型组相比,莪术油组肺组织内的胶原沉积有一定程度减少。
3.3 莪术油减少肺纤维化小鼠肺组织中纤维化相关蛋白表达
如图3所示,Western blotting结果显示,与对照组比较,模型组肺组织中collagen I、α-SMA、vimentin蛋白表达均明显升高(<0.05、0.01);与模型组比较,莪术油各剂量组collagen I蛋白表达显著降低,莪术油低剂量组vimentin蛋白表达显著下调(<0.05),莪术油高剂量组α-SMA蛋白表达显著下调(<0.01)。免疫荧光染色结果与Western blotting结果一致,与对照组比较,模型组collagen I阳性表达增加;与模型组比较,莪术油组collagen I阳性表达减少。

与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
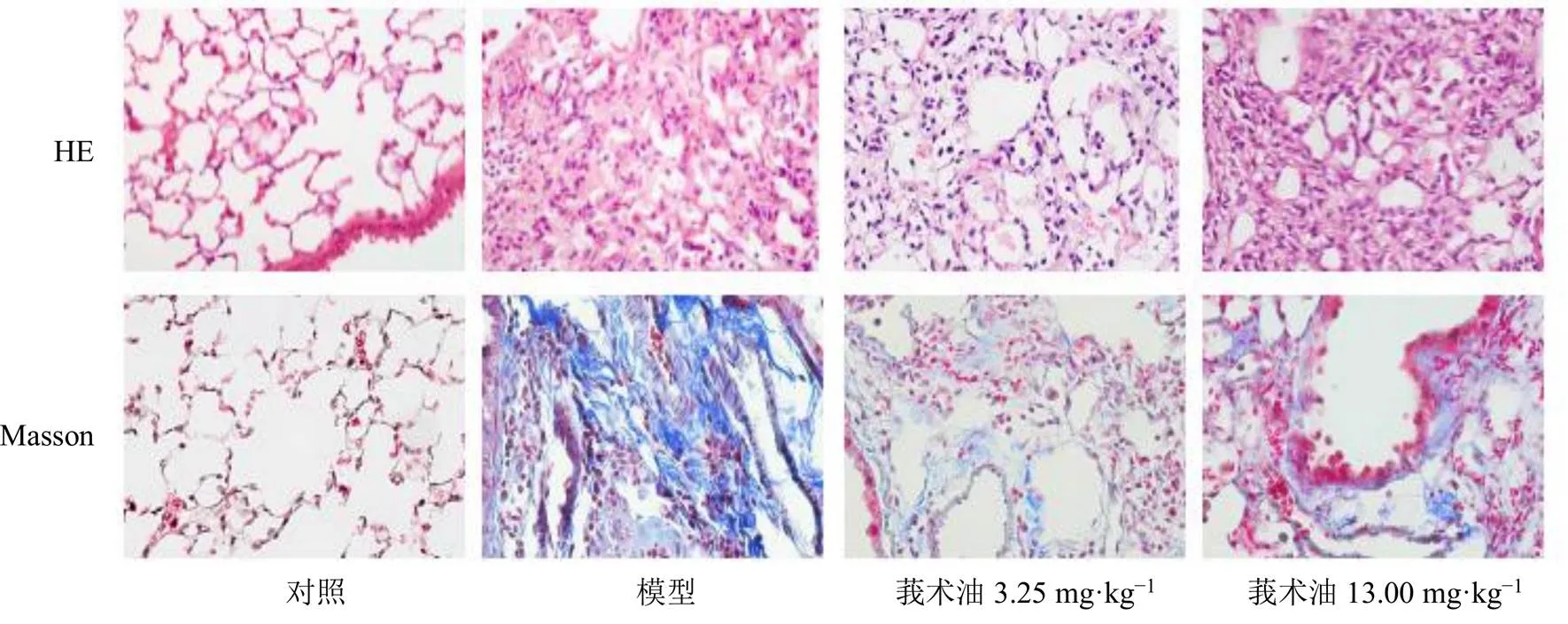
图2 莪术油对肺纤维化小鼠肺组织病理变化的影响(×400)

图3 莪术油对肺纤维化小鼠肺组织中collagen I、α-SMA和vimentin蛋白表达的影响(, n = 3)
3.4 莪术油降低肺纤维化小鼠血清中IL-1β、IL-6、TNF-α水平
如图4所示,与对照组比较,模型组小鼠血清中IL-1β、IL-6、TNF-α水平均显著升高(<0.05、0.01);与模型组比较,莪术油低剂量组小鼠血清中IL-1β、IL-6、TNF-α水平均显著降低(<0.01)。
3.5 莪术油改善肺纤维化小鼠氧化应激及减少HYP
如图5所示,与对照组比较,模型组小鼠肺组织中MDA和HYP含量显著升高(<0.01),GSH含量显著降低(<0.01),SOD活性呈降低趋势;与模型组比较,莪术油各剂量组GSH含量显著升高(<0.01),MDA含量显著降低(<0.01),SOD活性呈升高趋势;莪术油低剂量组HYP含量显著降低(<0.05)。

图4 莪术油对肺纤维化小鼠血清中炎症因子水平的影响(, n = 7)
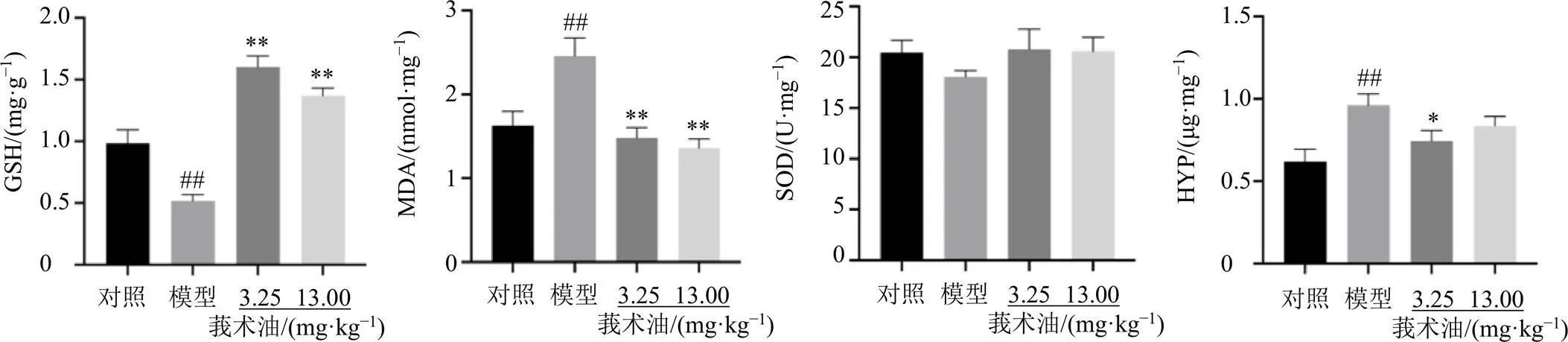
图5 莪术油对肺纤维化小鼠肺组织中氧化应激指标和HYP含量的影响(, n = 6)
3.6 莪术油抑制肺纤维化小鼠肺组织中铁死亡相关蛋白表达
如图6所示,与对照组比较,模型组肺组织中GPX4蛋白表达水平显著降低(<0.01),TFR1和DMT1蛋白表达水平显著升高(<0.05、0.01);与模型组比较,莪术油各剂量组GPX4蛋白表达水平显著升高(<0.01),TFR1和DMT1蛋白表达水平显著降低(<0.05、0.01)。免疫荧光染色结果与Western blotting结果一致,与对照组比较,模型组GPX4阳性表达减少;与模型组比较,莪术油组GPX4阳性表达增加。

图6 莪术油对肺纤维化小鼠肺组织中GPX4、TFR1和DMT1蛋白表达的影响(, n = 3)
4 讨论
肺纤维化是一种慢性间质性肺病,主要特征为ECM的过度表达和沉积、肌成纤维细胞形成的纤维灶累积以及肺重塑异常[14]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是间充质细胞产生和ECM过度分泌的重要途径之一,最终可能导致肺纤维化的发生[15]。EMT的过程主要表现为上皮黏附蛋白下调和间质细胞标记物α-SMA上调,同时包括纤连蛋白、vimentin、collogen I、collogen III、collogenIV等的生成[16]。莪术为姜科姜黄属植物,其性温,味辛、苦,归肝、脾经,其功效为破血祛瘀行气、消肿止痛。莪术油是从莪术中提取的挥发油,临床常用于抗炎、抗肿瘤治疗[17]。本课题组前期研究已证实莪术提取物对脂多糖(lipopolysaccharide,LPS)引起的小鼠急性肺损伤有一定的改善作用[18],但对博来霉素诱导的小鼠肺纤维化是否有改善作用及其作用机制尚未明确。
铁死亡是一种新型程序性细胞死亡,其特征为细胞内铁过载和活性氧(reactive oxygen species,ROS)积累[19]。铁离子是脂质过氧化物积累和铁死亡过程所必需的。因此,参与铁离子结合、转运、解离和储存的蛋白在铁死亡的调节中起着重要作用。Fe3+与转铁蛋白结合后通过膜上的TFR进入细胞。随后,细胞中的Fe3+被前列腺六跨膜上皮抗原3(six-transmembrane epithelial antigen of prostate 3,STEAP3)还原为Fe2+,Fe2+通过DMT1或锌-铁调节蛋白家族8/14(zinc-iron regulatory protein family 8/14,ZIP8/14)释放到细胞质中。这些相关蛋白的异常表达或功能障碍会使细胞内铁离子浓度失衡,导致铁过载。GPX4可减弱脂质过氧化物的毒性并维持双层脂质细胞膜稳定性,表明它是铁死亡的中枢调节因子[20]。GPX4表达降低导致细胞内脂质过氧化物累积,最终引起铁死亡[21]。研究发现,肺纤维化和肺损伤的诱导剂博来霉素和LPS可以诱导肺上皮细胞发生铁死亡。铁死亡抑制剂利普罗他汀-1(liproxstatin-1,Lip-1)可通过减少脂质过氧化,抑制铁死亡缓解博来霉素或LPS诱导的肺纤维化症状。TGF-β刺激上调人肺成纤维MRC-5细胞和小鼠原代肺成纤维细胞中TFR1的表达,导致细胞内Fe2+增加,从而促进成纤维细胞向肌成纤维细胞的转化[12]。还有研究发现,一些化合物和传统中药证实了铁死亡与纤维化之间存在联系[22-23]。表明铁死亡在肺纤维化的发生和发展中起着重要作用。因此,通过抑制铁死亡来缓解肺纤维化具有较高的创新性和实际应用价值。
本研究采用博来霉素诱导建立小鼠肺纤维化模型,造模7 d后隔日给予不同剂量莪术油治疗,给药14 d后,收集小鼠肺组织用于后续实验。实验结果表明,莪术油改善了博来霉素引起的小鼠体质量减轻和肺干湿质量比增加。进一步,HE染色结果表明,与模型组相比,莪术油治疗组小鼠肺组织结构更加完整,炎性细胞浸润程度更轻,肺脏纤维化改变减少;Masson染色结果表明,与模型组相比,莪术油治疗组小鼠肺组织中胶原明显减少。肺泡上皮细胞向成纤维细胞,以及成纤维细胞向肌成纤维细胞的转化在肺纤维化的发病机制中起着至关重要的作用。本研究结果显示,模型组小鼠肺组织collogen I、α-SMA、vimentin蛋白表达上调,且肺组织中collogen I沉积增多,表明博来霉素诱导的小鼠肺纤维化中有EMT发生;莪术油治疗减少了肺泡上皮细胞向成纤维细胞,及成纤维细胞向肌成纤维细胞的转化,下调了这些相关蛋白的表达。表明莪术油可以通过调节EMT,抑制上皮细胞转化或成纤维细胞转化从而改善肺纤维化。HYP为胶原纤维所特有,因此可以通过检测HYP的含量,从而评估纤维化程度。结果表明,莪术油治疗组可以在一定程度上改善小鼠肺组织中的纤维化程度。
研究表明,肺纤维化的发展与多种炎症因子相关,肺纤维化极易出现IL-1β、IL-6、TNF-α的过表达,高水平的TNF-α增加胶原沉积,导致肺损伤[24];IL-1β和IL-6通过激活TGF-β信号通路诱导EMT发生[25-26]。结果显示,博来霉素诱导的小鼠肺组织中IL-1β、IL-6、TNF-α水平提高,而经过莪术油干预后肺纤维化小鼠血清中相关炎症因子有所减少,其中莪术油低剂量组的下调作用明显,说明低剂量莪术油可能通过降低与纤维化相关的炎症因子水平,达到改善博来霉素诱导的小鼠肺纤维化的目的。研究证实,氧化应激促进了肺纤维化的产生,在肺纤维化的过程中,氧化应激水平提高,大量ROS产生,肺泡上皮细胞发生铁死亡,促进了成纤维细胞转化和肌成纤维细胞分化,引起了ECM过表达和过量沉积,最终导致了纤维化的产生[27]。结果显示,肺纤维化的产生会引起氧化应激相关产物(MDA)、还原酶(GSH、SOD)的活性改变,通过莪术油治疗可以下调MDA表达、上调GSH表达。说明莪术油可以改善博来霉素诱导的小鼠肺纤维化组织中的氧化损伤程度。Western blotting法检测铁死亡相关蛋白表达,结果表明,与模型组相比,莪术油给药治疗后GPX4表达上调,TFR1和DMT1表达下调,免疫荧光染色结果与Western blotting一致。说明莪术油减轻肺纤维化小鼠纤维化程度可能是通过抑制铁死亡实现的。莪术油作为一种中草药,具有天然、经济、易获取等优势,可以为肺纤维化患者提供有效的治疗选择。此外,最新的研究结果表明,雷公藤可以通过调节核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)/血红素氧合酶-1(heme oxygenase-1,HO-1)通路抑制铁死亡,从而减轻百草枯所致的急性肺损伤和肺纤维化[28],与本实验结论相吻合。证明了中草药的多成分、多靶点特性也为肺纤维化的个体化治疗提供了新的思路和方法。
综上,本研究发现博来霉素通过促进炎症因子释放,诱导氧化失衡,从而激活铁死亡引起小鼠肺组织发生ECM沉积,纤维化形成。莪术油干预后改善肺组织的炎性状态,重建氧化还原平衡状态,上调肺组织中GPX4,下调TFR1和DMT1的表达从而抑制铁死亡,减少胶原沉积,最终减轻博来霉素诱导的小鼠肺纤维化。
利益冲突 所有作者均声明不存在利益冲突
[1] Gross T J, Hunninghake G W. Idiopathic pulmonary fibrosis [J]., 2001, 345(7): 517-525.
[2] Noble P W, Barkauskas C E, Jiang D H. Pulmonary fibrosis: Patterns and perpetrators [J]., 2012, 122(8): 2756-2762.
[3] King T E Jr, Jr B, Castro-Bernardini S,. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis [J]., 2014, 370(22): 2083-2092.
[4] Richeldi L, du Bois R M, Raghu G,. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis [J]., 2014, 370(22): 2071-2082.
[5] Chen K D, Li G P, Cui H R,. Systems pharmacology and GC-MS metabolomics reveal the efficacy and mechanisms of zedoary oil on acute liver injury induced by oxidative stress [J]., 2022, 104: 154295.
[6] 孔红芳, 袁书同, 袁飞龙, 等. 莪术油注射液化学成分、药理作用和临床应用的研究进展[J]. 中草药, 2023, 54(12): 4053-4060.
[7] 姜程曦, 郭月琴, 张淑君, 等. 莪术油注射液协同治疗新型冠状病毒肺炎 (COVID-19) 可行性浅析 [J]. 中草药, 2020, 51(11): 3062-3069.
[8] 顾燕兰, 张雅琴, 孙钢. 莪术醇对大鼠肺纤维化模型的干预作用及对TGF-β1和PAI-1表达的影响 [J]. 中医药导报, 2019, 25(10): 27-31.
[9] Xie Y, Hou W, Song X,. Ferroptosis: Process and function [J]., 2016, 23(3): 369-379.
[10] Gong Y, Wang N, Liu N G,. Lipid peroxidation and GPX4 inhibition are common causes for myofibroblast differentiation and ferroptosis [J]., 2019, 38(7): 725-733.
[11] Liu Y, Cheng D M, Wang Y,. UHRF1-mediated ferroptosis promotes pulmonary fibrosis via epigenetic repression of GPX4 andgenes [J]., 2022, 13(12): 1070.
[12] Pei Z, Qin Y F, Fu X H,. Inhibition of ferroptosis and iron accumulation alleviates pulmonary fibrosis in a bleomycin model [J]., 2022, 57: 102509.
[13] Lazo J S, Hoyt D G, Sebti S M,. Bleomycin: A pharmacologic tool in the study of the pathogenesis of interstitial pulmonary fibrosis [J]., 1990, 47(3): 347-358.
[14] Chapman H A. Epithelial-mesenchymal interactions in pulmonary fibrosis [J]., 2011, 73: 413-435.
[15] Kim K K, Kugler M C, Wolters P J,. Alveolar epithelial cell mesenchymal transition developsduring pulmonary fibrosis and is regulated by the extracellular matrix [J]., 2006, 103(35): 13180-13185.
[16] Lederer D J, Martinez F J. Idiopathic Pulmonary Fibrosis [J]., 2018, 378(19): 1811-1823.
[17] 魏巍, 王冰瑶. 莪术及其主要成分的药理作用研究进展[J]. 药物评价研究, 2022, 45(10): 2154-2160.
[18] Wu Y Z, Zhang Q, Wei X H,. Multiple anti-inflammatory mechanisms of Zedoary Turmeric Oil Injection against lipopolysaccharides-induced acute lung injury in rats elucidated by network pharmacology combined with transcriptomics [J]., 2022, 106: 154418.
[19] Stockwell B R, Friedmann Angeli J P, Bayir H,. Ferroptosis: A regulated cell death nexus linking metabolism, redox biology, and disease [J]., 2017, 171(2): 273-285.
[20] Xu W T, Deng H M, Hu S,. Role of ferroptosis in lung diseases [J]., 2021, 14: 2079-2090.
[21] Kim S, Kang S W, Joo J,. Characterization of ferroptosis in kidney tubular cell death under diabetic conditions [J]., 2021, 12(2): 160.
[22] Zhang Z L, Guo M, Li Y J,. RNA-binding protein ZFP36/TTP protects against ferroptosis by regulating autophagy signaling pathway in hepatic stellate cells [J]., 2020, 16(8): 1482-1505.
[23] Kong Z Y, Liu R, Cheng Y R. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway [J]., 2019, 109: 2043-2053.
[24] Shao S Q, Qu Z Y, Liang Y W,. Iguratimod decreases bleomycin-induced pulmonary fibrosis in association with inhibition of TNF-α in mice [J]., 2021, 99: 107936.
[25] Epstein Shochet G, Brook E, Bardenstein-Wald B,. TGF-β pathway activation by idiopathic pulmonary fibrosis (IPF) fibroblast derived soluble factors is mediated by IL-6 trans-signaling [J]., 2020, 21(1): 56.
[26] Zhang W J, Chen S J, Zhou S C,. Inflammasomes and fibrosis [J]., 2021, 12: 643149.
[27] Otoupalova E, Smith S, Cheng G,. Oxidative stress in pulmonary fibrosis [J]., 2020, 10(2): 509-547.
[28] Song C Y, Feng M X, Li L,.Hook. f. ameliorates paraquat-induced lung injury by reducing oxidative stress and ferroptosis via Nrf2/HO-1 pathway [J]., 2023, 252: 114575.
Mechanism of Zedoary Turmeric Oil on attenuating bleomycin-induced pulmonary fibrosis in mice through inhibition of ferroptosis
WANG Yin-tong1, 2, WANG Cheng-gong3, JIA Si-ning3, YU Wen-xiu1, WANG Fang-yan4, JIANG Cheng-xi3, CHENG Jin-guo2
1. The Second Affiliated College of Wenzhou Medical University, Wenzhou 325000, China 2. The First Affiliated College of Wenzhou Medical University, Wenzhou 325000, China 3. School of Pharmacy, Wenzhou Medical University, Wenzhou 325000, China 4. School of Basic Medicine, Wenzhou Medical University, Wenzhou 325000, China
To explore whether Zedoary Turmeric Oil (莪术油) can alleviate bleomycin induced pulmonary fibrosis in mice by inhibiting ferroptosis and the specific mechanism.A total of 40 C57BL/6 male mice were divided into control group, model group, and Zedoary Turmeric Oil low-and high-dose (3.25, 13.00 mg/kg) groups. The model of pulmonary fibrosis was established by injecting bleomycin (3 mg/kg) through tracheal intubation in mice. The drug was administered 7 d after the model was established. The drug group was given Zedoary Turmeric Oil every other day for 14 consecutive days. After administration, the general condition of mice was evaluated by comparing their body weight and lung dry wet weight ratio in each group; Pathological changes of lung tissue was observed by HE and Masson staining; Levels of inflammatory factors in serum and hydroxyproline (HYP) and oxidative stress levels in lung tissue were detected; Western blotting was used to detect the expressions of pulmonary fibrosis and ferroptosis related proteins in lung tissue.Compared with model group, the body weight of mice in Zedoary Turmeric Oil group was increased (< 0.05), the degree of pulmonary edema was reduced, the damage of lung tissue was improved, and the deposition of collagen fibers was reduced; The levels of oxidation products malondialdehyde (MDA) and HYP in lung tissue were decreased (< 0.05, 0.01), and the activity of glutathione (GSH) was increased (< 0.05); The levels of inflammatory factors in serum were significantly reduced (< 0.01); Expressions of protein associated with pulmonary fibrosis collagen I, α-smooth muscle actin (α-SMA) and vimentin in lung tissue were down-regulated (< 0.05, 0.01), glutathione peroxidase 4 (GPX4) protein expression was up-regulated (< 0.01), transferrin receptor 1 (TFR1) and divalent metal transporter 1 (DMT1) protein expressions were down-regulated (< 0.05, 0.01).Zedoary Turmeric Oil can alleviate bleomycin induced-pulmonary fibrosis in mice by inhibiting ferroptosis, improving oxidative stress and inhibiting inflammation.
pulmonary fibrosis; Zedoary Turmeric Oil; ferroptosis; oxidative stress; inflammatory factors
R285.5
A
0253 - 2670(2023)16 - 5274 - 09
10.7501/j.issn.0253-2670.2023.16.016
2023-03-07
温州市新型冠状病毒肺炎疫情防控应急攻关项目(ZY202003)
王殷彤(1997—),女,硕士研究生,主要从事中医药防治纤维化的基础和临床研究。
程锦国,男,主任医师,博士生导师,主要从事中医药防治肾脏病的基础和临床研究。E-mail: wzwsjcjg@163.com
姜程曦,男,研究员,主要从事中药质量研究。E-mail: jiangchengxi@126.com
[责任编辑 李亚楠]
