牙鲆肠道益生菌的分离筛选及益生效果评价
2023-08-16王雪惠王祯辉董学旺郝俊耿绪云孙金生
王雪惠 王祯辉 董学旺 郝俊 耿绪云 孙金生

摘 要:為获得安全有效的牙鲆益生菌,从牙鲆(Paralichthys olivaceus)肠道分离到94株菌,经溶血性、消化酶活力测试筛选出3株候选菌:Y1、Y5、I66,进行16S rDNA分子鉴定,分别为枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloidophilus)和蜡样芽孢杆菌(Bacillus cereus)。经安全性检验后,开展为期4周的投喂试验,分别将3株菌以1×108 CFU·g-1 添加到饲料中投喂牙鲆,为3个试验组,同时设对照组(C),定期检测各组鱼血液先天免疫指标。结果发现,与对照组相比,试验组鱼淋巴细胞吞噬百分比显著升高(P<0.05),血清碱性磷酸酶(AKP)和溶菌酶(LYZ)活性显著升高(P<0.05),血清超氧化物歧化酶(SOD)活性极显著升高(P<0.01)。投喂相应饲料4周,腹腔注射溶藻弧菌(Vibrio alginolyticus)攻毒,试验组鱼死亡延迟,累积死亡率显著低于对照组(P<0.05)。综上,Y1、Y5和I66是牙鲆安全有效的益生菌,能促进先天免疫,提高抗病力,具有推广应用优势和潜力。
关键词:牙鲆;益生菌;酶活;先天免疫;抗病力
中图分类号:S917.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2023.08.007
Isolation, Screening and Evaluation of Intestinal Probiotics from Paralichthys olivaceus
WANG Xuehui1, WANG Zhenhui2, DONG Xuewang3, HAO Jun1, GENG Xuyun1, SUN Jinsheng4
(1. Tianjin Fisheries Research Institute, Tianjin 300221, China; 2. Tianjin Haifa Seafood Industrial Development Company Limited,Tianjin 300452, China; 3. Tianjin Animal Disease Prevention and Control Center, Tianjin 300402, China; 4. Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Science, Tianjin Normal University, Tianjin 300387, China)
Abstract: To obtain safe and effective probiotics derived from flounder (Paralichthys olivaceus), 94 strains were collected from the intestine of flounder. 3 candidate probiotics were screened out by hemolysis and digestive enzyme activity assays. Bacillus subtilis (Y1), Bacillus amyloidophilus (Y5) and Bacillus cereus (I66) were identified by 16S rDNA molecular approach, respectively. After the safety inspection, a four-week feeding test was carried out. The 3 strains were added to the diet at 1×108 CFU·g-1, which were used as three experimental groups, and a control group (C) was set up. The blood innate immune indexes in each group were tested regularly. The results indicated that the phagocytosis percentage of lymphocytes, the activity of alkaline phosphatase (AKP) and lysozyme (LYZ) of probiotics groups were significantly higher (P<0.05) than those of the control group (C), and the serum superoxide dismutase (SOD) activity of probiotics groups was extremely significantly increased (P<0.01). After feeding corresponding diet for four weeks, each group subjects were injected to seroperitoneum with pathogenic Vibrio alginolyticus. The death of the probiotics group was delayed, and the cumulative mortality was significantly lower than that of the control group(P<0.05). In conclusion, Y1, Y5 and I66 are safe and effective probiotics for flounder, which can promote innate immunity and improve disease resistance, and have advantages and potential for popularization and application.
Key words: Paralichthys olivaceus; probiotics; enzyme activity; immunity; disease resistance
牙鲆属鲽形目,繁殖力强,肉质鲜美,是我国重要的海水经济品种之一。随着集约化养殖规模的发展,由于养殖环境、养殖密度、饵料质量等因素的影响,疾病发生和流行在所难免[1],传统的疾病治疗方法以抗生素为主,但会对鱼类和水生环境产生诸多不良影响,包括容易造成药物残留和抗性因子的传递,产生抗药性病原菌等,给动物和人体健康带来危害,还可通过细胞间遗传物质的传递转移给对人类健康有害的菌株[2]。而益生菌被视为绿色、健康、安全的抗生素替代品[3],受到研究人员和产业界的关注,益生菌是改善鱼体健康的绿色添加剂,对宿主健康有积极作用且安全性更高,在鱼类养殖中具有很大的潜力和前景[4-7]。益生菌的英文名“Probiotic”源于希腊语,本意是“为了生命”,联合国粮农组织(FAO)和世界卫生组织(WHO)共同将其定义为:益生菌是一种“活的微生物,在给予足够剂量时,对宿主的健康起有益作用”[8]。益生菌能分泌各种酶类,通过调节宿主肠道或周围环境菌群,激活宿主免疫防御体系,或分泌拮抗物质与病原微生物竞争,从而对宿主产生有利作用[9]。Kozasa[10]1986年首次将益生菌应用到水产养殖中,此后水产益生菌的筛选和应用研究迅速发展,不论是在促进生长还是提高抗病力方面均取得良好效果[6-7,11-12],但也有使用效果不稳定的报道[13],一个重要的原因是菌株来自环境或恒温动物。Verschuere等[14]和Ninawe等[15]学者认为,从水产动物自身或环境中分离的益生菌应用在水产养殖中效果会更佳。本研究从健康牙鲆苗种肠道分离细菌,对分离到的细菌通过潜在致病性檢验和消化酶活性检测筛选出候选益生菌,筛选到的候选菌株经安全性检验后,添加到饲料中投喂牙鲆,评价其对牙鲆苗种生长和免疫效果的影响,为自身来源益生菌的开发和应用提供数据支持。
1 材料与方法
1.1 牙鲆肠道菌的分离
试验鱼来自天津某鲆鱼养殖场繁育的牙鲆苗种,健康无病,没有投喂过抗生素或其他药物,体长约8 cm,体质量15 g左右。用于分离牙鲆肠道菌的培养基为海水营养琼脂(SNA)平板,具体分离方法:用50 mg·L-1鱼用麻醉剂MS-222麻醉牙鲆10 min,于无菌条件下对试验鱼进行解剖,取肠道,去除内容物,用无菌生理盐水冲洗3次,放到预冷的无菌玻璃匀浆器中,每0.1 g肠道加1 mL无菌生理盐水匀浆,得匀浆原液。匀浆原液进行梯度稀释,稀释至10-5,分别取10-2、10-3、10-4、10-5 4个梯度的稀释液0.1 mL均匀涂布于海水营养琼脂(SNA)平板上,每个梯度做3个平行,25 ℃培养48 h以上。观察各个平板的菌落数量、形态、颜色、大小。挑单菌落划线纯化2~3次,挑取单菌落保种备用。
1.2 牙鲆肠道菌的筛选
1.2.1 潜在致病性的检测 将分离的肠道菌株用划线法分别接种于血琼脂平板(北京陆桥),25 ℃培养箱中培养24 h,根据菌落的溶血特征,筛选出不溶血的菌株。
1.2.2 产消化酶菌株的筛选 用于消化酶活性分析的培养基有酪蛋白培养基、脱脂乳培养基、淀粉培养基和油脂培养基,配制方法参照《微生物试验》,分别用于筛选产酪蛋白酶、蛋白酶、淀粉酶,以及脂肪酶的菌株[16]。
1.2.3 产蛋白酶试验 将分离到的不溶血菌株分别接种到海水营养肉汤中,25 ℃振荡培养48 h,4 500 r·min-1离心20 min,留上清液用于产酶试验。分别取受试菌上清0.1 mL加入到放置在酪蛋白培养基和脱脂乳培养基上的牛津杯中, 于25 ℃培养箱中培养24 h,观察酪蛋白培养基上牛津杯周围是否形成透明圈,脱脂乳培养基上牛津杯周围是否形成溶蛋白圈,并测量透明圈和溶蛋白圈直径,通过比较透明圈和溶蛋白圈直径即可判断菌株的产酶能力,透明圈和溶蛋白圈直径越大,产酶能力越强。
1.2.4 产淀粉酶试验 分别取受试菌上清0.1 mL加入到放置在淀粉培养基上的牛津杯中,于25 ℃培养箱中培养24 h。滴加少量碘液于培养基表面,轻轻旋转,使碘液铺满整个平板。观察并测量牛津杯周围透明圈直径。透明的水解圈区域显示有酶活,通过比较水解圈直径的数值来判断菌株的产酶能力,透明圈直径越大,产酶能力越强。
1.2.5 产脂肪酶试验 将分离到不溶血的菌株用划线法分别接种于油脂培养基上,于25 ℃培养箱中培养24 h,观察菌落上是否有红色斑点,有红色斑点的是能产脂肪酶的菌株。油脂培养基中的中性红在中性环境下呈黄色,在酸性环境下呈红色。若菌株分泌脂肪酶,脂肪酶能将培养基中的油脂分解为脂肪酸,使中性红变为红色。
1.3 候选益生菌的安全性检验
以体质量为(22.3±2.2) g、体长为(11±1) cm、120尾的健康牙鲆苗种为试验动物,检验筛选出的候选益生菌的安全性,试验在天津市某养殖公司的养殖水箱里开展,养殖水箱与养殖车间封闭循环水系统相连,水交换量50%·h-1,养殖水温21~ 22 ℃, 盐度22~23,溶氧8~10 mg·L-1。试验鱼在养殖水箱里适应7 d,随机分成4组,其中3组分别投喂添加候选益生菌的饲料,添加浓度为1×108 CFU·g-1具体方法是将细菌培养液按照体积质量比1∶40~1∶50(单位mL·g-1)拌到饲料中,另外1组为对照组,投喂牙鲆基础饲料,连续投喂7 d,分别统计各组牙鲆苗种的成活率,并于无菌条件下解剖肝、脾、肾,用1 mL无菌生理盐水制成组织匀浆,涂布在SNA琼脂平板上,看是否能分离到细菌,只有没有长出细菌,才能说明益生菌安全。
1.4 候选益生菌的鉴定
采用16S rDNA序列分析方法,对分离筛选到的3株候选益生菌进行鉴定。用细菌16S rDNA通用引物,扩增3株菌的16S rDNA片段,委托生工生物工程(上海)股份有限公司测序,序列在GenBank数据库中进行比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
1.5 应用效果评价
1.5.1 应用试验设计 经检验安全的3株候选益生菌,开展牙鲆应用试验。将3株菌分别接种在海水营养肉汤中,25 ℃振荡培养48 h,将细菌培养液按照体积质量比1∶40~1∶50(单位mL·g-1)拌到牙鲆基础饲料中,即得浓度为1×108 CFU·g-1的益生菌饲料,基础饲料为天津某饲料公司生产的牙鲆苗种饲料。
试验鱼为体长在9~11 cm的牙鲆健康苗种280尾,试验条件同1.3。试验鱼在养殖水箱适应7 d,待摄食正常后,随机分成4组:3个试验组,1个对照组,每组随机取20尾鱼称量体质量,计算初均质量。试验组分别投喂添加了不同候选益生菌的饲料,对照组投喂基础饲料,日投喂量为鱼体总重量的1.5%~2%。应用试验为期4周。
于投喂相应饲料前及投喂饲料4周后,每组随机取20尾鱼称量体质量,计算末均质量,用于生长指标的分析。于投喂饲料后1、2、3、4周,试验组和对照组每组随机取5尾鱼,尾静脉采血,采用两种方式采血:一种直接采集,用于收集血清,检测血液酶活;另一种采集抗凝血,用≥6 μL的肝素(30 U可抗凝1 mL血)溶液润湿的1 mL一次性注射器尾部取血200 μL,放到提前加了200 μL无菌生理盐水和200 μL M199培养基的1.5 mL离心管中,轻轻混匀,用于检测外周血细胞吞噬活性。
1.5.2 生长指标分析 根据试验前、投喂饲料4周的鱼体质量数据,分别计算每组初均质量、末均质量、平均增质量、增质量率、特定生长率,计算公式如下:
平均体质量=每组总质量/每组总尾数(1)
平均增质量=(末均质量-初均质量)/尾数(2)
增質量率=(末均质量-初均质量)/初均质量×100%(3)
特定生长率(%·t-1)=(ln w2-ln w1) ·t-1×100%(4)
式中,w1为初均质量,w2为末均质量,t为饲养时间。
1.5.3 细胞吞噬活性测定 取用于检测外周血细胞吞噬活性的血—生理盐水—培养基混合液100 μL,加入70 μL无菌生理盐水和30 μL灭活的金黄色葡萄球菌悬液,混匀,25 ℃,200 r·min孵育30 min。取孵育好的血-菌混合液涂片,每个样品涂片3张。用刘氏A液染色30 s,再加刘氏B液染色90~120 s,水洗,干燥,镜检。分别记录100个细胞中参与吞噬的细胞个数(吞噬百分率PP)和每个细胞吞噬细菌的个数(吞噬指数PI)。
吞噬百分率(PP)=(100个细胞中参与吞噬的细胞数/100)×100%(5)
吞噬指数(PI)=被吞噬的细菌数/吞噬细菌的细胞数(6)
1.5.4 血液酶活的测定 抽取的血液样品4 ℃过夜,3 000 r·min-1离心10 min,取血清。用南京建成试剂盒检测碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)和溶菌酶(LYZ)活性,24 h内测定完毕,依据试剂盒说明进行酶活力计算。
1.6 攻毒试验
投喂相应饲料4周后,3个试验组和1个对照组各取20尾鱼,每组设2个平行组,用本实验室保存的牙鲆致病菌——溶藻弧菌(3×107 CFU·mL-1)攻毒,腹腔注射50 μL·尾-1,每天记录各组的死亡数,统计2周时间,计算累计死亡率。
1.7 数据统计
数据分析采用单因素方差分析(One—Way ANOVA),并进行t检验,与对照组比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 筛选到3株候选益生菌
从健康牙鲆肠道分离到94株菌,其中不完全溶血(α溶血)43株,完全溶血(β溶血)25株,不溶血(γ溶血)26株。将26株不溶血菌株进行酪蛋白酶、蛋白酶、淀粉酶、脂肪酶活性检测,其中8株具有酪蛋白酶活性,8株具有蛋白酶活性,12株具有淀粉酶活性,6株具有脂肪酶活性,兼具3种酶活性的菌株有3株:Y1、Y5和I66。牛津杯直径为8 mm,3株菌的酪蛋白圈直径、溶蛋白圈直径、淀粉酶直径、脂肪酶活性详见表1。这3株菌不溶血,即没有潜在致病性,具有多种消化酶活性,传代稳定性好,被确定为益生菌候选菌株。
2.2 候选益生菌的安全性
投喂添加3株候选益生菌饲料1周,牙鲆苗种进食与活力正常,成活率均为100%。这说明3株菌以高剂量添加到饲料中投喂牙鲆,对鱼体也是安全无危害的。用SNA琼脂均未从各组鱼的肝、脾、肾分离到细菌,说明试验过程中未发生细菌位移。细菌位移是益生菌是否具有毒性的潜在标志,益生菌应用于养殖生产前评价其是否有细菌位移的风险十分必要[17]。试验中菌株未迁移到肝、脾或肾,是牙鲆安全的候选益生菌,可以开展养殖试验。
2.3 候选益生菌的分子生物学鉴定
综合溶血性、消化酶活性和安全性试验结果,对筛选出的3株候选益生菌进行16S rDNA测序,将测得菌株的16S rDNA 序列在GenBank中进行blast序列比对,比对结果显示,3株菌均为芽孢杆菌属,Y1与枯草芽孢杆菌(Bacillus subtilis)、Y5与解淀粉芽孢杆菌(Bacillus amyloidophilus)、I66与蜡样芽孢杆菌(Bacillus cereus)的同源性均达99%以上。
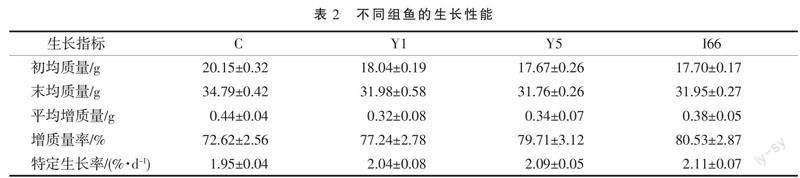
2.4 生长性能
分析了3株候选益生菌添加到饲料中投喂牙鲆4周对生长性能的影响(表2)。投喂添加候选益生菌组和投喂基础饲料组牙鲆的末均质量、平均增质量、增质量率,以及特定生长率均未见显著差异,说明添加的候选益生菌未能显著促进鱼体的生长,但也不会延缓鱼体生长;添加候选益生菌组的增质量率和特定生长率高于对照组,虽然统计学上没有呈现显著性差异,但有增高的趋势。
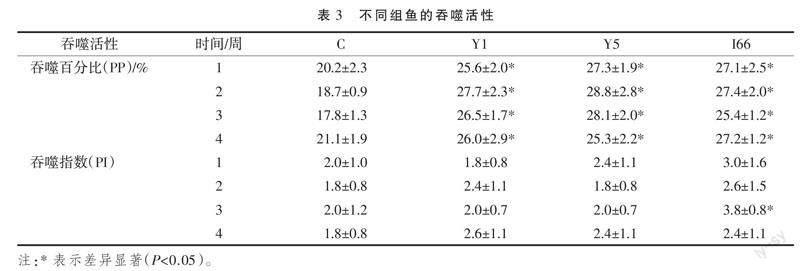
2.5 细胞吞噬活性
试验组和对照组分别于投喂相应饲料后1、2、3、4周,尾静脉采血,统计分析外周血细胞PP和PI,对照组4个时间点PI在(17.8±1.3)%~(21.1±1.9)%之间,P2在(1.8±0.8)~(2.0±1.2)之间。3个试验组4个时间点血细胞PP显著高于对照组,在(25.3±2.2)%~(28.8±2.8)%之间;投喂添加I66饲料3周时,血细胞PI显著高于对照组,为3.8±0.8;其他试验组血细胞PI与对照组不存在显著性差异(表3)。
2.6 血液酶活指标
3个试验组和1个对照组分别在投喂相应饲料1、2、3、4周时检测血液酶活。血液AKP活性随着鱼体生长呈上升趋势,于投喂4周时,3个试验组AKP活性显著高于对照组;血液ACP活性水平不随鱼体生长而发生变化,3个试验组与对照组的ACP活力水平均一致,不存在显著性差異;3个试验组血液SOD活性随着鱼体生长而升高,于3周时达到最高水平,与对照组形成极显著差异,4周时有所下降,但仍然显著高于对照组;3个试验组血液LYZ活性于投喂1周时即显著升高,且与对照组一直存在显著性差异(表4)。
2.7 攻毒试验
为评价饲料中添加候选益生菌对牙鲆抗病力的影响,开展攻毒试验,记录攻毒后试验组和对照组的死亡数,计算累计死亡率(图1)。攻毒后2 d,对照组即开始死亡,而试验组在攻毒10 d才开始出现死亡现象;随着时间的推移,到攻毒14 d时,对照组累计死亡率达到50%,而各试验组的累计死亡率在17.5%~30%范围内,显著低于对照组(P<0.05)。由此可见,饲料中添加Y1、Y5和I66菌均能提高牙鲆对溶藻弧菌的抵抗力,延缓发病,降低死亡率。
3 讨论与结论
随着健康养殖理念的不断深入和对食品安全性要求的不断提高,由抗生素导致的食品安全、生物和生态问题,特别是抗生素耐药性菌株的出现[18-19],使抗生素的使用受到严格管控,亟待寻找抗生素的替代品。益生菌是一类在微生态学理论指导下,经特殊工艺制成的含活菌或者包含细菌菌体及其代谢产物的活菌制剂,对宿主具有益生作用[20]。研究表明,益生菌的益生作用主要表现在促进机体生长、提高机体免疫力、改善肠道菌群平衡等[21-22],在水产养殖中还能改善养殖水体水质,具有绿色、无污染的特点,符合水产养殖业可持续发展战略,可以替代化学药品和抗生素在水产养殖中使用,保护养殖对象免受疾病危害[23];但益生菌的来源、使用量和投喂期等因素会影响益生菌的免疫调节活性[24-25],导致益生菌开发的复杂性和使用效果的不稳定性等;目前水产上使用的益生菌主要来自陆生动物[4],而对人类和陆生动物安全的益生菌可能对水生动物并不安全[26-27]。研究表明,益生菌在发挥作用时存在种属差异性和菌株特异性,宿主来源的益生菌在诸如温度、盐度、对生存环境的熟悉程度、对宿主的免疫条件等方面具有优势,具有巨大的开发潜力[5,18];Carnevali等[28]发现,从鱼类肠道中选择的益生菌可能具有更强的与本地有害微生物竞争、在肠道环境中占据主导地位的能力;而不合适的益生菌会对宿主的营养物质代谢、免疫调节等产生负面影响[5,29]。由此可见,应用于水生动物的益生菌必须考虑菌种来源问题,胃肠道(GIT)和黏液是水产养殖益生菌最常见的分离来源[5,25,30-32]。因此,本研究从健康养殖牙鲆苗种肠道进行细菌分离,通过产酶试验和安全性试验筛选出3株牙鲆肠道固有候选益生菌,并应用于牙鲆苗种养殖试验,避免益生菌应用时出现种属特异性,利于候选益生菌更好的在肠道黏附或定殖,发挥促进生长或提高免疫力等益生作用。
水产养殖中,益生菌主要通过酶促消化、促进生长、增强宿主免疫力等方面发挥益生作用[33]。本研究将筛选出的兼具3种消化酶活性的候选益生菌(Y1、Y5和I66)分别添加到基础饲料中投喂牙鲆,以期促进牙鲆对饲料营养成分的消化吸收,提高牙鲆生长速率。经过4周的养殖试验,发现添加益生菌组牙鲆未在生长性能方面显现优势,但益生菌组的增质量率和特定生长率高于对照组,即使统计学上没有显现显著性差异,但均有增高的趋势。类似的结果也有报道,Sun等[34]研究了快速生长的石斑鱼肠道优势菌——短小芽孢杆菌和克劳氏芽孢杆菌分别以1.0×108 cells·g-1的浓度添加到饲料中投喂石斑鱼60 d,益生菌饲养组的体质量增加和特定生长速度没有明显的改善,推测可能与投喂时间或投喂剂量有一定关系。
益生菌应用最大的益处之一就是调节宿主免疫[35]。本研究通过定期检测外周血细胞吞噬活性、血液酶活(AKP、ACP、SOD、LYZ)等非特性免疫指标来评价益生菌在增强鱼体免疫力方面的作用。吞噬活性出现在鱼类先天免疫应答的早期,对机体抵抗细菌入侵起着重要作用;AKP和ACP是动物体内参与免疫防御的重要水解酶;SOD是机体内一种重要的抗氧化酶,主要是清除动物体液或组织中的超氧基,在防御细胞组织超氧阴离子毒性、生物分子损伤方面具有重要的作用[36];LYZ是存在于溶酶体内的水解酶,是鱼类先天免疫系统重要的防御分子,是抵御病原微生物入侵的屏障[37]。目前也有不少关于益生菌调节水产动物先天免疫方面的报道,Newaj-Fyzul等[38]研究发现,枯草芽孢杆菌(Bacillus subtilis)能提高虹鳟鱼的免疫反应包括白细胞数量显著增加、呼吸爆发和吞噬活性增强等,亦能提高虹鳟对致病性嗜水气单胞(Aeromonas hydrophila)的抵抗力;高肖微等[39]研究发现,将地衣芽孢杆菌(Bacillus licheni-formis)以不同剂量添加到饲料中投喂鲤鱼,投喂20、40、60 d,均能显著提高鲤鱼SOD活性(P<0.05),投喂40、60 d,能显著提高溶菌酶(LYZ)活性,且随着地衣芽孢杆菌(Bacillus licheniformis)添加量的增加,鲤鱼免疫机能不同程度显著提高(P<0.05);Amoah等[40]在饲料中添加凝结芽孢杆菌(Bacillus coagulans)投喂凡纳滨对虾,发现血清溶菌酶(LYZ)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)活力等先天免疫指标显著提高,且对副溶血弧菌(Vibrio Parahaemolyticus)的抗感染力增强;Taoka等[41]用含有枯草芽孢杆菌(Bacillus subtilis)、嗜酸乳杆菌(Lactobacillus acidophilus)、丁酸梭菌(Clostridium butyricum)和酿酒酵母(Saccharomyces cerevisiae)益生菌产品添加到饲料中投喂牙鲆,牙鲆体表黏液和血浆中的溶菌酶活性均高于对照组[41]。本研究也取得类似结果,3个试验组4个时间点血淋巴细胞PP显著高于对照组;3个试验组AKP、SOD和LYZ的活力显著或极显著的高于对照组;投喂30 d后用牙鲆致病菌进行攻毒,3个试验组鱼发病延迟,累计死亡率显著低于对照组。以上均说明,益生菌候选菌株Y1、Y5、I66的添加,促进了牙鲆血液外周血细胞的吞噬活性,提高了牙鲆的先天免疫水平,增强了鱼体的抗病力。
这3株菌经鉴定分别为:枯草芽孢杆菌(Y1)、解淀粉芽孢杆菌(Y5)和蜡样芽孢杆菌(I66)。芽孢杆菌是水产养殖行业应用广泛的一类益生菌,因其具有易保存、抗逆行能力强等特点,在水产养殖上有许多应用的实例[14,40,42-43]。本研究筛选出的3株菌,均有分泌消化酶的活力,以往的研究结表明,饲料中添加具有分泌消化酶活性的益生菌能补充鱼体肠道消化酶不足的缺陷,促进饲料的消化吸收,提高饵料利用率,促进鱼体生长,但本研究未获得同样的结果,仅增质量率和特定生长率有增高的趋势,原因可能是投喂时间较短,不足以显现显著性差异。本试验条件下,Y1、Y5、I66这3株菌添加到饲料中投喂牙鲆,能显著增强牙鲆外周血细胞吞噬活性、血液碱性磷酸酶、超氧化物歧化酶和溶菌酶活性;提高牙鲆对溶藻弧菌的抵抗力,是牙鲆有效益生菌,可以在牙鲆苗种生产中应用。为了达到更好的效果,后期可以开展最佳添加剂量、最佳投喂期的优化试验,从而确定这3株益生菌的最佳应用方案。
参考文献:
[1] 赵志涛, 石磊, 王文娟, 等. 益生菌、益生元和合生元预防鱼类弧菌病应用的研究进展[J]. 饲料研究, 2022, 45(16): 115-119.
[2] GOMEZ-GIL B, ROQUE A, TURNBULL J F. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms[J]. Aquaculture, 2000, 191(1/3): 259-270.
[3] HE T F, LONG S F, MAHFUZ S, et al. Effects of probiotics as antibiotics substitutes on growth performance, serum biochemical parameters, intestinal morphology, and barrier function of broilers[J]. Animals, 2019, 9(11): 985.
[4] IRIANTO A, AUSTIN B. Probiotics in aquaculture[J]. Journal of Fish Diseases, 2002, 25(11): 633-642.
[5] LAZADO C C, CAIPANG C M A, ESTANTE E G. Prospects of host-associated microorganisms in fish and penaeids as probiotics with immunomodulatory functions[J]. Fish & Shellfish Immunology, 2015, 45(1): 2-12.
[6] MENG D L, HAO Q, ZHANG Q S, et al. A compound of paraprobiotic and postbiotic derived from autochthonous microorganisms improved growth performance, epidermal mucus, liver and gut health and gut microbiota of common carp (Cyprinus carpio)[J]. Aquaculture, 2023, 570: 739378.
[7] SHARIFUZZAMAN S M, AUSTIN B. Influence of probiotic feeding duration on disease resistance and immune parameters in rainbow trout[J]. Fish & Shellfish Immunology, 2009, 27(3): 440-445.
[8] SANDERS M E. How do we know when something called “Probiotic” is really a probiotic? A guideline for consumers and health care professionals[J]. Functional Food Reviews, 2009, 1(1): 3-12.
[9] G?譫MEZ G D, BALC?魣ZAR J L. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology and Medical Microbiology, 2008, 52(2): 145-154.
[10] KOZASA M. Toyocerin (Bacillus toyoi) as growth promotor for animal feeding[J]. Microbiologie Aliments Nutrition, 1986, 4(1): 121-135.
[11] 何偉聪, 董晓慧, 谭北平, 等. 益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J]. 动物营养学报, 2015, 27(12): 3821-3830.
[12] FERNANDES S, KERKAR S, LEITAO J, et al. Probiotic role of salt Pan bacteria in enhancing the growth of whiteleg shrimp, Litopenaeus vannamei[J]. Probiotics and Antimicrobial Proteins, 2019, 11(4): 1309-1323.
[13] NIKOSKELAINEN S, OUWEHAND A C, BYLUND G, et al. Immune enhancement in rainbow trout (Oncorhynchus mykiss) by potential probiotic bacteria (Lactobacillus rhamnosus)[J]. Fish & Shellfish Immunology, 2003, 15(5): 443-452.
[14] VERSCHUERE L, ROMBAUT G, SORGELOOS P, et al. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671.
[15] NINAWE A S, SELVIN J. Probiotics in shrimp aquaculture: avenues and challenges[J]. Critical Reviews in Microbiology, 2009, 35(1): 43-66.
[16] 沈萍, 陳向东. 微生物学实验[M]. 5版. 北京: 高等教育出版社, 2018: 216-217.
[17] STEFFEN E K, BERG R D. Relationship between cecal population levels of indigenous bacteria and translocation to the mesenteric lymph nodes[J]. Infection and Immunity, 1983, 39(3): 1252-1259.
[18] ZORRIEHZAHRA M J, DELSHAD S T, ADEL M, et al. Probiotics as beneficial microbes in aquaculture: an update on their multiple modes of action: a review[J]. Veterinary Quarterly, 2016, 36(4): 228-241.
[19] SCHWARZ S, KEHRENBERG C, WALSH T R. Use of antimicrobial agents in veterinary medicine and food animal production[J]. International Journal of Antimicrobial Agents, 2001, 17(6): 431-437.
[20] MARTEAU P R. Probiotics in clinical conditions[J]. Clinical Reviews in Allergy & Immunology, 2002, 22(3): 255-273.
[21] FAO, WHO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R]. Córdoba: FAO, 2001.
[22] JAVADI A, KHATIBI S A. Effect of commercial probiotic (Protexin R) on growth, survival and microbial quality of shrimp (Litopenaeus vannamei)[J]. Nutrition and Food Science, 2017, 47(2): 204-216.
[23] BANDYOPADHYAY P, MISHRA S, SARKAR B, et al. Dietary Saccharomyces cerevisiae boosts growth and immunity of IMC Labeo rohita (Ham.) juveniles[J]. Indian Journal of Microbiology, 2015, 55(1): 81-87.
[24] DAWOOD MAO, KOSHIO S, ISHIKAWA M, et al. Interaction effects of dietary supplementation of heat-killed Lactobacillus plantarum and β-glucan on growth performance, digestibility and immune response of juvenile red sea bream, Pagrus major[J]. Fish & Shellfish Immunology, 2015, 45(1): 33-42.
[25] HAI N V. Research findings from the use of probiotics in tilapia aquaculture: a review[J]. Fish & Shellfish Immunology, 2015, 45(2): 592-597.
[26] WANG A R, RAN C, WANG Y B, et al. Use of probiotics in aquaculture of China-a review of the past decade[J]. Fish & Shellfish Immunology, 2019, 86: 734-755.
[27] RAN C. Isolation and characterization of Bacillus spp. as potential probiotics for channel catfish, Ictalurus punctatus[D]. Auburn: Auburn University, 2013.
[28] ZORRIEHZAHRA M J, DELSHAD S T, ADEL M, et al. Probiotics as beneficial microbes in aquaculture: an update on their multiple modes of action: a review[J]. Veterinary Quarterly, 2016, 36(4): 228-241.
[28] CARNEVALI O, ZAMPONI M C, SULPIZIO R, et al. Administration of probiotic strain to improve sea bream wellness during development[J]. Aquaculture International, 2004, 12(4): 377-386.
[29] BURR G, GATLIN D III, RICKE S. Microbial ecology of the gastrointestinal tract of fish and the potential application of prebiotics and probiotics in finfish aquaculture[J]. Journal of the World Aquaculture Society, 2005, 36(4): 425-436.
[30] HAI N V. The use of probiotics in aquaculture[J]. Journal of Applied Microbiology, 2015, 119(4): 917-935.
[31] WU Z Q, JIANG C, LING F, et al. Effects of dietary supplementation of intestinal autochthonous bacteria on the innate immunity and disease resistance of grass carp (Ctenopharyngodon idellus)[J]. Aquaculture, 2015, 438: 105-114.
[32] TAPIA-PANIAGUA S T, D?魱AZ-ROSALES P, LE?N-RUBIO JM, et al. Use of the probiotic Shewanella putrefaciens Pdp11 on the culture of Senegalese sole (Solea senegalensis, Kaup 1858) and gilthead seabream (Sparus aurata L.)[J]. Aquaculture International, 2012, 20(6): 1025-1039.
[33] GIRI S S, SUKUMARAN V, OVIYA M. Potential probiotic Lactobacillus plantarum VSG3 improves the growth, immunity, and disease resistance of tropical freshwater fish, Labeo rohita[J]. Fish & Shellfish Immunology, 2013, 34(2): 660-666.
[34] SUN Y Z, YANG H L, MA R L, et al. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides[J]. Fish & Shellfish Immunology, 2010, 29(5): 803-809.
[35] NAYAK S K. Probiotics and immunity: a fish perspective[J]. Fish & Shellfish Immunology, 2010, 29(1): 2-14.
[36] 李敬璽, 刘继兰, 王选年, 等. 超氧化物歧化酶研究和应用进展[J]. 动物医学进展, 2007, 28(7): 70-75.
[37] SAURABH S, SAHOO P K. Lysozyme: an important defence molecule of fish innate immune system[J]. Aquaculture Research, 2008, 39(3): 223-239.
[38] NEWAJ-FYZUL A, ADESIYUN A A, MUTANI A, et al. Bacillus subtilis AB1 controls Aeromonas infection in rainbow trout(Oncorhynchus mykiss, Walbaum)[J]. Journal of Applied Microbiology, 2007, 103(5): 1699-1706.
[39] 高肖微, 齐遵利, 张秀文. 饲料中添加地衣芽孢杆菌对鲤鱼生长性能及非特异性免疫功能的影响[J]. 饲料工业, 2016, 37(8): 16-19.
[40] AMOAH K, HUANG Q C, TAN B P, et al. Dietary supplementation of probiotic Bacillus coagulans ATCC 7050, improves the growth performance, intestinal morphology, microflora, immune response, and disease confrontation of Pacific white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2019, 87: 796-808.
[41] TAOKA Y, MAEDA H, JO J Y, et al. Growth, stress tolerance and non-specific immune response of Japanese flounder Paralichthys olivaceus to probiotics in a closed recirculating system[J]. Fisheries Science, 2006, 72(2): 310-321.
[42] HONG H A, DUC L H, CUTTING S M. The use of bacterial spore formers as probiotics[J]. FEMS Microbiology Reviews, 2005, 29(4): 813-835.
[43] SELIM K M, REDA R M. Improvement of immunity and disease resistance in the Nile tilapia, Oreochromis niloticus, by dietary supplementation with Bacillus amyloliquefaciens[J]. Fish & Shellfish Immunology, 2015, 44(2): 496-503.
收稿日期:2023-04-12
基金項目:天津科技大学省部共建食品营养与安全国家重点实验室开放课题资助项目(SKLFNS-KF-202106);国家重点研发计划资助(2020YFD0900400)
作者简介:王雪惠(1979—),女,山东烟台人,高级工程师,硕士,主要从事鱼类病害及免疫防治技术研究。
通讯作者简介:孙金生(1965—),男,天津人,研究员,博士,主要从事水产动物疾病控制等方面研究。
