小鼠细小病毒VP2蛋白在昆虫细胞-杆状病毒系统中的表达和免疫原性分析*
2023-08-15赵迎峰赵志刚恽时锋
马 畅 赵迎峰 陈 莉 刘 彪 赵志刚 恽时锋
(1.中国人民解放军东部战区总医院医疗保障中心实验动物室,全军实验动物科普与伦理教育基地,全国科普教育基地,南京 210002)(2.中国人民解放军东部战区总医院第三派驻门诊部,南京 210002)
小鼠细小病毒(minute virus of mice,MVM)是啮齿类动物常见病原体,对肿瘤细胞、肠上皮细胞、造血细胞和淋巴细胞均具有较高亲和力[1-2],是细胞培养中的常见污染源[3-4]。MVM稳定性极强,在4 ℃或37 ℃放置一周,感染滴度下降不超过1.2 Log[5]。因此MVM污染不易清除和灭活,已成为危害生物制品安全的一个重要因素。自然情况下,MVM感染成年小鼠不表现任何临床症状,但能影响免疫系统、肿瘤接种和皮肤移植等实验数据的准确性[2,6-7]。因此,表达出免疫原性较好的抗原蛋白,可为MVM VP2相关功能的研究和临床诊断方法的建立提供依据。
1 材料和方法
1.1 材料
1.1.1细胞、杆状病毒表达系统:草地贪夜蛾卵巢细胞系(Spodoptera frugiperda cells 9, Sf9)由本实验室保存;Bac-To-Bac®杆状病毒表达系统采购于Life technologies公司。
1.1.2主要试剂:硫酸庆大霉素、氨苄青霉素、卡那霉素、链霉素、四环素、IPTG、X-Gal(北京索莱宝科技有限公司);Alexa Fluor 555标记驴抗小鼠IgG、辣根过氧化物酶标记山羊抗小鼠IgG、免疫染色固定液及His标签蛋白纯化试剂盒(碧云天生物技术公司);0.3%TritonX-100(北京博奥森生物技术有限公司);PCR相关试剂(南京诺维赞生物科技有限公司);BAC/PAC DNA提取试剂盒、无内毒素质粒提取试剂盒、DNA胶回收试剂盒(OMEGA公司);HiGene 转染试剂(普利莱基因技术有限公司);BamHI和EcoRI【宝日医生物技术(北京)有限公司】;I-Max昆虫细胞无血清培养液(维森特生物技术有限公司);PCR引物和优化基因序列由南京金斯瑞生物科技有限公司合成。
1.1.3序列优化与引物合成:根据NCBI GenBank中公布的MVM株全基因(GenBank:J02275.1)中VP2序列(2792-4554),进行编码序列偏好性优化,并在序列两端增加酶切位点、C端添加His-tag,合成后插入pUC57,命名为pUC57-MVM VP2,由本实验室保存。pUC57-MVM VP2和VP2特异引物均由南京金斯瑞生物科技有限公司合成。引物序列信息见表1。

表1 引物序列信息
1.1.4重组杆状质粒的构建及鉴定:质粒pUC57-MVM VP2作为模板,利用特异引物进行目的片段扩增。扩增体系:稀释后的质粒模板1 μL,MVM VP2-F/R引物(10 μmol/L)各1 μL,2× Phanta Max Master Mix 12.5 μL,灭菌水补足至25 μL。扩增程序:95 ℃ 30 s预变性,扩增片段35个循环(变性95 ℃ 15 s,退火56 ℃ 15 s,延伸72 ℃ 55 s),彻底延伸72 ℃ 5 min。PCR扩增产物经1%琼脂糖凝胶电泳,切下目的片段回收和纯化。回收片段经BamHI和EcoRI双酶切后,插入pFastBac1载体中,构建pFastBac1-MVM VP2重组质粒。提取质粒,取1 μg转化至DH10Bac感受态细胞,涂布蓝白斑筛选LB平板,恒温培养箱37 ℃避光培养。蓝白斑筛选两次后,挑选出白色单克隆用MVM VP2-F/R、pUC/M13-F/R引物进行PCR鉴定,扩大培养后提取Bacmid杆粒,获得重组Bacmid-MVM VP2,经再次PCR鉴定后备用。实验过程严格按照试剂盒说明书和杆状病毒表达系统操作说明书进行。
1.1.5重组杆状病毒的获得:参照HiGene转染试剂说明书,利用HiGene转染试剂将Bacmid-MVM VP2 转染至Sf9细胞,27 ℃温箱培养至细胞出现明显病变时,1 200 r/min、4 ℃低温离心5 min,弃去细胞和碎片沉淀,上清液即为第一代重组病毒rBac-MVM VP2(P0),按1∶10接毒比例传至第三代,测定病毒滴度(TCID50)后避光存放于4 ℃或分装冻存于-80 ℃冰箱。
1.1.6IFA鉴定蛋白表达:rBac-MVM VP2(MOI=1)感染Sf9细胞,同时设空白Sf9作对照,27 ℃恒温箱培养。分别于48、72 h后弃除细胞培养液,加入免疫染色固定液室温固定10 min,PBST洗涤3次;TritonX-100室温透膜10 min,PBST清洗,加入1∶500稀释的MVM鼠源单克隆抗体(由本实验保存),37 ℃孵育1 h,PBST清洗;加入1∶500稀释的Alexa Fluor 555标记驴抗小鼠IgG,37 ℃避光孵育45 min,PBST清洗后置于荧光显微镜下观察。
1.1.7Western blot检测蛋白表达:重组病毒感染Sf9细胞,操作同步骤1.6,27 ℃、90 r/min恒温摇床悬浮培养,于48、72 h分别收集细胞,使用MVM鼠源单克隆抗体作为一抗,辣根过氧化物酶标记山羊抗小鼠IgG作为二抗,进行Western blot检测。
1.1.8蛋白纯化:Sf9细胞同1.1.5方法接种重组杆状病毒,72 h后1 200 r/min低速离心收集细胞,去除培养液加入预冷细胞裂解液4 ℃作用30 min。超声破碎处理,超声条件:超声功率300 W,每次超声10 s,间隔10 s,共超声破碎10 min。细胞裂解液10 000 r/min、4 ℃低温离心10 min,上清液经0.45 μm蛋白低吸附针头滤器过滤后进行纯化。纯化过程严格遵照试剂盒说明书进行,SDS-PAGE检测纯化蛋白。
2 结果
2.1 重组杆状质粒的构建及鉴定
以pUC57-MVM VP2质粒为模板,利用特异性引物成功扩增出MVM VP2条带,与预期大小1 781 bp一致(图1A)。再用限制性内切酶(BamHI和EcoRI)酶切纯化后的目的条带,酶切片断再次纯化后插入pFastBac1载体构建重组质粒pFastBac1-MVM VP2。重组质粒转化至DH10Bac感受态细胞,蓝白斑筛选后用PCR方法对Bacmid-MVM VP2菌液进行鉴定(扩增片断大小为2 300 bp+插入片段1 781 bp)。结果显示(图1B),第1、2、4、6号为阳性,选取4号Bacmid-MVM VP2重组菌提取重组杆粒,经再次PCR鉴定后(图1C)进行Sf9细胞转染。
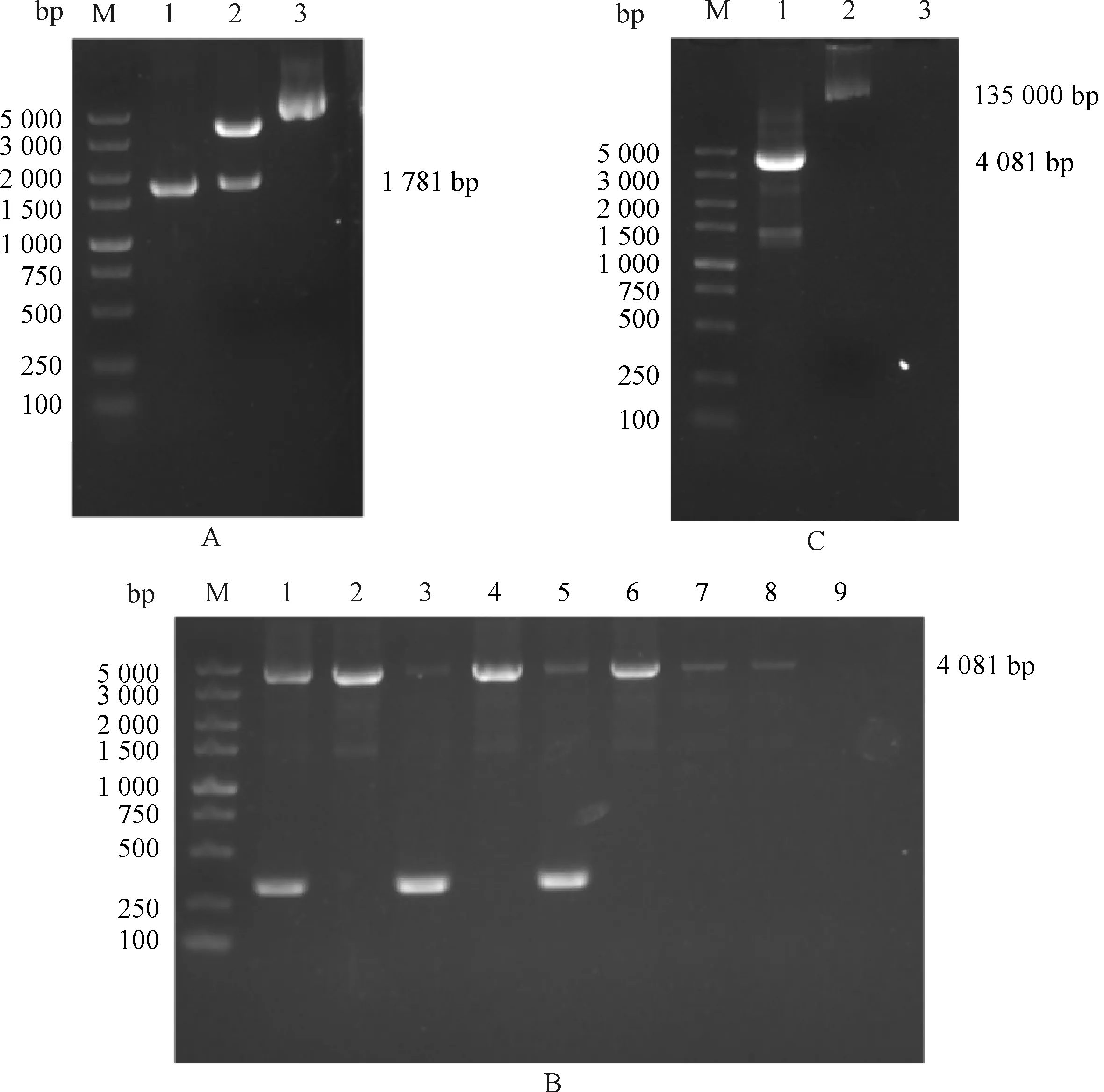
注:A.M:DL5000 DNA Marker;1.特异引物扩增产物MVM VP2;2.重组质粒pFastBac1-MVM VP2经BamH I和EcoR I双酶切;3.重组质粒pFastBac1-MVM VP2;B.M:DL5000 DNA Marker;1-8.pUC/M13引物对Bacmid-MVM VP2重组菌鉴定;9.阴性对照;C.M:DL5000 DNA Marker;1.pUC/M13引物鉴定Bacmid-MVM VP2 4号质粒;2.重组Bacmid-MVM VP2杆粒;3.阴性对照
2.2 重组杆状病毒rBac-MVM VP2的获得
将重组杆状质粒Bacmid-MVM VP2 转染至Sf9细胞,27 ℃恒温培养,每天观察细胞状态,直至出现病变,低温离心收集细胞上清液,获得重组杆状病毒P0代。与空白组相比,感染病毒后的Sf9细胞体积变大,核区扩增明显并向内凹陷,细胞边缘模糊颜色变暗,且有较多细胞碎片漂浮在培养液中。继续感染Sf9细胞,进行病毒增殖,收集病毒液并测定病毒滴度,P3株滴度可达到2.52×108TCID50/mL(图2)。
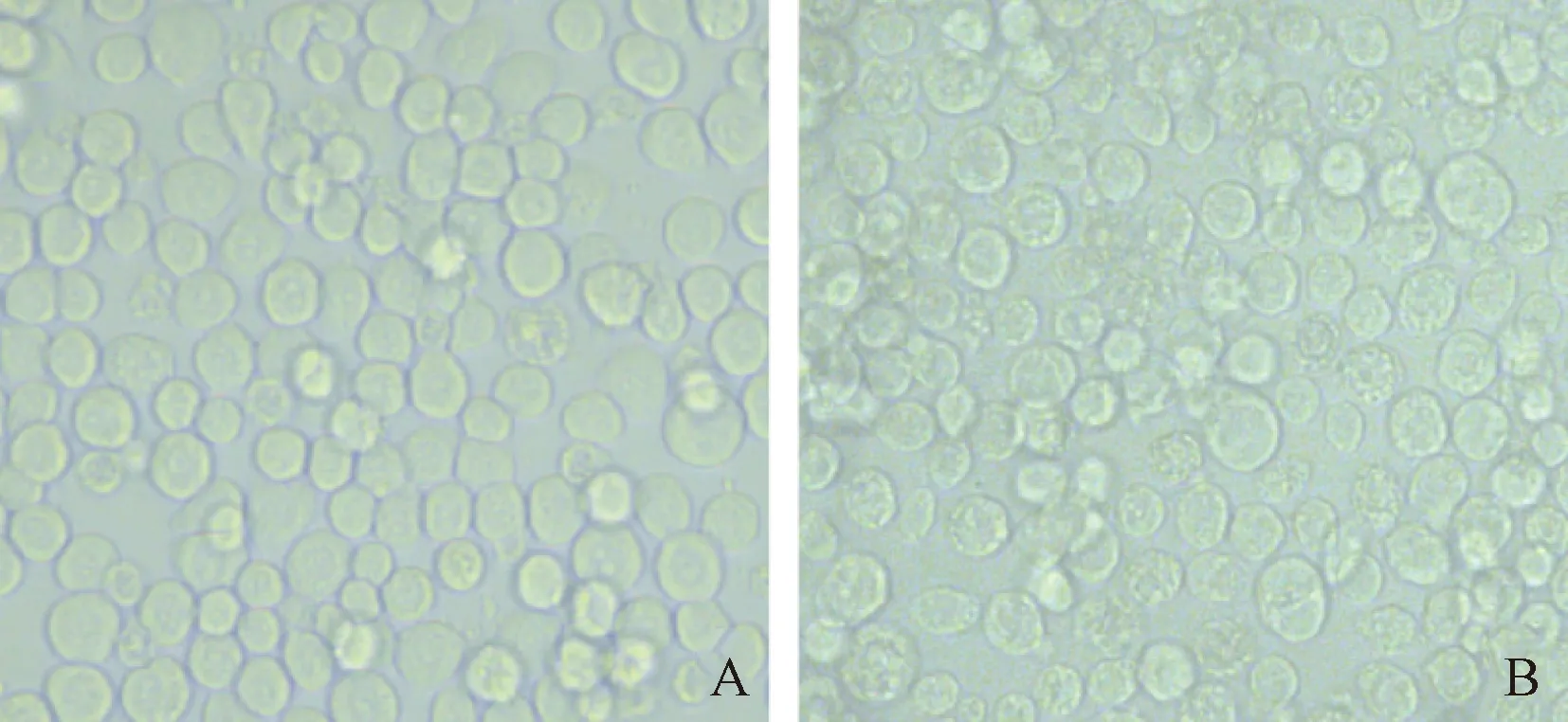
注:A.正常Sf9细胞; B.感染重组杆状病毒 rBac-MVM VP2 后病变的Sf9细胞
2.3 IFA鉴定蛋白表达
于接毒后48和72 h两个时间点,分别收集重组病毒感染(MOI=1)的Sf9细胞,IFA鉴定蛋白表达。如图3所示,感染rBac-MVM VP2 的Sf9细胞出现特异性红色荧光,而空白组无荧光。荧光强度统计结果显示,72 h感染细胞的荧光数量明显多于48 h的荧光数量(P<0.01)。表明接毒48和72 h后,Sf9细胞中均成功表达VP2重组蛋白,且在感染72 h后时蛋白表达量较高。
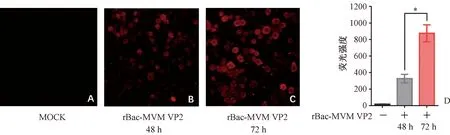
注:A.正常Sf9细胞; B.重组杆状病毒感染Sf9细胞48 h; C.重组杆状病毒感染Sf9细胞72 h; D.荧光强度统计图,*P<0.01
2.4 Western blot检测蛋白表达
于48和72 h两个时间点,分别收集病毒感染(MOI=1)的Sf9细胞蛋白,Western blot检测蛋白表达情况。如图4所示,重组VP2蛋白在Sf9细胞中得到高效表达,能与MVM鼠源单克隆抗体结合出现特异条带,大小约64 kU。且病毒感染72 h后胞内重组VP2蛋白的表达量明显较48 h高(P<0.01)。结果表明,感染病毒的Sf9细胞表达出的MVM VP2重组蛋白可与MVM单克隆抗体特异性结合,且在感染72 h后蛋白表达量较高。

注:M.蛋白Marker; 1.正常Sf9细胞; 2.重组杆状病毒感染Sf9细胞48 h; 3.重组杆状病毒感染Sf9细胞72 h;*P<0.01
2.5 重组蛋白纯化结果
重组杆状病毒感染(MOI=1)Sf9细胞,悬浮培养72 h后低速离心收集细胞。加入适量预冷细胞裂解液,冰浴条件下超声破碎细胞,裂解液经低温离心后收集上清进行蛋白纯化,SDS-PAGE检测纯化前后的蛋白纯度。如图5所示,经过多次洗涤后,可以得到纯度较高的VP2重组蛋白,大小约64 kU,蛋白大小符合预期。
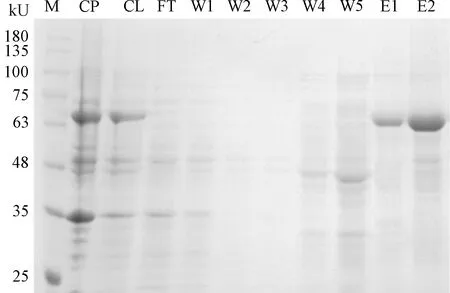
注:M.蛋白Marker; CP.细胞沉淀; CL.细胞裂解上清; FT.上样穿流液;W1~W5.洗涤液1-5; E1~E2.洗脱液1-2
3 讨论
细小病毒(MVM株)是啮齿类动物常见的感染性病原体,在欧洲、美国和澳大利亚等国家都有较高的感染率。我国也曾报道,在普通小鼠群体中MVM感染非常普遍[8],MVM已被列为实验动物国家标准中要求排除的感染性病原体。MVM对新生小鼠可以诱发致命性肾出血,但在自然条件下,MVM对成年小鼠常呈隐性感染,不表现任何临床症状。但研究报道,在涉及免疫系统、肿瘤移植的实验中,感染MVM可增强动物机体对诱发性或自发性肿瘤的抵抗力,直接降低肿瘤生长速度[9],还会干扰淋巴细胞的调节和腹水的产生,改变异体皮肤移植的排斥反应[2]。此外,由于MVM在外界环境中呈高度稳定性[10-11],所以设施内动物之间传播可能性很大。因此,建立针对MVM血清学和病原学的检测方法,表达出敏感性好、特异性高的抗原蛋白显得尤为重要。
MVM,细小病毒科细小病毒属,无包膜单链DNA病毒,基因组总长度约5 000 bp,呈二十面体对称结构,直径约26 nm[12]。基因组携带有5’ORF和3’ORF两个开放阅读框(open reading frame, ORF),前者编码结构蛋白VP1和VP2,而后者编码非结构蛋白NS1和NS2[13]。与VP1相比,VP2为主体衣壳蛋白(约占衣壳总蛋白的85%),主要参与病毒外壳的组装,并在入胞时介导病毒与受体蛋白的互作。所以,MVM VP2常作为免疫检测方法中的特异检测蛋白。
昆虫细胞-杆状病毒系统作为表达外源基因的有效途径,具有表达产量高、保持蛋白天然生物学特性的优点。除此,Sf9、High5等昆虫细胞具有培养操作简便、成本较低、易于扩大培养的特性,常广泛运用于重组蛋白的高效表达[14-15]。为此,本研究将MVM VP2目的序列优化为杆状病毒偏爱密码子序列,利用分子克隆技术将 MVM VP2 基因片断插入pFastBac1质粒。用双酶切方法验证重组质粒,再将其转化至DH10Bac细胞中进行重组,得到Bacmid-MVM VP2重组杆粒。重组杆粒用经典PCR方法验证正确后,利用脂质体转染试剂转染至呈对数期生长的Sf9细胞。通过Sf9昆虫细胞表达系统,成功获得重组杆状病毒rBac-MVM VP2。将此病毒感染Sf9细胞48和72 h后,分别进行IFA和Western blot验证。IFA结果显示感染rBac-MVM VP2的Sf9细胞48 h时出现VP2蛋白的特异性荧光,且在感染72 h时特异性荧光明显增多。同样,Western blot结果显示,感染 rBac-MVM VP2 的细胞48 h后即可被MVM鼠源单克隆抗体特异性识别,具有良好的免疫活性,且72 h时蛋白表达量明显升高。蛋白纯化SDS-PAGE结果显示,多次洗涤后,可洗脱下纯度较高的MVM VP2蛋白,蛋白大小与Western blot检测结果相同,符合预期。
综上,本研究利用昆虫细胞-杆状病毒系统成功表达MVM VP2蛋白,经鉴定重组VP2蛋白表现出良好的生物学构象,免疫原性较好,可为MVM VP2相关功能的研究和诊断方法的建立奠定基础。
