短链脂肪酸的功能研究进展
2023-08-12高亚男王加启
杨 雪,高亚男,王加启,郑 楠
(中国农业科学院北京畜牧兽医研究所,农业农村部奶及奶制品质量安全控制重点实验室,农业农村部奶产品质量安全风险评估实验室(北京),北京 100193)
短链脂肪酸(short chain fatty acid,SCFA)是特定的肠道菌群(结肠厌氧菌)发酵膳食纤维和抗性淀粉后产生的主要代谢物。SCFA是碳链为1~6 个碳原子的饱和脂肪酸,包括甲酸、乙酸、丙酸、丁酸、戊酸、己酸及其异构体[1]。SCFA参与机体新陈代谢,并在不同器官和组织中发挥重要作用,例如肠道、大脑、骨骼、脂肪组织和胰岛等[2]。而且,SCFA能调节碳水化合物的代谢和脂质的利用,并通过副交感神经系统调节能量代谢[3],维持机体的能量稳态,这一特性使得SCFA具有缓解或治疗肥胖和糖尿病的潜力[4-5]。此外,SCFA还可以抑制炎症以及肿瘤细胞的生长[6]。因此,SCFA是影响宿主生理功能的重要因素,其对人类健康具有重要的作用。
前期研究表明,SCFA主要通过抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)和激活G蛋白偶联受体(G-protein coupled receptors,GPRs)这两种信号转导机制调节机体反应。HDAC能调节基因表达,SCFA通过抑制HDAC引起机体的级联反应。SCFA作为信号分子,不仅可以通过改变组蛋白乙酰化作为表观基因组的重要调节器,还可以作为GPR41和GPR43(后分别更名为FFAR3、FFAR2)的内源性配体介导机体的多种反应[7]。FFAR2、FFAR3和GPR109A已被确定为SCFA的受体,研究表明,其在肠道、大脑、骨骼中高度表达,在调节机体功能中发挥着重要作用[8-9]。此外,SCFA能够通过改变细胞趋化性和吞噬功能、诱导活性氧的产生、影响细胞增殖及相关功能,发挥抗炎、抗肿瘤和抗菌等生理作用。综上,SCFA在机体健康中发挥了重要的作用。本文聚焦SCFA的功能研究进展,归纳总结了SCFA在体内的产生和吸收、发挥作用的信号转导机制及其在机体健康中发挥的作用,为后续SCFA在营养学领域的研究与应用提供理论参考。
1 SCFA的产生和吸收
1.1 SCFA在体内的产生途径
SCFA主要在肠道产生和释放,其中以较高浓度(70~140 mmol/L)在近端结肠中释放,而以较低浓度分别在远端回肠(20~40 mmol/L)和远端结肠(20~70 mmol/L)释放[10]。乙酸盐、丙酸盐和丁酸盐在结肠中产生的物质的量比为60∶20∶20。研究表明,产生SCFA的途径主要分为两大类(图1):1)植物性食物来源,以糖为底物合成SCFA、通过碳链延伸途径合成SCFA以及使用特定底物合成SCFA的其他代谢途径;2)动物性食物来源,以氨基酸为底物合成支链SCFA[11]。在以上两种合成途径中,不同的肠道菌群会参与不同种类SCFA的合成(表1),其中参与合成丁酸的肠道菌群最多,其次是丙酸,且参与合成这两种SCFA的肠道菌群都集中在变形菌门,参与合成乙酸的肠道菌群则分散在放线菌门、拟杆菌门、厚壁菌门、变形菌门和疣微菌门。
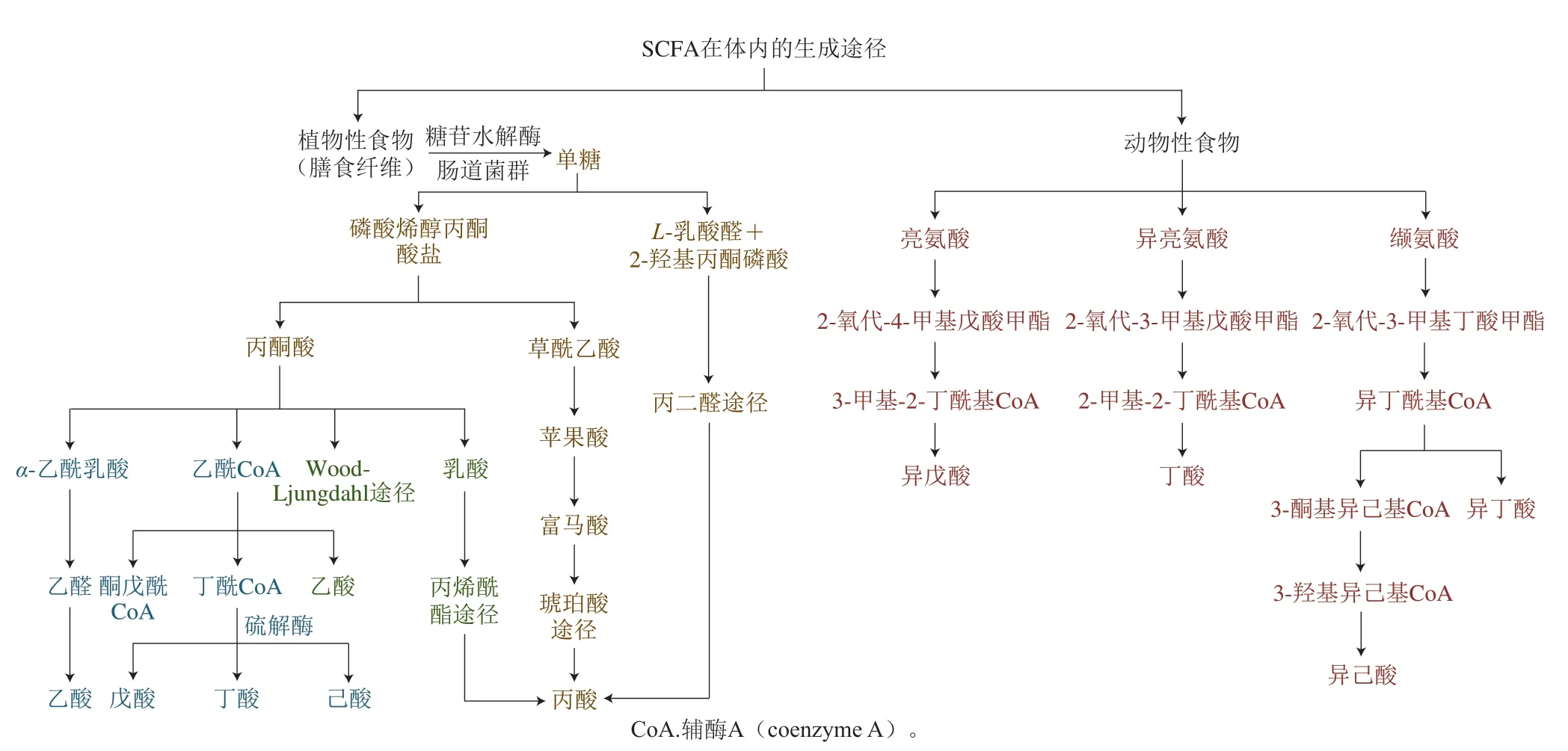
图1 SCFA在体内的生成途径Fig.1 Pathways of SCFA synthesis in vivo

表1 参与合成SCFA的肠道菌群Table 1 Gut microbiota involved in the synthesis of SCFA

续表1
1.1.1 植物性食物来源
1.1.1.1 以糖为底物合成SCFA
木聚糖酶、葡聚糖酶和阿拉伯糖酶等膳食纤维是肠道菌群产生SCFA的主要底物。糖苷水解酶及肠道菌群将膳食纤维降解为单糖,主要是戊糖和己糖[22],然后通过糖酵解或戊糖磷酸途径生成SCFA[23]。乙酸主要由丙酮酸通过两步酶催化(丙酮酸甲酸裂解酶和乙酸-辅酶A连接酶)与代谢中间体乙酰-辅酶A产生。产酸细菌,例如梭菌属的某些菌种,可以将一个葡萄糖分子转化为3 个乙酸分子[24]。丙酸合成中最重要的途径之一是琥珀酸途径,拟杆菌门如Dialisterspp.和Veillonellasp.等以戊糖或己糖为底物合成丙酸。此外,毛螺菌科和瘤胃球菌科可以将岩藻糖或鼠李糖等其他糖类作为丙二醇途径的底物合成丙酸[19]。
1.1.1.2 通过碳链延伸途径合成SCFA
通过辅酶A依赖性途径的碳链延长是丁酸合成的经典途径:两分子乙酰辅酶A可缩合生成一分子丁酰辅酶A,然后通过丁酰辅酶A和乙酸辅酶A转移酶转化成丁酸[25]。丁酰辅酶A也可以通过磷酸转丁酰酶和丁酸激酶转化为丁酸,但磷酸转丁酰酶和丁酸激酶在人结肠菌群中不常见[13]。之前的研究已经分离出了产生戊酸的Megasphaera elsdenii和Megasphaerasp.,戊酸合成的关键步骤由硫解酶催化,以丙酰辅酶A和乙酰辅酶A作为底物[26],但目前鲜有对戊酸合成代谢途径的深入研究。目前还没有确定的己酸合成途径,但通常认为丁酰辅酶A和乙酰辅酶A通过硫解酶缩合合成己酸[11]。
1.1.1.3 其他代谢途径
除了上述提到的两种合成途径外,SCFA还可以通过Wood-Ljungdahl途径合成。某些肠道细菌如Blautia hydrogenotrophica可以利用H2和CO2作为底物来合成乙酸,该菌株还可以将甲酸作为底物通过Wood-Ljungdahl途径合成乙酸[26]。此外,一些梭菌属通过丙烯酸酯途径,以乳酸作为前体物质通过丙烯酰辅酶A合成丙酸,但这种方式产生的丙酸有限[17]。丁酸也可以使用乳酸和乙酸作为底物,由厌氧菌属和真杆菌属合成[16]。乳酸是SCFA重要的代谢中间产物,可作为Megasphaera elsdenii合成戊酸的底物[20],或被梭菌属转化为丁酸或己酸[27]。
1.1.2 动物性食物来源
以氨基酸为底物合成支链SCFA即通过氨基酸代谢途径与α-酮酸的脱羧和还原途径相结合,可产生支链SCFA——异丁酸、异戊酸和异己酸[28]。大约17%和38%的支链SCFA分别通过盲肠、乙状结肠以及直肠中的蛋白质发酵产生[29]。缬氨酸、亮氨酸和异亮氨酸等氨基酸可以作为合成异丁酸、异戊酸、异己酸和2-甲基丁酸的底物。目前有研究已经分离出能够合成支链戊酸的天然肠源性菌Megasphaera elsdenii、Prevotella copri和Prevotella stercorea[20],为肠道菌群合成支链脂肪酸提供了强有力的支撑。此外,氨基酸的降解也会影响乙酸和丙酸的合成,如谷氨酸、丙氨酸、天冬氨酸代谢会影响三羧酸循环和丙酸前体琥珀酸的代谢。
1.2 SCFA的吸收
SCFA优先由三酰甘油分子水解产生,并直接从肠道转移到血液中。大多数SCFA在肠道附近产生和利用,其中一小部分丙酸和乙酸到达肝脏,通过线粒体β-氧化快速代谢,并可作为产生能量的三羧酸循环底物,有效代谢产生葡萄糖,成为机体的快速能量来源。
肠道中只有一小部分联合形式存在的SCFA可直接穿过上皮屏障,而绝大部分SCFA以电离状态存在,需要专门的转运蛋白才能被机体吸收。大部分SCFA主要通过单羧酸转运蛋白1(monocarboxylate transporter 1,MCT-1)和钠偶联单羧酸转运蛋白1(sodium-dependent monocarboxylate transporter 1,SMCT-1)这两种受体蛋白介导的主动运输穿过黏膜通道。MCT-1和SMCT-1在结肠细胞以及包括小肠和盲肠在内的整个胃肠道上都高度表达[30]。此外,MCT-1在淋巴细胞上也高度表达,SMCT-1在肾脏和甲状腺上表达,SMCT-1结合SCFA的亲和力顺序由强到弱依次为丁酸、丙酸、乙酸。所有未被机体吸收的SCFA均被排出体外[31]。综上所述,两种转运蛋白在全身的表达情况提示SCFA的摄取对于机体健康具有重要的意义。
2 SCFA的功能及其相关机制
SCFA对机体的许多器官和组织都有一定的生理功能,如图2所示,SCFA能促进和维持肠道健康、大脑功能和骨骼功能,缓解肥胖和糖尿病。此外,SCFA还参与免疫调节、发挥抗肿瘤和抗菌作用。SCFA调节宿主生物反应的能力取决于两个主要机制:1)直接抑制HDAC以调节基因表达,其中丁酸盐和丙酸盐具有内源性HDAC抑制剂活性;2)通过结合GPRs从而引发机体的级联反应,FFAR2、FFAR3和GPR109A是SCFA激活的主要受体。GPRs广泛存在于肠道、大脑、骨髓、肌肉、脂肪组织、外周交感神经元等中[32-35]。正是这种SCFA受体的表达模式使它们能够在器官和组织及一些病理学疾病如糖尿病、肥胖和代谢综合征、炎症性肠病等中发挥重要的作用。
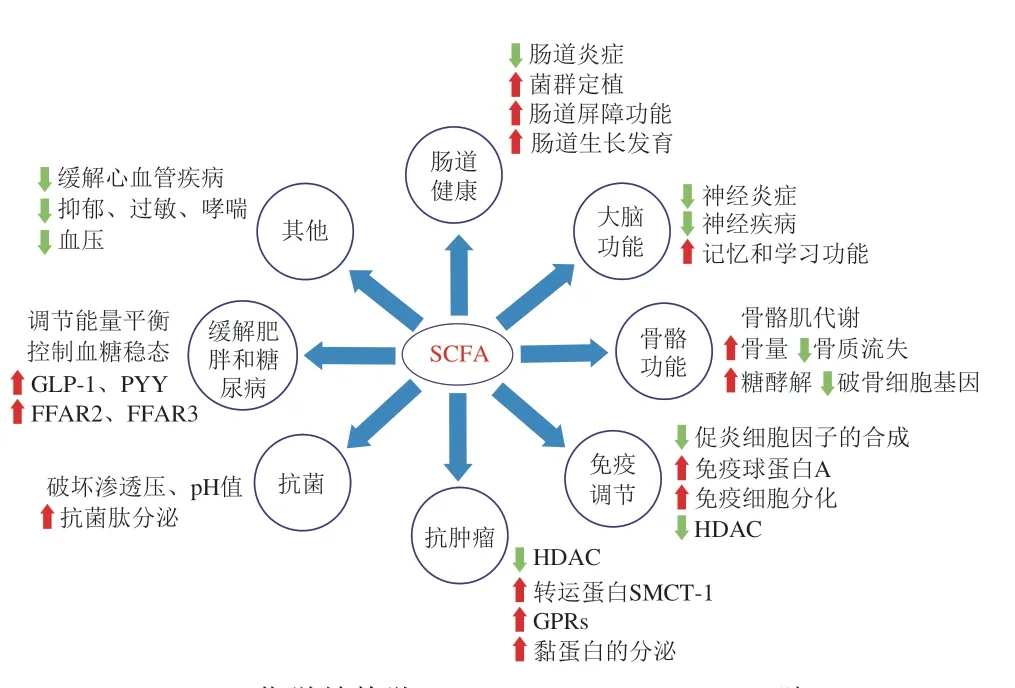
图2 SCFA的功能概括Fig.2 Overview of SCFA functions
2.1 肠道健康
SCFA能发挥多种作用以维持和改善肠道健康。例如,SCFA可以通过促进婴儿肠道菌群的定植,促进肠组织的生长和成熟[36];可以保持肠道屏障的完整性,防止肠道炎症[37]。SCFA主要通过激活腺苷酸单磷酸(adenosine monophosphate,AMP),活化腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)上调紧密连接蛋白的表达量来增强肠屏障功能[38-39]。SCFA还可通过改变肠上皮细胞系O2的消耗,使屏障保护相关的转录因子缺氧诱导因子(hypoxia inducible factor,HIF)稳定表达,从而增强肠道屏障功能[40]。研究表明,富含乙酸盐的酸奶可以改善肠道上皮对肠道的保护功能[41]。有学者将巴马母猪生产的12 头新生无菌仔猪随机分为对照组和SCFA处理组,对照组每天口服25 mL/kgmb无菌生理盐水,SCFA组每天口服25 mL/kgmb无菌SCFA混合物(乙酸、丙酸和丁酸浓度分别为45、15 mmol/L和11 mmol/L),结果表明SCFA显著降低了空肠、回肠和结肠中促炎细胞因子白细胞介素(interleukin,IL)-1β和IL-6的mRNA丰度,显著提高了空肠和血清中胰高血糖素样肽(glucagon-like peptide,GLP)2的含量,并增加了血液中白细胞、中性粒细胞和淋巴细胞计数,揭示外源性补充SCFA(独立于肠道菌群产生的SCFA)通过促进肠道发育和吸收功能以及增强肠道免疫功能,从而改善肠道健康[42]。此外,SCFA还影响胃肠道的黏液生成,从而减少上皮细胞与管腔微生物和有毒物质之间的相互作用,保护细胞免受消化过程中pH值波动的影响[43]。乙酸盐和丁酸盐主要通过上调黏蛋白2(mucoprotein 2,MUC2)基因表达刺激和增加大鼠结肠中黏蛋白的分泌和生成[44-45]。
除此之外,SCFA还能缓解肠道疾病。在肠易激综合征(irritable bowel syndrome,IBS)模型组中,从出生后第10天开始,对模型小鼠注射SCFA(第10~15天,0.3 mL/d;第16~21天,0.5 mL/d),在最后一次注射SCFA 2 周后,进行内脏超敏反应和结肠运动实验,结果表明0.5、1、5、10、30 mmol/L SCFA均能诱导IBS与腹泻相关的结肠张力、自发收缩幅度和频率以剂量依赖性降低,其中乙酸钠、丙酸钠、丁酸钠发挥抑制作用的半最大效应浓度(concentration for 50% of maximal effect,EC50)分别为4.79、7.58 mmol/L和3.15 mmol/L,丁酸抑制效果最好[46]。一项旨在分析3 种SCFA联合处理对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的斑马鱼仔鱼肠道炎症影响的研究显示,SCFA显著提高了TNBS处理后幼虫的存活率,保护了肠道内吞功能,减少了炎症细胞因子的表达及肠道中由TNBS引起的中性粒细胞浸润[47]。此外,丙酸能够直接作用于γδT细胞,通过抑制HDAC活性来抑制炎症性肠病患者γδT细胞产生IL-17[48]。同样,另一项研究也表明丁酸能通过HDAC8抑制己糖激酶2的表达,起到缓解结肠炎的作用[49]。此外,丁酸还可通过HDAC8在上皮细胞系和小鼠结肠内诱导肌动蛋白结合蛋白突触素(recombinant synaptopodin,SYNPO)的表达促进肠道上皮屏障功能和伤口愈合[50]。黏蛋白缺乏会加剧各种肠道疾病,例如黏膜炎,而SCFA能促进黏蛋白的合成来减少肠道损伤及溃疡;与SCFA混合溶液相比,单独使用丁酸能更有效地改善肠道损伤参数,缓解肠道黏膜炎[51],因此,丁酸可作为结肠黏膜的抗炎剂。
综上,SCFA可以通过激活或上调AMPK、肠道屏障相关蛋白来提高紧密连接蛋白和黏蛋白表达水平,提升肠道屏障的完整性,进而维持和促进肠道的健康。此外,SCFA还能通过抑制HDAC活性来缓解肠道相关疾病。
2.2 大脑功能
前期研究已经表明SCFA不仅可以改善认知功能,还可以改善脑源性疾病。作为肠道菌群的代谢物,SCFA缺乏的小鼠模型表现出认知障碍,而补充SCFA能够改善小鼠的认知功能[52]。母亲饮食中的纤维能够通过改变SCFA水平来调节后代的神经认知功能[53]。此外,丁酸可减轻脂多糖诱导的大鼠原代小胶质细胞、海马组织培养物以及小脑颗粒神经元、星形胶质细胞和小胶质细胞共培养物的炎症[54]。通过单剂量三乙酸甘油酯(6 g/kgmb)补充乙酸盐能减少大鼠神经炎症的发生[55]。在帕金森病动物模型中,丁酸处理改善了动物模型的运动障碍和多巴胺缺乏症状[56-57]。在躁狂症的动物模型中,丁酸钠干预逆转了大鼠的多动行为,降低了前额叶皮质、海马和杏仁核中线粒体呼吸链复合体的活性,并逆转了抑郁和躁狂行为[58]。与单独使用氟西汀(一种抗抑郁药)相比,丁酸盐(0.6 g/kgmb)联合氟西汀(10 mg/kgmb)治疗显著减少了小鼠的抑郁行为,且提高了脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达水平[59],推测BDNF可能在丁酸抗抑郁行为中发挥了重要的作用。在阿尔茨海默症小鼠模型中,丁酸处理恢复了小鼠的记忆功能,并提高了其与学习相关基因的表达水平[60]。此外,在小鼠体内全身注射(1.2 g/kgmb)和海马体内注射(55 mmol/L)丁酸钠可持续消除小鼠的恐惧[61]。在自闭症谱系障碍小鼠模型中,腹腔注射丁酸钠(100 mg/(kgmb·d),连续10 d)可通过调节兴奋-抑制平衡减轻社会缺陷[62]。前期研究证实SCFA水平与婴幼儿的神经认知功能息息相关[53],但目前关于SCFA缓解脑源性疾病的作用研究大多集中在动物模型上,还缺乏相关对人类的研究数据来支持这一作用。
2.3 骨骼功能
骨骼肌是人类最大的器官,在全身能量代谢中起着关键的作用,SCFA通过与特异性受体FFAR3和GPR109A结合发挥作用。FFAR3在结肠平滑肌中表达,SCFA以FFAR3依赖性方式诱导肌肉的阶段性收缩,改善骨骼功能[63]。GPR109A在破骨前体巨噬细胞中高度表达,在破骨细胞分化和骨吸收过程中发挥重要作用[64]。Lucas等[65]通过饮水给小鼠补充150 mmol/L乙酸钠,为期8 周,结果发现乙酸钠可以改善小鼠的骨形成。SCFA能够增加骨骼肌组织中的AMP表达量和AMP/ATP比率,从而诱导肌管和骨骼肌中AMPK的激活,进而诱导脂肪酸的摄取和氧化、葡萄糖的摄取和糖异生的增加,抑制脂肪生成和糖酵解[66-67]。SCFA还能够通过增加AMPK和PPARγ共激活因子1α(PPARγ coactivator 1 alpha,pGC1α)的磷酸化影响骨骼肌葡萄糖和脂质代谢,增加胰岛素受体底物1的表达和蛋白激酶b的磷酸化,从而保持骨骼肌胰岛素的敏感性[68]。此外,SCFA是体内破骨细胞代谢和骨量的调节剂,用其处理可显著增加小鼠骨量并防止绝经后以及炎症引起的骨质流失;SCFA对骨量的保护作用与破骨细胞分化和骨吸收的抑制有关,包括下调破骨细胞基因TRAF6和NFATc1的表达量等[65]。因此,SCFA作为破骨细胞代谢和骨量的调节剂,与特异性受体结合,AMPK的激活可能是SCFA改善骨骼肌代谢的关键机制。
2.4 免疫调节
在免疫系统中,SCFA的受体FFAR2在嗜酸性粒细胞、嗜碱性粒细胞、中性粒细胞、单核细胞、树突状细胞和黏膜肥大细胞上均能表达[69-70],同时,FFAR2在小鼠的骨髓和脾等造血组织中也高度表达[71-72],这表明SCFA在免疫反应中具有广泛的作用。SCFA激活FFAR2后,FFAR2通过激活β-arrestin 2抑制促炎性转录因子核因子κB(nuclear factor kappa-B,NF-κB)的激活,从而减少促炎性细胞因子IL-1β、IL-6的合成[73]。乙酸通过FFAR2介导肠道菌群的改变,促进结肠中免疫球蛋白A的产生[74]。FFAR3与SCFA结合后主要通过促进免疫细胞的分化参与骨髓合成,从而调节机体的免疫反应[75]。丁酸能在毫摩尔浓度下以低亲和力结合受体GPR109A。GPR109A在免疫细胞上表达,例如真皮树突细胞、单核细胞、巨噬细胞和中性粒细胞[76]。在丁酸的刺激下,GPR109A能激活巨噬细胞、树突状细胞等肠道免疫细胞,调节细胞因子的分泌,通过促进调节性T细胞(regulatory T cell,Treg)的分化、抑制辅助性T细胞17(T helper cell 17,Th17)的增殖,从而抑制肠道炎症与癌变[77]。分别用浓度2、20 μmol/L和200 μmol/L SCFA处理人外周血单核细胞,发现SCFA主要通过Toll样受体4(Toll-like receptor 4,TLR4)途径下调宿主促炎因子IL-1β、IL-6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)表达[78]。在母乳中可检测到的浓度(0.75 mmol/L)下,丁酸盐在3 种过敏动物模型中能有效刺激耐受性细胞因子、抑制Th2细胞产生、调节氧化应激,从而缓解食物过敏症状[79]。SCFA可诱导Treg细胞增殖,防止过度炎症反应的发生,因此可用于减轻或者治疗皮肤炎症症状[80]。此外,戊酸可通过调节淋巴细胞中的代谢活性,抑制肠道和中枢神经系统中异常的免疫细胞激活,发挥免疫调节作用[81]。
除了上述提到的通过结合GPRs受体调节免疫反应外,SCFA还可以通过抑制HDAC的活性来调节免疫细胞的免疫反应。例如,1 mmol/L乙酸可以通过抑制HDAC的整体活性,降低人巨噬细胞促炎因子IL-6、IL-8和TNF-α的表达水平[82]。同样,丁酸和丙酸处理显著降低了人外周血单核细胞中TNF-α的表达水平,其作用机制是通过抑制HDAC来调节细胞的炎症反应[83]。这些结果表明,SCFA能够通过抑制HDAC来调节与炎症相关的细胞因子的释放。此外,SCFA对HDAC抑制作用会调节T淋巴细胞和Treg细胞分化[84]。虽然上述研究已经证实了SCFA介导的免疫调节与HDAC活性有关,但对特定的HDAC抑制或表达的研究很少,需要进一步研究。综上,SCFA可通过激活GPR、抑制HDAC活性和调节Treg细胞等下调相关免疫细胞分泌促炎因子的表达水平,发挥免疫调节作用,抑制机体炎症、过敏等的发生。
2.5 抗肿瘤
SCFA可作为HDAC抑制剂发挥抗癌作用。丁酸是HDAC最有效的抑制剂[85],在浓度为0.5~5.0 mmol/L条件下可显著抑制HDAC活性,从而抑制结肠癌细胞增殖[86]。同时,丁酸可通过抑制HDAC的活性,诱导细胞周期停滞和细胞凋亡,抑制肿瘤的侵袭性[87]。SCFA也可通过激活GPR发挥抗肿瘤的作用[88]。丁酸诱导GPR109A活化后,一方面通过诱导细胞凋亡直接抑制结肠癌细胞的生长;另一方面通过促进MCT-1表达使得更多的丁酸转运至细胞而间接起作用。丁酸转运蛋白SMCT-1在结肠癌细胞上的表达对其抗肿瘤作用至关重要,并且与整体组蛋白乙酰化水平的增加有关[89]。与正常结肠细胞相比,SMCT-1在人结肠癌细胞中表达量下调,进一步证实了SMCT-1在结肠癌中的作用[90]。此外,丁酸会通过促进MUC2的合成来抑制人结肠癌细胞LS174T的增殖,从而抑制肿瘤的生长[91]。有研究表明,结直肠癌的肿瘤大小与粪便中的丁酸盐水平呈负相关[92]。综上,SCFA通过抑制HDAC活性、激活受体蛋白发挥抗癌作用,具体表现为减少细胞增殖、抑制肿瘤细胞的迁移和侵袭、促进细胞死亡、抑制肿瘤细胞的血管生成,从而降低癌细胞活性[93]。
2.6 抗菌活性
SCFA具有内在的广谱抗菌活性,如丙酸盐通常用作食品中的抗菌添加剂[94],而丁酸盐可用于防止沙门氏菌感染[95]。SCFA抗菌的关键机制包括破坏渗透压和pH值平衡、营养吸收以及能量产生,且发挥作用的有效浓度远低于其对宿主细胞的毒性阈值。丁酸通过抑制HDAC活性来促进细胞释放cathelicidin类抗菌肽[96],阻止志贺氏菌诱导的抗菌肽表达下调,2 g/kgmb丁酸钠通过提高抗菌肽的表达量缓解断奶仔猪大肠杆菌感染的临床症状,并提高肺泡巨噬细胞中细菌的清除率[97]。丁酸钠处理牛乳腺上皮细胞后,β-defensin类以及cathelicidin类内源性抗菌肽的表达水平均升高[98]。以上研究表明,SCFA主要通过促进抗菌肽的释放来发挥抗菌作用。
2.7 缓解肥胖和糖尿病
SCFA通过调节全身的能量平衡控制血糖稳态,具有缓解肥胖和糖尿病的潜力。将临床诊断为2型糖尿病的患者随机分为对照组和益生元治疗组,在保持能量和营养素一致的情况下,治疗组膳食纤维的摄入量(主要是SCFA)显著高于对照组,从28 d开始,治疗组血红蛋白和血糖水平均显著降低,证实SCFA不足与2型糖尿病有关[4]。与野生小鼠相比,SCFA受体FFAR2敲除小鼠GLP-1释放量减少,导致血糖升高,增加糖尿病的风险[32]。另一个SCFA受体FFAR3能参与丁酸诱导的蛋白激酶B(protein kinase B,Akt)的产生和AMPK信号转导,提高胰岛素敏感性标记物的表达水平[99]。前期研究表明,对喂食高脂饮食的小鼠补充5%(质量分数)乙酸,发现其显著抑制了高脂饲料诱导小鼠体质量的增加[100-101]。SCFA降低血糖和体质量的机制可能是通过分泌与食欲相关的GLP-1和PYY减少食物的摄入量,同时它们也可以直接调节脂肪组织。此外,FFAR2能调节血脑屏障的通透性,并促进肠道中GLP-1和PYY的合成。大鼠和兔子结肠被直接输注SCFA后,其通过与FFAR2结合诱导PYY的释放从而发挥厌食作用,达到缓解肥胖的作用[102]。进一步研究发现,高脂饮食会上调皮下脂肪组织中FFAR2的表达,同时增加脂肪细胞中的脂肪储存,而添加可产生SCFA的菊粉型果聚糖和可发酵碳水化合物会抑制高脂饮食导致的小鼠FFAR2过度表达,抑制小鼠体质量增加[103]。与FFAR2类似,接受高脂饮食饲喂的FFAR3敲除小鼠的体脂和血糖水平均高于野生型小鼠,并且FFAR3基因敲除小鼠的瘦素合成减少[104]。然而,也有研究表明FFAR2参与调节脂肪组织中的能量积累和脂肪生成,乙酸和丙酸通过上调小鼠脂肪组织中FFAR2的表达水平,导致血浆游离脂肪酸水平降低以及脂肪分解减少[105]。目前,FFAR2对人体脂肪组织的影响仍存在争议。综上,通过与受体FFAR2和FFAR3结合,SCFA对GLP-1和PYY水平的调节作用提示了其在靶向治疗肥胖和糖尿病中的潜力。但目前关于SCFA与肥胖和糖尿病之间的直接关系在人类研究中较少,且横断面或队列分析显示,SCFA与肥胖相关性的结果不一致。例如,一项研究表明肥胖女性空腹乙酸酯水平与内脏脂肪含量呈负相关[106],而另一项研究表明肥胖男性和女性空腹血浆中已酸盐水平与肥胖程度呈正相关[107]。因此,需要进一步探究SCFA在肥胖和糖尿病中的作用及其相关机制。
2.8 其他功能
除了上述提到的功能外,SCFA还具有其他功能,包括但不限于降血压,缓解心血管疾病、抑郁、过敏和哮喘,改善肝脏代谢,对心脏的保护以及延长婴儿的睡眠时间等。SCFA主要通过酰化作用缓解动脉样硬化、高血压和心力衰竭等心血管疾病[108]。它主要通过FFAR3介导的血管舒张降低血压,且FFAR3敲除小鼠表现出收缩性高血压,进一步证实了SCFA在治疗高血压方面的潜力[109]。通过体内和体外实验研究SCFA对心血管的影响时发现,SCFA能降低动脉压和心率,改善血压和心脏功能[110-111]。此外,丙酸能够缓解Akt缺失诱导的心肌细胞收缩和线粒体缺陷,对心脏具有保护作用[112]。一项调查青年人群粪便SCFA水平与抑郁症之间关系的研究显示,抑郁症状程度与乙酸盐水平呈显著正相关,与丁酸盐和丙酸盐水平呈显著负相关[113];同时,另一项研究显示,与非抑郁女性相比,抑郁女性粪便中乙酸含量显著降低,丙酸含量呈现下降趋势,异己酸含量显著增加[114]。由此可以看出,SCFA的水平变化与抑郁症具有显著相关性。一项针对301 名儿童的队列研究显示,SCFA与过敏和哮喘相关,且BALB/c小鼠实验证实SCFA能够降低过敏性气道炎症的严重程度[115]。此外,膳食补充SCFA能在不影响肠道环境的前提下,通过FFAR3改善肝脏代谢功能[116]。线性回归分析显示,丙酸盐每增加1%,7、8 月龄婴儿的最长夜间睡眠时间都会延长6 min,且粪便中丙酸的比例越高,婴儿睡眠时间越长[117]。
3 结语
SCFA在机体生理功能和健康方面发挥了重要的作用,包括维持肠道健康、大脑功能、骨骼功能,调节免疫反应,发挥抗炎和抗肿瘤等作用。此外,大量的动物研究也表明,SCFA具有缓解或治疗肥胖和糖尿病的潜力,以及缓解心血管疾病、抗抑郁、抗过敏和降血压等其他功能。但是,由于目前许多结果都是基于动物模型或体外研究,因此SCFA对人类健康的作用需要进一步研究,并应探究其潜在的作用机制,为SCFA在营养学上的研究与应用提供理论参考。
