樟科植物精油的研究进展
2023-08-12杜易潼薛婉玉范宇鑫姜子涛
杜易潼,王 颖,*,薛婉玉,范宇鑫,姜子涛,2,*
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津天狮学院食品工程学院,天津 301700)
樟科植物是一类数量庞大的被子植物,大多数为常绿或落叶的乔木或灌木。目前,全球已知樟科植物约有45 个属、2 000~2 500 个种,我国有约20 个属,包括樟属(Cinnamomum)、木姜子属(Litsea)、月桂属(Laurus)、山胡椒属(Lindera)、鳄梨属(Persea)等[1]。上述属中的主要代表植物有肉桂(CinnamomumcassiaPresl)、阴香(Cinnamomum burmannii(Nees et T.Nees)Blume)、香樟(Cinnamomum camphora(L.) Presl)、龙脑樟(Cinnamomum camphorachvar.Borneol)、猴樟(Cinnamomum bodinieriLévl.)、木姜子(Litsea pungensHemsl.)、香桂(Cinnamomum subaveniumMiq.)、山胡椒(Lindera glauca(Sieb.et Zucc.) Bl)、琼楠(Beilschmiedia madang)以及牛油果(Persea americanaMill)等。其中肉桂、阴香、木姜子等为著名的药材,具有悠久的入药历史;香樟和龙脑樟则能够作为化工及医药行业常用的樟脑和樟油提取原料;香樟、润楠、猴樟的木材坚硬、细致,常作为优质建材,在造船、家具制造等领域应用广泛,具有极高的经济价值[2];肉桂、山胡椒、月桂叶等作为传统的香辛料,可以有效提高肉制品的品质并延长其保质期,是一种天然的抑菌剂及抗氧化剂[3]。
大量文献表明,樟科植物在我国分布广泛。例如,我国肉桂种植面积和年产量均居世界首位,种植面积约24万 hm2,年产桂皮130 000 t、桂油2 000 t,肉桂产品出口亚洲、欧美的40多个国家和地区,年贸易额超过4亿美元[4];我国山苍子(又名山鸡椒,Litsea cubeba)总种植面积1.44万 hm2,占全国经济林总面积的0.04%,其中挂果面积1.28万 hm2,山苍子油年产量14.01万 t,总产值9.76亿元[5];四川省宜宾市宜宾县油樟种植面积约50万 亩(1 亩=667.6 m2),年产值6 000万元,已形成一定的产业规模[6]。樟科植物的枝叶及种子中精油含量极高,是丰富的精油资源。早在20世纪50年代,樟科植物精油就已经被开发及利用,学者们发现樟科樟属中种内精油存在内化学型(或生理型),即同属同种的植物精油成分存在多样性,即便同一种枝叶精油主要成分的化学型亦可能有较大差异,其中主要类型包括芳樟醇型、龙脑型、桉油素型以及异橙花叔醇型等[7]。早期针对樟科植物的研究主要集中在樟属精油中,随着近年来人们对丰富的樟科植物资源探索和利用的深入,肉桂属、月桂属、木姜子属、山胡椒属等的植物精油亦逐渐引起学者们的关注。例如,山胡椒属中的山胡椒精油、乌药精油,在抗肿瘤、抗菌、抗病毒、抗氧化等方面效果显著[8-9]。月桂属中月桂精油抗氧化能力突出,同时也具有抗菌杀虫等生物活性[10]。木姜子属中木姜子和山苍子的枝叶、果实均能产出精油,具有抗菌、镇痛、治疗类风湿关节炎、抗哮喘、抗肿瘤等药理作用[11]。樟科植物精油主要生物活性及应用如图1所示。植物精油组成成分、含量及生物活性受生长周期[12]、提取部位[13]及方法[14]、地理环境[15]等多种因素的影响。目前关于樟科植物精油的研究内容相对单一且研究对象相对分散,鲜见以科为集合的系统概述,且对其生物活性及作用机理报道有限。为了进一步综合分析和开发利用樟科植物精油,本文重点探讨樟科植物精油的提取方法、化学成分及其影响因素、生物活性及其作用机理,以及它们在食品保鲜方面的应用,以期为天然、绿色、健康的樟科植物精油的开发和利用提供理论依据。
1 樟科植物精油的成分及其影响因素
植物精油成分的定性和定量分析现阶段通常使用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法。植物精油是一类次生代谢产物,由多种类别化合物组合而成,主要是萜类,其次是芳香族、脂肪族以及含氮、含硫类化合物。樟科植物中的萜类主要包括单萜及倍半萜类,其中前者包括柠檬烯、芳樟醇、松油烯、沙宾烯和月桂烯等[16-18],后者则包括依兰烯、咕巴烯、杜松烯、荜澄茄油烯等[19-20]。萜类化合物是萜烯酶修饰的产物,其结构中的羟基具有一定的抗菌作用,因此当羟基结构发生变化时,其对微生物的抑制能力也会发生改变[21]。芳香族化合物也是构成精油挥发香气的重要组成部分,大部分是小分子萜源衍生化合物,如对孟烷脱氢产物麝香草酚,此外,C6—H3骨架的桂醛、茴香醛、丁香酚也是由苯酚或其酯的形式转变而来的[4]。精油中脂肪族化合物的含量相对较低,常见的为小分子异戊醛和异戊醇[22]。此外,含硫、含氮类化合物是精油刺激性气味的主要来源。
1.1 生长周期对樟科植物精油成分的影响
生长周期亦可能对植物精油的成分产生影响。随着植物的生长发育,其所含精油的组成均可能发生较大变化。例如,单萜烯烃是在花蕾期和整个开花期采集的植物精油样品中最具代表性的化合物[13]。周丽免等[14]测定不同采摘时期的木姜子果挥发性化学成分,发现5、6、7月份采摘果实的化学成分数量存在差异,分别为32、49、98 种,其中5月采摘果实的主要化学成分为双戊烯、β-蒎烯等萜烯类化合物;6月和7月采摘果实中萜烯类化合物虽然含量逐渐下降但种类逐渐增多,而醛类物质种类及含量均有所上升,且6月采摘果实中新增油酸、丙氨酸乙酯等挥发性化合物;7月采摘果实中新增香芹酚、乙酐、乙酸铵和呋喃类等化合物,且由于挥发性成分种类增多,果实气味更为丰富和浓郁。Fajar等[20]研究探讨了5、12、20 年生阴香树龄对叶、枝、干树皮挥发油产量和化学成分的影响。结果表明,12 年生树木精油中肉桂醛和反式肉桂醛的总含量最高,其次是5 年和20 年生树木。随着植物的成熟,其积累精油的紧迫性降低,化合物呈现多样化趋势。随着阴香树龄的增加,其肉桂乙酸酯的含量呈下降趋势。在树龄达到5 年左右,其开花初期后肉桂乙酸含量达到稳定,并随着树龄的增长而下降。此外,20 年生树木的叶片精油中含有10%的香豆素衍生物(α-苯并吡喃酮),而5 年和12 年生树木几乎不含此成分。
1.2 提取部位对樟科植物精油成分的影响
樟科植物分布广泛,同株植物不同部位的组成和结构各不相同,其化学组分也存在一定的差异。由表1可知,采用水蒸气蒸馏(hydrodistilation,HD)法提取时,香樟枝、木的精油主要成分以樟脑为主,根以黄樟素为主[17];而脑樟6 个不同部位的精油中,叶、新枝、老枝、树干主要的化学成分为樟脑,主根、侧根为黄樟油素,新枝和老枝的主要成分十分接近,主根和侧根较于其他部分精油成分种类少,以黄樟油素、樟脑和1,8-叶桉油素为主[18];由此可见,樟属精油中常见主要成分有樟脑、芳樟醇、1,8-桉叶油素等。而琼楠属叶和树皮的精油以倍半萜烯为主[19];月桂属花、叶和树皮的精油以单环单萜类化合物(1,8-桉叶油素)、倍半萜化合物(β-石竹烯、β-榄香烯)为主,但各成分之间的含量存在一定差别[23];木姜子属中的山苍子根和果实的精油主要成分含氧单萜,其他部分主要成分为单萜烃类,根和果以含氧单萜类(如柠檬醛、香茅醛、芳樟醇等)为主,茎和其他部分则以单萜类(如β-水芹烯、柠檬烯等)为主[24]。

表1 HD法提取自樟科植物不同部位的精油主要化学成分比较Table 1 Comparison of major chemical components of essential oils from Lauraceae plants extracted from different plant parts by HD
1.3 提取方法对樟科植物精油成分的影响
精油的提取方法各异,不当的提取方法和操作过程可能导致植物精油化学成分的破坏或改变,从而导致其生物和自然特性丧失,在极端情况下,可能会发生变色及风味和物理变化[25]。目前,HD法、有机溶剂提取(organic solvent extraction,OSE)法及超临界流体CO2萃取(supercritical carbon dioxide extraction,SFE)法等[26]是常见的樟科植物精油提取方法。由不同提取方法所提取的精油成分亦可能有一定程度的差异,如表2所示,香樟、肉桂、木姜子、山胡椒这4 种植物经不同的提取方法,主要化学成分种类基本一致,但含量不同。由提取方法形成的差异主要体现在挥发油的气味、色泽、总化学成分数量及含量等方面,林洁茹[26]通过对比HD、OSE及SFE这3 种方法,发现相较于后两种方法,通过HD法得到的香樟精油气味强且存在颜色差异,倍半萜烯类碳氢化合物含量排序依次为OSE法>SFE法>HD法;单萜类化合物含量排序依次为OSE法>HD法>SFE法;含氧单萜类化合物含量排序依次为HD法>SFE法>OSE法;3 种提取方法得到的精油提取量、密度、折光率及主成分差异不明显。周丽免等[14]用热油浸提、冷油浸提、超声波辅助浸提和HD 4 种方法提取木姜子果精油,并利用GC-MS进行成分分析,结果表明经HD法提取的精油挥发性成分种类最多、含量最高。曾朝懿等[27]使用超声辅助水蒸气蒸馏(ultrasonic-assisted steam distillation,UASD)法、微波辅助水蒸气蒸馏(microwave-assisted steam distillation,MASD)法和SFE法提取木姜子花精油,结果表明前两种方法所提取的精油中柠檬醛、月桂烯、罗勒烯的含量相近;SFE法所提精油的萜类成分含量相较于前两种方法较低,但芳香醇的含量却远高于前两种方法。MASD法可以从肉桂皮中获得高比例含氧化合物,且油腺无明显损伤,但倍半萜烃的比例较低,而HD法则相反[28]。此外,HD法相较于UASD法产生的倍半萜烃的种类较多,而含氧化合物的数量较少[29]。这可能是由于HD法的提取时间较长,导致一些活性化合物降解或分解,进而使精油中含氧化合物的种类减少;此外,由于水解或酯交换作用,一些化合物可能被转化为倍半萜烃[29]。
综上,HD法由于提取设备、方法、材料简单,适合大多数精油的提取,且获得精油成分丰富,但存在提取时间长、挥发性化合物存在潜在损失、高能耗[30-31]、精油得率低的问题。经OSE法提取的精油以单萜类化合物为主,萃取时间长,且精油得率较低,不适合大批量精油提取,且存在有机溶剂残留的问题[26]。SFE法可增强流体溶解和渗透的能力,迅速使溶质和溶媒达到平衡[32],提取时间短但得率低,且精油中成分较其他方法种类少,适合短时间快速提取。为了达到更好的精油提取效果,越来越多的新方法不断涌现,如分子蒸馏法[26]、UASD法[27,33]、MASD法[27,34]、超声-微波结合法[35]、同时蒸馏(simultaneous distillation extraction,SDE)法[36]等,上述方法将多种分离方法结合,具有浓缩率高、质量稳定的优点,适合高质量精油的提取。樟科植物种类繁多,其油细胞分布不同,提取目的亦不相同,不同的提取方法所获得的精油成分、得率均可能不同,因此多样的提取方法为樟科植物精油的利用创造出更多可能性。
1.4 地理环境对樟科植物精油的影响
地理环境的变化是影响生态系统的关键因素,在气候及土壤条件等不同的地理环境因素影响下,同一植物相同部位提取的植物精油在化学成分和质量上可能存在显著差异[12]。表3比较了不同地区同种植物精油成分的差异,表明不同地域、气候的植物精油主要成分含量和种类均存在明显差异。肉桂、柴桂(Cinnamomum tamala)、月桂产地的气候类型大致相同,但经纬度不同,所提取的植物精油成分存在差异,且其差异与植物本身遗传特性相关[22,36,40-42]。经纬度之间的差异可导致气候、生长环境的差别及地理、生态的隔离,且树木在系统发育过程中,长期自然选择和人为活动的影响使其形成了不同的基因频率,且其生态要求各异,形态特征不一,生长、发育、适应性等的明显差别[43],亦可显著影响植物精油的成分。如研究者通过研究福建地区不同经纬度上樟树叶油的成分,发现芳樟型叶片含油量随着经度的下降呈现上升趋势,且随着纬度变化差异显著,其中芳樟醇含量随经度变化无明显变化,而随纬度变化显著变化;脑樟型叶片及桉樟型叶片的含油量及樟脑、叶桉油素的含量随着经纬度的变化差异不明显;黄樟型叶片的含油量受纬度影响显著,而经度对其无显著影响,其中黄樟油素含量在不同经纬度差异显著[44]。从危地马拉、墨西哥提取的木姜子精油由于气候类型的差异,其成分差别极大[45-46]。植物精油等次生代谢产物受土壤因素、气候和地质形成的强烈影响,也会产生相应的变化[40]。此外,有研究发现海拔高度变化亦是影响陆地生态系统的重要因素,因其显著变化会引起相应的温度、相对湿度、风速、有效降水量和辐射率的变化,从而改变植物体内的许多生态反应[47]。例如,从越南地区提取的山苍子精油,在高海拔地区富含1,8-桉叶素,在低海拔地区则以芳樟醇为主要成分[48]。海拔的变化普遍影响了萜类生物的合成和含氧单萜含量,在低海拔时海拔的变化对含氧单萜含量的影响尤为显著;而在高海拔的情况下,海拔的变化对于倍半萜类化合物含量影响显著[12]。可见,地理环境的变化不仅可能影响精油中的主要成分,同时亦影响精油的含量。因此,不同地域可以根据环境条件划分多个区域。综上,应因地制宜,选择合适的樟科植物以得到理想化学型的精油,并进行合理栽培避免对生境和种群造成破坏。

表3 不同产地的樟科植物精油主要化学成分比较Table 3 Comparison of main chemical components in essential oils from Lauraceae plants from different production areas
2 樟科植物精油的生物活性
2.1 抑菌活性
目前,抗生素的大量使用导致细菌和真菌耐药性的出现,而精油可以抑制或延缓细菌、真菌的生长,是一种绿色、天然的抗菌剂[49]。研究表明樟科植物精油具有广谱抑菌效果,对食品中常见的革兰氏阳性菌(金黄色葡萄杆菌、枯草芽孢杆菌(Bacillus subtilis)等)[50-52]、革兰氏阴性菌(大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas alcaligebes))[17]等细菌及酵母菌、白色念珠菌、黑曲霉等真菌均具有一定的抑菌活性。此外,其对一些病原菌如伤寒杆菌(Salmonella typhi)[51]、多杀巴斯德菌(Pasteurella multoecide)[51]、肺炎克雷伯菌(Klebsiella pneumoniae)[53]等也有一定的抑杀作用。由表4、5通过比较最小抑菌浓度(minimum inhibitory concentration,MIC)、抑菌圈直径两项指标可知,樟科植物精油针对不同种类微生物的抑菌效果存在差异。肉桂[50]、月桂[38,53]、川桂(Cinnamomum wiloniiGamble)[54]精油是绿色健康的天然调味品和防腐剂,常用于果蔬制品及肉制品的保鲜;山苍子[50]、钓樟[51]、山胡椒[55]、锡兰肉桂[56]、木姜子[57]精油对于体外致病真菌有一定的抑制作用,故具有防治感染性疾病、作为新型抗菌药物的开发和应用前景。此外,从表4中可以看出,同属不同种的樟科植物精油对同一微生物的抑制活性也不同,例如樟属中的肉桂精油对于金黄色葡萄球菌及大肠杆菌的抑制能力要高于香樟精油。且樟科植物精油与其他植物精油复配后,相互协同能达到更好的抑菌效果。例如,吕好新等[58]研究了肉桂、山苍子、丁香、香茅及百里香5 种植物精油对分离自发霉花生的优势霉菌黑曲霉(Aspergillus niger)的抑菌效果,通过抑菌圈实验发现肉桂-山苍子复合精油抑菌效果最佳,经其处理后菌丝体损伤严重,发生皱缩、干瘪、凹陷等变形现象。当山苍子精油与右旋龙脑配比为2∶1(m/m)时,对痢疾志贺氏菌、单核细胞增生李斯特菌(以下简称单增李斯特菌)以及大肠杆菌的分级抑菌浓度(fractional inhibitory concentration,FIC)指数低于0.5,表现为协同作用;配比为3∶1(m/m)时,对金黄色葡萄球菌(Staphyloccocus aurens)、单增李斯特菌以及大肠杆菌的FIC指数低于0.5,亦表现为协同作用;而配比为1∶1和4∶1(m/m)时,对痢疾志贺氏菌、单增李斯特菌、大肠杆菌、沙门氏菌表现为无协同作用[59]。

表4 樟科植物精油的MICTable 4 MIC of essential oils from Lauraceae plants

表5 樟科植物精油的抑菌圈直径Table 5 Inhibition zone diameters of essential oils from Lauraceae plants
2.2 抗氧化活性
樟科植物精油具有一定的体内、体外抗氧化活性。体外抗氧化活性主要体现在对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、·OH等自由基的清除方面。罗世惠等[60]通过将香樟、天竺桂、蜀桂、香桂4 种植物精油与人工合成抗氧化剂丁基羟基茴香醚(butylated hydroxytoluene,BHA)比较,发现低质量浓度(小于0.4 mg/mL)的香桂精油总抗氧化活性显著优于BHA,且具有最高的DPPH自由基清除活性,半数效应浓度(concentration for 50% of maximal effect,EC50)小于1.0 mg/mL,而香樟精油、天竺桂精油和蜀桂精油的EC50分别为23.86、34.11、11.99 mg/mL;4 种精油对·OH也都表现出了较好的清除活性,随质量浓度升高,4 种精油对·OH的清除活性均稍低于BHA。虽然目前对樟科植物精油抗氧化活性主要集中在体外研究,但一些研究表明樟科植物精油也具有一定的体内抗氧化活性。例如,唐寅等[61]对APP/PS1模型小鼠进行龙脑樟精油嗅吸实验,并测定其脑组织氧化指标超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力,结果显示嗅吸龙脑樟精油可以提高小鼠脑组织的SOD和GSH-Px活力,降低丙二醛(malondialdehyde,MDA)含量,由此可见,龙脑樟精油嗅吸干预能够提高小鼠体内的抗氧化能力。大量的体内及体外抗氧化活性实验证明,樟科植物精油具有出色的抗氧化活性。
2.3 驱虫杀虫活性
目前樟科植物在驱虫杀虫方面的研究主要集中在樟属的樟树、阴香、肉桂,月桂属的月桂,木姜子属的山苍子,山胡椒属的山胡椒、香叶树,油丹属的油丹,檫木属的檫木,鳄梨属鳄梨等[62]。樟科植物精油中常见的单萜类化合物如柠檬烯、沙宾烯、芳樟醇、桉树醇、冰片、α-松油醇、4-松油醇和乙酸α-松油醇对赤拟谷盗、粉茶蛀虫等昆虫均表现出不同程度的驱避或抑杀活性;樟科植物精油常见成分龙脑在63.17~2.53 nL/cm2剂量范围内对昆虫具有接触毒性和驱避作用,且无熏蒸毒性;沙宾烯和α-松油醇在剂量范围为78.63~3.15 nL/cm2时对赤拟谷盗有显著的趋避作用,此外β-石竹烯对书虱具有接触毒性和驱避性[63]。
2.4 其他生物活性
植物精油已被证明有一定的细胞毒性,但在人体内一般都是非基因毒性的,这种细胞毒性是筛选抗肿瘤药物的关键[64]。Unlu等[65]采用MTT法对锡兰肉桂精油细胞毒性进行评价,将5RP7(c-H-ras转化的大鼠胚胎成纤维细胞)和F2408(正常大鼠成纤维细胞)暴露于锡兰肉桂精油中,结果表明25 μg/mL精油处理48 h后,5RP7细胞活力仅为10%。研究表明,樟科植物精油及其成分可能会对细胞转化具有干扰作用,其细胞毒性特性与抗癌活性有关[66]。肖瀛等[67]研究肉桂精油对小鼠肝脏代谢相关酶活性、肠道菌群以及肝、十二指肠、结肠组织等抗氧化能力的影响,发现摄入肉桂精油可以降低肠道中条件致病菌丰度,增加有益菌群丰度,调节肠道菌群的组成,从而干预肠道生态紊乱,具有潜在的促进机体健康的作用。
3 樟科植物精油的作用机理
3.1 抑菌机理
精油是由多种具有抗菌特性的低分子质量且具有挥发性的化合物组合而成的复杂混合物。植物精油的抑菌机理涉及多种成分间的相互作用,其抑菌活性主要取决于主成分或主成分与其他成分之间的协同作用,不同化合物结构不同,从而导致其抑菌机理不同。植物精油及其主要成分一般通过两种方式作用于微生物,其一,主要是通过影响微生物的细胞结构,如破坏细胞膜、细胞壁以及内含的细胞器的形态结构,从而造成无法逆转的细胞损伤;还可以通过诱导微生物菌丝体的溶解,最终导致微生物死亡。精油不可逆损伤具体表现在当疏水性的精油作用于细胞膜磷脂双分子层时,能够与其相互作用并被纳入细胞内,精油的一些成分与疏水蛋白位点结合并促进膜组织的变化,破坏细胞膜的完整性,导致电子传递链功能的改变,间接破坏蛋白质和核酸的合成[21]。其二,精油可以减少或抑制微生物分生孢子的生成和继续萌发,从而降低或彻底阻断病原菌后代继续造成危害的可能性[68]。此外,由于细胞壁组成的差异,革兰氏阴性细菌往往比革兰氏阳性细菌对精油更具耐药性[69]。Li Wenru等[70]研究发现0.062 5%(体积分数,下同)的山苍子油能将大肠杆菌细胞的生长滞后期延长至约12 h,而0.125%的山苍子油能将大肠杆菌细胞完全杀灭。透射电子显微镜观察显示,0.125%山苍子油处理后2 h内大肠杆菌大部分被杀灭或严重破坏,山苍子油可穿透并破坏大肠杆菌的内外膜。吴克刚等[71]发现经芳樟醇气相熏蒸大肠杆菌后,其细胞膜的膜脂和膜蛋白结构发生变化,增加了细胞膜的通透性,导致一些维持细胞正常生长的钾、磷等小分子和生物大分子如蛋白质、DNA、RNA等物质泄漏,最终导致大肠杆菌死亡。肉桂醛和丁香酚可抑制细菌产生某种必需酶或导致细菌细胞壁的破坏[72]。Hu Wei等[73]阐明了山苍子精油的抗菌机制,经山苍子精油处理后的耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)细胞膜破裂,细胞内生物大分子渗漏流出;MRSA的己糖单磷酸途径及其关键酶(葡萄糖-6-磷酸脱氢酶)活性也受到抑制;紫外吸收光谱结果表明,山苍子精油的关键组分柠檬醛可以与DNA以嵌合体的形式发生反应,从而抑制细菌的繁殖。根据Bassolé等[74]的研究,丁香酚与芳樟醇或薄荷醇的组合显示出最高的协同作用,这表明单萜酚与单萜醇是有效的抑菌组合。根据上述研究,推测樟科植物精油抑菌机制如图2所示。
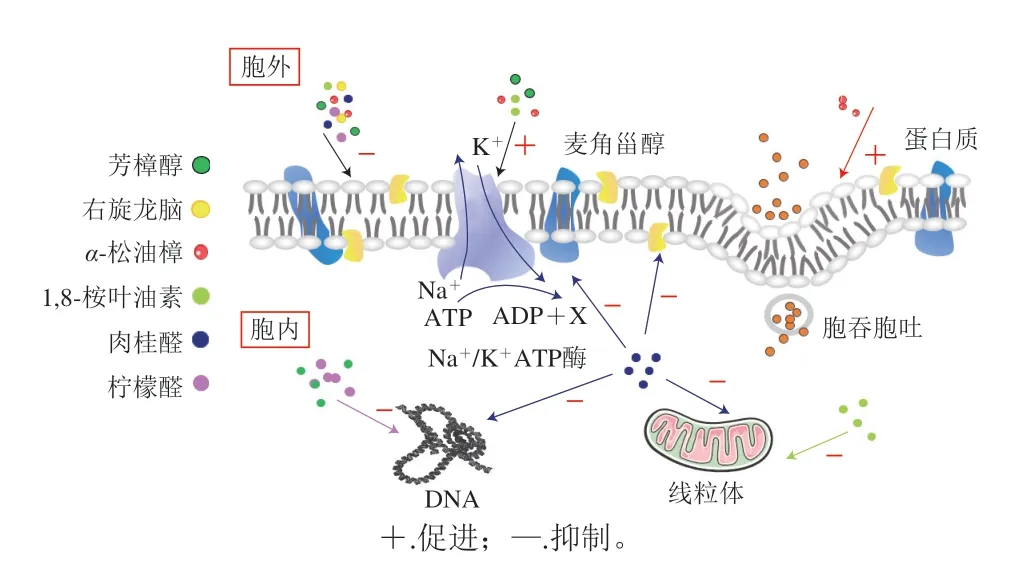
图2 樟科植物精油主要成分对微生物的抗菌机理[75-82]Fig.2 Antibacterial mechanisms of the major components of essential oils from Lauraceae plants[75-82]
3.2 抗氧化机理
抗氧化活性通常分为直接氧化、间接氧化两种方式,前者是通过对自由基的直接清除,后者主要是通过调节抗氧化酶的活性、与金属离子螯和、抑制脂质的过氧化等。自由基是新陈代谢的副产物,主要包括含氧和含氮自由基两种。当人体静态平衡失调时,过量的自由基和活性氧(reactive oxygen species,ROS)不但对正常的细胞生理功会造成影响,而且会加速细胞膜的脂质过氧化,且与有氧代谢相关的生理生化反应均可能失衡,此外,对核酸(DNA)、蛋白质、脂质、不饱和脂肪酸等生物大分子结构均可能造成破坏,最终导致细胞损伤变形直至死亡[83]。
樟科植物精油成分中的多不饱和双键、杂原子的萜烯类、醇类、酚类、醛类、芳香族化合物等物质具有极强的还原性[84]。图3展示了其主要成分的相关抑菌机制,萜烯类物质中单萜烯和倍半萜占主导地位,如α-蒎烯、β-蒎烯、月桂烯、石竹烯等;无环单萜含氧衍生物单萜醇,如香叶醇、芳樟醇、乙酸芳樟醇等,是一类次生代谢产物。萜烯中的类异戊二烯类和苯丙素类在反复的高温、强光和干旱的环境中,可以对抗激烈的氧化应激反应,具有补充抗氧化酶功能的潜力[85-86]。酚类物质如月桂叶中的丁香酚对CCl4引起的肝脏总抗氧化能力(total antioxidant capacity,T-AOC)降低及SOD、GSH-Px、过氧化氢酶(catalase,CAT)活力下降具有很好的拮抗作用,15 mg/(kgmb·d)的给药量对小鼠肝脏具有较好保护效果[87],上述抗氧化酶能够有效地将体内多余的过氧化氢物质转化为低毒、无害的物质,故其活力被认为是对抗氧化应激的关键。醛类中的反式肉桂醛、肉桂醛、柠檬醛对·OH、DPPH自由基等有良好的清除能力[81]。樟科植物中的芳香族化合物也具有一定的抗氧化能力。清除ROS的系统可分为酶性和非酶性,防御系统中,它们以协同和互动的方式工作,以中和自由基,达到抗氧化的目的[88]。

图3 樟科植物精油主要成分抗氧化机理[89-92]Fig.3 Antioxidant mechanism of the major components of essential oils from Lauraceae plants[89-92]
3.3 驱虫杀虫机理
精油的驱虫杀虫机理主要涉及以下几个方面:首先,精油具有很强的挥发性,这些挥发性成分在释放的过程中能与其他生物产生化学效应,并吸引昆虫前来传粉、交配,或其特殊气味可以对昆虫进行忌避、驱逐和毒杀[93]。樟科植物精油中无环或单环单萜(芳樟醇、香叶醇、柠檬醛、1,8-叶桉油素、α-松油醇等)都是小分子挥发性物质,它们参与了植物向昆虫传递空气信号的过程。在昆虫的感受器中,专门的气味结合蛋白对挥发性单萜做出反应,影响昆虫的行为活动[94-95]。Pavela[96]测定了30 种芳香族化合物及其相互二元组合对致倦库蚊幼虫的急性毒性,其中有9 种物质(柠檬烯、反式茴脑、4-烯丙基苯甲醚、香芹酚、异丁香酚、薄荷酮、香芹酮、冰片和樟脑)确定能够与20 多种物质产生协同效应,其中柠檬烯、冰片、樟脑都是樟科植物精油中常见的化合物,单萜类化合物作为亲脂性化合物,极易渗透到昆虫的皮肤中,进而干扰其身体的生理功能。Price等[97]通过电生理实验发现,丁香酚能有效抑制神经元活性,而柠檬醛和香叶醇具有剂量依赖性的双相效应,即低剂量时,柠檬醛和香叶醇引起腹部神经的自发性电活动增加,高剂量时引起自发性电活动减少。Chaubey[95]对柴桂精油及其主要成分丁香酚的驱虫作用进行了评估,当精油含量为0.2%时,能够有效驱除米象(Sitophilus oryzae)成虫;当米象成虫暴露于柴桂精油及丁香酚24 h后半致死浓度(median lethal concentration,LC50)分别为0.249、0.167 μL/cm3,暴露48 h后LC50分别为0.198、0.152 μL/cm3。
其次,植物精油能够抑制昆虫体内的多功能氧化酶,因此其能够作为有机合成杀虫剂的增效剂[95]。樟科植物中的单萜类化合物可引起昆虫麻痹致死,表现出对昆虫的神经毒性,一些具有较强杀虫活性的单萜类化合物是乙酰胆碱酯酶的有效抑制剂,如柠檬烯和桉树醇[98]。在昆虫的神经系统中有许多潜在的靶点,如乙酰胆碱酯酶(acetylcholinesterase,AChE)的抑制剂和γ-氨基丁酸(γ-aminobutyric acid,GABA)受体的修饰剂[64]。在众多的作用机制中,迄今为止研究最广泛的是AChE的抑制机制,具体如图4所示[99]。
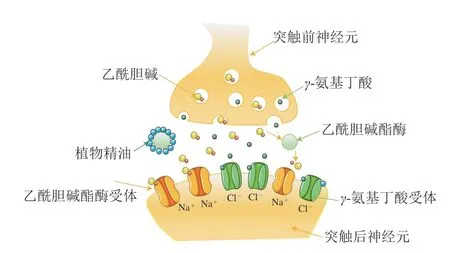
图4 樟科植物精油成分对乙酰胆碱酯酶及γ-氨基丁酸活性的抑制机制[99]Fig.4 Inhibitory mechanism of components of essential oils from Lauraceae plants on the activities of acetylcholinesterase and γ-aminobutyric acid[99]
此外,植物精油具有驱虫效果是由于油中的一些化学成分会干扰昆虫的章鱼胺神经系统,但该靶点与哺乳动物不同,因此大多数精油类化学品在毒理学测试中对哺乳动物和鱼类相对无毒,符合“降低风险”农药的标准,因此植物精油相较于其他合成的驱虫剂具有一定的优势[93]。
4 樟科植物精油在食品保鲜中的应用
利用精油作为保鲜剂是一种高效、绿色、高回报的新兴生物保鲜技术。目前的保鲜方法主要有可食用膜的制备、微胶囊制备技术、纳米乳液技术。根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[100]的规定,樟科植物中可作为添加剂使用的精油有山苍子油、月桂叶油、中国肉桂油、西印度月桂叶油、斯里兰卡肉桂油,常见成分有莰烯、β-石竹烯、月桂醇、芳樟醇、龙脑、肉桂醛、柠檬醛、丁香酚、α-蒎烯、β-蒎烯、1,8-桉叶素等。其中部分精油来源于食品原辅料,如GB 21725—2017《天然香辛料 分类》[101]中规定可以作为食品原辅料添加的有阴香皮、桂皮、木姜子果实、月桂叶。
4.1 可食用涂膜技术
樟科植物精油的涂膜技术主要可应用于肉制品、果蔬保鲜中。Khare等[102]将卡拉胶和氯化钾(1%)按4∶1(m/V)的比例混合后添加0.5%柠檬酸,在60 ℃下加热溶解后添加0.05%肉桂油制得可食用涂膜液,经该涂膜液处理后的鸡肉与对照组相比可将货架期延长2 d,延长了低温贮藏的时间。Utami等[103]将5 g木薯淀粉溶于100 mL蒸馏水中,在70 ℃下溶解30 min,冷却至60 ℃后加入2 mL甘油制备可食用薄膜,在30 ℃下添加不同含量的阴香树皮精油(0、0.5%、1.0%、1.5%和2%)及等量的吐温80制成薄膜混合物,并应用于新鲜牛肉品质评价。结果表明,2%阴香树皮精油富集膜可以保持牛肉的新鲜度,有效减少微生物生长和脂质氧化。Zheng Kewang等[104]采用溶液浇铸法制备了以苦楮淀粉、壳聚糖、月桂精油为原料的可食性薄膜,该涂膜在精油含量为16%时拉伸强度、透湿性、吸湿性和总可溶性物质含量显著降低,静态接触角和抗菌活性显著提高,具有良好的抗菌和抗氧化性能。以上添加樟科植物精油的可食性薄膜系统不仅在食品包装中具有良好的应用前景,且为食品可食用薄膜的进一步研究提供了参考。
4.2 微胶囊技术
微胶囊技术由芯材和壁材两部分组成。通常将植物精油制成小粒子作为芯材,壁材通常由淀粉、纤维素、壳聚糖、天然植物胶等蛋白质及多糖构成。Wang Ying等[105]通过比较甲基-β-CD(heptakis(2,6-di-methyl)-β-CD,DM-β-CD)、羟乙基-β-CD(mono[2-O-(2-hydroxyethyl)]-β-CD,HE-β-CD)和羟丙基-β-CD(mono[2-O-(2-hydroxypropyl)]-β-CD,HP-β-CD)包结物的性质,发现包结能力依次为HP-β-CD>HE-β-CD>DM-β-CD>β-CD,表明HP-β-CD与山苍子精油包结作用最佳,制备微胶囊效果最好。Pratiwi等[106]采用麦芽糖糊精与阿拉伯胶1∶1的包封比例对肉桂精油微胶囊化,在30、40、50、60 ℃和70 ℃的温度下,微胶囊的货架期分别为20、14、10、8 周和6 周,能有效提高肉桂精油的品质。da Silva Barbosa等[107]以吐温80和聚己二酸丁二烯-共对苯二甲酸酯为壁材,制备了肉桂精油的微胶囊,抑菌实验结果表明该微胶囊对大肠杆菌、单增李斯特菌、肠道沙门氏菌和金黄色葡萄球菌均有明显的抑制作用,抑菌圈直径分别为44.1、51.9、55.3 mm和56.6 mm。对微生物的显著抑制效果说明植物精油微胶囊有望添加至食品或者与食品接触的薄膜中,从而延长食品的保质期。
4.3 纳米乳液技术
纳米乳液(粒径在50~200 nm之间)是液相以液滴的形式分散在第二相的一种非热力学稳定的胶体分散体系。该纳米级粒径能够防止因聚集和重力引起的乳液分离优势,并具有抗沉降和乳化的动态稳定性特征。精油纳米乳液体系可以提高精油的稳定性、溶解度和可适用性。Paudel等[108]以吐温80为乳化剂,采用超声波破碎法制备了不同配方的肉桂油纳米乳液,实验结果表明,与水处理相比,0.5%纳米乳液对单增李斯特菌和沙门氏菌的抑制作用均非常显著,证明了肉桂油纳米乳液具有减少瓜类等新鲜农产品中沙门氏菌和单增李斯特菌污染方面的潜力。Wang Yanbo等[109]采用超声乳化、中链三酰甘油和磷酸盐缓冲液制备了一种高稳定性、水分散的山苍子精油纳米乳液,该纳米乳液可用于食品的低温保存和环境温度保存,并可用于控制细菌生长和防止食品氧化变质。
5 结语
化学成分的鉴定和定量、提取方法、对特定微生物的作用机制以及这些成分与食品系统的相互作用是影响精油大范围应用的因素。研究证明,从不同植物来源提取的精油均具有天然化合物成分,因此是应用于复杂食品系统的潜力性原料。由于樟科植物精油本身具有“天然、健康”的特点,其在工业加工食品中的应用可以满足消费者对健康和安全食品的需求。此外,还应拓宽视野,增加精油使用的可能性,从精油的控释封装、加入活性包装、食用涂料、不同精油的协同组合和不同保存方法的组合等方面入手,利用好中国丰富的樟科植物资源,将风味独特的植物精油融合进复杂的食品体系中,提升消费者对于精油的认可度,为提升精油的利用价值创造出更多可能。
