噬菌体在食品微生物安全领域中应用的局限性和挑战
2023-08-12惠潇然黄振华许天明段为旦潘迎捷张昭寰
惠潇然,黄振华,刘 静,吴 倩,许天明,段为旦,潘迎捷,2,3,张昭寰,*,赵 勇,2,3,*
(1.上海海洋大学食品学院,上海 201306;2.农业农村部(上海)水产品贮藏保鲜质量安全风险评估实验室,上海 201306;3.上海水产品加工及贮藏工程技术研究中心,上海 201306)
噬菌体是侵袭细菌的病毒,寄生于活菌体内,在自然界中广泛分布,于1916年由D’Hérelle首次分离[1],其主要通过吸附到宿主细胞上,将遗传物质注入宿主细胞内,导致宿主细胞裂解并释放子代噬菌体,从而杀死宿主细菌[2],可用于预防和治疗各种细菌感染[1]。将噬菌体合理地应用于食品工业中,能够专一地杀灭包括耐药菌在内的特定菌株,而不对其他细菌造成任何影响[3]。此外,研究者们还可根据不同需求分离出针对特定致病菌的噬菌体[4]。综上,噬菌体可弥补传统抗生素及杀菌技术的不足,在控制食源性致病菌的污染方面具有良好的应用前景[3]。
在“农场-餐桌”的食品供应链中,大量研究报告了噬菌体能够有效抑制食源性致病菌的生长[5-9],且不会影响食品的感官特征[10]。但噬菌体在食品工业中的实际应用相对较少,其原因主要包括一些技术的限制和消费者的接受程度,如噬菌体应用于食品时如何确保其覆盖于食品表面达到最佳抑菌效果,噬菌体生物防治的广泛应用可能会引起对噬菌体有耐药性细菌的出现,以及消费者可能不愿意购买不熟悉技术加工的食品等[3,11]。因此,需要进一步评估噬菌体的安全性和有效性,以确保它们在食品工业中安全、高效的使用[12]。
本文系统地综述了限制噬菌体在食品领域中广泛应用的原因,涵盖了噬菌体在食品工业中应用的可接受程度、潜在耐药传播风险、细菌的噬菌体抗性问题、复杂的食品基质对其作用效果的影响,并对噬菌体在食品工业中的应用方式提出了科学合理的建议,以推动噬箘体的基础研究走向食品工业的实际应用。
1 噬菌体在食品工业中应用的可接受程度
噬菌体在食品及食品相关环境中的杀菌效果得到了广泛的研究[13],可抑制多种食物中的致病菌和腐败菌,如水果[5]、蔬菜[6]、肉制品[7]、乳制品[8]和水产品[9]等。2006年,美国食品和药品管理局(Food and Drug Administration,FDA)推出第一款可用于食品工业的噬菌体产品ListShieldTM,用于即食食品肉类和家禽产品中单核细胞增生李斯特菌(以下简称单增李斯特菌)(Listeria monocytogenes)的控制[14]。国内对噬菌体的研究主要集中在临床医学[15]和农业方面[16]。在食品工业中,对噬菌体的应用研究主要集中在对肉质品中的食源性致病菌的控制,如牛肉中大肠埃希菌O157:H7(Escherichia coliO157:H7)的防控[17]、鸡肉中沙门氏菌(Salmonella)的防控[18]、冷却羊肉中产碱假单胞菌(Pseudomonas alcaligenes)的防控[19]。目前我国还未批准相关应用于食品的噬菌体产品,这与消费者对噬菌体应用于食品的可接受程度密切相关。
相对于新兴技术加工的食品而言,多数消费者更加倾向于传统技术加工的食品[20]。尽管利用噬菌体杀菌是一种绿色、安全和靶向的抗菌手段,但其作用方式是在食品表面喷洒“病毒活体”,导致广大消费者对这种杀菌技术的接受程度较低。病毒在普通大众的固有观念中是有害的,所以消费者很难接受应用噬菌体技术加工的产品[12]。尽管噬菌体技术背后的科学原理十分明确,但消费者对于未知事物的不了解甚至误解,某种程度上限制了噬菌体在食品工业中的应用。
2 噬菌体传播耐药性的潜在风险
近年来,人们在农业生产过程中抗生素的滥用问题,促使大量抗生素通过农业废弃物释放到环境中,对微生物群落造成选择性压力,从而导致了耐药菌和耐药基因的选择和传播[21]。目前,来源于各类水体、土壤、畜禽以及人体粪便分离的噬菌体中,均检测出不同种类的抗生素耐药基因(antibiotic resistance genes,ARGs),如β-内酰胺类、喹诺酮类、四环素类、甲氧西林、磺胺类等。如表1所示,噬菌体携带了较高水平的β-内酰胺类耐药基因(主要集中于blaTEM和blaCTX类)和喹诺酮类耐药基因qnrA、qnrB和qnrS,以及一些其他的耐药基因,如磺胺类耐药基因sul1和sul2、四环素类耐药基因tetA、tetW和tetM以及万古霉素耐药基因vanA等。随着测序手段的进步,研究人员利用宏基因组学的方法同样也检测到了噬菌体携带各种ARGs,这表明噬菌体可以被视为一种ARGs的储存库。
研究发现,大约20%的细菌基因组是通过噬菌体样元件而获得[21],其介导细菌间基因转移的主要方式为转导或溶源转变。转导是通过噬菌体介导外源DNA转移的过程[21,39],携带耐药基因的噬菌体感染细菌后,可能会将耐药基因重组到感染细菌的基因组中,从而使其获得新的遗传特性[39-40]。如噬箘体EC10通过转导的方式将大肠杆菌(E.coliNBRC 12713 KEN1)中的耐药基因bla转移到大肠杆菌(E.coliC600RK2/HB101/NBRC 12713/W3110)中[41];噬箘体P24通过转导的方式将海德堡沙门氏菌(S.heidelbergS25)中的耐药基因blaCMY-2、tetA和tetB转移到鼠伤寒沙门氏菌(S.TyphimuriumMZ1262)中[42]。溶源性转变是指温和型噬菌体基因组在宿主基因中的整合[43],当温和型噬菌体感染细菌细胞时,噬菌体DNA整合到宿主细胞染色体上,此时原噬菌体基因的表达将导致宿主表型的变化,形成的溶原细胞可以在不产生噬菌体颗粒或有害噬菌体蛋白的情况下生存[43-44]。如温和噬菌体TEM123通过溶源转变的方式将β-内酰胺类抗生素耐药基因转移到金黄色葡萄球菌(Staphylococcus aureus)基因组上[45]。因此,噬菌体能够在ARGs的传播中发挥重要的作用,造成细菌耐药性传播的风险,限制了其在食品工业中的实际应用。
3 细菌的噬菌体抗性问题
在噬菌体应用研究中发现,细菌的噬菌体抗性问题使得噬菌体在食品工业的生物防治效果明显降低。尤其是在控制食源性致病菌方面,在噬菌体与细菌不断进化的过程中,细菌抵抗噬菌体的能力也在不断地提升,从而导致噬菌体用于抑制细菌的效果并不理想,这大大限制了噬菌体在食品工业中的应用。
有无局部现浇的墩柱在节段底部与承台之间的相对滑移上也有很大差异,如图10所示,图10(a)为无耗能钢筋的2个墩柱,图10(b)为有耗能钢筋的2个墩柱.从图10中可以看出,局部有现浇混凝土的墩柱在节段墩柱底部的相对滑移较大,说明墩柱节段通过局部现浇的连接方式会使墩柱各个节段有很好的整体性,在实际施工中只需对墩柱底部进行细部处理即可.
3.1 难以彻底杀灭细菌
噬菌体生物防治只能在短期内抑制食源性致病菌的生长,不久之后细菌可恢复生长(表2)。理论上,一个噬菌体从感染一个细菌细胞开始,到复制周期结束时,该细胞中会产生100~200 个子代噬菌体,子代噬菌体持续裂解细菌细胞,导致细菌数量会显著减少[11],但实际情况并非如此。Guenther等[46]用10 mL SM缓冲液(50 mmol/L Tris-HCl,pH 7.5,100 mmol/L NaCl、8 mmol/L MgSO4)稀释噬菌体颗粒,在15 ℃条件下用3×108PFU/g的噬菌体FO1-E2处理接种103CFU/g沙门氏菌的热狗、鸡胸肉、牛奶和蛋黄等食品,观察噬菌体处理对沙门氏菌的控制效果。结果发现,除蛋黄外,其他食物中的活菌数量均下降了2(lg(CFU/g)),但是2 d后沙门氏菌能够再次生长,证明噬菌体处理并不能完全抑制沙门氏菌的繁殖。Spricigo等[47]用3 种噬菌体组成的噬菌体制剂处理猪皮、鸡胸肉、鸡蛋等食品,结果发现,鸡胸肉中肠炎杆菌UA1894在处理后5 d活菌数量减少1.4(lg(CFU/g)),但在第7天时活菌数量仅减少0.9(lg(CFU/g))。Kang等[48]分离出一种强效噬菌体wksl3,将其涂抹于鸡皮上观察噬菌体的抑菌活性,结果发现,在1 d后沙门氏菌数量降低了3(lg(CFU/mL)),但在7 d后细菌数量又有所增加。很多研究均报道了噬菌体只可短期内有效降低食品中致病菌的数量,而不能够完全清除。产生这一现象的原因可能是出现了抗噬菌体突变株,使噬菌体无法彻底杀灭细菌。
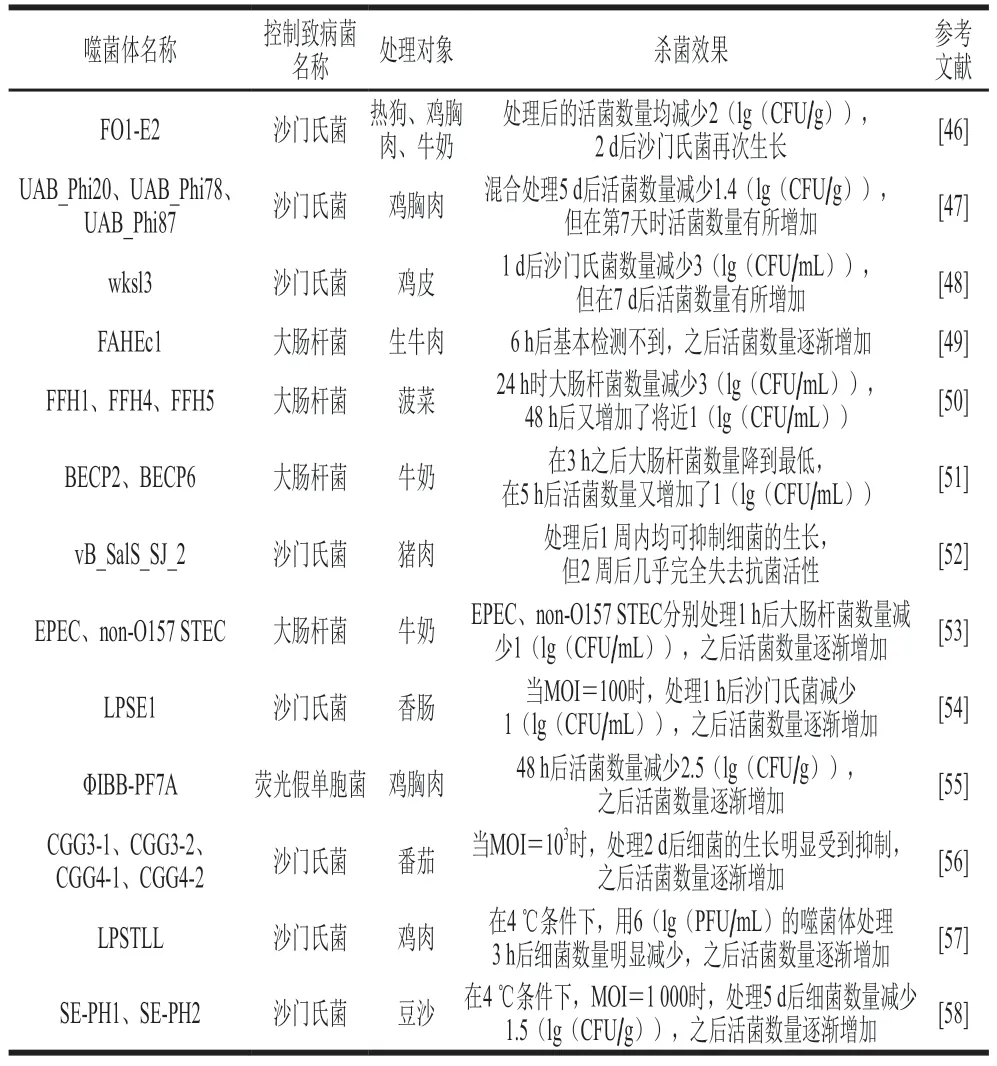
表2 噬菌体在食品杀菌中应用的研究Table 2 Recent studies on the application of phages in food sterilization
3.2 细菌对噬菌体的抗性机制
在应对噬菌体侵袭的过程中,食源性致病菌进化了各种免疫系统来抵御噬菌体的感染,主要有吸附抑制(adsorption inhibition,AI)系统、超感染排斥(superinfection exclusion,Sie)系统、限制修饰(restriction modification,RM)系统、CRISPR-Cas系统、流产感染(abortive infection,Abi)系统和毒素-抗毒素(toxin-antitoxin,TA)系统(图1)。

图1 细菌对噬菌体的抗性免疫系统Fig.1 Bacterial immune systems for phage resistance
3.2.1 阻止噬菌体的吸附(AI系统)
噬菌体的吸附是噬菌体感染细菌的第一步(图1)。噬菌体感染成功的关键是噬菌体与细菌表面受体特异性结合,因此受体变异就会使噬菌体无法吸附,从而导致噬菌体感染失败[59]。在长期进化中,细菌已经进化出许多表面结构来阻止噬菌体的吸附,这一阻断机制主要包括:噬菌体受体基因突变或修饰、竞争性抑制剂的竞争抑制、胞外基质的覆盖、噬菌体自身编码的蛋白与其受体蛋白结合。如霍乱弧菌分泌的OMV可作为噬菌体受体的诱饵蛋白,从而保护细菌免受噬菌体的感染[60],OMV还能够不可逆地与噬菌体结合,噬菌体一旦附着在OMV上,感染能力就会大大降低[61]。铜绿假单胞菌IV型菌毛糖基化使噬菌体无法识别,从而阻止以菌毛为特异性受体噬菌体的感染[62]。大肠杆菌以及其他革兰氏阴性菌可通过产生过量的胞外多糖,使噬菌体无法进入宿主细胞[63]。十一烯基磷酸葡萄糖-1-磷酸转移酶是噬菌体117吸附肺炎克雷伯菌KP36完成裂解过程中的关键功能酶,控制该酶的编码基因WcaJ突变能够阻断噬菌体117的吸附[64]。粪肠球菌OG1RF中受体蛋白的编码基因突变,阻断了噬菌体的吸附,从而增加了细菌对噬菌体的抗性[65]。假单胞菌噬菌体DMS3编码的蛋白Aqs1可以与菌毛组装蛋白PilB结合,从而阻止同类噬菌体与细菌受体结合[66]。假单胞菌噬菌体D3112编码的蛋白Tip也可以与菌毛组装蛋白PilB特定区域相互作用并阻断其活性,从而阻止同类噬菌体的吸附[67]。
3.2.2 阻断噬菌体DNA的侵入(Sie系统)
噬菌体DNA的侵入是噬菌体感染细菌的第二步(图1)。Sie系统最初在温和噬菌体中被发现[68],是阻止噬菌体DNA进入宿主细胞的主要机制,当宿主细胞被噬菌体感染后,同一类噬菌体再次感染宿主细胞时,这种多为膜锚定蛋白或与膜成分相关蛋白就会发挥作用,从而阻止同类噬菌体的再次感染[69]。
在革兰氏阴性菌中,大肠杆菌T4噬菌体有两个由imm和sp编码的Sie系统,T4噬菌体编码的imm蛋白通过与另一种膜蛋白结合来改变注射位的构象从而阻止噬菌体DNA的进入[69-70],T4噬菌体编码的sp蛋白抑制了由gp5编码的溶菌酶的活性,阻止了细胞壁肽聚糖的降解,从而阻断噬菌体DNA的侵入[69]。在革兰氏阳性菌中,最具有特征的系统Sie2009发现于温和型噬菌体乳球菌(Lactococcus lactis)噬菌体Tuc2009的基因组中,可以在不影响噬菌体吸附的情况下阻止936噬菌体组中某些噬菌体DNA的侵入[71];温和型嗜热链球菌(Streptococcus thermophilus)噬菌体TP-J34编码的ltp蛋白可通过抑制噬菌体DNA进入细菌细胞质中,从而阻止嗜热链球菌的重复感染[72]。
3.2.3 切割噬菌体DNA(RM系统和CRISPR-Cas系统)
噬菌体的生物合成是噬菌体感染细菌的第三步(图1),RM系统普遍存在于细菌与古细菌的噬菌体防御机制中,该系统主要由MTase和REase组成[63]。在噬菌体在完成吸附和侵入后,RM系统作为免疫系统攻击进入细胞的噬菌体DNA,其中REase主要识别并切割特异DNA序列,当噬菌体DNA进入宿主细胞后,REase会识别并切割特定的位点,破坏噬菌体DNA,而宿主细胞DNA上的相同位点则被MTase甲基化,以保护自身DNA不被REase切割。RM系统根据作用机制和亚基可成分为4 种类型,即I~IV型[73-74]。I型和III型RM系统相似,REase都沿着DNA移位,并从识别位点切割,在II型RM系统中,REase在DNA识别位点内部或附近进行切割,IV型系统由于缺乏MTase,只能切割修饰过的DNA[74-75]。最近发现的一种新的防御系统——限制-修改相关的防御岛系统(defence island system associated with restrictionmodification,DISARM)能限制噬菌体的DNA进入,类似于RM系统,是一种新型的多基因限制性修饰模块[76]。
CRISPR-Cas系统是由一个含有短且保守的重复序列的CRISPR基因组位点以及由Cas编码的Cas蛋白组成[75]。到目前为止,CRISPR-Cas系统一共可分为两大类(一类是由多个蛋白组成的效应蛋白模块;另一类是单个蛋白效应模块),共有6 种类型(I~VI型)和33 种亚型[77]。噬菌体在完成吸附和侵入后(图1),该系统通过识别和切割外源的DNA或RNA,以一种序列特异性发挥作用,其行使功能分为3 个阶段:获取间隔序列、crRNA的生物合成和目标干扰[78]。当噬菌体DNA第一次进入细菌细胞时,两种蛋白质Cas1-Cas2复合物会选择一部分外源DNA序列(原间隔序列)纳入CRISPR序列中,形成一段新的间隔序列,这一过程使宿主细胞记住噬菌体的DNA。随后这段间隔序列就会被转录成一个长前体crRNA(pre-crRNA),该前体crRNA进一步加工成含有噬菌体序列的成熟crRNA。最后在成熟的crRNA引导下,Cas核酸酶利用crRNA通过互补碱基配对来识别和切割噬菌体的DNA[78-79]。
3.2.4 阻止噬菌体颗粒释放(Abi系统和TA系统)
噬菌体的组装和释放是噬菌体感染细菌的第四步(图1),当噬菌体DNA成功入侵后,Abi系统能够干扰噬菌体复制周期的各个环节,阻止子代噬菌体的释放,同时导致宿主细胞的死亡[80]。该系统主要是由单一蛋白质或蛋白质复合物组成,通常在噬菌体侵入后被活化,是单个细菌为保护周围细菌的一种自我牺牲的过程,主要通过干扰细菌细胞DNA的复制、转录和翻译来实现[73,75]。Abi系统种类较多,在乳酸乳球菌中发现有20 种Abi系统(AbiA~AbiZ)[81]。2006年,Lossouarn等在表皮葡萄球菌中也发现了Abi系统,噬菌体表达的蛋白会激活噬菌体防御激酶Stk2,诱导Abi的发生,从而阻止噬菌体向其他细菌种群的繁殖[82]。最近研究人员在粪肠球菌中发现了一种新的Abi系统(Abiα),由原噬菌体编码的Abiα基因能够引起粪肠球菌的提前裂解,具有典型的Abi表型[83]。
TA系统广泛存在于细菌中,主要依靠一个毒素和一个抗毒素组成的防御系统。该系统的基本特点是抗毒素具有不稳定性,必须连续表达才能与毒素保持适当的化学计量比。TA系统中的毒素包括脱氧核糖核酸酶(DNase)和核糖核酸酶(RNase),可以抑制DNA复制、ATP合成[16,75]。以植物致病菌萎缩果胶杆菌为例(图1),ToxI和ToxN组成了一个TA系统,其中ToxN可以抑制细菌生长,在噬菌体感染后导致ToxN释放并降解细菌细胞RNA,导致噬菌体和细菌细胞死亡[84]。
4 复杂食品基质对噬菌体作用效果的影响
在噬菌体应用于食品工业的过程中,复杂的食品基质也是影响噬菌体作用效果的重要因素,主要包括食品的pH值、温度、化学成分等[85]。这些因素往往是食品自身的固有属性,很难通过工艺优化的方式进行消除,限制了噬菌体在此类食品环境中的实际应用。
4.1 食品pH值对噬菌体作用效果的影响
食品p H 值是影响噬菌体杀菌效果的重要参数之一[85],研究表明,噬菌体在蜜瓜上的应用效果优于苹果[86-88],Leverent等[86]用噬菌体分别处理蜜瓜(pH 5.8)和苹果(pH 4.2),结果发现5 ℃和10 ℃下贮藏168 h后蜜瓜上沙门氏菌数量均减少了约3.5(lg(CFU/g)),但苹果片上沙门氏菌的数量未显著减少。之后Leverentz等[87]发现,用噬菌体混合物可使蜜瓜(pH 5.5~6.5)中单增李斯特菌的数量降低2.0~4.6(lg(CFU/g)),而对苹果(pH 3.8~4.2)中单增李斯特菌仅能杀灭0.4(l g(C F U/g))。Oliveira等[88]用噬菌体Listex P100处理密瓜、梨和苹果4 h后,结果发现蜜瓜和梨中单增李斯特菌的数量分别减少了1.5(lg(CFU/mL))和1.0(lg(CFU/mL)),而在苹果片上的效果较差。Leverentz等[87]认为噬菌体的感染可能受到苹果酸性的影响。
4.2 食品温度对噬菌体作用效果的影响
食品的温度是影响噬菌体作用效果的另一因素,例如,在4、10 ℃和20 ℃条件下,用噬菌体P100处理接种4(lg(CFU/cm2))单增李斯特菌的干腌火腿片,结果发现在4 ℃条件下噬菌体的杀菌效果最好[89]。用商业噬菌体混合制剂处理奶酪时,观察到不同温度对噬菌体的影响效果不同,在22 ℃下噬菌体杀灭单增李斯特菌的效果最好,比6 ℃条件下多杀灭0.79(lg(CFU/g))单增李斯特菌,但22 ℃不适合贮存奶酪,这种条件下会促进霉菌和其他腐败菌的生长[90]。
4.3 食品中化学成分对噬菌体作用效果的影响
食品中的蛋白质、脂质等化学成分会干扰噬菌体与特定宿主细胞受体之间的相互作用,从而影响噬菌体的作用效果[91]。Gill等[92]发现牛乳中的乳清蛋白因吸附在细菌细胞表面,阻断了噬菌体的结合,从而影响噬菌体对金黄色葡萄球菌的抗菌活性。Garcia等[93]在半脱脂牛奶和全脂牛奶中检测了噬菌体对金黄色葡萄球菌的抑菌作用,结果发现噬菌体ΦH5和ΦA72混合处理后,半脱脂牛奶中的金黄色葡萄球菌数量下降了2(lg(CFU/mL)),而对全脂牛奶中的金黄色葡萄球菌几乎没有抑制作用。
5 结语
噬菌体在食品工业中应用的可接受程度较低,其本身还具有潜在传播耐药性的风险,在控制食源性致病菌时,细菌对噬菌体产生的抗性问题以及复杂的食品基质对其作用效果的影响等诸多问题限制了噬菌体在食品工业中的实际应用。但是,噬菌体具有易于分离、资源丰富、特异性强等优势,若对其进行合理的开发、提高应用效率、控制潜在风险,能够有助于突破其在食品工业应用中的局限性。基于此,本文进一步对噬菌体在食品工业中的发展及应用提出以下三点建议。
5.1 推动噬菌体的基础研究走向食品工业化应用
基于大量关于噬菌体的基础研究,向食品行业以及广大消费者进行噬菌体的科普宣传,使其充分了解噬菌体具有高效、安全、靶向等优势,并通过微信、短视频等新兴媒体,科学合理地普及噬菌体相关信息,提高噬菌体在食品工业应用中的可接受度。此外,可根据每种噬菌体的最佳条件优化食品工艺,在不影响食品风味的情况下,使噬菌体在食品中发挥作用,从而推动噬菌体的基础研究走向食品工业化应用。
5.2 基于多组学技术严格筛选可用于食品加工的优质噬菌体菌种
噬菌体在自然界中普遍存在,将其作为生物防控剂应用于食品时必须严格筛选,从基因组学、蛋白组学等多组学技术上严格把控,筛选出不携带耐药基因、毒力基因等风险因素的优质噬菌体菌种,为噬菌体在食品领域中的应用提供科学依据和数据基础,研发安全、高效的噬菌体类食品添加剂,从而为食品安全的切实保障提供可靠的防控策略。
5.3 采用噬菌体裂解酶扩大适用范围
大部分噬菌体都能编码相应的裂解酶,具有裂解活性强、安全性高、易于改造等优势,在食品实际生产过程中,可以使用噬菌体裂解酶代替噬菌体活体,其不仅具备噬菌体的特异性优势,而且不易改变食品的质地和口感,能够较好地克服噬菌体应用的局限性。因此,今后可以将噬菌体裂解酶作为研究目标,发掘出裂解活性高、稳定性强、宿主谱广的噬菌体裂解酶,以应用于食品工业领域。
