葡萄酒中生物胺的研究进展
2023-08-12史学容宋育阳刘延琳
史学容,宋育阳,2,3,秦 义,2,3,刘延琳,2,3,*,姜 娇,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学 陕西省葡萄与葡萄工程技术研究中心,陕西 杨凌 712100;3.西北农林科技大学宁夏贺兰山东麓葡萄酒试验示范站,宁夏 永宁 750104)
葡萄酒口感复杂多样,香气优雅浓郁,备受消费者的青睐。其中微生物在葡萄酒质量风格塑造中发挥着极其重要的作用,如果发酵控制不当,则会产生威胁葡萄酒饮用安全的不良代谢物,其长期过量摄入可能会触发相关疾病。葡萄酒中不良代谢物主要包括氨基甲酸乙酯(ethyl carbamate,EC)、生物胺(biogenic amines,BA)、赭曲霉毒素A(ochratoxin A,OTA)等[1]。近年来,葡萄酒的质量安全问题逐渐成为食品行业关注的焦点,我国先后出台了GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》[2]、GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》[3]、GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》[4]3 项食品安全国家标准,对葡萄酒等发酵食品中的EC、BA及OTA含量进行了限定。
BA是一类含氨基的有机低分子化合物的总称。微量的BA是生物体内的正常活性成分,在活细胞中具有重要的生理功能,具备清除自由基等代谢活力,但过量摄入则会引起头疼、腹部痉挛、呕吐等不良生理反应[5]。BA还是一些有害物质的前体,如腐胺和尸胺与亚硝酸盐反应后会生成强致癌物亚硝胺,此外,精胺、亚精胺和胍丁胺等BA作为致癌物亚硝胺的前体物质,超量摄入也可能会危及生命[6]。在葡萄酒酿造过程中,部分微生物具有较强的氨基酸脱羧酶(BA生物合成的关键酶)活性,会增加BA的积累及葡萄酒饮用风险[7]。尽管人体内本身存在解毒酶系,可有效降解部分的BA,但葡萄酒的特殊环境及某些BA能削弱这些酶的功效。如有研究表明,胺氧化酶(amine oxidase,AOs)作为BA代谢中的关键酶,能够将BA分解成相对安全的醛、氨气和过氧化氢[8],从而实现对BA的生物降解,以缓解其大量积累对机体带来的毒害。其活性会受到乙醇、多酚或SO2的限制,随着乙醇发酵(alcohol fermentation,AF)的进行,高乙醇体积分数会强烈抑制AOs的活性,体积分数12%的乙醇可抑制91% AOs的活性[7],而葡萄酒中乙醇体积分数普遍在13%以上,这不仅增加了葡萄酒中BA降解的难度,还显著增强了BA的毒性。腐胺和尸胺会抑制组胺的降解酶,从而增强其毒性,酪胺和色胺分别会影响单胺氧化酶和双胺氧化酶的活性,β-苯乙胺会抑制双胺氧化酶及组胺-N-甲基转移酶的表达[9]。因此,对葡萄酒中BA含量的限定较其他发酵食品更为严苛,BA也成为了葡萄酒领域长期以来关注的热点之一。
近年来,我国虽加强了对葡萄酒中BA检测方法和形成机理等方面的研究,但由于起步较晚,相关基础性研究和风险评估数据尚不完善。2013年,李志军等[10]利用高效液相色谱(high performance liquid chromatography,HPLC)法对国内消费市场葡萄酒中BA水平进行了检测,结果表明国产及进口葡萄酒中BA含量均较低,具有良好的安全性。3 年后该团队又对来自北京、天津、河北等20 个省市及产区的250 款国产葡萄酒产品中BA组成和含量进行检测分析,结果显示,全部葡萄酒样品中的8 种BA含量均符合食品安全要求,具有较高的饮用安全性[11]。王瑞等[12]利用HPLC法对新疆天山北麓、焉耆盆地、吐哈盆地及伊犁河谷四大优势产区60 个葡萄酒样品中的总BA含量及8 种BA组分的含量进行检测,发现4 个产区的葡萄酒均具有较高安全性。同年,Ke Runhui等[13]对我国市售的456 个葡萄酒样品进行抽查分析,发现组胺的检出率为59%,检测值范围为0~22 mg/L;酪胺的检出率为89%,最高检测含量21 mg/L;腐胺检出率高达98.5%,这表明我国市售葡萄酒中仍存在BA含量超出国外标准的风险。2020年,刘睿等[14]利用HPLC法对国内外葡萄酒中的9 种BA含量进行检测分析,也发现国产葡萄酒中BA含量较国外稍高。因此,准确分析及掌握葡萄酒中BA的组成和含量,对葡萄酒中各BA限量进行进一步的风险评估,能够为今后完善葡萄酒中BA限量和管控葡萄酒质量安全提供科学依据。
1 葡萄酒中主要的BA
目前葡萄酒中检测出的BA共20余种,包括腐胺、组胺、酪胺、尸胺、色胺、β-苯乙胺、精胺、亚精胺、甲胺、乙胺、异戊胺等[15],其中组胺、酪胺和腐胺含量最高,相关研究也最为广泛[13]。组胺是葡萄酒中公认毒性最强的BA,许多国家对葡萄酒中组胺的含量已有明确限定(表1),其中德国和荷兰最为严苛,限量为2 mg/L[16]。我国尚未明确对葡萄酒中BA的限量要求。在葡萄酒中,酪胺能促进体内去甲肾上腺素的释放,其毒性仅次于组胺。适量的酪胺经肠道吸收后被单胺氧化酶氧化和分解,过多摄入则会造成积累,从而引起偏头痛等不良反应[17]。腐胺是葡萄酒中最普遍存在的BA,几乎在所有葡萄酒中都能够检测到,虽然其毒性较组胺而言更低,但其能抑制相关AOs活性,减少AOs对组胺、酪胺的分解,导致组胺和酪胺含量积累、毒性增强[18]。因此,腐胺的大量积累也会对机体造成间接损害,引起不适。同腐胺一样,尸胺、精胺、亚精胺等BA尽管没有直接毒性作用,但在一定条件下,它们的存在也能够与亚硝酸盐反应积累致癌物质亚硝基胺[6]。因此,严格控制葡萄酒中BA种类与含量对于酿造健康的高品质葡萄酒具有积极的作用。
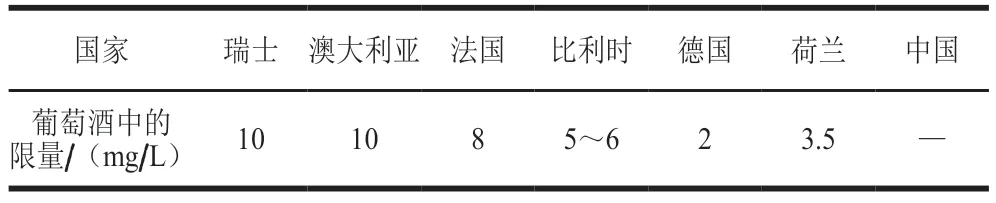
表1 不同国家组胺的限量标准[14]Table 1 Limits of histamine in different countries[14]
2 葡萄酒中BA的来源
葡萄酒中的BA主要来源于发酵过程中微生物的代谢[19],微生物产生的底物特异性脱羧酶能催化相应的前体氨基酸合成BA。这些前体氨基酸既可能来源于葡萄浆果[20],又可能通过微生物在自身溶解酶的作用下释放产生[21]。因此,葡萄酒中BA含量主要取决于原料中前体氨基酸含量组成及微生物对其的代谢能力[22]。此外,还有少数BA在葡萄生长过程中因应对氮过量或缺乏等环境而产生,随机械处理(除梗、破碎)后的原料进入葡萄酒中。如葡萄酒中被广泛报道的组胺、腐胺和酪胺,以及甲胺、乙胺、苯乙胺、异戊胺和尸胺均少量存在于葡萄汁(醪)中[23]。葡萄酒中BA信息及其来源总结见表2。
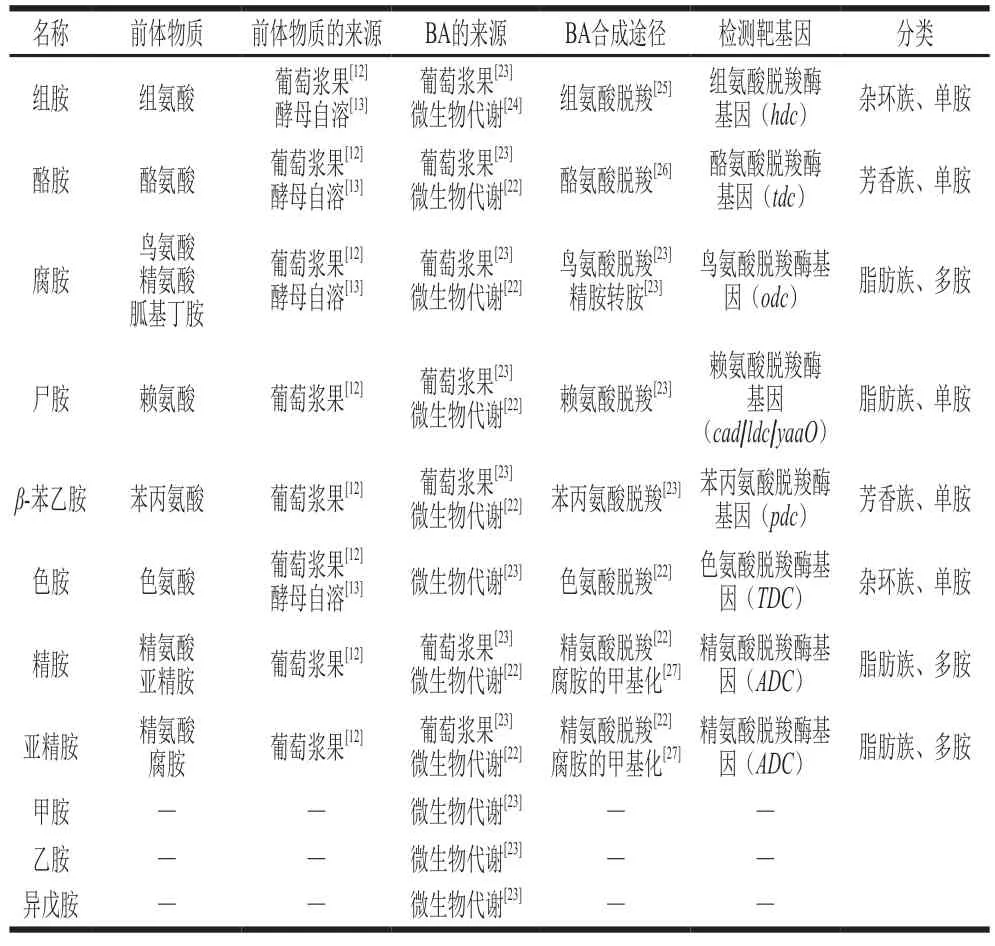
表2 葡萄酒中BA信息及其来源Table 2 Information and sources of BA in wine
3 葡萄酒中主要BA的生成及其调控机制
BA作为生理活性物质,其合成及代谢受到严密调控,在生物体内维持在微量水平,但在特殊刺激条件下,部分微生物会代谢合成大量BA,具有较高的风险。因此,掌握葡萄酒中BA的形成原因和合成代谢机理有助于更好地监控葡萄酒中BA含量,为葡萄酒的饮用质量提供保障。相关研究表明,微生物生成BA的主要原因有3 点:一是具有脱羧能力的微生物在缺乏营养物质及酸胁迫下,会代谢产生碱性的BA,改变基质pH值以适应环境,维持自身生长繁殖[24];二是当基质中缺乏碳源时,氨基酸脱羧反应和氨基酸/对应胺反向转运能产生质子动力,为微生物代谢提供能量[25];三是氮代谢物阻遏效应的发生,即微生物优先利用的氮源及其代谢产物能阻遏非优先利用氮源相关基因的转录,或从转录水平上抑制某些酶类的生成,使得次级氮源大量积累,只能代谢合成BA、EC等含氮的有害物质[26]。
在葡萄酒酿造过程中,微生物合成、降解BA主要经历4 种酶反应:1)脱羧;2)转氨基;3)还原胺化;4)某些前体氨基化合物的降解[27]。脱羧作用为葡萄酒中BA的主要合成途径,即相应氨基酸转运蛋白将前体氨基酸转移至细胞基质中,经氨基酸脱羧酶脱羧后形成BA,最后再由转运蛋白直接分泌至胞外或经胺氧化酶氧化为醛类,醛类物质经脱氢氧化后形成对应酸,最后分解为CO2和H2O释放到细胞外[25]。值得注意的是,脱羧途径中前体氨基酸的吸收和产物的释放属于耦合反应。组胺、酪胺和腐胺为葡萄酒中最主要的BA,分别由组氨酸脱羧酶(histidinede carboxylase,HDC)、酪氨酸脱羧酶(tyraminede carboxylase,TDC)、鸟氨酸脱羧酶(ornithinede carboxylase,ODC)催化相应的前体氨基酸代谢产生,这3 种脱羧酶分别由组氨酸脱羧酶基因(hdc)、酪氨酸脱羧酶基因(tdc)和鸟氨酸脱羧酶基因(odc)编码[28]。目前已发现具有hdc[29]、odc[30]、tdc[23]基因的乳酸菌在进行苹果酸-乳酸发酵(malolactic fermentation,MLF)时会增加酒液中组胺、酪胺和腐胺积累的风险。其中,有研究发现部分含有tdc基因的Oenococcus oeni不仅可以产生酪胺,还可以产生苯乙胺[31]。因此,准确掌握BA的合成、降解途径为利用生物手段控制葡萄酒中BA含量提供了理论依据。
组氨酸的脱羧过程是由组氨酸/组胺转运蛋白(HdcP基因编码)、HDC(HdcA基因编码)和氨酰-tRNA合成酶(HdcRs基因编码)3 个蛋白共同完成的[32]。胞外组氨酸经过转运蛋白转移至胞内,在HDC作用下转变成组胺,再随组氨酸/组胺转运蛋白分泌至胞外。HDC作为目前关于组胺研究较为深入的酶,根据其辅酶的差异,可分为丙酮酰和磷酸吡哆醛依赖型两类。与后者相比,前者具备无需外源辅助因子且高催化特异性的优势,且两者在催化过程中均会发生底物依赖性失活现象[33]。真核细胞和革兰氏阳性菌多以磷酸吡哆醛为辅酶;革兰氏阴性菌多以丙酮酰为辅基[34]。此外,由转运蛋白参与的摄取底物和分泌产物是一个偶联的过程,即氨基酸由胞外进入到胞内和相应的BA分泌到胞内是同时进行的[35]。HDC的最适pH值为4.8,葡萄酒中L-乳酸也会抑制HDC的活性,相关研究表明,在葡萄酒中2 g/L的L-乳酸能抑制22%的HDC活性[36]。研究人员在比对了Raoultella planticola、Morganella morganill、Pseudomonas fluorescens中HDC蛋白的氨基酸序列后,设计了可用于多重聚合酶链式反应(polymerase chain reaction,PCR)且特异性高的引物对106/107[37],以检测微生物是否具备合成BA的能力。作为葡萄酒中毒性最强的BA,组胺有3 种降解途径:其既能在HDC催化下降解为乙醛和氨;也能在二胺氧化酶的作用下形成咪唑乙酸;除此之外,还可通过甲基化形成甲基组胺,经胺氧化酶氧化形成醛,脱氢后形成相应的酸[38]。
与组氨酸类似,酪氨酸的脱羧过程由TDC(tdc基因编码)、酪胺酰-tRNA合成酶(tyrS基因编码)与酪氨酸/酪胺反向转运体(tyrP基因编码)多个酶共同合作完成[8]。2002年研究人员首次确定了原核生物中的基因位点,并从Lactobacillus brevisIOEB 9809[39]和粪肠球菌(Enterococcus faecalis)[40]中部分纯化和表征得到了TDC。相关研究表明在tyrP上游存在一个能编码Na+/H+转运蛋白(nhaC-2)的开放阅读框[41]。Coton等[42]设计了用于基因间隔序列PCR(internal transcript space-PCR,ITS-PCR)的TDrc1/TDrc2、TDrcl/TyrS2及用于常规PCR的TD5/TD2等引物检测Carnobacterium divergens508中潜在编码TDC的基因。在TDC催化下合成酪胺的降解途径为:胺氧化酶催化酪胺降解为对羟基苯乙醛,对羟基苯乙醛氧化后形成对羟基苯乙酸[43]。
食品中腐胺的合成途径有3 条:除精氨酸在精氨酸脱羧酶(arginine decarboxylase,ADC)(speA编码)作用下形成胍基丁胺,再由胍基丁胺酶(speB编码)分解为尿素和腐胺[44];精氨酸在精氨酸脱亚胺酶催化下脱亚胺产生瓜氨酸和氨,瓜氨酸又在转氨甲酰酶的催化下得到N-氨甲酰腐胺,后转化为腐胺[45];瓜氨酸在鸟氨酸氨甲酰基转移酶的作用下降解为氨基甲酰磷酸和鸟氨酸,在ODC作用下合成腐胺(ADI途径)[46]。无论是ADI途径还是脱羧途径,均涉及α-氨基甲酸激酶催化氨基甲酰磷酸盐产生ATP、CO2和NH3[46]。不同的是,脱羧途径是通过产生质子动力碱化细胞质,而ADI途径以ATP的形式代谢能量并产生氨,二者均能实现对细胞质pH值的控制[47]。2008年,Liu Xiaoyan等[48]在Escherichia coliBL21中表达枯草芽孢杆菌(Bacillus subtilis)的speA基因序列,对得到的speA蛋白晶体进行X射线衍射,以确定ADC的三维结构来进一步阐明其催化机理。刘艳敏等[49]对克隆得到B.subtilisBJ3-2的speA基因进行序列对比后,证实了其编码的蛋白为典型的III型磷酸吡哆醛(pyridoxal phosphate,PLP)依赖型鸟氨酸/赖氨酸/ADC。需要明确的是,虽然在大多数发酵食品中腐胺既可在ODC作用下催化生成,也能通过胍氨酸脱亚胺酶(agmatine deiminase,AgDI)途径合成,但在葡萄酒中尚鲜有报道依赖AgDI途径产生腐胺。
葡萄酒中尸胺是赖氨酸在LDC的催化下脱羧得到的。赖氨酸脱羧途径由编码赖氨酸脱羧酶的cadA、编码赖氨酸/尸胺转运蛋白的cadB、调控基因cadC共同组成,并由cad基因座控制。其中cadC受到外界pH值和赖氨酸浓度的诱导,能够调控cadA及cadB共同组成的cadBA操纵子的表达[50]。Kikuchi[51]和唐雪[52]等分别在E.coli和B.subtilis中发现了编码LDC的ldc和yaaO基因。尸胺在AOs及脱氢酶的分别作用下最终降解为CO2和H2O排出体外[53]。色胺的合成和降解途径与尸胺相似,即色氨酸在色氨酸脱羧酶的作用下合成色胺,在胺氧化酶的作用下形成吲哚乙醛,再经氧化形成吲哚乙酸,后降解为CO2和H2O(图1)。

图1 葡萄酒中BA的合成及降解途径Fig.1 Synthesis and degradation pathways of BA in wine
精胺和亚精胺的形成过程相对复杂,涉及到多重反应。亚精胺的合成主要有两条分支:精氨酸先经speA编码的ADC催化合成胍基丁胺,再在胍基丁胺脲水解酶(speB编码)的催化下合成腐胺,腐胺在亚精胺合成酶(spermidine synthase,SPDS)(sms编码)的作用下生成亚精胺,亚精胺在精胺合成酶的作用下形成精胺[54],同时精胺在精胺氧化酶(spermine oxidase,SMO)的作用下转变成亚精胺,亚精胺与精胺间的转化是可逆的[55]。此外,L-甲硫氨酸和ATP在S-腺苷甲硫氨酸合成酶的催化下合成S-腺苷甲硫氨酸(S-adenosine methionine,SAM)。SAM作为氨丙基供体,经S-腺苷蛋氨酸脱羧酶(speD编码)脱羧后与腐胺结合,分别在SPDS和SMO的催化下形成精胺和亚精胺[55]。其中主要限速酶S-腺苷蛋氨酸脱羧酶只有结合了辅因子丙酮酰才具备催化活性。精胺和亚精胺通过反向转化机制进行分解代谢,该途径的分解酶主要有亚精胺/精胺N-乙酰基转移酶(spermineN-acetyltransferase,SSAT)、N-乙酰基多胺氧化酶(N-polyamine acetyl oxidase,PAOX/PAO)和精胺氧化酶(spermine oxidase,SMOX/SMO)。即亚精胺/亚精胺在SSAT和PAOX/PAO的共同作用下将精胺转化为亚精胺,随后将亚精胺转化为腐胺[56]。同时,精胺在SMOX/SMO诱导下能够直接转化为亚精胺[57]、H2O2及3-乙酰氨基丙醛等,过氧化氢酶会迅速降解H2O2[57]。其中SSAT为分解代谢途径的主要限速酶。
由此可见,BA的合成较为复杂,不仅涉及多个基因及操纵子的表达与调控,脱羧酶、胺氧化酶及脱氢酶等也起到十分关键的作用(图1)。然而目前研究对葡萄酒中氨基酸脱羧酶的报道仅涉及个别关键基因,对于其在葡萄酒微生物中的研究还不够深入和全面。
4 葡萄酒中参与合成BA的微生物
BA含量对葡萄酒的品质及质量安全的控制具有重要影响,因此,准确了解葡萄酒中产生BA的微生物菌群及其分子检测方法对科学监控葡萄酒中BA的含量具有重要的指导意义。目前关于参与合成BA的葡萄酒微生物仍存在一定争议,但葡萄酒中BA的产生与发酵微生物脱羧酶基因的存在与否具有较强的相关性,一般不含hdc、tdc和odc基因的菌株不具备产生组胺、酪胺、腐胺的能力,具有较高的安全性[58]。
4.1 酵母菌
关于AF期间酵母菌能否合成BA尚存争议。以Delr等[59]为代表的绝大多数研究者发现AF结束后BA含量并无显著变化。但也有少数研究指明一些酵母菌株在AF过程中能够合成BA,且合成BA的能力存在菌株特异性。如Caruso等[60]研究发现酿酒酵母(Saccharomyces cerevisiae)、柠檬克勒克酵母(Kloeckera apiculata)、星形假丝酵母(Candida stellata)、美极梅奇酵母(Metschnikowia pulcherrima)都能够产生微量的甲胺和胍基丁胺,S.cerevisiae还能产生一定浓度的乙醇胺,且较M.pulcherrima、C.krusei及K.apiculata合成的BA更丰富[61]。Bordiga等[62]研究了不同酵母菌株发酵葡萄酒时对BA含量及其相关前体氨基酸演变能力的影响,结果表明酵母菌也会参与葡萄酒中BA的合成,因此在进行AF时谨慎选择菌株和氮源十分重要。另外,Marcobal等[63]报道了酵母菌在发酵过程中会产生一定浓度的挥发性BA,但不影响葡萄酒的香气成分及感官品质。AF结束后,部分酵母菌在自身蛋白酶的酶解作用下发生自溶,释放出游离氨基酸或多肽等BA合成的必需前体物质,间接增加葡萄酒中BA的含量[21]。
4.2 乳酸菌
AF结束后,乳酸菌通常作为MLF的发酵剂分解L-苹果酸,降低葡萄酒的酸涩感,在MLF完成后,葡萄酒中的BA水平普遍存在不同程度的升高。因此,目前的主流观点认为乳酸菌是葡萄酒中产生BA的主要微生物。迄今为止,在酒球菌属(Oenococcussp.)、乳杆菌属(Lactobacillussp.)、明串珠菌属(Leuconostocsp.)和片球菌属(Pediococcussp.)等葡萄酒乳酸菌中普遍检测出氨基酸脱羧酶活性[27],且不同菌株在合成BA能力上存在显著性差异。Landete等[64]发现Pediococcus parvulus和Lactobacillus hilgardii较O.oeni能产生更多的组胺,这可能是因为前者同时携带3 种编码基因——hdc、odc和tdc的O.oeni菌株数量相对较少[65]。此外,值得注意的是,在一些产组胺和酪胺的乳酸菌中,其HDC和TDC活性由多个基因簇协同调控,进而催化游离的氨基酸生成BA并分泌至胞外[66]。
4.3 其他微生物
葡萄酒酿造体系是一个极其复杂的混菌发酵系统,系统内微生物群落结构复杂,除酵母和乳酸菌外,其他发酵微生物能否合成BA基本处于研究空白阶段。芽孢杆菌(Bacillussp.)和巴氏醋杆菌(Acetobacter pasteurianus)具备合成BA的能力,这在葡萄果醋的研究中得到证实[67]。然而利用从葡萄醪及葡萄酒中分离的40 株醋酸菌发酵模拟葡萄汁和葡萄汁,却未能检测出组胺、酪胺、腐胺等葡萄酒中常见的BA[65]。随着葡萄酒微生物多样性研究的不断深入,探索其他真菌、细菌是否参与BA的合成对葡萄酒中BA的监控是非常必要的。
4.4 葡萄酒中合成BA微生物的检测
葡萄酒中的BA主要是通过脱羧途径产生,故是否携带编码氨基酸脱羧酶的基因是判断该菌株是否能合成BA的重要依据。由于微生物在培养时,其新陈代谢容易产生酸性或碱性物质,导致假阴性或假阳性结果,故传统利用微生物方法对产BA菌的检测复杂且不可靠。因此,目前采用分子生物学方法检测微生物中是否存在编码合成BA相关基因,以判断其是否具有合成特定BA的潜力。设计脱羧酶基因序列相应的引物,对被测菌株进行PCR反应,若能得到对应产物,则证明该菌株具备合成BA的潜力[9]。Costantini等[68]对133 株从葡萄汁和葡萄酒中分离出的具有合成组胺、酪胺和腐胺能力的乳酸菌利用PCR法进行氨基酸脱羧酶基因检测,结果发现PCR扩增的阳性结果与对BA含量检测的结果一致。Christine等[69]通过PCR扩增技术比较了Lactobacillus30A、Clostridium perfringens和Lactobacillus buchneri的hdcA碱基序列和氨基酸序列,发现引物JV16HC/JV17HC具有普适性,能够实现对携带hdc基因O.oeni的检测。朱成龙等[70]利用PCR技术检测40 株O.oeni产BA的能力,结果表明,40 株O.oeni均具有HDC、TDC、ODC活性,都可能代谢合成组胺、酪胺和腐胺,因此,不建议将上述菌株用作MLF的发酵剂。此方法具有快速、准确可靠、易操作等优点,可在BA合成前检测出相关基因,分析其潜在危害,从分子生物学角度保证菌株的安全性[8]。
在此基础上开发的多重PCR技术可同时检测能合成多种BA的微生物。Coton等[71]采用以多个乳酸菌的hdc、tdc为目的基因的多重PCR技术,同时鉴定能产生组胺和酪胺的革兰氏阳性菌。同年,Marcobal等[72]利用多重PCR以含有hdc、tdc和odc的基因片段为目的片段鉴定产生组胺、酪胺和腐胺的乳酸菌,随后,将多重PCR的鉴定范围优化扩展到革兰氏阴性菌中,至此葡萄酒中常见的具有HDC、TDC和ODC活性的微生物均能通过多重PCR检测。相比之下,该方法特异性强、成本低、耗时短、可同时扩增多个DNA片段,能够广泛应用于BA微生物溯源的检测中。随着分子生物学的发展和检测技术的提高,利用实时定量PCR技术也能实现对BA微生物溯源的定量检测[73]。
5 BA的检测方法
葡萄酒中的BA含量是衡量葡萄酒质量安全的重要指标之一,开展葡萄酒中残留BA及其代谢物的分离与检测相关技术研究对BA快速检测分析及葡萄酒的质量安全具有重要的实践意义。但由于BA本身缺少发色基团,且不具备紫外吸收和荧光电化学活性,通常需要对样品进行预处理,如提取、净化、萃取、衍生等。适当的预处理不仅能够减少基质干扰,还能够增加BA的信号强度,为次级分析奠定基础[74]。传统的预处理技术,如液-液萃取(liquid-liquid extractions,LLE)存在需要大量的危险化学试剂、操作费时、消耗样品数量大等缺点。目前基于LLE发展出一些液相微萃取(liquid-phase micro-extraction,LPME)新技术,如盐析辅助液液萃取(salting-out assisted liquid-liquid extraction,SALLE)、凝固-漂浮分散液液微萃取(dispersive liquid-liquid microextraction based on solidification of floating organic droplets,DLLME-SFO)、涡旋辅助表面活性剂增强乳化液液微萃取(vortex assisted surfactant-enhanced emulsification liquid-liquid microextraction,VSLLME)及分子印迹固相萃取(molecularly imprinted solid phase extraction,MISPE)。MISPE是一种对葡萄酒中组胺具有特异性亲和力的分子创新方法,具有较高的重复性和准确性[75]。这些新技术不仅能够避免传统方法的弊端,还能够有效提高预处理效果及降低BA检出限[76-78]。
HPLC法是我国食品BA含量检测的标准方法,其中使用C18反相柱的LC法具有高分辨率和高灵敏度的特点[79],是目前检测葡萄酒中BA含量的主要手段。此方法需要对样品进行衍生化,因为衍生化能降低BA的极性,从而提高C18柱的分离率,使其对检测器更为敏感[80]。样品衍生化处理可在色谱柱前后进行,但柱前衍生较柱后衍生更易受到矩阵效应的影响[81]。此外,通常葡萄酒的pH值处于较低水平(pH 2.8~4.0)[82],而大多数衍生化试剂的最佳反应pH值均高于7.5,因此,需要使用缓冲液提升衍生化的效果[81]。葡萄酒中BA常用衍生化试剂有邻酞醛(orthophthalaldehyde,OPA)、丹酰氯化物(dansyl chloride,DNS-Cl)、苯甲酰氯(benzoyl chloride,BZL-Cl)、6-氨基喹啉-羟基琥珀酰胺基氨基甲酸酯(6-aminoquinoline-hydroxysuccinamido carbamate,AQC)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、9-乙烯基氯甲酸甲酯、二乙基乙氧甲基丙醛酸盐(diethylethoxymethyl propionate,DEEMM)和4-氯-3,5二硝基苯三氟等。OPA具有反应快、耗时短、灵敏度高等优点,但其衍生物不稳定,只能与初级BA反应[83],因此通常与巯基乙醇等其他试剂一起使用,以提高其衍生灵敏度和稳定性[65]。DNS-Cl是BA检测中应用最广泛的非特异性衍生化试剂,能与其他物质如酚类或脂肪醇发生反应[84],具有稳定性高、检测范围广的优点,但其衍生化时间会随温度改变[85]。BZL-Cl是一种非特异性试剂,可以与其他基团(酚类、脂肪族醇和一些糖)发生反应[65],具有廉价且衍生物稳定[86]等诸多优点,多用于衍生化反应后的液体萃取。DEEMM能产生稳定的衍生物[87],但其操作复杂,衍生化反应需在超声浴中进行30 min以上,还需要加热2 h(70~80 ℃)使过量的DEEMM完全降解[88]。AQC是一种特异性试剂,其产生的化合物能稳定保持1 周,但在使用紫外检测器时过量的试剂峰(6-氨基喹啉)导致吸收率高而产生干扰,其检测信号较小,因此该方法不能分离苯乙胺和亚精胺[89]。
近年来,将HPLC和毛细管电泳法(capillary electrophoresis,CE)与紫外线(ultraviolet,UV)或荧光检测器(fluorescence detector,FLD)技术结合,可实现对BA更高灵敏度的检测。如HPLC-UV/FLD[74]、HPLC-蒸发光散射检测器(HPLC-evaporative light-scattering detector,HPLC-ELSD)[75]、HPLC-质谱检测器(HPLC-mass detector,HPLC-MSD)[76]等。在这些分析方法中,LC-MSD/MSD较为准确和可靠,能够快速分离并具有高灵敏度,发展前景广阔。除此之外,薄层色谱法(thin layer chromatography,TLC)、气相色谱法(gas chromatography,GC)、离子色谱法(ion chromatography,IC)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)、CE、BA传感器法(Biosensors)等技术也能实现对BA含量的检测[77]。CE目前可分为毛细管等速电流(capillary isotachophoresis,CITP)、毛细管等速泳-毛细管区电泳(apillary isotachophoresis-capillary zoneelectrophoresis,CITP-CZE)、非离子胶束电动色谱法(non-ionic micellar electrokinetic chromatography,MECK)等[30]。尽管迁移时间的重现性低于LC,但该技术具有快速、高效的优势,且成本低廉,被认为是良好的测定发酵食品中BA的选择[30],其适用性取决于发酵饮料样品中预期的BA水平。不同方法的精密度、线性范围、检出限、定量限、回收率、相关系数r等存在一定差异(表3),需结合待检样品的特点选择可靠性优、适用性强且高效准确的方法。

表3 葡萄酒中BA的分析方法Table 3 Analytical methods for the detection of BA in wine
6 葡萄酒中BA的影响因素及其控制方法
在葡萄酒生产过程中,BA含量始终呈现动态变化。除少量存在于葡萄原料中的BA外,其主要形成于葡萄酒发酵和贮存阶段。BA的形成一般需要3 个条件:一是游离的前体物质;二是具备氨基酸脱羧酶的微生物;三是适宜的环境条件[74]。因此影响葡萄酒中BA含量的主要因素包括:1)葡萄原料,即游离氨基酸;2)葡萄酒微生物,即氨基酸脱羧酶及BA降解酶;3)工艺参数,即发酵工艺。发酵过程中,可根据葡萄酒中BA的相关影响因素,采取相应的策略(图2)来控制其含量。
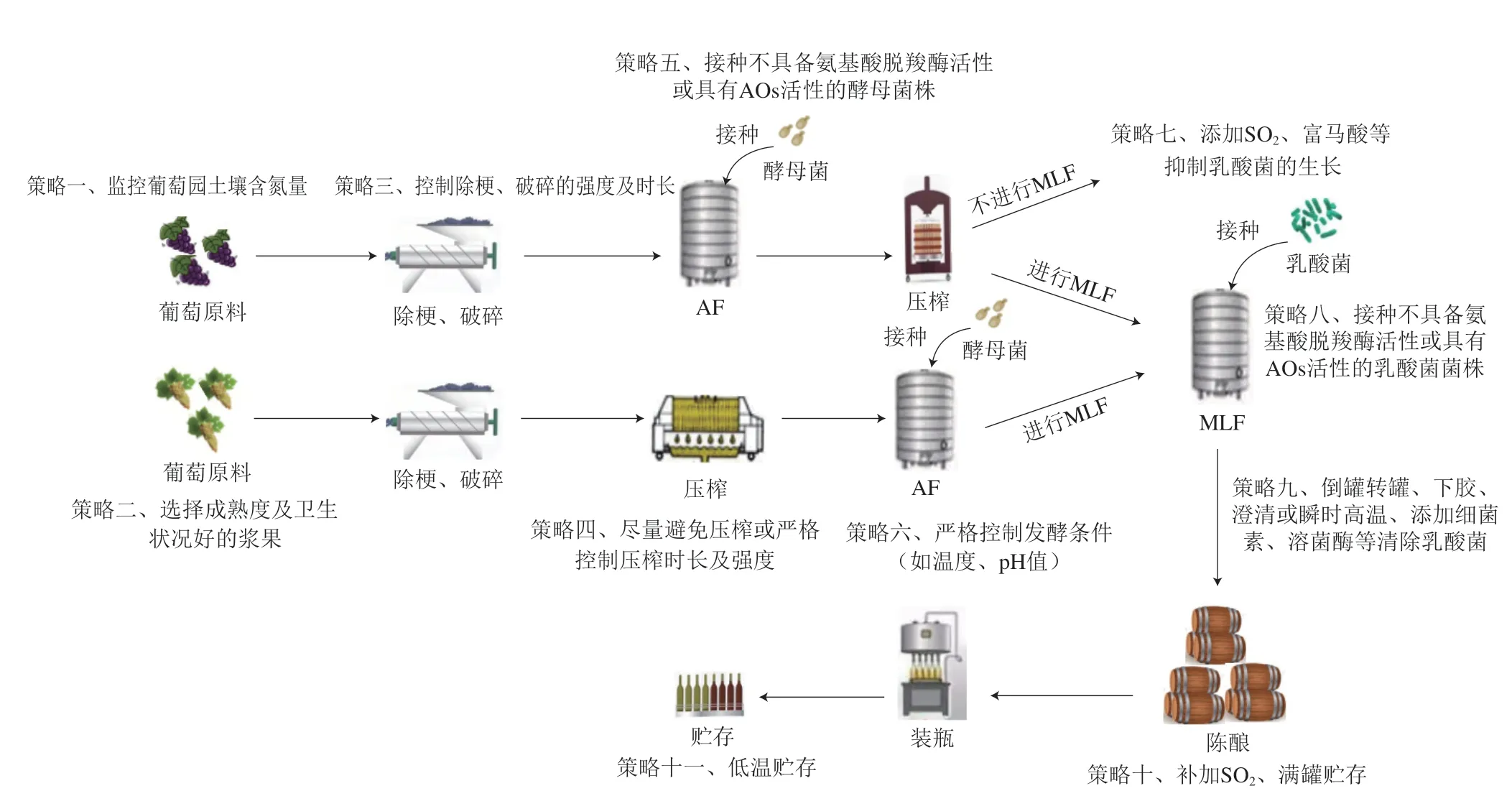
图2 葡萄酒酿造过程中BA的控制Fig.2 Control of BA during wine brewing
6.1 葡萄原料的优选
葡萄原料中游离氨基酸蓄积量随着品种、成熟度、产地、年份、气候等多重因素的不同呈现显著差异,进而影响发酵后葡萄酒中BA的种类及组成[21,90-91],从而影响最终葡萄酒中BA的含量。邓玉杰等[92]对新疆不同产区葡萄酒中BA的含量进行测定,结果表明,葡萄酒中BA的总量和种类因产地而异,即使是同一产区葡萄酒中BA含量也存在较大的差异。Wang Yaqin等[93]发现西北地区赤霞珠葡萄汁中BA包括腐胺、尸胺、苯乙胺、乙醇胺、亚精胺和酪胺6 种;Ortega-Heras等[94]比较了2008、2009、2010年份葡萄酒中的BA含量,发现2009年的葡萄酒中BA含量显著高于其他两个年份。值得说明的是并非所有影响葡萄原料的因素都会影响葡萄酒中BA含量,如干旱胁迫对葡萄原料中的BA组成及含量无显著影响。
从反应机制层面来说,减少底物供给能够减少BA的生成,但若对葡萄浆果中的游离氨基酸含量进行绝对的控制则会产生适得其反的效果。氮素对于酵母菌在葡萄酒环境中的生长代谢具有重要作用,当葡萄汁/醪中的可同化氮含量低于140 mg/L时,酵母不仅难以顺利完成AF,还会产生H2S,给葡萄酒的香气带来不良影响[95]。由此,选择成熟度和卫生状况良好葡萄浆果,不仅能够充分保障发酵的顺利进行,提高葡萄酒香气的纯净度,还能减少具有合成BA潜力的杂菌侵染(图2)。
6.2 葡萄酒微生物的选择
微生物的选择是影响葡萄酒质量的关键因素,微生物代谢也是葡萄酒中BA的主要来源。葡萄酒中的BA主要由具有氨基酸脱羧酶的葡萄酒微生物代谢产生,不同菌株发酵的葡萄酒BA含量也存在差异,故在葡萄酒酿造过程中,接种不产生氨基酸脱羧酶或具有AOs活性的菌株是降低产品中BA含量最有效的方式(图2),前者可预防由葡萄酒微生物代谢导致的BA积累,后者能够实现对BA不同程度的降解。目前,具备此功能的乳酸菌已有相关报道,如Callejón等[96]从葡萄酒植物乳杆菌(Lactobacillus plantarum)J16和乳酸片球菌(Pediococcus acidilactici)CECT中分离纯化得到两种AOs,能够降解葡萄酒中部分组胺、酪胺和腐胺;Capozzi等[97]发现两株L.plantarum能够降解腐胺和酪胺。有学者探究了从葡萄酒中分离出的多种乳酸菌菌株对BA的降解能力,发现不同菌株对不同BA的降解能力存在显著差异,其中干酪乳杆菌IFI-CA52因能产生胺氧化酶,具有较高的BA降解能力,其降解效果虽因乙醇、多酚、SO2的影响而有所下降,但仍具有降解葡萄酒中BA的潜力[98]。Cueva等[99]采用仅含有组胺、酪胺和腐胺为氮源的特定培养基对从土壤和葡萄藤中优选出的真菌进行培养,评价其对BA的降解潜力,结果表明,所有真菌都能降解至少两种不同的胺类,具有较强的降解BA能力。牛天娇[100]从乳酸菌中筛选具备产胺氧化酶能力的植物乳杆菌L.plantarumDN2,其在发酵黄酒时能够降解高达50.3%的BA,且对成品酒的质量和感官品质无显著影响。上述菌株在葡萄酒产业中的应用性还将取决于它们的发酵特性,如MLF发酵性能、产香潜力等。
6.3 优化发酵工艺
大量研究表明,葡萄酒中的BA主要来源于发酵过程,适宜的酿造工艺对于保证葡萄酒的安全性至关重要[101]。如前文所述,少量BA和大多BA生物合成的前体氨基酸均存在于葡萄浆果中,故对葡萄原料进行除梗、破碎、压榨、澄清等工艺处理必然会影响上述物质在发酵基质中的含量,最终影响酒体中BA的含量。因此,选择合适的机械处理和澄清工艺可有效避免葡萄酒酿造过程中BA的积累。机械处理后,通常对葡萄醪进行果胶酶处理以提高其出汁率,但果胶酶种类、添加时间、添加量等都会影响发酵基质中氨基酸水平,从而进一步对BA含量产生影响[102]。发酵温度也是影响葡萄酒中BA含量的重要因素之一,研究发现葡萄酒中BA生成速率通常随MLF发酵温度的升高而有所增加[103],这是由于蛋白酶和氨基酸脱羧酶在较高温度下酶活力更高,更利于BA的生成。此外,酸性环境有利于BA的生成,主要是因为大部分氨基酸脱羧酶的活力在pH 4~5时较高,故当发酵基质的pH值较高时有助于乳酸菌的快速繁殖,BA含量也会随之增加[104]。综上,在AF过程中,必须严格控制发酵条件,如机械处理强度、发酵温度和pH值,以减少这一过程中BA的积累。
MLF的启动时间也对葡萄酒的BA水平存在影响。如Lonvaud等[105]对自发MLF、同时进行AF与MLF、AF后进行MLF 3 种处理后酒样中的BA含量进行检测,发现AF结束后接种乳酸菌产生的BA最少,而自发MLF通常会导致最终葡萄酒中BA浓度的升高。因此,对于不进行MLF的葡萄酒而言,可在AF结束后及时添加SO2、富马酸等化学抑制剂抑制乳酸菌的生长;而对于陈酿型葡萄酒,在二次发酵MLF结束后,因酒液中pH值升高及SO2含量较低,发酵基质中残余的一些微生物如乳酸菌仍具备氨基酸脱羧能力,可采用倒罐转罐、下胶、澄清或瞬时高温灭菌处理,以及添加乳酸链球菌素、片球菌素等细菌素及溶菌酶等[106]及时清除乳酸菌,从而控制BA的含量(图2)。陈酿阶段的贮藏温度和时间也是影响BA合成的重要因素[107],由于酵母可通过自溶效应释放氨基酸,酒液与酒泥接触过久也会增加BA积累的风险,因此在葡萄酒成熟时,应适当添加SO2、进行满罐低温陈酿(图2)。Jae-Young[108]和栾光辉[109]等分别探究了不同贮存温度下韩国米酒和啤酒中的BA含量,结果表明贮存温度与BA积累量呈负相关,然而Marco等[110]研究发现,葡萄酒的贮藏温度对BA浓度的影响较小。但为保证葡萄酒的饮用质量,低温贮存和运输仍是有效措施。
迄今为止,葡萄酒中BA一旦过量并无有效的方式去除。尽管极少数的葡萄酒微生物能够合成AOs降解组胺、酪胺和腐胺等[8],但这种微弱的自然降解并不能完全去除成品葡萄酒中的BA。因此,葡萄酒中BA控制的重点并非在于对已有BA的去除,而应在于在葡萄酒酿造过程中多措并举,及时控制BA的产生,确保葡萄酒的安全性。
7 结语
近年来,消费者对于葡萄酒质量安全的关注越来越多,BA含量对葡萄酒质量的影响也是葡萄酒研究的前沿热点之一,全球研究者以多个视角对葡萄酒中BA形成的机理展开研究,并获得了一系列重要的认知。目前普遍认为葡萄酒中BA主要由大多数的乳酸菌和少数酵母菌代谢合成,其检测主要依赖HPLC法,但该方法前处理繁琐复杂,因此探索简便快速、稳定灵敏、可靠的检测方法十分必要。葡萄酒中BA含量随原料、微生物、工艺等因素的变化而变化,据此可实施相应的葡萄酒工艺策略实现对BA含量的有效控制。其中合理使用菌株是控制葡萄酒中BA含量的重要手段,可采用多重PCR、实时定量PCR等分子生物学方法检测发酵体系中是否存在乳酸菌等葡萄酒微生物。此外,由于葡萄酒发酵体系微生物的高度复杂性,当前对除酿酒酵母与乳酸菌外的其他微生物,如非酿酒酵母、醋酸菌等是否参与BA的合成还缺乏全面的认识,亟需进一步的探索,为控制葡萄酒BA含量提供更多思路。同时我国葡萄酒生产商应严格遵守相关国家标准,为消费者提供安全健康的葡萄酒产品,促进国产葡萄酒实现“量质并重”的战略转型。
