新型电物理加工对多尺度蛋白质结构的影响研究进展
2023-08-12丛海花崔保威张紫薇宋京城逯晓燕黎茉可
丛海花,崔保威,张紫薇,周 倩,宋京城,高 岳,*,逯晓燕,*,黎茉可
(1.苏州农业职业技术学院食品科技学院,江苏 苏州 215008;2.大连海洋大学食品科学与工程学院,辽宁 大连 116023;3.江南大学设计学院,江苏 无锡 214122)
新型电物理加工技术主要包括电场技术和电磁场技术(图1),电场技术是将产品置于通电电场中,并将其作为一段导体进行加工的技术;电磁场是由电荷流动产生的,该加工技术是通过外加电场与食品中的偶极分子相互感应来进行食品加工[7]。电物理加工技术因其适用性广、成本低等特点最早应用在疾病治疗方面,之后逐渐进入食品领域,成为食品加工的一种新技术。电物理加工可以使蛋白质的极性基团(巯基)吸收能量产生自由基,或使蛋白质发生聚集和解折叠反应,破坏蛋白质分子之间的各种相互作用力,包括范德华力、静电和疏水相互作用、氢键、二硫键和盐桥等,导致蛋白质构象发生变化,影响蛋白质的结构和功能性质,进而影响食品品质和风味[3,8]。许多研究详细介绍了高压[9]、超声波[10]和常规加热[11]等物理方法对蛋白质构象和功能特性的影响。然而,目前缺乏针对电物理加工技术对多尺度蛋白质结构影响的汇总。因此,本综述介绍新型电物理加工技术(主要包括欧姆加热、静电场、微波、射频和磁场)对多尺度蛋白质结构变化的影响,并结合不同电物理加工技术中蛋白质结构和功能变化的研究结果进行分析,为进一步开展相关电物理加工技术应用提供理论支持。

图1 新型电物理加工技术对多尺度蛋白质结构的影响示意图Fig.1 Schematic diagram showing the effect of new electrophysical processing technology on multiscale protein structure
1 欧姆加热对多尺度蛋白质结构的影响
欧姆加热也称为焦耳加热、电阻加热或导电加热,是指待加热材料(例如反应混合物)作为欧姆加热器,通过交流电流加热的一种点加热技术。该反应器用于食品加热时,通过食品物料自身的电导特性来加热食品,在食品两端施加电场后,电流会流进食品内部。此时,食品的自身阻抗可产生热量,从而达到加热物料的目的[12]。欧姆加热可以消除通过温度梯度或热表面或从周围环境到介质的传热步骤,实现快速均匀加热[13],同时也由于其通电的原因会改变蛋白质的结构。
由于热和电场的共同作用,欧姆加热可以干扰蛋白质构象及其相互作用,改变其展开机制和聚集模式,从而诱导大分子(如蛋白质)发生特异性变化[14-16]。在不同的处理条件下,欧姆加热对多尺度蛋白质结构有明显的影响(表1)。有研究发现蛋白质经欧姆加热后,随着温度的进一步升高,伴随着静电相互作用的产生,蛋白质分子发生拉伸、修饰,使得溶解度、发泡性能和ESI降低,EAI和浊度增加[17]。同时,欧姆加热也使嵌在分子内部的巯基暴露在分子表面,导致电流传导时巯基发生氧化生成二硫键,极大地干扰了蛋白质的二级和三级结构构象[17-18],也使得蛋白质解折叠,发生不可逆的聚集反应,如经欧姆加热(50 ℃)处理后的虾壳内胶原蛋白的部分α-螺旋缺失,酰胺I带峰蓝移,使得蛋白的二级结构变得不稳定[19];大豆蛋白组分发生荧光猝灭且最大发射波长发生红移,改变了蛋白质的三级构象[20];欧姆加热处理乳铁蛋白,更高的温度导致反应性(未折叠)球状蛋白质分子数量增加,分子结构局部展开,导致荧光强度升高,三级构象发生变化,从而提高蛋白质-蛋白质碰撞频率,有利于蛋白质聚集[21];在相对较高的温度(60 ℃)下,β-乳球蛋白(β-lactoglobulin,β-lg)分子经历变性和构象转换,暴露出疏水基团和游离巯基基团,而游离巯基可与共价二硫键发生交换反应,并在非共价相互作用下产生较大的β-lg聚集体,导致蛋白质溶解度下降和浊度上升[22];利用TEM进行的研究也证实了欧姆加热(90 ℃,5 min)和中等电场处理(3 V/cm)可使蛋白质以更无序的方式发生聚集,并使凝胶产生了更均匀和紧凑的结构,这说明凝胶网络的形成与欧姆加热和中等电场强度的大小有关[23]。综上所述,欧姆加热过程中产生的电流可干扰蛋白质的静电相互作用[24],使蛋白质拉伸;或者是电场以一种非常独特的方式影响疏水核或局部蛋白质的疏水性基团,使疏水基团暴露,干扰蛋白质二级和三级结构构象,导致分子之间不同形式的聚合或展开[22],从而形成较大的聚集体,使得溶解度等功能特性发生变化。
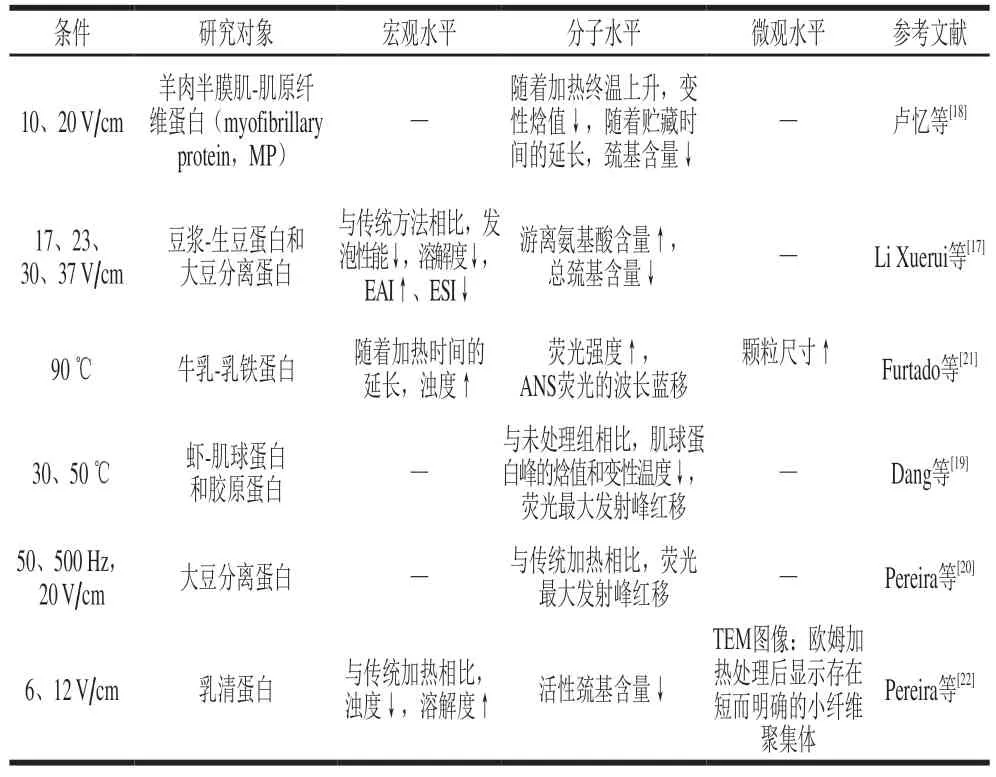
表1 欧姆加热对多尺度蛋白质结构的影响Table 1 Effect of ohmic heating on multiscale protein structure
欧姆加热是一种较成熟的加工方式,应用于食品加工过程中还存在一些问题:1)加热速度难以控制;2)对于不导电、水分极低干燥的物料无法加工;3)加热时容易时使物料黏附在电极表面,影响加热效率。因此,后续应扩大欧姆加热的使用范围并且实现精准控温;避免物料接触电极表面,对设备造成影响。目前已有研究使用欧姆加热技术对冷冻食品(金枪鱼)进行解冻,探究其解冻过程中品质的变化[25],未来可进一步探究其在解冻时蛋白质的变化(变性和氧化)及作用机制。
2 静电场对多尺度蛋白质结构的影响
静电场技术是一种新型的食品加工技术,其可根据输出电压可将静电场分为高压静电场(high-voltage electrostatic field,HVEF)(>2.5 kV)和低压静电场(low voltage electrostatic field,LVEF)(≤2.5 kV)[26]。HVEF的输出电压很高,可以通过非热力系统避免热量对食品风味、颜色和营养价值的不利影响[27]。与传统解冻相比,在质量变化最小且能耗较低的情况下,可以缩短冷冻食品的解冻时间,但其存在安全隐患,难以应用于大规模肉类加工[28];LVEF技术通过静电板产生静电场再经变压器升压产生直流电压,避免了物料与放电板的直接接触,提升了安全性能[26]。
静电场技术对多尺度蛋白质结构的变化影响如表2所示。Jia Guoliang等先后利用不同电压的HVEF对猪肉和兔肉进行解冻处理,发现HVEF可使蛋白质发生降解或聚集,使得溶解度和α-螺旋含量下降,而在-20 kV时变化较小,并保持了良好的持水能力(water holding capacity,WHC)[29];且HVEF解冻猪肉对α-螺旋结构含量和β-折叠的移位影响较小[30]。有研究认为在电晕放电和带电离子流的影响下,针电极数量较少时,MP中的非共价相互作用发生变化,导致蛋白质链展开,比表面积增加,粒径减小[31];且HVEF解冻后的牛肉样品表面更光滑,纤维之间的间隙更小,凝胶强度更高,并认为这与净表面电荷和蛋白质链之间的静电排斥力有关[32]。而对于LVEF来说,LVEF能促进MP在解冻过程中的复性,使得表面疏水性降低,溶解度随时间延长显著增加,并且观察到纤维束之间的间隙更窄,肌肉微观结构更完整[28]。此外有研究认为由于LVEF在冷冻过程中诱导形成了小冰晶,有利于形成更紧密的肌纤维束,能够减轻冷冻过程中牛肉横切面的微观结构损伤[33];李侠等利用LVEF辅助冻结-解冻牛肉MP,研究样品与静电场发生装置间距离对二级结构的影响,结果发现β-转角含量显著下降,并向α-螺旋和β-折叠转变,而距离静电场发生装置30 cm处,更有利于维持牛肉MP二级结构的稳定性[34]。
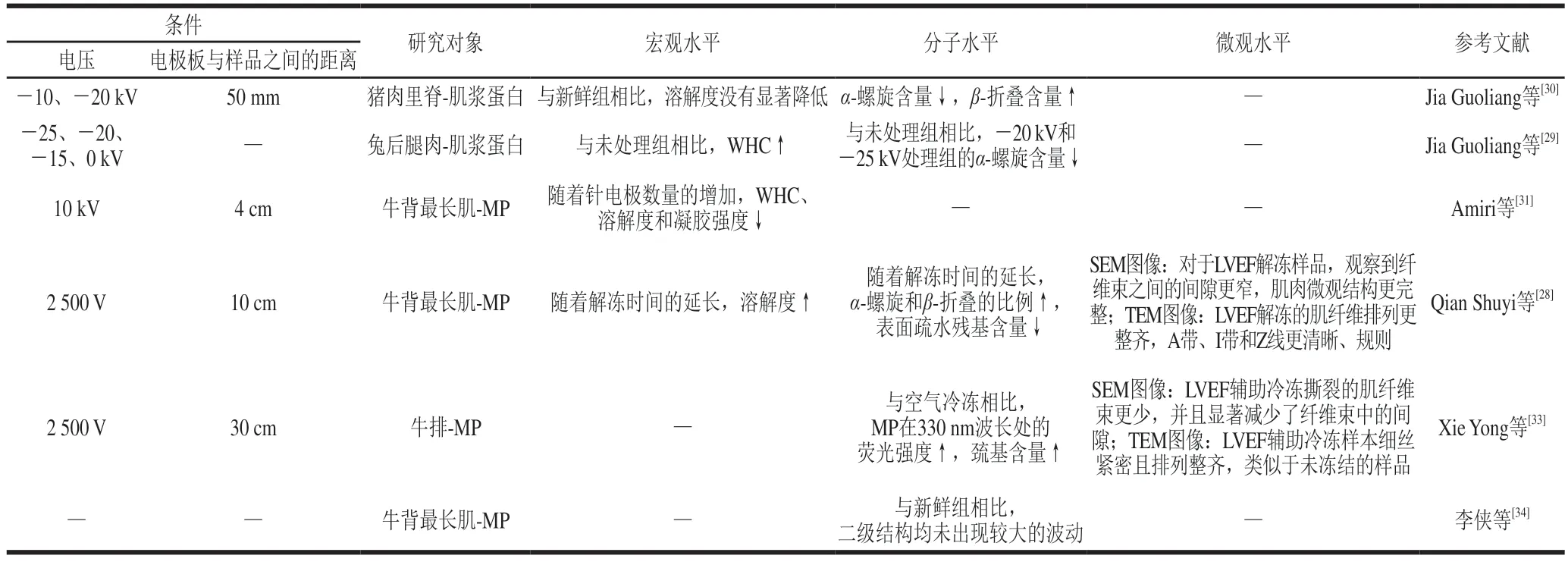
表2 静电场对多尺度蛋白质结构的影响Table 2 Effect of electrostatic field on multiscale protein structure
静电场技术主要集中在对肉制品冷冻-解冻方面,而HVEF技术存在电压高、缺乏安全性、对贮藏环境要求高、操作复杂等问题,很难大规模应用,而LVEF技术则不存在实际操作中的安全性问题。因此,应通过调整静电场设备的加工强度和针电极数量以实现规模化应用。近几年研究的DENBA+静电波技术可将电压控制在3 500 V以下,提升了安全性,目前已初步应用于冰箱等冷冻/冷藏设备,但还需对其作用机制进行深入探究。
1.3疗效判断标准 显效:各项生理指标降至正常范围,临床症状消失;有效:各项生理指标降至治疗前的50%以下,临床症状有所改善;无效:各项生理指标降低幅度<50%,临床症状改善不明显甚至无改善。
3 微波对多尺度蛋白质结构的影响
3.1 微波加热
微波加热已成为现代工业食品加工中的常用方法。微波是一种频率在300 MHz~300 GHz之间变化的电磁波。微波加热的原理是由材料吸收微波能量并将其转化为热。食品材料的微波加热主要是通过双极化和离子传导,与传统加热相比,微波加热速度更快、作用更均匀、能耗更少、效率更高、整体更环保[35]。
不同的微波加热条件对多尺度蛋白质结构有明显的影响。研究表明,经微波加热处理的蛋白质溶解度随着微波功率的升高呈现出先增大后减小的趋势,但随着微波功率的增加,发泡性和乳化性能略有增加[36-37]。微波加热可以通过断裂蛋白质的非共价键(氢键、离子键等),使得蛋白质结构展开,暴露出更多的疏水基团,从而影响蛋白质的结构和功能[38-39]。如:微波加热使鸡肉肌球蛋白的二硫键与蛋白质分子间巯基互相结合,导致二硫键含量升高,并发生解折叠,使分子内部基团暴露,发生交联,引起溶液浊度增加[40];大米蛋白的二硫键因微波加热而断裂,导致游离巯基含量增加[41];微波加热处理米糠蛋白降低了α-螺旋结构和β-折叠结构含量,并使蛋白质分子之间相互吸引,重新形成聚集体,增强水合作用,从而提高蛋白质的溶解度[42]。且微波加热产生的交变电场会产生撕裂效应,这利于肌球蛋白分子在较高温度下展开,有助于肌球蛋白聚集,从而改善凝胶化过程,原子力显微镜(atomic force microscope,AFM)下观察到的图像证实了这一点[43];凝胶电泳图谱和SEM分析表明,经微波加热处理后的MP凝胶具有良好的凝胶性能和紧密的蛋白质网络,这是由于在微波加热过程中可以通过控制二硫键和疏水氨基酸的生成,抑制组织蛋白酶在MP凝胶上的降解[44]。微波加热预处理(700 W、1 min)可以降低游离巯基含量,进而影响二硫键的形成,并且暴露出更多的疏水基团,使得溶解度降低,凝胶强度升高[45];并且温和的微波加热预处理可以提升肌球蛋白的拉伸性,稳定有序的二级结构,并增强蛋白质-蛋白质疏水相互作用和蛋白质-水氢键结构,防止严重变性和聚集,且随着处理强度的增加和温度的升高,肌球蛋白的平均粒径显著增加,用300~400 W微波处理加热至80 ℃后,粒径分布的第一峰消失,表明可溶性蛋白质分子的构象轻度改变有助于形成更规则的间隔排列,使所有小结构都聚集成高分子质量化合物[46]。SEM和CLSM观察结果也表明,经过微波加热协同常规加热进行处理得到的鱼糜网络结构更加紧凑[47];使用微波(2 450 MHz)对厚度为2.0 cm的鱼糜进行加热,发现可形成有序且致密的网络结构,并且具有更高的凝胶性能(16.42 MPa)和保水性(73.59%)[48]。
而且微波加热的非热效应也可能对蛋白质的二级和三级结构产生影响最终会导致蛋白质功能特性的改变。如微波加热后磨碎牛肉样品的温度低于常规加热组,并且由于聚集β-折叠结构含量较高,过渡偶极耦合增加,这一结果反映出微波加热对蛋白质二级结构的非热效应[49];使用微波加热至50 ℃以上,β-乳球蛋白的α-螺旋和β-折叠含量都比常规加热降低得更快,此外,荧光光谱峰值波长的红移表明β-乳球蛋白的三级结构发生了显著变化[50];因此说明除了热效应外,微波加热的非热效应也可能破坏蛋白质的二级和三级结构,从而影响其功能特性。然而,到目前为止,微波加热非热效应与蛋白质分子结构演变的相关性并不明确,主要原因是缺乏能够精确控制加热速率或模拟加工过程的设备和方法;并且现在行业主流认为,工业生产使用的微波加热技术并不考虑非热效应。
3.2 微波解冻
目前冷冻保藏是肉及肉制品贮运保鲜最重要的方式,肉制品品质的优劣不仅取决于冷冻保鲜技术,还取决于解冻技术[51],而微波解冻就是常用的解冻技术之一。微波解冻是利用微波能将冷冻品进行穿透性迅速加热,使原料肉内外同步解冻并升温至不滴水的状态[52]。微波解冻具有速度快、均匀度高且对肌肉组织损伤少等优点[53],同时也伴随着原料肉局部过热的现象[52]。
微波解冻对蛋白质变化的影响如表3所示。Wang Bo等[54-55]先后报道了使用微波解冻后猪背最长肌结构和功能的变化,蛋白质分子发生解折叠,产生聚集反应,使得浊度增加,结构发生变化,凝胶粗糙度增加,并认为蛋白质的聚集性与凝胶表面粗糙度呈正相关,一方面是微波加热的瞬时高温导致猪背最长肌局部过热,削弱了分子间的氢键,导致部分蛋白质结构不稳定,荧光红移与局部过热或固有的不均匀解冻有关,这表明解冻样本中的蛋白质氧化程度相对较高,并促进了蛋白质的展开;另一方面是由于解冻通过异构化和烯化促进了酪氨酸自由基的交联使得蛋白质表面氨基酸残基变化,二酪氨酸含量的增加证实了这一点。微波会引起蛋白质氧化和次级键断裂,使内部的极性基团暴露,蛋白质原有结构被破坏[55],如:500 W微波解冻鱿鱼后其总巯基含量下降程度较小,氧化程度降低[56];使用微波对鲤鱼进行冻融实验,随着冻融循环次数的增加,总巯基含量呈下降趋势,说明由于二硫键的形成或降解,导致蛋白质三级结构的破坏[57]。微波解冻会使蛋白质通过共价作用和疏水相互作用形成胶束,最终形成三维凝胶网络[58]。如:微波解冻冰蛋黄后α-螺旋相对含量减少并向其他结构转变,使二级结构变得不稳定,且β-转角含量越高,溶解性越强;且解冻过程中粒径的增加是由于聚集体的形成,主要是蛋白质结构中氢键或静电键的热损伤所造成的[58]。此外,有研究发现,单一的微波解冻效果较差,而使用微波联合远红外解冻可以维持鲈鱼MP的结构稳定性[59],并且经微波和超声协同微波解冻处理的鱼类样品利用SEM观察可见组织几乎没有裂纹和气孔,并且肌肉膜结构相对完整,与新鲜样品没有显著差异[60]。微波解冻会使物料迅速融化,使得物料的表面温度迅速降低,出现局部过热的现象,微波场中食品的温度难以测定,不利于把握解冻时间、控制食品品质[52]。因此,后续的设备应注重物料解冻时的均匀加热和对过程中温度的精准把控。
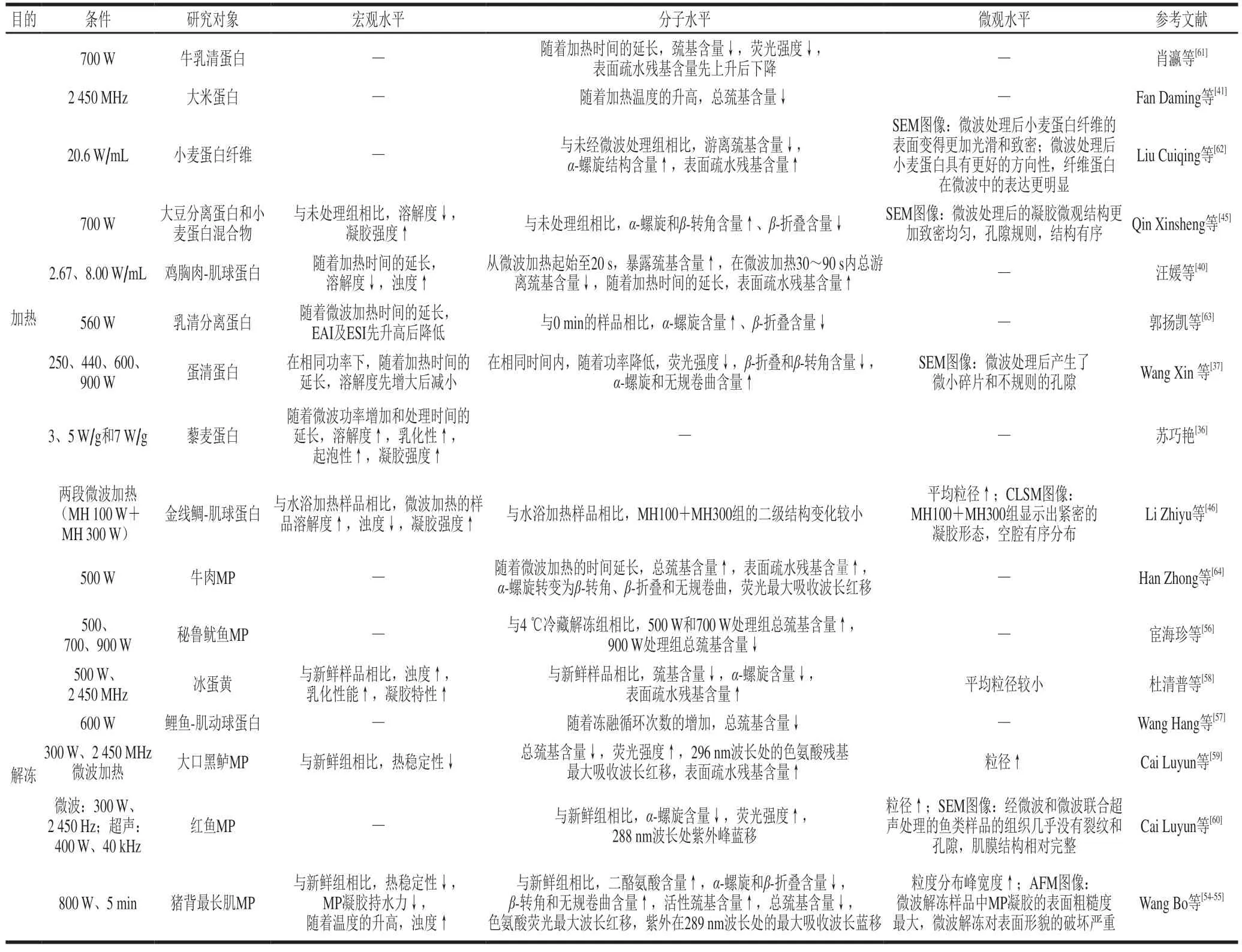
表3 微波处理对多尺度蛋白质结构的影响Table 3 Effect of microwave treatment on multiscale protein structure
4 射频对多尺度蛋白质结构的影响
射频(1~300 MHz)是非电离电磁波,原理是由于偶极子分子旋转的极化机制和直接传导效应,在介电材料中产生体积热,从而形成快速均匀的加热过程[65]。与传统加热相比,其设备成本高,但能耗低[66];与欧姆加热不同,射频能量可以穿透传统的纸板或塑料包装,且产品和电极之间没有任何接触;与微波相比,射频能量可以深入到样品中,更适合处理大尺寸和大块材料[67]。
在不同的处理条件下,射频对蛋白质有明显的影响(表4)。有研究表明,射频加热时由于高频电场引起物料分子内和原子间的摩擦,二硫键、氢键以及静电相互作用遭到破坏,导致蛋白质结构展开,暴露出更多的疏水性氨基酸,并增强水合作用,最终导致溶解度、乳化性、起泡能力以及热稳定性提高[68]。经射频加热后,蛋白质的二级结构之间发生了相互转换,如:射频加热诱导了大豆分离蛋白从无规卷曲到β-折叠的自组装[69];射频处理(100 mm)猪肉MP诱导了其从β-折叠到α-螺旋的自组装[70];射频处理后(140 mm),草鱼MP凝胶的部分α-螺旋转变为无规卷曲,使蛋白质完全展开,内部基团通过疏水相互作用和二硫键交联,形成清晰光滑的凝胶[71]。蛋白质的不同类型和状态以及不同的射频加热方法都会影响蛋白质的结构,进而影响其功能特性,而主要的影响因素是最终温度和电极间隙。无论电极间隙如何,随着处理温度的升高,米糠分离蛋白的荧光强度降低,大豆分离蛋白紫外吸收强度降低,表面疏水性的增加,证实了射频处理可以导致蛋白质分子部分展开,使蛋白质分子发生聚集和交联,导致蛋白质的三级结构发生了变化[67,69]。在相同的最终温度(90 ℃)下,随着射频电极间隙的增大,其功能特性以及热稳定性逐渐增加,并在200 mm时达到最高值,此时巯基含量和表面疏水性最大[68]。目前有研究发现,无论是二级结构还是三级结构的变化,磁纳米协同射频处理样品都更接近于新鲜样品,使样品均匀解冻,缩短解冻时间,可减少对样品结构的损伤,提高解冻后鱼蛋白结构的稳定性[72]。

表4 射频对多尺度蛋白质结构的影响Table 4 Effect of RF on multiscale protein structure
目前射频技术的应用主要集中在热处理、灭菌及解冻等领域,其虽然具有一定的优势,但还具有一定程度的加热不均匀问题,且由于设备投资费用高等原因还未进行工业化应用。若能从设备着手调整适合的电极间隙以提升温度分布的均匀性,射频技术将更能适应目前的加工环境。射频与其他技术协同对食品进行加工也是一个新的研究方向,如磁性纳米协同微波或射频、射频加热联合盐水解冻和射频加热协同磁场等。
5 磁场对多尺度蛋白质结构的影响
磁场是一种看不见、摸不着但真实存在的一种物理场,分为时变磁场和稳态磁场两种[73]。低频磁场(low frequency magnetic field,LF-MF)(<300 Hz)属于时变磁场也属于感应磁场,其不依靠空间传递能量,由电压和电流产生感应电场和感应电流来形成磁场[74];直流磁场(direct current magnetic field,DC-MF)(<400 mT)属于稳态磁场,是向磁场发生器提供稳定的直流电形成磁场[75]。在这类磁场作用过程中食品中水分子会发生磁偶极矩,使得氢键含量增加,水分子之间的键联更紧密,形成的网络更稳定,从而导致热导率升高和冰点冻结[76],达到加热或冷冻目的。与常规方式相比,磁场具有方便、高效、安全、无残留等特点[77]。磁场在加热过程中可以实现快速升温,在冷冻过程可以形成均匀细小的冰晶,以此来保护食品的品质属性(抑制蛋白质变性、保持良好的持水力和延缓汁液流失等)[73]。
5.1 低频磁场
LF-MF可以增强蛋白质之间的静电相互作用,为水分子提供更多的结合点,并促进蛋白质展开,促使发生聚集反应,改变凝胶强度和WHC[78],不同的磁场处理条件对食品加工中的蛋白质结构展开有明显的影响。磁场可以增加肌红蛋白总游离巯基的暴露量,且磁场强度越高,暴露的总游离巯基越多,这可能是肌红蛋白结构的展开或巯基还原为游离巯基造成的[77];并有研究发现,随着LF-MF强度的增加,蛋白质结构展开,疏水基团暴露,氢键减弱,导致α-螺旋断裂,形成β-折叠、无规卷曲和β-转角[79]。在热诱导MP变性形成凝胶的过程中,利用LF-MF(9.5 mT、2 ℃/min)进行加热处理,猪肉MP的α-螺旋含量降低,β-折叠和β-转角含量增加,使得MP显示出均匀的微观结构,从而导致WHC增加,且适当提高加热速率有利于缩短MP的加工时间[80];采用二段式加热(9.5 mT)对草鱼MP加热,发现在第一阶段(40 ℃)的24 h内,LF-MF诱导不利于草鱼MP的展开,相反,在第二阶段(85 ℃),α-螺旋展开和无规卷曲的形成导致更多内部基团的暴露,导致离子键含量的减少和氢键含量的增加[78];还有研究采用射频(140 mm、40 ℃、10 min)和磁场(9.5 mT、80 ℃、40 min)代替二段式水浴加热,发现在第二阶段磁场辅助加热可能会增强草鱼MP之间的静电斥力和结构的稳定性,减少α-螺旋含量,为水分子提供更多的结合位点,形成结构良好的草鱼MP凝胶[81]。pH值也会诱导蛋白质解折叠从而改变二级结构,在相同pH值(pH 6.0和7.0)下,LF-MF加热处理(从20 ℃加热至72 ℃)的凝胶α-螺旋含量更少,β-折叠含量更多,蛋白质分子发生重排,暴露出更多参与氢键的水结合位点,最终使得WHC升高[82]。
综上所述,在一定的LF-MF下,加热速率、加热方式、pH值等均会影响蛋白质分子间的静电相互作用,导致蛋白质分子重新有序排列,并提供更多的水分子结合位点;随着强度的增加,蛋白质分子逐渐展开,暴露出更多的基团,且减弱了分子内的氢键,导致α-螺旋断裂,使得蛋白质二级结构变得不稳定,最终影响蛋白质的多尺度结构。
5.2 直流磁场
近几年的研究表明,使用DC-MF进行冷藏/冷冻处理会使MP发生去折叠,引起巯基含量和表面疏水性的变化,导致蛋白质发生聚集,增强蛋白质之间的相互作用,从而改善凝胶的WHC,增加浊度。如Yang Kun等[83-84]先后报道了磁场强度和处理时间对猪肉MP的影响,发现适当强度磁场处理(3.8 mT)有助于蛋白质结构的展开,导致更多内部酪氨酸基团和脂肪族基团暴露在蛋白质表面,以及一些二硫键被破坏,DC-MF处理显著改善了WHC,在3.8 mT时达到了最大值(50.36%),形成更致密、更均匀的凝胶网络;并且适度的DC-MF处理(3 h)也可以增强蛋白质-蛋白质和蛋白质-水之间的疏水相互作用和水合作用,导致蛋白质发生交联和聚集,使得浊度增加,并形成牢固的三维网络结构。Wu Di等[85]使用DC-MF在22 ℃下处理低盐MP,所有处理组的α-螺旋和β-折叠含量均无显著变化,低盐溶液抑制MP的展开,进一步导致热诱导的凝胶结构变差、WHC降低;而在低温(4 ℃)下,DC-MF可以提高低盐MP凝胶的WHC。综上所述,DC-MF的磁场强度及处理时间均会影响蛋白质的结构,都可以使蛋白质结构展开,使得一些疏水基团暴露,增强疏水相互作用和水合作用,导致蛋白质发生交联和聚集,导致蛋白质构象改变,而使用DC-MF在22 ℃下处理低盐MP,二级结构并没有明显的变化,说明在低盐溶液可以抑制蛋白质的展开聚集,维持一定的结构稳定性。
5.3 其他
目前,有研究使用2 mT的静磁场对冷冻面团进行冻融处理,随着冻融循环次数的增加,谷蛋白结构由无序向有序转变,说明磁场处理可以保持贮藏过程中谷蛋白的二级结构稳定性[86];使用振荡均匀磁场(应属交变磁场)对鱼糜进行冻融实验,发现在磁场作用下,含铁离子的冻融鱼糜具有较高的热稳定性,且具有较高的持水能力,而变性焓值较低的原因可能是亚铁离子与蛋白质的结合导致了鱼糜中蛋白质的变性,并说明热稳定性与小冰晶的形成有关[87]。Calabrò等[88]发现,经高频磁场处理(180 mT、1 750 MHz、20 ℃、4 h)后,牛血清白蛋白的二级结构发生了变化。这种变化是由于磁场引起α-螺旋C=O和N—H配体的弯曲排列、振动和弯曲,导致酰胺I带含量显著增加。
磁场对多尺度蛋白质结构的影响汇总如表5所示。

表5 磁场对多尺度蛋白质结构的影响Table 5 Effect of magnetic field on multiscale protein structure
综上所述,磁场的作用效果与pH值、场强和作用时间等条件相关,合适的条件对食品的加工效果有明显的影响,与LF-MF不同的是,DC-MF处理低盐MP,其二级结构并没有明显变化,且仍具有良好的结构稳定性。因此,需要对磁场的条件进行更系统的研究,并探索其作用机制。目前关于磁场与食品加工的研究还处在初期阶段,因食品的千变万化,其磁场的具体参数也并不稳定,因此,还需要更多的研究确定一个合适的磁场参数。目前所拥有的磁场设备还处于实验室研究阶段,需进一步研发适合工业化生产的设备。
6 结语
电物理加工(欧姆加热、静电场、微波、射频、磁场)作为一类新型的食品加工技术,与传统加工方式相比,不仅能缩短加工时间、节能环保,还能在一定程度上减少蛋白质损伤,改善食品品质,具有良好的应用前景。不同的电物理加工技术都会使多尺度蛋白质结构发生变化,如MP纤维间隙更为紧凑;蛋白质二级结构的主要构象α-螺旋在加工过程中被破坏,蛋白质稳定性下降;色氨酸等残基暴露,蛋白质分子之间产生静电相互作用,蛋白质分子拉伸、修饰或解折叠,从而发生不可逆的聚集反应和交联形成聚集体,而聚集体大小、形态等因素最终影响功能特性。本研究综述了新型电物理加工技术对多尺度蛋白质结构变化的影响,以期为新一代电物理加工的战略构想和进一步产业化提供理论参考。
然而,电物理加工过程中,多尺度蛋白质结构的变化还受很多因素影响,如盐分、pH值、电极间隙、升温速率、温度和作用时间等,值得更深入研究,尤其是不同加工技术的具体作用机制。电物理加工技术也显现出一些不足,如适用性低、加热不均匀和设备费用高、无法大规模生产等,需要进一步优化电物理加工的设备和工艺参数等,以达到对蛋白质结构变化的适当控制,提高产品品质。此外,尽管最近的研究趋势偏向于各种电物理加工技术和各种非热加工技术,但是也不能忽略传统的加热、冷冻、解冻等方法的可能性和固有优势,同时在工业化应用过程中,也不能排除电物理加工技术产生有害副产物的可能性。
