生物被膜初始黏附调控机制及其在食品品质控制中的应用研究进展
2023-08-12熊儒恒
熊儒恒,阎 俊,谢 晶
(上海海洋大学食品学院,农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海水产品加工及贮藏工程技术研究中心,上海 201306)
细菌是影响食品品质的主要因素[1],其通过自身代谢作用,产生初级或次级代谢产物,使得食品基质发生劣变,形成挥发性有机物等有害物质,进而影响食品风味和食品安全性,导致食品安全问题的发生[2-4]。细菌在自然界中有两种生存模式[5]:浮游态和生物被膜态,其中生物被膜态是细菌细胞在自然界中普遍且主要的存在形式。生物被膜是细菌细胞黏附于物体表面后,自身分泌胞外聚合物(extracellular polymeric substance,EPS),并将细菌细胞包裹其中而形成的菌体聚集膜状物[6]。EPS主要包括胞外蛋白、胞外多糖、核酸、脂质等胞外大分子以及其他生物分子等[7],它能使细菌固定在物体表面并形成稳定的微生物群落,维持生物被膜结构。生物被膜的形成增强了细菌细胞的代谢能力[8]、环境耐受性[9]等,赋予了细菌复杂的代谢功能,增强了细菌的持续感染力、毒力以及耐药性等[7,10]。
生物被膜的生命周期分为4 个阶段:初始黏附、微菌落形成、生物被膜成熟和生物被膜降解[11]。初始黏附是浮游态细菌通过细菌表面元器件、EPS等作用与物体表面产生一系列理化作用并吸附到生物或非生物表面的过程[12]。细菌初始黏附分为可逆黏附和不可逆黏附两个阶段。在可逆黏附阶段,浮游态细菌首先在重力、布朗运动以及自身鞭毛和菌毛[13-14]等作用下到达生物或非生物界面,在界面环境的影响下,细菌细胞表面物质逐渐发生构象变化,并在液体流速[15]、黏附介质等外界因素[16]的影响下,与界面表面分子产生分子间作用力或静电引力等理化作用,发生可逆黏附作用。同时,细菌细胞将胞外基质的受力变化和环境变化等信号传导到细胞内,激活细菌特异性基因的表达,如细菌外排泵基因的激活[17]等,促进细菌发生不可逆黏附作用。细菌发生不可逆黏附后,其EPS如胞外多糖等能进一步增强细菌与外界接触表面的不可逆黏附[8,18-19],并最终使细菌完成初始黏附过程[20]。细菌经不可逆黏附过程完成初始黏附后,才能顺利形成生物被膜[20]。初始黏附是细菌形成生物被膜过程中的重要阶段,也是细菌能否形成生物被膜的决定性阶段。
细菌初始黏附受到多种因素的影响,其中细菌细胞内的调控系统是影响其初始黏附的重要因素。环二鸟苷酸(cyclic diguanylate,c-di-GMP)、双组分调控系统和群体感应系统是细菌细胞中常见的调控系统[21]。c-di-GMP是细菌细胞中常见的第二信使分子,其含量变化会影响细菌EPS如胞外多糖和胞外蛋白的合成和分泌,以及细菌鞭毛的迁移率,导致细菌黏附性发生变化,并最终影响细菌的初始黏附作用[19,22];双组分调控系统是细菌细胞常见的调控系统,其能根据细菌细胞外界环境如营养物质水平等的变化,通过磷酸化等化学反应调节细菌细胞中基因的转录水平,并影响细菌初始黏附等生命活动[23-24];群体感应系统是细菌由于群体密度增加,在细菌细胞与细胞之间产生的一种调控系统。群体感应系统对细菌细胞的调控作用主要通过细菌分泌的群体感应信号分子实现,细菌细胞可以通过感受自身细胞或其他细菌细胞分泌的群体感应信号分子的种类和浓度,调节自身初始黏附作用和生物被膜的形成[25]。c-di-GMP、双组分调控系统和群体感应系统等调控系统的存在能帮助细菌感知和应答外界环境信号,是影响细菌发生初始黏附作用、形成生物被膜,并最终影响食品品质和安全的重要因素。因此,研究不同调控系统对细菌初始黏附作用的调控十分有必要。
本文阐述并分析了c-di-GMP、双组分调控系统和群体感应系统3 种调控系统(图1)对细菌初始黏附的调控作用及其作用机制,并对从控制初始黏附角度进行食品品质控制的应用进行了总结和展望。本文可为控制细菌造成的食品品质危害提供一定的理论依据,有助于生物被膜靶向控制技术的开发,对食品产业的发展具有一定意义。
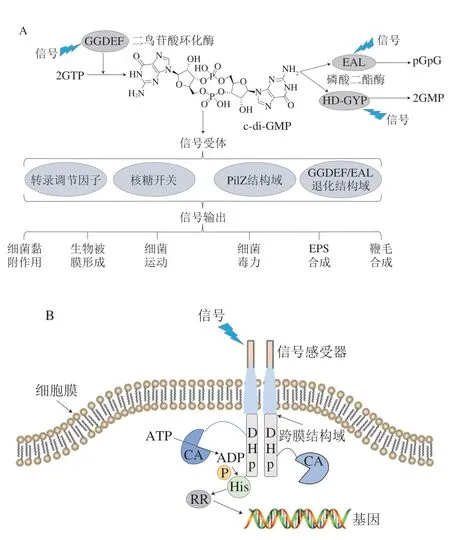
图1 细菌调控系统Fig.1 Bacterial regulatory system
1 c-di-GMP调控系统
c-di-GMP是在1987年由Ross等[26]于木糖醋杆菌(Acetobacter xylinum)中首次发现的一种化合物。随着研究的深入,c-di-GMP在细菌尤其是革兰氏阴性菌中的调控作用得到越来越多的关注。c-di-GMP的合成和降解分别在二鸟苷酸环化酶(diguanylate cyclase,DGC)和磷酸二酯酶(phosphodiesterases,PDE)的催化作用下进行[27],编码DGC和PDE的基因在细菌细胞中广泛存在[27]。光照[28]、氧气[29]和温度[30]等外界环境条件可通过调控DGC和PDE编码基因的表达来调节细菌细胞中DGC和PDE的表达水平,进而影响细菌体内c-di-GMP的含量。细菌体内c-di-GMP含量的变化对调节细菌生理代谢有十分重要的作用。一般情况下,细菌细胞内c-di-GMP含量较高时,细菌倾向于生物被膜态;当细菌细胞内c-di-GMP含量较低时,细菌倾向于浮游态[31]。
c-di-GMP调控细菌下游表型的方式分为3 种:c-di-GMP作为核糖开关,结合mRNA在核糖体上的结合位点,调节mRNA的转录和翻译[32-33];c-di-GMP的受体蛋白为转录因子,与转录因子结合,调控转录因子对基因转录的调控能力,从而调控下游靶基因的表达[34-35];c-di-GMP的受体蛋白为激活/阻遏蛋白,与受体蛋白结合,通过调控靶蛋白的活性来影响细菌生命活动[36-37],其中c-di-GMP作为核糖开关调控下游表型的现象较少,目前仅在艰难梭菌(Clostridium difficile)中被发现[32-33]。通过结合转录因子直接调控下游细菌基因的表达,以及通过调节靶蛋白活性以调控细菌代谢等生命活动的两种调控方式,是c-di-GMP调控细菌初始黏附和生物被膜形成的主要方式。c-di-GMP在细菌初始黏附过程中起到了不可忽视的作用。在细菌初始黏附阶段,c-di-GMP先通过调节细菌元器件如鞭毛的合成、控制鞭毛转动速度等调节细菌菌体接触外界固体表面,并选择性调节EPS组分如胞外蛋白和胞外多糖的合成和分泌基因的表达,促进细菌细胞黏附在外界固体表面[19,36-37]。c-di-GMP能够调控多数EPS组分的合成和分泌,这是其调控细菌初始黏附的重要方式。
1.1 c-di-GMP对胞外多糖的影响
胞外多糖是EPS的重要组成部分,在细菌初始黏附、生物被膜的形成和成熟过程中发挥了重要作用,并能增强细菌对宿主的浸染力以及环境耐受性[5]。胞外多糖的结构、流变学和热力学特性受到温度和pH值等多种因素的影响[38],且不同胞外多糖的理化性质也有很大差异[38-39]。细菌能产生多种形式的胞外多糖,常见的有纤维素、聚-N-乙酰葡萄糖胺、海藻酸盐、Psl多糖和Pel多糖等[40-41]。其中,c-di-GMP通过调控Pel和Psl多糖的合成和分泌来调控细菌初始黏附作用受到了研究人员的广泛关注。
Pel是一种阳离子胞外多糖[42],它的合成和转运由pelA~G操纵子编码的蛋白质负责[43-44]。Pel多糖的合成和转运过程如图2A所示,PelD、PelE、PelF和PelG在细菌细胞内或内膜上形成复合物,该复合物负责Pel多糖前体的合成和转运;Pel多糖前体在PelE的协助下经过内膜到达周质空间,再经PelA的去乙酰化修饰后形成Pel多糖;最后,Pel多糖在PelC和PelA的帮助下经过PelB穿过外膜后输出到细菌细胞表面发挥作用[43,45]。

图2 细菌胞外多糖合成和转运Fig.2 Synthesis and transport of bacteria extracellular polysaccharides
c-di-GMP能通过多种方式影响细菌胞外多糖Pel的合成和转运,进而调控细菌的初始黏附。早期的研究发现,铜绿假单胞菌(Pseudomonas aeruginosa)中存在一种结合蛋白FleQ,该蛋白能抑制pel基因的表达,影响细菌的初始黏附。当细菌中c-di-GMP水平升高时,c-di-GMP与FleQ结合,并解除后者对pelA基因转录的抑制作用,促进Pel多糖的正常合成和分泌[46]。同时,近一步的研究表明,在c-di-GMP水平升高的情况下,细菌细胞中pelA基因的转录水平也相应升高,细菌黏附能力和形成生物被膜的能力也得到加强[41]。c-di-GMP对Pel多糖的直接调控体现在对Pel多糖合成基因pelD转录产物的调控上。研究人员发现,在铜绿假单胞菌(P.aeruginosa)的Pel多糖合成基因中,pelD基因能直接接受c-di-GMP的调控,作为c-di-GMP的效应蛋白,pelD转录蛋白上含有环状核苷酸受体和GGDEF结构组成的双结构域,这个结构有助于pelD转录蛋白和c-di-GMP结合形成复合物,该复合物能有效促进Pel多糖的合成和分泌,并促进细菌的初始黏附[47-48]。c-di-GMP对Pel多糖的影响通过多种形式进行,这也是c-di-GMP通过影响Pel合成和分泌,进而调控细菌初始黏附,从而应对复杂多变的外部环境的一种有效形式。
与Pel不同的是,Psl是一种中性的细菌胞外多糖[49]。Psl的合成和转运由Psl胞外多糖生物合成系统负责[50],该系统是一个包含12 个基因(pslA~L)的psl操纵子,Psl胞外多糖的合成和转运如图2B所示,dTDP-鼠李糖等Psl多糖合成原料经PslB作用后,通过PslI、PslH、PslF和PslC等转移糖基形成Psl多糖单元,其由内膜蛋白PslA提供结合位点,在结合位点的帮助下,Psl多糖单元被组装到细胞质的类异戊二烯脂质上,然后在PslJ、PslK和PslL等内膜蛋白的作用下经过聚合作用形成Psl多糖,并在PslE协助下穿过细胞内膜,随后在PslG的帮助下穿过周质空间,并经PslD转运到细胞膜外[50]。Psl有助于增强细菌黏附作用,促进细菌附着于宿主细胞表面[51-52]。此外,Psl能够通过增强细胞黏附作用增加细菌毒性,对菌株有一定的保护作用[53]。
c-di-GMP通过影响Psl多糖的编码基因来影响Psl合成和转运。研究表明,当细菌细胞中c-di-GMP水平升高时,细菌中pslA基因的转录水平也相应升高,从而增强了细菌的初始黏附和抗药性等作用[41,54]。研究人员在对铜绿假单胞菌(P.aeruginosa)的研究中发现,当鸟苷酸环化酶SadC在细菌中过表达时,铜绿假单胞菌(P.aeruginosa)细胞外Psl的产量显著增加,这一促进作用可能与SadC结构中的跨膜结构域有关,其虽然不会影响c-di-GMP的合成,但却对Psl的形成和分泌有调控作用[55]。此外,Psl可诱导DGC如SiaD和SadC的合成,提高细菌细胞内c-di-GMP的水平,实现正反馈调节[56]。目前,关于c-di-GMP调控Psl合成和分泌的研究还比较少,c-di-GMP调控Psl操纵子的作用还需要进一步研究。
1.2 c-di-GMP对胞外蛋白的影响
胞外蛋白作为生物被膜的主要成分之一,在细菌初始黏附和生物被膜形成过程中也起到重要的作用。黏附蛋白是细菌胞外蛋白的组分之一,c-di-GMP不仅影响细菌胞外多糖的合成和分泌,也能调控细菌黏附蛋白的合成,并通过影响胞外蛋白的黏附作用调控细菌的初始黏附[57]。目前,研究人员已在不同的菌种中发现多种黏附蛋白[58-59],其中,c-di-GMP调控BpfA和LapA蛋白并影响细菌初始黏附的作用机理是研究人员关注的热点。
BpfA 蛋白最初是在奥奈达希瓦氏菌M R-1(Shewanella oneidensisMR-1)中发现的,该蛋白的分子质量为285 kDa,是一种非常大的蛋白,并由bpfa基因(SO4317)编码,通过I型蛋白质分泌系统(the type I secretion system,TISS)分泌,它是细菌进行初始黏附和维持成熟生物被膜结构所必需的[60]。细菌细胞内c-di-GMP水平的变化会影响细菌BpfA蛋白的含量。Cheng Yuanyuan等[61]通过研究发现,腐败希瓦氏菌CN32(Shewanella putrefaciensCN32)中存在一种转录调解因子FlrA,其能阻遏BpfA蛋白操纵子的表达,进而影响BpfA蛋白的合成和分泌;当细菌细胞中c-di-GMP水平升高时,c-di-GMP可以与辅助蛋白FlhG结合,解除FlrA对BpfA操纵子的抑制,从而使bpfa基因得到正常表达。同时,研究证实,BpfA的合成和分泌受BpfD和BpfG两种蛋白质的调控[62]。通过进一步的研究发现,c-di-GMP可根据其在细菌细胞内的含量变化,调控BpfA在细菌细胞表面的含量(图3A)。当细菌细胞内c-di-GMP水平较高时(图3A中a),c-di-GMP可以激活c-di-GMP结合蛋白BpfD并形成复合物,该复合物能结合周质蛋白酶BpfG,从而阻止BpfG水解BpfA蛋白,帮助细菌完成初始黏附并形成生物被膜。但当细胞内c-di-GMP水平较低时(图3A中b),BpfG的抑制作用被解除,BpfA在BpfG的水解作用下从细胞表面释放,细菌的黏附作用被大幅降低。而在环磷酸腺苷(cyclic adenosine monophosphate,cAMP)存在的情况下(图3A中c),低浓度的c-di-GMP可以和cAMP以及cAMP受体蛋白(cAMP receptor protein,CRP)相互作用,协同维持BpfD和BpfG之间的相互作用,防止BpfA蛋白被BpfG水解;只有当细菌细胞内c-di-GMP水平低到一定程度,不足以和cAMP发挥协同作用时(图3A中d),BpfG蛋白才会发挥正常作用[63]。c-di-GMP能在不同水平上通过调控BpfA蛋白影响细菌初始黏附和生物被膜形成等,这也是c-di-GMP通过影响细菌胞外蛋白从而调控细菌初始黏附的一种重要手段。

图3 c-di-GMP对胞外蛋白BpfA和LapA的调控模式Fig.3 Regulatory patterns of c-di-GMP on extracellular proteins BpfA and LapA
LapA蛋白是一种在铜绿假单胞菌(P.aeruginosa)中发现的黏附蛋白,其也可以通过TISS分泌到细胞表面并发挥黏附作用[64]。与BpfA相比,c-di-GMP对LapA蛋白的调控机理较为简单(图3B)。LapA的分泌受到LapE、LapD和LapG等蛋白的调控。LapE是细胞外膜孔径蛋白,LapA蛋白的N-端部分可与外膜孔蛋白LapE锚定,并被束缚在细胞周质区域内,使LapA蛋白其余部分固定在细胞外侧,发挥黏附作用。LapD是一种c-di-GMP受体,当细菌细胞内c-di-GMP含量较高时(图3B中a),LapD可以与c-di-GMP结合形成复合物,该复合物能与周质蛋白酶LapG相互作用,阻止LapG切割LapA的N-端区域,使LapA可留在细胞表面,增强细菌细胞的黏附作用;当细菌细胞内c-di-GMP含量较低时(图3B中b),LapD与c-di-GMP无法形成复合物,周质蛋白酶LapG可以顺利切割黏附蛋白LapA的N-端区域,并将LapA从膜孔径蛋白LapE中释放,削弱细菌细胞的初始黏附作用[65]。细菌细胞内c-di-GMP的水平并不直接影响LapA的合成和分泌,但是能通过调控LapD蛋白与周质蛋白酶LapG的结合作用,影响LapG对LapA的水解,进而影响细菌细胞外膜表面LapA的含量,这也是c-di-GMP调控细菌初始黏附作用的一种有效方式。
除此之外,c-di-GMP还可以通过调节细菌鞭毛结合蛋白与鞭毛组分的相互作用[66]以及鞭毛蛋白的合成等作用[67],影响细菌初始黏附。c-di-GMP与细菌菌毛蛋白和菌毛运动之间的相互作用也对细菌初始黏附有很大的影响[68-69]。细菌多种生命活动都需要c-di-GMP参与,c-di-GMP对细菌初始黏附作用的调控已经得到了广泛研究,但其作用机制还需要进行深入的探讨。
2 双组分调控系统
双组分调控系统是细菌细胞中一种常见的调控系统(图1B),该系统主要由组氨酸激酶(histine kinase,HK)和应答调节蛋白(response regulator,RR)组成,并通过磷酸化作用进行信号转导[70-71]。双组分调控系统是细菌感知外界环境并调控细胞生理活动的重要方式之一[72-74]。一般情况下,细菌HK蛋白的胞外感受器会在外界信号的作用下,通过跨膜区和连接区将信号转移到胞内的二聚和组氨酸磷酸转移(dimerization and histidine phosphotransfer,DHp)区域,并使DHp区域发生螺旋翻转,同时连接在该区域上的ATP结合区会结合ATP,并将其分解为ADP,转移一分子磷酸基团到DHp区域上的保守组氨酸残基,使HK蛋白自磷酸化。自磷酸化的HK进一步将磷酸基团转移到下游RR的保守天冬氨酸残基上,该残基可以接收由HK传递的磷酸基团并被磷酸化。磷酸化的RR发生构象转变,变为激活状态,与细菌的基因相结合,从而调控细菌相关基因的表达以实现对外界信号刺激的应答[75-76]。
细菌细胞能通过双组分调控系统对环境信号如营养[77]、氧气浓度[78]、渗透压[79]等做出响应,并调节自身活动以适应环境变化。不同的双组分调控系统能响应的外界信号类型不同,且细菌同一种生命活动受多种双组分调控系统影响。双组分调控系统对细菌生物被膜的调控已得到广泛关注[80-81],研究显示,仅在铜绿假单胞菌(P.aeruginosa)中就已发现SagS[82]、BfiS/BfiR[83]和MifS/MifR[84]等多种调控细菌初始黏附和生物被膜形成的双组分调控系统,其会对细菌初始黏附产生很大的影响。
ArlS/ArlR是较为典型的双组分调控系统,该系统于2000年在金黄色葡萄球菌(Staphylococcus aureus)中发现[85],arls基因的转录产物ArlS蛋白与组氨酸蛋白激酶有很强的功能相似性,这使得科研人员进一步发现了ArlS/ArlR类型的双组分调控系统,研究证实,双组分调控系统ArlS/ArlR可以通过影响细菌分泌的肽聚糖水解酶活性来控制细菌对聚合物表面的附着[86]。这是早期较为成熟的关于双组分调控系统影响细菌初始黏附作用的报道。进一步的研究发现,ArlS/ArlR系统还可以通过影响下游效应蛋白MgrA的活动来控调控金黄色葡萄球菌(S.aureus)在宿主细胞或活体组织表面的初始黏附[87]。比较特殊的是,ArlRS-MgrA系统并不是通过直接调控细菌黏附相关因子来调控细菌初始黏附作用的。细菌EPS中其他大分子表面蛋白会对黏附蛋白的黏附行为产生干扰作用,ArlRS-MgrA能通过解除这种干扰作用来增强黏附蛋白的黏附作用(图4)。细菌通过功能性ArlRS-MgrA的级联作用抑制大分子表面蛋白如Ebh、SraP、SasG等的活性,并增强细菌黏附因子与配体的结合,从而增强细菌初始黏附作用(图4A)。当ArlRS-MgrA级联作用失活时,Ebh、SraP和SasG会出现在细菌细胞表面并阻止相邻的黏附因子与其配体结合,从而大幅抑制细菌的初始黏附作用(图4B)。需要注意的是,ArlS/ArlR系统通过解除细菌初始黏附的抑制作用,间接增强细菌的初始黏附作用,这为研究特异性的细菌调控系统调控细菌初始黏附作用提供了新的思路。
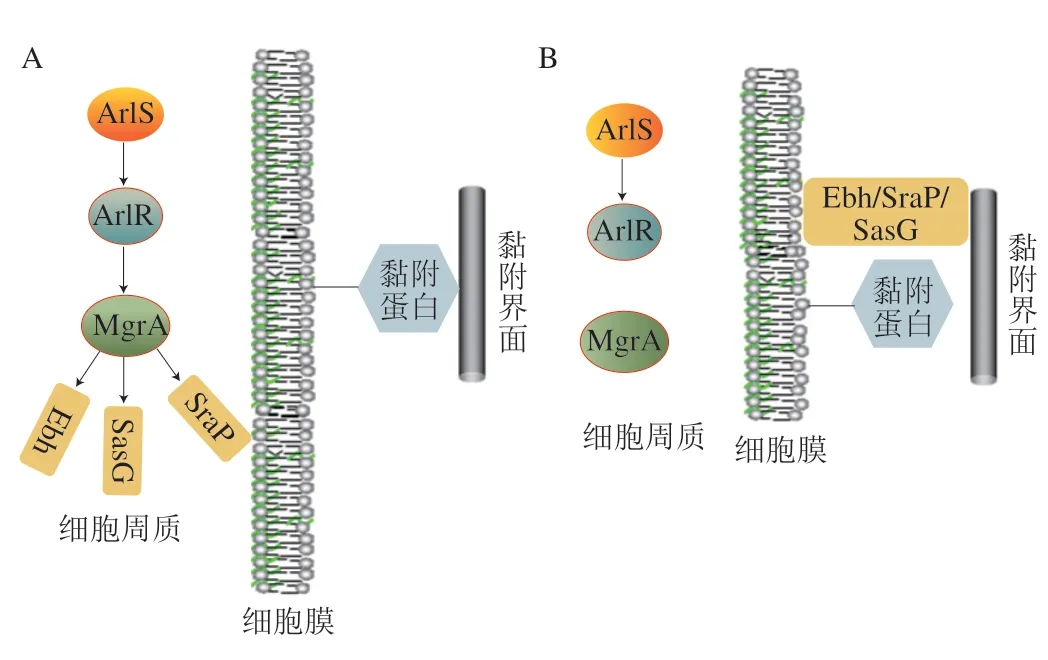
图4 ArlS/ArlR双组分调控系统Fig.4 Two-component system ArlS/ArlR
双组分调控系统可以单独调控细菌多种生命活动,也可以与其他生物大分子共同发挥调控作用。SagS是在铜绿假单胞菌(P.aeruginosa)中发现的一种杂合HK[88]。与普通双组分调控系统不同的是,SagS不仅具有HK的保守蛋白结构,还能编码类似反应调节蛋白的结构。研究表明,SagS可以和铜绿假单胞菌(P.aeruginosa)中的调控系统Gac/Rsm以及双组分调控系统BfisR相互作用,共同调控细菌的初始黏附以及生物被膜的发育和成熟[89]。此外,SagS与第二信使c-di-GMP的级联效应也是铜绿假单胞菌(P.aeruginosa)调节初始黏附作用的一种重要方式。研究发现,当细菌培养环境中6-磷酸葡萄糖的水平上升时,细菌泳动性降低,且其细胞内c-di-GMP含量上升,细菌初始黏附作用增强,6-磷酸葡萄糖并不直接促进DGC合成c-di-GMP,而是通过SagS的作用促进c-di-GMP水平上升,当细菌细胞内6-磷酸葡萄糖水平上升时,SagS可被激活并与DGC NicD结合形成复合物,该复合物可促进c-di-GMP的合成,提高细菌细胞内c-di-GMP的水平,进而增强细菌的初始黏附作用[82]。与其他双组分调控系统不同的是,SagS系统并不是根据外部信号直接调控细菌的初始黏附,而是作为中转信号调控细菌c-di-GMP,由c-di-GMP含量的变化调节细菌初始黏附等生命活动。这种调控方式与普通的双组分调控系统和c-di-GMP调控系统相比更为复杂,涉及到细菌细胞内更多的生命活动,但也拓宽了不同调控系统的调控范围,增加了各系统调控功能间的关联性,有利于细菌适应不同的外部环境。
双组分调控系统可以同时调控包括细菌初始黏附在内的多种生命活动,如在单核细胞增生李斯特菌(以下简称单增李斯特菌)中,LisRK双组分调控系统可以同时调控细菌的抗生素抗性和初始黏附作用,在无LisRK系统的调控下,单增李斯特菌的抗药性大幅降低,同时,细菌初始黏附作用也较野生菌株有所减弱[90]。双组分调控系统的存在使得细菌应对复杂多变外界环境的能力大幅提高。与其他调控系统相比,双组分调控系统调控方式多样,调控行为复杂,且与其他调控系统有不同程度的相互作用,目前的研究还未能完全阐明双组分调控系统的具体调控路径,且该系统与其他生物大分子和调控系统的相互作用也需要进一步研究。
3 群体感应系统
群体感应系统是研究人员先后在肺炎链球菌(Stretococcus pneumonia)和费氏弧菌(Vibrio fischeri)中发现的[91]。细菌细胞向培养环境中释放群体感应信号分子至一定浓度时,群体感应信号分子与细胞上的受体结合,调节细菌中相关基因的表达,从而调控细菌生命活动[92-94](图1C)。细菌群体感应信号分子主要分为3 类:革兰氏阴性菌中的N-酰化高丝氨酸内酯类(N-acyl-L-homoserine lactones,AHLs)、革兰氏阳性菌中的自诱导肽类(autoinducing peptides,AIPs)以及革兰氏阴性菌和革兰氏阳性菌之间的自诱导子-2类(autoinducer-2,AI-2)[93-95]。目前,关于AIPs调控细菌黏附作用的报道还比较少[96],AHLs[25]和AI-2[95]是细菌黏附领域初始黏附中研究较为广泛的两类群体感应信号分子。
3.1 AHLs对细菌初始黏附的影响
基于AHLs的群体感应系统已经取得了广泛的研究[97],该系统主要包括AHLs信号分子、AHLs合成酶和AHLs受体3 个部分。AHLs经AHLs合成酶(LuxI)合成后,被分泌到细菌细胞外并积累;当AHLs浓度随着细菌细胞密度的提高而增加到一定程度后,AHLs信号分子将结合并激活受体蛋白(LuxR)形成AHLs-LuxR蛋白复合体,调控目标基因转录,从而达到影响细菌生命活动的目的[93,98]。
以AHLs为代表的群体感应分子在浓度低时并不能直接调控细菌的初始黏附作用,当环境中的群体感应信号分子达到一定阈值后,其可作为外源性信号分子与其他细菌细胞上的受体结合并上调此类细菌细胞基因(如编码胞外多糖和胞外蛋白等基因)的表达[98-100],增加细菌胞外多糖和胞外蛋白的含量,并增强细菌黏附作用,这是细菌应对环境变化的一种有效方式。AHLs通过上调EPS编码基因的表达,增加EPS的含量,加快细菌黏附作用和生物被膜的形成,是调控细菌生物被膜形成的重要的方式[25,100],但是以往的研究多集中在细菌自身产生的AHLs对细菌细胞本身调控的影响方面,关于外源AHLs对细菌生物被膜和细菌初始黏附作用影响的报道还比较少。研究人员分别探究了两种常用的AHL分子——N-己酰基-L-高丝氨酸内酯(N-hexanoyl-homoserine lactone,C6-HSL)和N-辛酰基-L-高丝氨酸内酯(N-octanoylhomoserine lactone,C8-HSL)在不同浓度下对铜绿假单胞菌(P.aeruginosa)初始黏附和其他生命活动的影响[101]。研究结果显示,外源AHLs分子C6-HSL和C8-HSL不仅能影响细菌的运动性、代谢活性和细菌有关基因的调控水平,还能有效促进细菌生物被膜的形成,并影响细菌的初始黏附作用。在一定浓度范围内,随着外源AHLs信号分子浓度的增加,细菌初始黏附作用强度也得到不同程度的增强。细菌生物被膜形成的强度与细菌初始黏附作用也表现出一致性,当外源性AHLs对细菌初始黏附作用的影响降低时,细菌生物被膜形成的强度也随之降低。外源性AHLs能通过增强细菌初始黏附作用来促进细菌生物被膜的生成,这有助于揭示外源性信号分子对细菌初始黏附作用和生物被膜形成等生命活动的影响机制,同时,对于如何理解细菌自身产生的AHLs信号分子促进细菌生物被膜形成的机理也有一定的启示作用。
关于AHLs信号分子调控细菌初始黏附作用等生命活动机制和方式的研究目前还处于起始阶段。探究外源性AHLs信号分子对细菌初始黏附作用等的影响,对于揭示外源以及细菌自身AHLs类信号分子对细菌调控的影响有十分重要的意义。
3.2 AI-2对细菌初始黏附的影响
除了AHLs,AI-2类群体感应信号分子也得到了研究人员的广泛关注[102]。AI-2常与LuxS蛋白一同构成群体感应系统,且AI-2类群体感应信号分子的合成在luxS基因的转录产物LuxS蛋白的协作下完成[103],AI-2类群体感应系统已在多种细菌中被发现[104-105],同时luxS基因是一种高同源性基因,不同细菌分泌的AI-2信号分子结构相似,这使得AI-2的应用范围更为广泛[106]。
一般情况下,当菌体密度低、A I-2 水平低时(图5A),LuxQ在LuxQ感应激酶的作用下发生自磷酸化作用,磷酸基团经过磷酸转移蛋白LuxU被转移至调节蛋白LuxO[107],LuxO-P激活细菌细胞内小分子核糖核酸(small RNAs,sRNAs)的转录,sRNAs和sRNAs伴侣蛋白Hfq结合,促使luxR无法正常转录;当菌体密度高、AI-2水平高时(图5B),AI-2与受体蛋白LuxP结合,并通过LuxQ导致LuxO去磷酸化失去活性,使LuxR蛋白得到正常合成,调控下游基因正常转录[108]。

图5 AI-2调控系统Fig.5 Regulatory system AI-2
与AHLs类似,AI-2对细菌黏附作用和生物被膜的形成也有一定的影响。研究人员评估了多种空肠弯曲杆菌的黏附和生物被膜形成能力。结果发现,实验中所有的空肠弯曲杆菌都可以黏附到聚苯乙烯塑料表面;而不含LuxS/AI-2群体感应信号系统的菌株黏附和生物被膜形成能力与存在这种系统的细菌有明显差别[109]。这种现象揭示了AI-2对细菌初始黏附作用可能有一定的调控作用。进一步的研究证实,当敲除luxS基因时,空肠弯曲杆菌在聚乙烯材料表面的黏附能力也随之降低[110]。阪崎肠杆菌是一种常见的食源性致病菌,该细菌能导致婴儿坏死性小肠结肠炎和败血症等多种严重疾病。不同类型的阪崎肠杆菌致病性和黏附/侵染能力也不同。研究人员针对两种序列类型相同但黏附性和侵染力不同的阪崎肠杆菌进行了蛋白组学分析,并鉴定了多种表达差异的蛋白质。结果表明,强黏附/侵染菌株中LuxS蛋白的含量是弱黏附/侵染菌株的近4 倍[111]。LuxS表达量的降低或消失能导致细菌黏附力下降,这种现象在其他细菌的研究中也得到了证实[112]。越来越多的研究表明,LuxS/AI-2系统对阪崎肠杆菌的黏附/侵染能力起关键作用,是调节细菌初始黏附的一种重要调控系统。
AI-2信号系统和AHLs类似,对细菌初始黏附和其他生命活动等都有一定的调控作用,是研究细菌黏附作用不可忽视的调控系统。目前,关于AI-2对细菌黏附和生物被膜形成能力的研究已取得了很大的进展,AI-2对细菌初始黏附作用的报道也得到越来越多的重视。但是,AI-2对细菌初始黏附的调控作用仍有很多工作待开展,如AI-2系统对细菌初始黏附作用的调控机制,外源AI-2信号分子对细菌黏附作用和生物被膜形成的调控作用等。因此,AI-2调控细菌初始黏附作用的机理仍需进一步研究。
4 初始黏附机制在食品品质控制中的应用
细菌初始黏附是开启细菌生物被膜形成的重要过程,该过程受到细菌体内调控系统等多种因素的影响[6,13]。利用细菌调控系统等作用调控细菌初始黏附,对抑制细菌初始黏附、消除细菌生物被膜、保障食品品质和安全有积极的影响。细菌初始黏附作用发生在生物被膜成熟之前[9],因此,在细菌处于初始黏附阶段时,通过生化等方法抑制细菌的初始黏附能够有效抑制细菌生物被膜的形成,对降低因细菌生物被膜而造成的危害有十分积极的作用。目前,根据调控系统调控细菌初始黏附的机理及通过抑制细菌初始黏附作用来控制食品品质的方法如表1所示。细菌初始黏附是一个动态的过程,细菌在不同生命活动过程中表现出的理化性质和生物学特性等较为复杂,食品工业中常规的抗菌方法如巴氏灭菌法、焙烤、蒸煮等热加工技术虽然能直接杀灭细菌,但也会影响食品活性成分如多酚和黄酮类物质的含量、结构以及活性等[113],造成食品风味的变化,影响食品品质;乙醇和含氯杀菌剂等虽然能有效抑制细菌黏附和生物被膜的形成,但也存在杀菌剂残留、低浓度杀菌剂增强单增李斯特菌等微生物黏附性和生物被膜形成能力等隐患[114-115]。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)[116]或超疏水性材料[117-118]等特种材料和改性材料虽然能对包括食源性细菌在内的多种细菌展现出良好的抗黏附性,但其应用条件苛刻、材料成本高等缺点也不可忽视。电场[119]和磁场环境[120]等虽然也表现出了抗细菌黏附的优势,但受电场强度和磁场方向等环境因素的影响,存在抗细菌黏附效果低、作用不稳定等问题,也限制了其在食品品质控制领域的应用。因此,如何在不影响食品品质和安全性的前提下,采用经济有效的方法抑制细菌初始黏附,是保障食品安全和人类健康的一个重要问题。Karygianni等[121]曾提出以细菌基质为靶点来消除不同细菌中普遍存在的EPS组分,可能为抑制细菌初始黏附和生物被膜形成、控制食品品质提供潜在的思路。同时,在其他领域应用细菌调控系统控制细菌初始黏附作用和生物被膜形成,也为研究人员利用细菌初始黏附机制控制食品品质提供了参考。

表1 食品工业中细菌初始黏附的控制Table 1 Control of initial bacterial adhesion in food industry
5 结语
细菌初始黏附作用发生在细菌生物被膜形成阶段的初期,是细菌形成生物被膜并造成食品工业污染和浪费,进而危害人类健康的重要因素。细菌初始黏附作用是一个复杂的动态过程,该过程发生在细菌生命周期的整个阶段,且不同细菌的初始黏附作用特点也不尽相同,这就为如何高效且有针对性地抑制细菌初始黏附造成了较大困难。c-di-GMP、双组分调控系统和群体感应系统等细菌调控系统能通过感受外界环境信号,调控包括EPS合成和分泌等多种细菌生命活动,影响细菌初始黏附作用。目前,关于c-di-GMP、双组分调控系统和群体感应系统调控细菌初始黏附作用的研究已经获得不同程度的进展,根据上述研究结果提出有针对性地抑制食源性细菌初始黏附作用的方法也得到了研究人员的关注。但是,不同调控系统调控细菌初始黏附作用的方式不同,且不同环境条件下每个调控系统对细菌初始黏附作用的影响也不一样,因此,深入阐明细菌调控系统对细菌初始黏附作用的调控机制,以及多种调控系统对细菌初始黏附作用的协同调控效果,对于正确研究不同调控系统对细菌初始黏附作用的影响,以及针对性地提出抑制细菌黏附的方法有积极的作用,对进一步研究细菌初始黏附作用的影响因素和特点也有一定的指导意义。
