肠杆菌目细菌常见碳青霉烯酶耐药基因多重PCR检测方法的建立及应用评价*
2023-08-09杨冰雪袁亚玲黄金珠夏培雯党梓军廖佳佳罗胜利
杨冰雪,易 淼,袁亚玲,黄金珠,夏培雯,党梓军,廖佳佳,罗胜利,夏 云△
1.重庆医科大学附属第一医院检验科,重庆 400042; 2.成都市第二人民医院医学检验科,四川成都 610000
耐碳青霉烯的肠杆菌目细菌(CRE)是近年来备受关注的条件致病菌,其与院内感染性疾病的发病率和病死率密切相关[1]。CRE的出现导致多耐药细菌感染治疗最后手段——碳青霉烯类药物失活,对全球感染控制和疾病治疗形成了极大挑战[2],CRE的流行病学调查和监测对临床感染性疾病的预防和治疗具有重要意义。产碳青霉烯酶是CRE最主要的耐药机制,根据Ambler分类法可将碳青霉烯酶分为 A、B、D 类酶[3];其中肺炎克雷伯菌碳青霉烯酶(KPC)是A类酶的典型代表,作为KPC的主要生产者,肺炎克雷伯菌是世界范围内最常见的产碳青霉烯酶的肠杆菌目细菌(CPE)[4-5]。2020年我国国家耐药监测网(CHINET,www.chinets.com)数据显示,2005-2018年肺炎克雷伯菌对亚胺培南(IPM)和美罗培南(MEM)的耐药率分别从3.0%上升至25.0%和2.9%上升至26.3%[6]。B类酶又称金属β-内酰胺酶,常见的金属β-内酰胺酶包括维罗纳整合子编码金属β-内酰胺酶(VIM)、亚胺培南金属β-内酰胺酶(IMP) 和新德里金属β-内酰胺酶(NDM)[7];自2008年首次在印度发现NDM以来[8],其在肠杆菌科、不动杆菌属及假单胞菌属细菌中多有出现[9],我国2017年一项在肠杆菌科细菌和不动杆菌属细菌中进行的多中心研究表明含有NDM型基因的致病菌在国内广泛传播[10]。文献[11]调查显示,2018-2019年在四川地区,NDM在CRE中的检出率达到42.1%。在D类酶中,OXA-48-like则是全球某些地区肠杆菌目细菌中最常见的碳青霉烯类型,并且正在逐步进入非流行地区,造成院内感染暴发[12]。编码碳青霉烯酶的耐药基因多位于可移动元件上,比如转座子、整合子和质粒[13]。耐药基因的水平转移和传播可导致CRE在全球范围内蔓延[14]。目前用于检测CRE的方法主要有表型检测和分子检测。常见的表型检测方法包括Triton Hodge 试验、改良 Hodge 试验、Carba NP 试验、碳青霉烯灭活法[包括改良碳青霉烯灭活试验(mCIM)和乙二胺四乙酸(EDTA)改良碳青霉烯灭活试验(eCIM)]及碳青霉烯酶抑制剂增强试验等[15-16]。大多数检测方法的优点是操作简单,经济成本低,但最显著的问题是耗时较长。分子检测法通常被认为是碳青霉烯酶检测的金标准[3],普通PCR是最常用的分子检测方法,但使用PCR逐一检测耐药基因的时间成本高,本研究旨在建立一种快速、准确的多重PCR体系,能同时检测包括KPC、NDM、VIM、IMP、OXA-48-like在内的5种碳青霉烯酶耐药基因,并将其运用于临床分离的CRE菌株检测,与普通PCR及碳青霉烯酶抑制剂增强试验检测结果相比较,从灵敏度、特异度、准确度、一致性等方面进行分析,评价该方法的可行性,从而为临床提供早期诊断、治疗依据。
1 材料与方法
1.1菌株来源 收集重庆医科大学附属第一医院检验科2020年6月至2021年9月临床鉴定为对碳青霉烯类药物耐药的(亚胺培南或美罗培南最低抑菌浓度≥4 μg/mL)非重复肠杆菌目细菌共118株和对碳青霉烯类药物敏感的肠杆菌目细菌9株。其中CRE包括肺炎克雷伯菌68株,大肠埃希菌29株,阴沟肠杆菌16株,布氏柠檬酸杆菌1株,产气克雷伯菌2株,产酸克雷伯菌1株,弗氏柠檬酸杆菌1株;敏感菌株包括7株肺炎克雷伯菌,2株大肠埃希菌。主要标本来源包括血液、尿液、伤口分泌物、穿刺液、呼吸道标本及胆汁、肛门拭子等。携带blaKPC、blaIMP、blaOXA-48-like的肺炎克雷伯菌,携带blaVIM 的铜绿假单胞菌和携带blaNDM的大肠埃希菌作为阳性对照,均由重庆医科大学附属第一医院医学检验科微生物实验室保存。
1.2仪器与试剂 VITEK2 Compact全自动微生物分析系统及配套板卡(法国生物梅里埃公司);PCR扩增仪(ABI公司);电泳仪(北京六一仪器厂);凝胶成像仪(美国Bio-Rad公司);哥伦比亚血琼脂平板及MH平板(重庆庞通公司);美罗培南药敏纸片(Oxoid公司);DNA分子量标记物DL2000、Taq酶(TaKaRa公司);琼脂糖(Hydragene公司);本试验所用引物合成及扩增产物测序均来自北京擎科生物科技有限公司。
1.3方法
1.3.1细菌鉴定及药敏试验 收集非重复临床标本分离株,使用Vitek 2 Compact全自动微生物分析仪进行细菌鉴定及药敏试验,将收集的碳青霉烯类药物耐药菌株及敏感菌株-80 ℃冷冻保存。
1.3.2碳青霉烯酶抑制剂增强试验 根据A类丝氨酸碳青霉烯酶的活性可被3-氨基苯硼酸(APB)抑制,金属β-内酰胺酶的活性可被EDTA抑制原理,使用碳青霉烯酶抑制剂增强试验对试验菌株进行碳青霉烯酶表型鉴定,具体操作步骤如下:将待测菌调节成0.5麦氏浓度的菌液,均匀涂布于MH培养基上,随后贴4张美罗培南纸片(10 μg),在其中两张纸片上分别滴加APB、EDTA溶液,另一张纸片上同时滴加两种溶液,最后一张纸片不滴加任何溶液留作空白对照。空气环境,(35±2)℃培养16~18 h后分别测量4个抑菌圈直径(dr)。判读标准:若dr美罗培南+APB-dr美罗培南≥5 mm,则可认为受试菌株产A类酶,若dr美罗培南+EDTA-dr美罗培南≥ 5 mm,则可认为受试菌株产B类酶,若dr美罗培南+EDTA+APB-dr美罗培南≥ 5 mm,则可认为受试菌株同时产A类酶和B类酶。
1.3.3DNA提取 本试验采用煮沸裂解法提取细菌DNA。将-80 ℃储存的分离菌复苏后接种在哥伦比亚血平板上培养16~18 h,取单个菌落悬浮于1 000 μL蒸馏水中,95 ℃煮沸10 min,在4 ℃,13 000 r/min离心混合物10 min,分离上清液作为DNA样本保留,并储存于-20 ℃。
1.3.4引物设计 下载Bate-Lactamase数据库(http://bldb.eu/BLDB.php?prot=A#GES)已公布的blaKPC基因序列[17],使用软件ClustalXe 2.0进行序列比对,选择高度同源区域,使用primer premier 5 进行blaKPC引物设计。根据已发表的文献下载blaNDM,blaIMP,blaVIM,blaOXA-48-like引物[18-19,1]。引物序列由北京擎科生物科技有限公司合成。见表1。

表1 5种碳青霉烯酶耐药基因扩增引物
1.3.5普通PCR 普通PCR反应体系:premix taq 12.5 μL,正反向引物各(10 μm)1.0 μL,DNA 模板1.5 μL,加双蒸水(ddH2O)补足至25.0 μL。反应条件:95 ℃ 5 min,94 ℃ 30 s,57 ℃ (blaKPC、blaNDM、blaVIM)/55 ℃ (blaIMP、blaOXA-48-like) 30 s,72 ℃ 1 min,共30个循环,72 ℃ 7 min。扩增产物经1.5%琼脂糖凝胶电泳分析,产物送基因测序,测序结果在NCBI网站进行Blast 比对(www.ncbi.nlm.nih.gov/blast/),确定基因型。
1.3.6多重PCR 多重PCR反应条件采用25.0 μL体系:premix taq 12.5 μL,5种不同引物构成比例见表1,DNA模板1.5 μL,加ddH2O补足25.0 μL。反应条件:95 ℃ 5 min;95 ℃ 40 s,57 ℃ 40 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。扩增产物经1.5%琼脂糖凝胶电泳分析。
1.4统计学处理 采用统计软件SPSS25.0 进行数据分析,配对卡方检验用于试验结果分析,采用灵敏度、特异度、阳性预测值、阴性预测值和准确度评价多重PCR、碳青霉烯酶抑制剂增强试验与普通PCR的有效性。Cohen′s kappa (κ)系数评估多重PCR、碳青霉烯酶抑制剂增强试验与普通PCR 的检测一致性。κ系数的比较含义:κ>0.75,一致性极好;κ为0.40~0.75,检测方法之间存在一致性;κ<0.40,检测方法之间一致性较差,P<0.05表示差异有统计学意义。
2 结 果
2.1多重PCR检测5种碳青霉烯酶耐药基因 建立多重 PCR 体系,分别扩增含有blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48-like基因的DNA阳性对照模板;另将5种阳性对照DNA模板按等比例混合后进行多重PCR扩增;考虑到多重PCR反应过程中存在引物二聚体及非特异扩增风险增加的问题,另对8株碳青霉烯类药物敏感的肠杆菌目细菌进行扩增,用于评估多重PCR的正确性。扩增结果使用1.5%的琼脂糖凝胶电泳分析。在最佳反应条件下,多重PCR能分别正确扩增出5种不同的耐药基因,也能在单次反应中同时识别出多种耐药基因(图1A),整体扩增体系较为稳定,对敏感菌的扩增产物中几乎不含有非特异性扩增产物(图1B)。
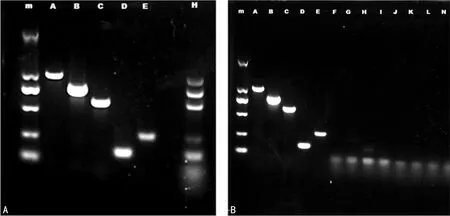
注:A表示使用多重PCR扩增含有5种碳青霉烯酶耐药基因的阳性DNA模板,泳道m为2 000 bp DNA分子量标记物;泳道A~E依次为NDM、KPC、OXA、VIM、IMP;泳道H为单次多重PCR扩增同时含有5种耐药基因的模板混合物;B表示多重PCR体系扩增对碳青霉类药物敏感的肠杆菌目细菌DNA;泳道m~E与A的注解相同,泳道F~N为多重PCR扩增8株对碳青霉烯类药物敏感菌DNA结果。
2.2普通PCR与多重PCR检测结果比较 药敏试验确定127株细菌中包含9株对碳青霉烯类药物敏感菌及118株对碳青霉类药物耐药菌。普通PCR检测含有碳青霉烯酶耐药基因CRE菌株96株(81.36%,96/118),耐药但不含碳青霉烯酶耐药基因菌株22株(18.64%,22/118),碳青霉烯酶耐药基因以blaKPC和blaNDM为主,分别占39.83%(47/118)和38.14%(45/118);含有blaKPC的菌株全部为肺炎克雷伯菌,而含有blaNDM的菌株包括肺炎克雷伯菌9株,大肠埃希菌22株,阴沟肠杆菌12株,弗氏柠檬酸杆菌1株,产酸克雷伯菌1株;共表达blaKPC+blaNDM 3株,包括产气克雷伯菌,布氏柠檬酸杆菌及肺炎克雷伯菌。多重PCR检测118株CRE中包含碳青霉烯酶耐药基因菌株85株(72.03%;85/118);耐药但不含碳青霉烯酶耐药基因菌株33株(27.97%;33/118),其中22株与普通PCR检测结果完全一致,另外11株为普通PCR检测含有碳青霉烯酶耐药基因但多重PCR检测为不含碳青霉烯酶耐药基因的CRE。在检测结果不一致的11株CRE菌株中,包括表达blaKPC的4株肺炎克雷伯菌和表达blaNDM的1株肺炎克雷伯菌、 3株大肠埃希菌、2 株阴沟肠杆菌及 1株产酸克雷伯菌;9株敏感菌的多重PCR检测结果与普通PCR检测结果一致。共表达blaKPC+blaNDM的3株CRE的多重PCR检测结果与普通PCR检测结果一致。见表2。

表2 普通PCR和多重PCR检测肠杆菌目细菌结果对比(n)
2.3多重PCR与碳青霉烯酶抑制剂增强试验的耐药表型检测结果比较 碳青霉烯酶抑制剂增强试验耐药表型检测共含有94株产A类酶或B类酶的CRE和24株不产碳青霉烯酶的CRE。在产A类酶46株耐药菌中,多重PCR检测含有blaKPC基因CRE 43株;产B类酶的48株耐药菌中,多重PCR检测含有blaNDM基因CRE 38株;碳青霉烯酶抑制剂增强试验表型检测中未检测到同时产A+B类酶的菌株,但多重PCR检测到3株共表达blaKPC+blaNDM基因耐药菌株;多重PCR检测含有blaOXA-48-like的菌株碳青霉抑制剂增强试验表型检测为不产酶CRE。见表3。
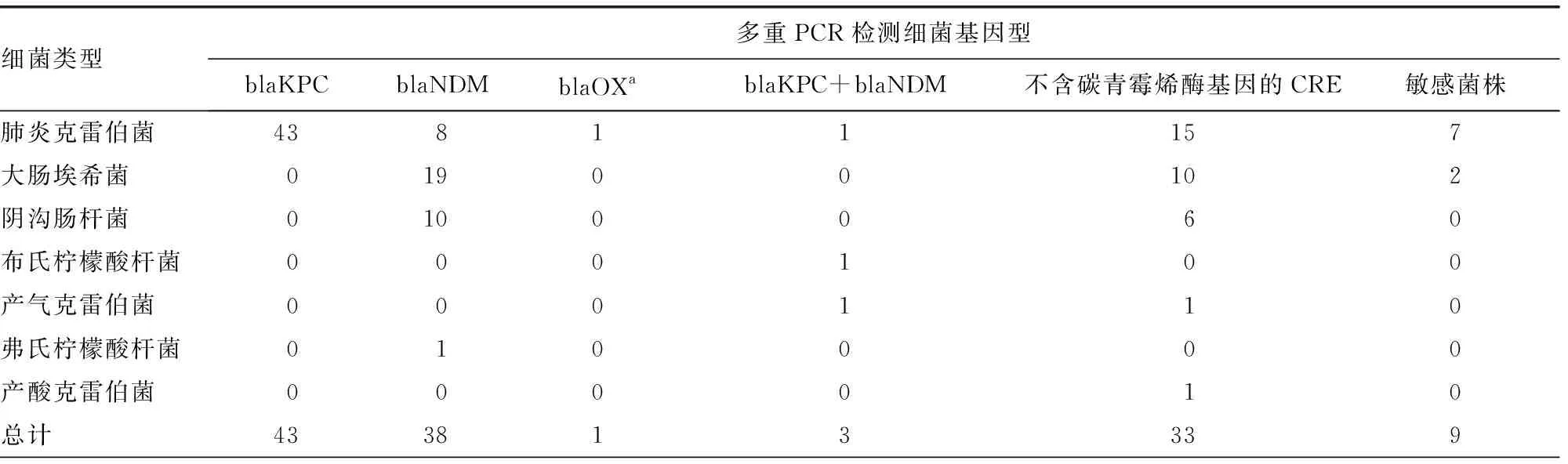
表3 多重PCR和碳青霉酶抑制剂增强试验检测127株肠杆菌目细菌基因型及耐药表型(n)
2.4多重PCR、碳青霉烯酶抑制剂增强试验结果分析 以普通PCR检测方法作为参考,多重PCR检测灵敏度为88.54%,特异度为100.00%,κ值为0.79。碳青霉抑制剂增强试验检测灵敏度为92.71%,特异度为93.55%,κ值为0.81。在CRE检测中,多重PCR检测的灵敏度稍低于碳青霉烯酶抑制剂增强试验(88.54%vs.92.71%),但多重PCR比抑制剂增强试验检测拥有更好的特异度(100.00%vs.93.55%),见表4。多重PCR和碳青霉烯抑制剂增强试验在阳性率检测上比较差异无统计学意义(P>0.05),并且二者拥有良好的检测一致性(κ=0.63)。见表5。

表4 多重PCR和碳青霉烯酶抑制剂增强试验和普通PCR检测结果分析
3 讨 论
CRE的出现,尤其是对碳青霉烯类药物耐药的肺炎克雷伯菌和大肠埃希菌,给发达国家和发展中国家的公共医疗卫生事业造成极大威胁和负担[20-21]。CRE的传播具有极高的隐匿性,相对于无症状感染者或定植人群,CRE的实验室阳性病例报告数比例约为1∶100[22],而其他两类人群可以向阳性病例转化[23]。因此建立一种快速、准确的实验室方法用于检测CRE,为临床早期提供诊断治疗依据具有重要意义。目前,一线临床实验室用于检测CRE及其耐药表型最常用的方法包括抗菌药物药敏试验和纸片扩散法等,虽然操作简便但其耗时较长,临床报告时间在16~24 h,且无法明确具体的碳青霉烯酶类型。本研究建立多重 PCR 检测法,可在单次试验中快速筛查5种常见的碳青霉烯酶耐药基因,并可基于耐药基因检测结果预测耐药表型,与现有检测方法相比,多重PCR可在3~4 h获得检测结果,大幅缩短临床报告时间,为早期临床诊疗提供可靠依据。
在本研究中发现22株(17.3%,22/127)不产碳青霉烯酶的CRE,其耐药机制可能是染色体突变(如孔蛋白基因突变、外排泵过表达和(或)青霉素结合蛋白改变)和获得性非碳青霉烯耐药机制(如超广谱β-内酰胺酶的表达获取或上调、产AmpC酶)[24]。多重 PCR 对这类耐药细菌的检测能力有限,但文献[25]研究证实,CPE病死率(32.4%)高于不产碳青霉烯酶CRE (13.0%),故对CPE的检测更为重要。3株由多重PCR检测发现共表达blaKPC+blaNDM的菌株在碳青霉烯抑制剂增强试验表型检测中仅表达一类酶,这可能是因为在缺乏抗菌药物压力的传代培养下,含有耐药基因的质粒缺乏稳定性而丢失[26],导致表型检测假阴性。7株碳青霉烯酶抑制剂增强试验表型检测为产B类酶的CRE在多重PCR检测中并未检出相应耐药基因,可能是因为多重PCR体系引物种类较多,在扩增过程干扰风险增加,因此更难获得较长片段产物。
此外,1株多重PCR检测含有blaOXA-48-like耐药基因的肺炎克雷伯菌在碳青霉烯酶抑制剂增强试验表型检测中为假阴性,由于表型检测中试剂APB、EDTA仅能抑制A类酶和B类酶而对D类酶没有影响,故不能检测OXA-48型碳青霉烯酶[27],说明相较于表型检测,多重PCR在CRE的监测中更具全面性。blaOXA-48-like经测序后序列对比鉴定为blaOXA-181。blaOXA-181被认为是除blaOXA-48外最常见的blaOXA-48-like基因,常出现在大肠埃希菌中,目前发现的blaOXA-181几乎都位于含有Tn2013的lncX3质粒上[28]。我国最早关于blaOXA-181的报道是文献[29]发现的1株大肠埃希菌,本研究中发现含有blaOXA-181的是肺炎克雷伯菌,耐药基因在肠杆菌目细菌之间的传播及基因分子特性值得进一步探究。
近年来,基质辅助激光解吸电离飞行时间质谱、免疫层析法及基于生物发光技术的碳青霉烯酶药敏试验检测等多种新技术被应用于碳青霉烯酶的检测[30-32]。这些技术拥有操作简单、省时的优点,但技术设备、耗材及人力成本昂贵,难以在大量基层医疗机构中展开。目前也有其他多重PCR 技术的报道,例如,YOSHIOKA等[33]使用COBAS®z480同时检测6种碳青霉烯酶耐药基因,虽然其时间成本低于多重 PCR,但由于设备的限制需将6种基因分次构建为同时检测3组耐药基因的分组,增加了操作过程的复杂性,另外检测过程中荧光探针的使用也增加了经济成本。相比之下,多重PCR使用普通PCR设备即可完成,且操作步骤简单,能快速、方便、准确检测肠杆菌目细菌中5种常见碳青霉烯酶耐药基因,与目前临床应用的碳青霉烯酶抑制剂增强试验在CRE及其表型检测结果上具有良好的一致性,极大缩短临床报告时间,在CRE的监测调查中发挥良好作用,适用于临床实践中展开推广。
