水杨酸对盐胁迫下棉苗生长及生理的调控作用
2023-08-07徐雪雯王兴鹏王洪博李国辉唐茂淞曹振玺
徐雪雯 王兴鹏,3 王洪博 李国辉 唐茂淞 曹振玺
(1 塔里木大学水利与建筑工程学院,843300,新疆阿拉尔;2 塔里木大学现代农业工程重点实验室,843300,新疆阿拉尔;3 农业农村部西北绿洲节水农业重点实验室,832000,新疆石河子)
新疆独特的气候环境有利于棉花生长和优质高产,是我国重要的优质棉生产基地[1]。据2021年数据显示,新疆棉花皮棉总产量512.9 万t,占全国总量的89.5%,占全球总量的20%以上[2]。然而,新疆棉花种植常受盐碱胁迫,尤其是盐渍化程度较严重的南疆地区。研究[3]表明,南疆地区遭受盐渍害的耕地面积占总耕地面积的49.6%。南疆盐碱地多为复合型盐碱地,盐化与碱化作用往往相伴发生,不合理灌溉和过度施用化肥等原因使耕地次生盐碱化严重[4],严重阻碍南疆地区农业可持续发展。盐碱化会严重抑制棉花种子萌发,降低棉花出苗率[5],抑制棉花生长发育[6]。因此,如何缓解盐渍化对棉花生长的影响已成为棉花可持续生产的关键问题。
研究表明,施用外源植物生长调节剂可以调节盐胁迫下植物生长发育[7],提高植物抗逆性[8]。水杨酸(salicylic acid,SA)是一种天然有效的信号分子,可以通过促进植物叶绿素含量累积[9]和降低植株蒸腾速率[10]来提高抗氧化酶活性[11]、增加渗透调节物质含量[12]等生理活动,从而提高植物的耐盐性。施加外源SA 能够提高植株超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性,降低丙二醛(MDA)含量,增加生物累积量,并提升耐盐性[13-14]。还可促进小麦幼苗[15]生长和增强根系活力,促进脯氨酸(Pro)积累[16]。同时促进盐胁迫下颠茄生长发育,增加可溶性糖(SS)含量[17]。
棉花具有较高的耐盐性,但在棉种萌发和苗期的抗逆性相对较弱,较高的土壤盐分会对其生长发育产生不利影响。为此,本试验以中棉619(新疆地区无膜直播的特早熟棉花新品种)为研究对象,开展苗期化控试验,分析施加SA 对盐胁迫下棉花幼苗根系生长和生理特性的影响,阐明施加SA 缓解盐胁迫抑制棉花幼苗生长的机理,得出不同浓度盐胁迫条件下宜于棉花生长的SA 浓度,在盐胁迫条件下为棉花苗期生长提供外源植物生长调节剂施用策略。
1 材料与方法
1.1 试验设计
试验于2022 年4-5 月在塔里木大学人工气候室中进行,气候室温度设置为25℃,湿度40%,光照/黑暗时长14h/10h。设置2 个NaCl 浓度水平[18]:3 和6g/L,4 个SA 水平:0.00、0.01、0.05和0.10mmol/L,基于前人研究[19-22]基础的同时在试验正式开始前进行预试验,最终确定SA 浓度水平,组合共8 个处理,分别为3g/L NaCl+0.01mmol/L SA(T1S1)、3g/L NaCl+0.05mmol/L SA(T1S2)、3g/L NaCl+0.10mmol/L SA(T1S3)、3g/L NaCl+0.00mmol/L SA(T1S0)、6g/L NaCl+0.01mmol/L SA(T2S1)、6g/L NaCl+0.05mmol/L SA(T2S2)、6g/L NaCl+0.10mmol/L SA(T2S3)、6g/L NaCl+0.00mmol/L SA(T2S0),并设置无外源SA 无盐分为对照(CK),每个处理重复3 次。
以中棉619(中国农业科学院棉花研究所提供)为供试品种,试验精选饱满一致的棉花种子进行消毒处理,置于萌发袋(CYG-98LB,长30cm,宽25cm;由PhytoTC 生产厂家提供)纸芯凹槽里,每袋放置8 粒种子,萌发袋垂直放置,如图1 所示,培养期为12d。量取50mL 预先配制的NaCl 和SA溶液加至对应处理。在气候室连续培养5d 后,量取30mL 配制营养液(由北京采菊东篱水培园艺中心生产)加入所有处理[21],此后不再施加盐溶液、外源剂和营养液。

图1 棉花幼苗生长装置Fig.1 Cotton seedling growth device
1.2 测定项目与方法
1.2.1 棉花根系形态指标 试验开始后第12 天取样,每个重复取3 株棉花幼苗进行根系扫描,使用根系扫描仪(Epson Perfection V800 Photo,精工爱普生株式会社)获取棉花根系形态图片,利用LA-S系列植物图像分析软件(杭州万深检测科技有限公司研制)分析根系形态指标。
1.2.2 棉花主根长度 从第3 天开始,每天用直尺(精度为1mm)测定棉花主根长度,连续测至第12 天。
1.2.3 干物质量 第12 天从萌发袋中取出棉花幼苗,用剪刀分成地上部和地下部,烘箱105℃杀青30min,再80℃烘干至恒重,用根系扫描后根系样本测定地下部干重。
1.2.4 根冠比 根冠比=地下部干质量/地上部干质量。
1.2.5 根系生理指标 培养至第12 天,利用南京建成生物工程研究所的SOD 试剂盒(WST-1 法)测定棉花根系SOD 活性,采用POD 试剂盒(分光光度比色法)测定POD 活性,采用CAT 试剂盒(钼酸铵法)测定CAT 活性,采用MDA 试剂盒(硫代巴比妥酸反应比色法)测定MDA 含量,采用Pro试剂盒(酸性茚三酮显色法)测定Pro 含量,采用SS 试剂盒(蒽酮硫酸比色法)测定SS 含量。测定生理指标SOD、POD、CAT、MDA、Pro 和SS 共需要0.5g 样品。每个重复有5 株棉花植株,3 个重复共有15 株棉花幼苗用于生理指标测定。
1.3 数据处理
采用Microsoft Excel 2021 进行数据处理,DPS v7.05 进行双因素方差分析,SPSS 22 进行主成分分析,应用Origin 2022 绘图。
2 结果与分析
2.1 盐胁迫下SA 对棉花幼苗根系指标、生物积累量及根冠比的影响
盐胁迫下SA 对棉花幼苗根系指标、生物累积量及根冠比的影响如表1 所示。盐效应、SA 效应对棉花幼苗根系指标、生物量及根冠比效果极显著(P<0.01),二者的互作效应除对棉花幼苗根系总长度效果不显著外(P>0.05),对其余指标均显著。棉花幼苗根系总长度、表面积、体积、地下部、地上部干重及根冠比随盐浓度上升显著降低,其中T1S0较CK 分别显著降低30.6%、43.3%、57.0%、43.6%、20.4%和29.1%,T2S0较CK 分别显著降低58.5%、62.0%、66.5%、57.7%、26.7%和42.3%。低盐胁迫下则随SA 浓度增大呈先增加后减小趋势,T1S2较T1S0处理棉花幼苗根系指标、生物累积量及根冠比分别显著增加39.0%、66.0%、118.6%、74.6%、25.4%和39.4%;高盐条件下棉花幼苗生长指标变化规律与低盐相同,T2S2处理较T2S0分别增加58.7%、47.3%、49.3%、60.6%、11.1%和44.5%。
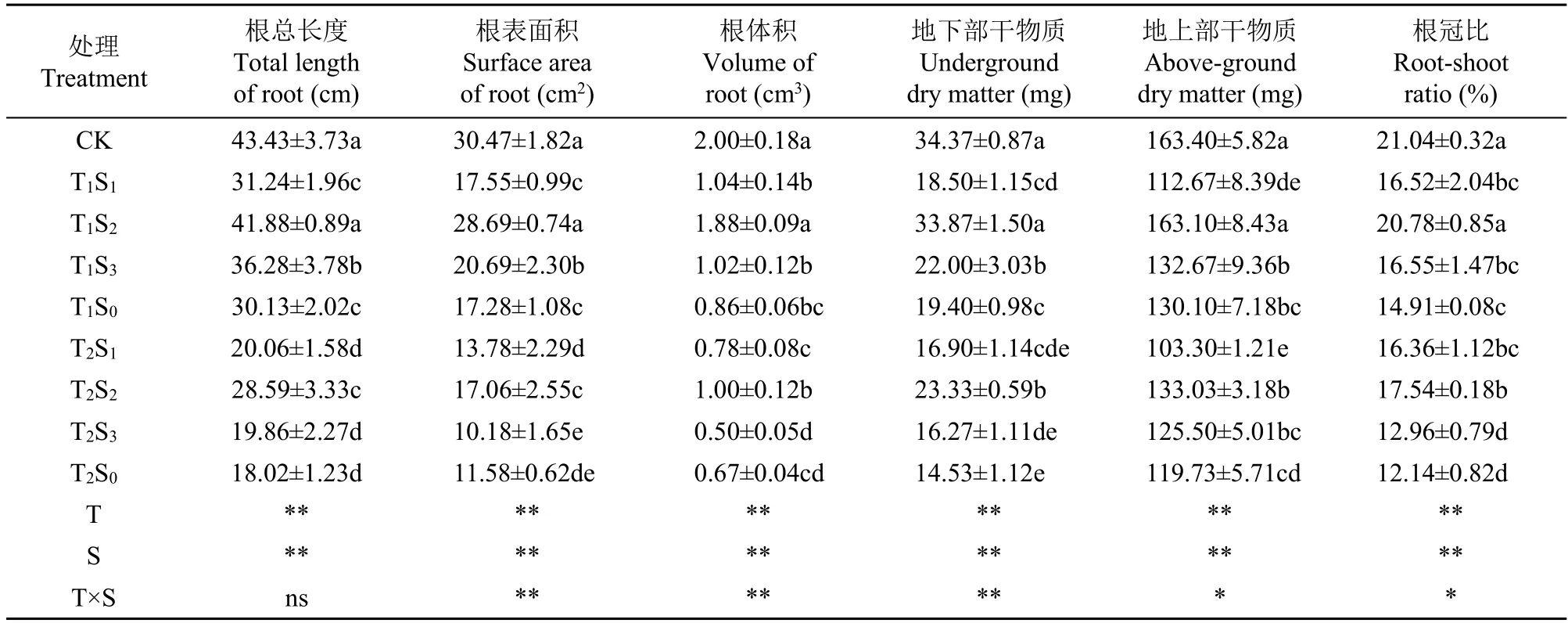
表1 盐胁迫下SA 对棉花幼苗根系指标、生物累积量及根冠比的影响Table 1 Effects of SA on root index,bioaccumulation and root-shoot ratio of cotton seedlings under salt stress
2.2 盐胁迫下SA 对棉花幼苗主根长的影响
盐胁迫下SA 对棉花幼苗主根长的影响如图2所示,盐胁迫下棉花幼苗主根长均低于CK,施加不同浓度SA 后,棉花幼苗主根长随外源SA 浓度增大呈先上升后降低趋势。T1S1、T1S2和T1S3处理第12 天棉花主根长均高于T1S0;T2S2处理主根长较T2S0处理增长19%,而T2S1和T2S3棉花主根长均低于T2S0,较T2S0分别减少0.7%和13.0%。
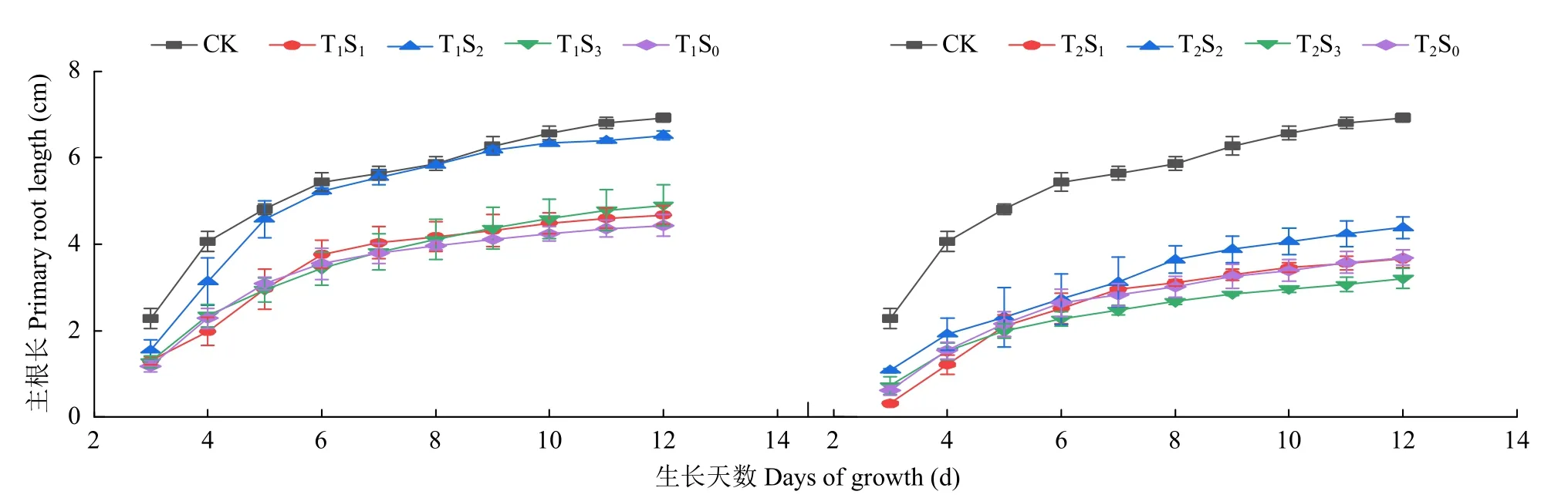
图2 不同盐浓度下施加SA 对棉花幼苗主根长的影响Fig.2 Effects of SA on primary root length of cotton seedlings under different salt concentrations
2.3 盐胁迫下SA 对棉花幼苗根系抗氧化酶活性、MDA 含量及渗透调节物质含量的影响
由图3 可知,低盐胁迫(T1S0)对棉花幼苗根系POD、CAT、SOD 活性及MDA、Pro 和SS 含量影响显著,与CK 相比分别显著上升9.7%、19.4%、23.6%、35.3%、16.3%和20.5%。与T1S0相比,T1S2处理后棉花幼苗根系生理参数抗氧化酶活性和渗透调节物质含量分别显著提高20.5%、26.1%、16.4%、30.2%和35.4%;MDA 含量显著降低20.9%。与CK 相比,T2S0处理对棉花幼苗根系抗氧化酶活性、MDA 含量及渗透调节物质含量影响显著;与T2S0对比,T2S2处理下POD、CAT、SOD 活性及Pro、SS 含量分别提高23.1%、12.1%、18.2%、9.7%和10.8%;在T2S1处理下棉花幼苗MDA 含量最低。

图3 盐胁迫下SA 处理下棉花幼苗根系抗氧化酶活性、MDA 含量及渗透调节物质含量Fig.3 Antioxidant enzyme activities,MDA content and osmoregulatory substance content of cotton seedling roots under SA treatment under salt stress
2.4 主成分分析
将8 个处理13 个指标的平均值进行主成分分析,得到载荷矩阵、特征值、贡献率和累积贡献率(表2)。由表2 可知,SA 对盐胁迫下棉花幼苗生理生长调控作用主要是主成分1(PC1为根系形态因子)和主成分2(PC2为酶活性因子根系因子),8 个处理前2 个主成分贡献率分别为54.68%和35.42%,累积贡献率90.10%,说明PC1和PC2代表原来13 个单项指标90.10%的变化,选取前2 个主成分作为综合评价指标从而减少单项指标的个数。在新确定的综合指标中,根系因子主成分中地下部干物质、根表面积和根体积的特征值最大,均为0.98;抗氧化酶因子成分中CAT 的特征值最大,为0.98。表明地下部干物质、根表面积、根体积和CAT 指标的贡献率最大,影响程度较高,可作为SA 对盐胁迫下棉花生长生理调控作用的主要研究指标。

表2 主成分特征值、贡献率和累积贡献率Table 2 Principal component eigenvalues,contribution rates and cumulative contribution rates
2.5 基于主成分分析的综合评价
以主成分对应的特征值为权重与13 个不同指标标准化数据线性加权得到主成分表达式为Yi,与主成分贡献率线性求和从而得到主成分的综合得分模型Y[23],主成分得分系数情况如表3 所示。将不同处理进行主成分综合评价,得到主成分分析综合得分情况(表4),得出T1S2处理综合得分最高,为2.32,其次为T2S2处理,为1.71,说明在不同盐胁迫下SA 的最佳施用浓度为0.05mmol/L。

表4 主成分分析综合得分Table 4 Composite score of principal component analysis
式中,Yi表示第i个主成分表达式;Eij表示第i个主成分第j个主成分得分系数;Xj表示第j个单项指标的标准化值。
式中,Y表示综合评价值;Wi表示第i个主成分累积贡献率。
3 讨论
盐胁迫会导致棉花幼苗根系生长受到抑制,导致生物累积量减少[24]。本试验表明,盐浓度升高导致棉花幼苗主根长、根总长度、表面积和体积显著降低,棉花幼苗地上部和地下部干重均显著下降,这是由于盐胁迫下作物根系对水的吸收利用受到阻滞后,改变了植物新陈代谢,造成棉花幼苗生理性缺水,从而阻碍植物生长发育[25]。在本试验中,外源SA 处理后,棉花幼苗根系参数随SA 浓度增加呈先增加后减小的趋势,一定程度上促进了棉花幼苗根系生长,增加了棉花幼苗的生物累积量,减弱盐胁迫不利影响,提升棉花幼苗耐盐性。但本试验高盐胁迫下,高浓度SA 抑制了棉花幼苗根系表面积和体积的增加,较T2S0均有不同程度下降,这可能是由于高浓度SA 加剧了高盐胁迫对棉花幼苗的不利影响。
当植物受到外界环境胁迫时,抗氧化保护酶活性及渗透物质等生理代谢指标会发生变化,常被用于评价作物的抗逆性[26]。本试验表明,Pro 和SS积累量随盐浓度升高而增加,这是由于Pro 和SS积累可以调节细胞渗透电位以及与渗透保护作用相关的盐效应[27],从而降低植株细胞渗透压以吸收外界水分维持细胞膨压,维持植株正常生长发育,缓解盐胁迫对植株造成的伤害,是植物自我保护和适应逆境的表现。逆境下植株体内溶解蛋白减少,促进合成SS 酶基因表达量增强[28],Pro 和SS 含量升高也被认为是减少盐度有害影响指标[29-30],这已在逆境下葡萄[31]、烟草[32]及小麦幼苗[15]等植物中得到证实。本试验结果表明,外源SA 处理可以促进棉花幼苗根系渗透调节物质累积量增加,说明施加SA 可以缓解盐胁迫带来的细胞膨压失衡。
为应对盐胁迫,植物会通过增加体内与抗逆相关的酶(SOD、POD、CAT)活性来减少植物体内水分和养分的流失及生物量的减少[33]。本试验结果表明,棉花幼苗根系SOD、POD 和CAT 活性随盐分增大呈增加趋势,这是由于盐胁迫会触发植株产生更多的H2O2并加快脂质过氧化[34],从而促使SOD 等抗氧化酶活性提高,以缓解盐胁迫对作物[35]造成的损伤,这与稷子[36]幼苗中抗氧化酶活性较对照显著提升结果一致。随SA 浓度增大,棉苗根系抗氧化酶活性呈先增后减趋势,中浓度SA 显著提升了棉花幼苗抗氧化酶活性,降低盐胁迫对细胞造成伤害,缓解了盐胁迫对棉花幼苗的不利作用,也是棉花幼苗对盐胁迫耐受性增加的原因。这与硝普钠(SNP)[34]、褪黑素[24]、硫化氢(H2S)[37]等外源处理可以提高盐胁迫下棉花植株SOD、POD、CAT 等抗氧化酶活性的结果一致。MDA 是氧化应激的另一个主要指标,MDA 含量越多说明植株受损伤程度越高[38]。本试验表明,随盐分浓度增加,棉花植株MDA 含量逐渐增加,这与石婧等[39]在不同盐浓度下诱导棉花幼苗氧化应激造成的结果一致。施加SA 后,棉花植株MDA 含量均有不同程度降低,说明SA 能通过降低MDA 含量以此消减盐胁迫对棉花幼苗根系生长的不利影响。
主成分分析可以实现数据降维,通过主成分分析在减少了变量个数的同时体现变量间的内在联系[40]。本研究对中棉619 的13 项单项指标进行主成分分析,前2 个主成分累积贡献率为90.10%,其中主成分1 解释了54.68%的变化,主成分2 解释了35.42%的变化。通过主成分分析发现,地下部干物质、根表面积、根体积和CAT 对SA 缓解盐胁迫响应度较高,可作为棉花耐盐性筛选指标。因此,基于主成分分析的综合评价筛选出外源SA 最佳施用为0.05mmol/L。
4 结论
盐胁迫浓度上升会降低棉花幼苗根系生长参数;施加SA 可促进植株Pro 和SS 含量增加,提高POD、SOD 和CAT 等抗氧化酶活性,降低MDA含量,从而调节棉花植株渗透压,缓解氧化损伤,促进棉花幼苗生长发育,增强棉花幼苗对盐胁迫的耐受性。通过综合评价得出不同盐胁迫下,SA 最佳施用浓度为0.05mmol/L。
