基于Au/Rh-HNP复合纳米材料的CEA免疫传感技术的构建及验证*
2023-08-04孟凡飞
陈 亚,孟凡飞,刘 飞
(陆军军医大学第二附属医院:1.药理基地;2.检验科,重庆 400037)
新型纳米材料应用在生物传感器中能够增强电子传导和响应界面,可显著放大信号,同时还可作为载体起到支撑和吸附的作用[1-3]。癌胚抗原(carcinoembryonic antigen,CEA)是目前最常用的肿瘤标志物之一,作为诊断肠癌及评价其预后的重要指标,在腺癌及大细胞癌患者中升高明显[4-5]。本研究以自制金铑空心纳米球(gold-rhodium hollow nanospheres,Au/Rh-HNP)为信号放大催化剂,构建新型纳米材料免疫传感器,研制肿瘤标志物CEA检测的新技术,为CEA检测提供可选方案。
1 材料与方法
1.1 材料与仪器
CEA一抗、CEA二抗、CEA标准品均购自郑州博赛生物技术股份有限公司,牛血清白蛋白(bovine serum albumin,BSA)、人血清白蛋白(human serum albumin,HAS)、聚乙烯吡咯烷酮(poly-vinyl pyrrolidone,PVP)购自美国Sigma公司,氧化铝(Al2O3)粉末、1%氯金酸(HAucl4)溶液、氯化铑(RhCl3)、铁氰化钾、硫堇(Thi)购自美国Sigma-Aldrich公司,Au/Rh-HNP为实验室自制。 Z36HK低温高速离心机购自德国Hermil有限公司,Chi650d电化学工作站购自上海辰华仪器有限公司,玻碳电极(glass carbon electrode,GCE)购自天津艾达恒晟科技发展有限公司,S-4800电子扫描电镜购自日本日立公司。
1.2 方法
1.2.1构建原理
传感器构建过程见图1。首先在麂皮上对直径为4 mm GCE依次用0.3 μm和50 nm Al2O3颗粒反复打磨,抛光电极表面;随后在双蒸水(ddH2O)、无水乙醇中超声1 min。裸电极抛光表面沉积纳米金,简要过程如下:将抛光电极放入100 μmol/L HAuCl4溶液中,采用循环伏安(cyclic voltammetry,CV)法,设置静息电位上下电位均为-0.2 V,电沉积30~45 s沉积纳米金颗粒,从而在电极表面固化形成纳米金颗粒层。在ddH2O中晃洗干净电极,吸干水滴;在电极表面滴加20 μL CEA一抗(浓度1 μmol/L),4 ℃孵育过夜或者室温3 h固定CEA一抗。在ddH2O中晃洗干净电极,吸干水滴;在电极表面滴加15 μL CEA抗原,室温孵育1 h。在ddH2O中晃洗干净电极,吸干水滴;加入20 μL CEA二抗(浓度1 μmol/L),室温孵育3 h。在ddH2O中晃洗干净电极备用。

图1 Au/Rh-HNP CEA传感器的构建原理
1.2.2制备Au/Rh-HNP
参照文献[6]自制Au/Rh-HNP,将六水合氯化钴(CoCl2·6H2O,10 mg)和PVP(40 000 Mw,60 mg)溶解在50 mL ddH2O(18.2 M)中,超声10 min,并用氮气(N2)吹扫10 min。然后,将1.0 mL 1% RhCl3和0.2 mL 1% HAuCl4溶液合并在单独的烧瓶中。然后搅拌,逐滴添加新制备的硼氢化钠(NaBH4)溶液(5 mg溶于10 mL H2O中)。添加所有NaBH4后,将所得混合物逐滴添加到CoCl2/PVP混合物中,搅拌20 min。最后,通过离心法收集沉积物,并用H2O和乙醇冲洗数次。将沉淀物重新悬浮在2 mL H2O中,并在4 ℃条件下储存备用。
1.2.3制备CEA二抗Au/Rh-HNP复合物
将酶标液、保护剂加入烧杯,搅拌;再加入100 μL硫堇,搅拌,离心,洗涤3次,加入ddH2O。再加入600 μL Au/Rh-HNP,加入CEA二抗,低温搅拌,再加入过氧化物酶,搅拌。
1.2.4制备CEA一抗复合物电极
将备好的裸电极置于1% HAuCl4溶液中,CV法沉积15 s,再置于铁氰化钾溶液中。CEA一抗材料溶液加到修饰后的电极上,放置8 h。置于铁氰化钾溶液中,CV法及电化学阻抗谱(electrochemical impedance spectroscopy,EIS)法对加抗体修饰后的GCE进行表征,加 BSA于电极上封闭未与抗体结合的镀金表面,置于铁氰化钾溶液中。
1.2.5CEA抗原的检测
将CEA标准品分别制成20.0、5.0、1.0、0.5、0.1 mg/dL 5个浓度,加于复合电极上,于37 ℃静置15 min,然后加入CEA抗体Au/Rh-HNP复合物,洗涤,再加入3%过氧化氢(H2O2),检测电极电信号的变化。
1.2.6特异性实验
按CEA抗原检测方法,被检物中0.5 mg/dL HSA、0.5 mg/dL BSA作为干扰物。
1.2.7电化学检测方法
电化学检测在包含三电极的常规电化学池中进行,分别采用了CV、EIS和差分脉冲伏安法(differential pulse voltammetry,DPV)进行检测。 CV法和EIS法在含有0.1 mol氯化钾(KCl)的5 mmol [Fe(CN)6]3-/4-溶液中进行;DPV在2 mL 0.1 mol磷酸盐缓冲液(PBS,pH 7.4)中进行,加入适量H2O2作为催化底物,电压为-0.6~0 V,扫描速率为50 mV/s。
1.3 统计学处理
2 结 果
2.1 制备的Au/Rh-HNP表征
该金铑纳米材料均呈圆球形,具有中间亮度较低、四周亮度较高的典型空心结构。Au/Rh-HNP分布较均匀,直径范围为80~200 nm,见图2。

A:bar=2.00 μm;B:bar=200 nm。
2.2 修饰电极的CV法表征
a1曲线氧化峰电流>120 μA、氧化峰还原峰电流差值<0.12 V;a2较a1电流增大;a3固化一抗后电阻增大;a4在相同电压下较各自对应电极曲线a3电流减小;a5捕获二抗后电阻继续增加,电子的传导能力最小,见图3。

a1~a5分别表示电极裸电极、表面沉积金后、固化一抗、捕获CEA抗原后、加入Au/Rh-HNP捕获二抗后的CV法表征。
图3 CEA免疫传感修饰过程CV法表征图
2.3 修饰电极的EIS法表征
b1电阻<200 Ω;b2较b1电阻减小;b3捕获CEA抗原对应电极曲线b2电阻增大;b4较b3电阻增大;曲线b5表示捕获二抗后(未加H2O2)电阻是最大的,见图4。
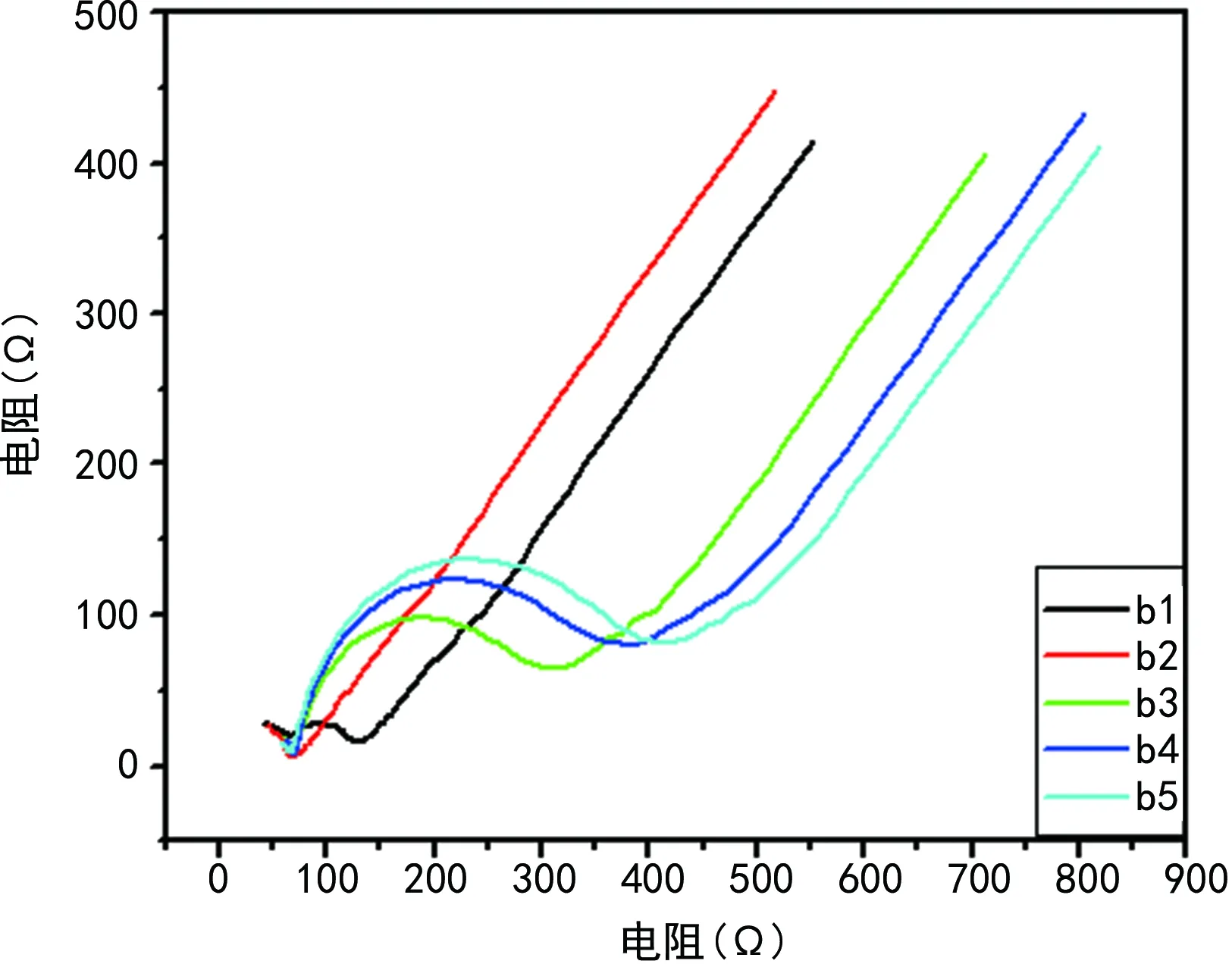
b1~b5分别表示电极裸电极、表面沉积金后、固化一抗、捕获CEA抗原后、加入Au/Rh-HNP捕获二抗后的EIS法表征。
2.4 催化剂体积与电极电流的影响
在相同电压下电流增大,催化前与催化后形成鲜明的对比;当20、25、30 μL时电流没有明显变化,见图5。
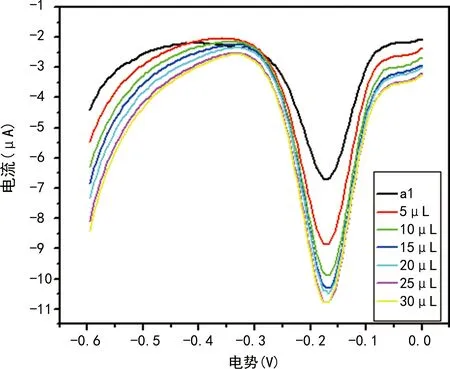
曲线a1表示未催化时,其他曲线分别表示依次加入3% H2O2 5、10、15、20、25、30 μL条件下的电流变化。
2.5 CEA检测结果
检测范围为0.1~20 mg/dL,回归方程为:Y=0.008 7X+0.019,见图6。
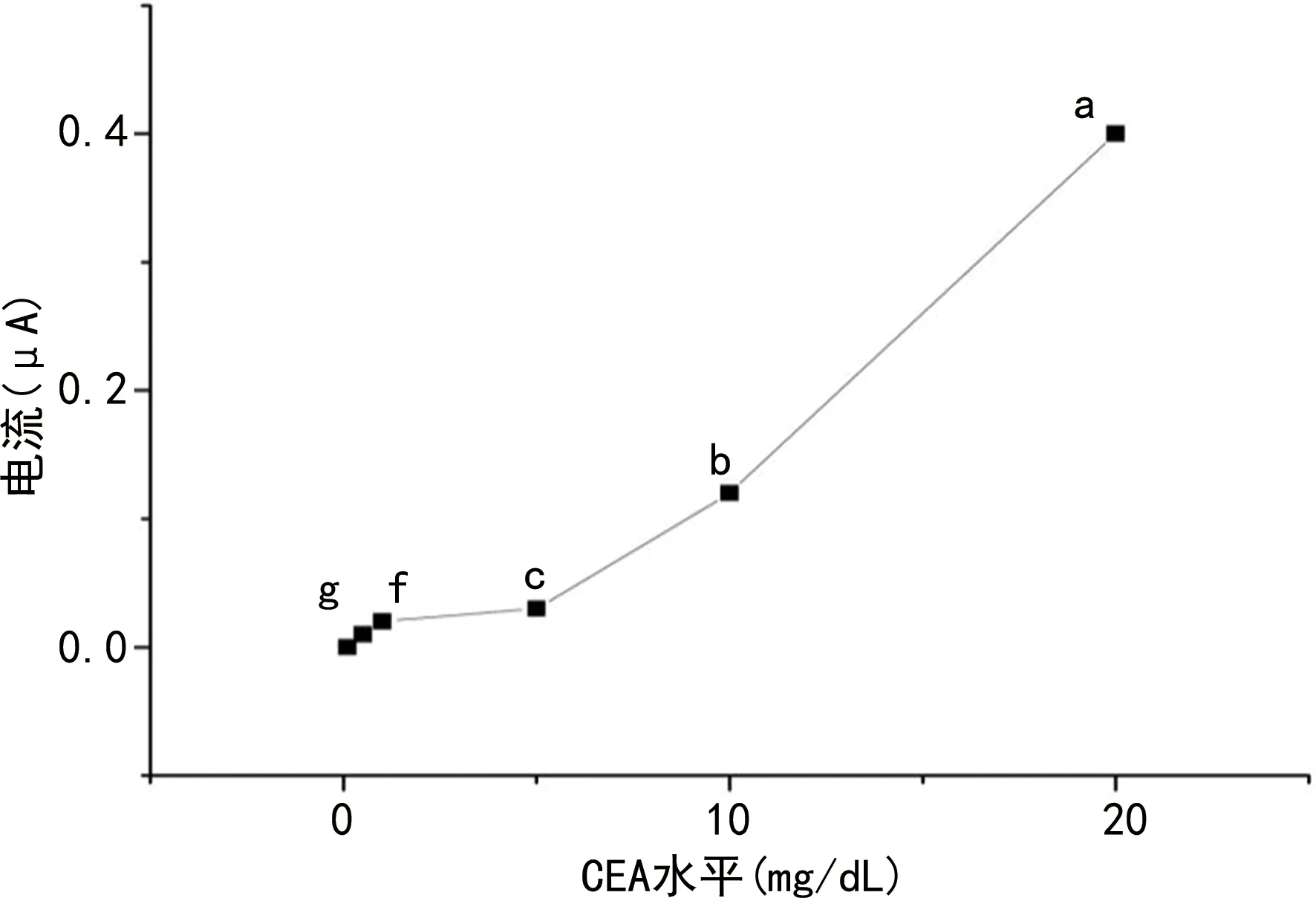
a、b、c、f、g分别检测为20.0、5.0、1.0、0.5、0.1 mg/dL。
2.6 特异性实验
AFP和BSA加入后能检测到的电流很小,而CEA抗原检测的电流变化明显,见图7。
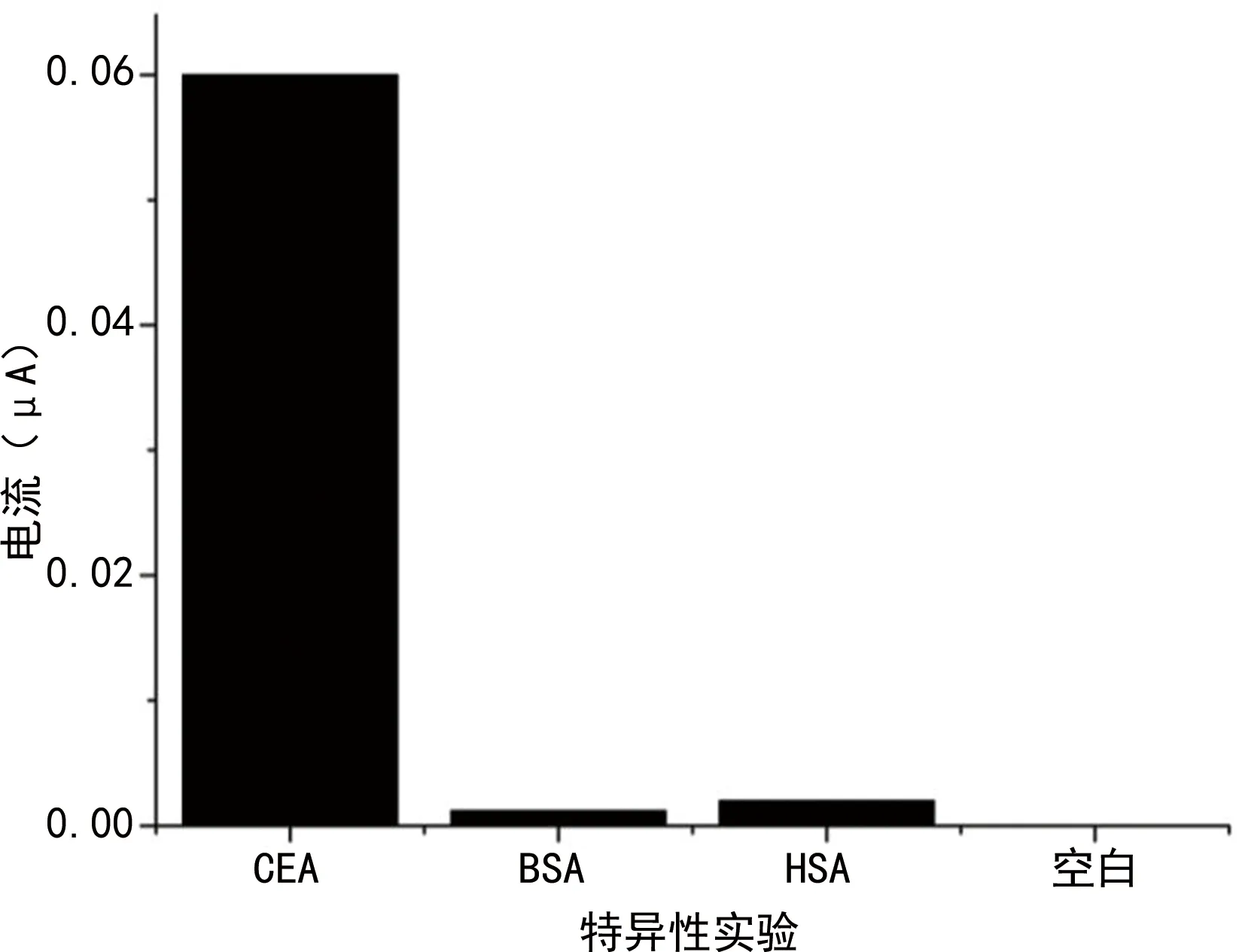
图7 检测特异性实验
3 讨 论
CEA是临床上使用最广泛的肿瘤标志物之一[7],与众多肿瘤的发生、发展密切相关,主要功能是在肿瘤细胞和基质胶原间起黏附作用,在肿瘤的生长和转移过程中扮演重要的角色[8]。健康人血清中CEA水平很低,但在不同癌症中如乳腺癌、结直肠癌和肺癌中可以观察到CEA水平不同程度的升高[9-10]。另外,术前和术后定期检查CEA水平为预测肿瘤所处阶段、进展和复发提供了有用的信息[11]。CEA的检测方法较多,常用的检测方法如酶联免疫吸附试验(ELISA),操作步骤多,干扰因素也较多,通常由于光学背景过高而灵敏度不够;放射免疫法(RIA)由于使用放射性元素对检测人员和环境有危害;化学发光法准确度较高,但检测时间较长,成本较高。因此,这些方法都存在一定缺陷,开发更加灵敏、特异的CEA检测方法对于肿瘤的早期诊断和筛查具有重要的意义。
以金和铑为材料,制备相应纳米颗粒用于检测不同生物标志物已有较多报道,自制的Au/Rh-HNP无色、呈圆球形,是一种中间亮度较低、四周亮度较高的典型空心结构,这种结构可极大地扩大微球的表面积,可结合更多的信号分子,由于金与蛋白分子间有很强的亲和力[12],因此标记和固化蛋白分子很容易实现。本研究自制的Au/Rh-HNP分布均匀,直径范围为80~200 nm,不易聚合沉淀,因此它可能成为有潜力的蛋白分子标记载体,从而构建更方便的检测方法[13-14]。从实验结果看,CV法表征a1曲线氧化峰电流>120 μA、氧化峰还原峰电流差值<0.12 V,表明电极达到抛光要求;a2较a1电流增大,是由于电极表面沉积金后导电能力增强,电子的传递速度加快;a3固化一抗后电阻增大,电子的传导能力较沉积金及裸电极时减小,因此在相同电压下较各自对应电极曲线a2电流减小,同时也小于a1的电流;a4由于捕获抗原后电阻较前增大,电子的传导能力较前裸电极、表面沉积金及固化一抗时减小,因此在相同电压下较各自对应电极曲线a3电流减小;a5捕获CEA抗原后电阻继续增加,电子的传导能力最小,表明电极各步的修饰是成功的。EIS法表征b1电阻<200 Ω,表明达到抛光要求;b2较b1电阻减小,表明已沉积上金层;b3捕获CEA抗原对应电极曲线b2电阻增大,表明已固化了一抗;b4较b3电阻增大;曲线b5表示捕获二抗后(未加H2O2)电阻是最大的,表明电极各步修饰是成功的。由于Au/Rh-HNP具有催化H2O2的功能,在整个催化过程中电子转移到硫堇上,因而在相同电压下电流增大,催化前与催化后形成鲜明的对比,说明抗原抗体已经牢固地结合。
在CEA电极检测中,该免疫传感器检测CEA的灵敏度已达到0.1 mg/dL,检测范围为0.1~20.0 mg/dL,表明该传感器对不同水平的CEA溶液有良好的响应,与CEA水平间有良好的线性关系。为验证实传感器的特异性,选择5 mg/dL AFP、5 mg/dL BSA作为干扰物,从结果可以看出,AFP和BSA加入后能检测到的电流信号很弱,而同水平CEA抗原检测的电流信号变化明显,表明CEA抗体的结合是特异性结合。
生物传感器用于生物标志物的检测具有广泛的应用前景[15],传感器与不同的生物材料或不同的生物标志物结合,可以构建多种不同的检测器。本研究自制的Au/Rh-HNP具有良好的生物兼容性和吸附力,可有效放大检测信号,同时该纳米颗粒还具有H2O2的催化特性,因此具备建立不同检测方法和检测不同生物标志物的潜力。本研究利用该纳米颗粒与金电极结合建立了基于抗体-抗原-抗体夹心法快速、简便、定量检测CEA的方法,并获得了初步的成功,为进一步开发利用这种新型纳米材料奠定了基础。但本实验仍存在一定不足之处:没有用临床真实标本对实验方案进行验证,其灵敏度还有待提高,其他干扰性疾病标志物的检测并没有完全囊括在本实验中。
