干细胞因子促进共培养DPSCs 与HUVECs 的成血管能力
2023-08-03姬红娇徐丽莉丁文通李培慧王彦九潘爽
姬红娇,徐丽莉,丁文通,李培慧,王彦九,潘爽
1.哈尔滨医科大学附属第一医院,哈尔滨医科大学口腔医学院,黑龙江 哈尔滨(150001);2.北京大学口腔医学院第二门诊部,北京(100101)
在牙髓再生的组织工程领域中,主要包括神经再生、血管再生和牙本质再生,其中血管再生是关键,建立丰富和瞬时的血液供应对于牙髓组织的成功再生和长期生存是必要的[1]。牙髓干细胞(dental pulp stem cells,DPSCs)是牙髓再生的种子细胞[2-4]。内皮细胞是组织再生过程中新血管形成的潜在来源[5]。本课题组前期研究结果表明,以1∶5 的比例直接共培养DPSCs 和人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs),可促进血管形成,但形成的管状结构6 h 后便发生分解[6]。文献报道,在共培养体系中加入生长因子可促进更多管状结构的形成和长期稳定[7-8]。
干细胞因子(stem cell factor,SCF),又称为Kit配体,是介导细胞血管形成和调节造血及其他生物过程的细胞因子[9-11],相关研究及本课题组前期结果证实适宜浓度(100 ng/mL)的SCF 可分别提高DPSCs 和HUVECs 的迁移能力和管状结构形成能力[12-13]。因此,本实验拟通过将SCF 作用于共培养条件下的DPSCs 和HUVECs,探讨其是否可以促进稳定血管结构生成。
1 材料和方法
本实验已获得哈尔滨医科大学附属第一医院伦理委员会批准。
1.1 主要试剂与仪器
DMEM 培养基(SH30022.01,Hyclone,美国);ECM 培养基(1001,ScienCell,美国);胎牛血清(10099-141,Gibco,美国);青霉素-链霉素混合溶液(15140-122,Gibco,美国);SCF 干细胞因子(AF-300-07,PeproTech,美国);Matrigel基质胶(356234,Corning,美国);活细胞示踪剂CM-DiI(40718ES60,翌圣,中国);活细胞示踪剂CMFDA(40721ES60,翌圣,中国);一抗(鼠抗人):CD31(3528s,CST,美国);一抗(兔抗人):CD34(GB111693,赛维尔,中国);一抗(兔抗人):血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)(WL03335,万类,中国);羊抗小鼠二抗(BA1050,博士德,中国);羊抗兔二抗(BA1054,博士德,中国)。酶标仪(Epoch,Biotek,美国),荧光显微镜及照相系统(IX73,Olympus,日本),显影仪(FluorChem FC3,ProteinSimple,美国)。
1.2 细胞培养和实验分组
HUVECs 购买自iCell(赛百慷,中国)。本实验所采用的DPSCs 均为经过课题组鉴定后冻存的原代细胞,选取第3 ~7 代的细胞用于后续实验[14]。实 验 分 组 分 别 为:HUVECs 组、SCF+HUVECs 组、DPSCs+HUVECs 组和SCF+DPSCs+HUVECs 组,SCF浓度为100 ng/mL,DPSCs 与HUVECs 按照1∶5 的比例接种于孔板中。
1.3 CCK-8 法检测细胞增殖能力
0.25%胰酶分别消化HUVECs 和DPSCs,用内皮细胞培养基或者混合培养液(ECM∶DMEM=1∶1)重悬将其调整为3×103个/孔的细胞悬液备用。每组设6 个复孔,其中两个复孔只加培养液作为空白对照,将各组细胞混匀后接种在4 个96 孔板中,分别培养1、3、5、7 d,每孔避光加入10 μL CCK-8 溶液,37 ℃孵箱避光孵育1 h,取出冷却至室温,用酶标仪测定波长在450 nm 处每个孔的吸光度值进行统计分析。
1.4 细胞划痕实验检测水平向迁移能力
胰酶分别消化HUVECs 和DPSCs,用混合培养液或ECM 重悬将其调整为3×105个/孔的细胞悬液,每组设置3 个复孔,将各组细胞混匀后接种在6 孔板中。待细胞贴壁并铺满孔板后,使用200 μL枪头垂直于孔板划痕,然后用PBS 轻轻洗涤2 遍,洗去脱落的细胞,吸净PBS 后在各组中加入含或不含SCF 的无血清培养液,放入37 ℃,5% CO2孵箱中继续培养。在0、12、24 h 后放置在倒置显微镜下观察拍照,图像采集后用Image J 软件检测划痕面积,计算各组细胞12、24 h 的愈合面积百分比,进行统计分析。
1.5 Transwell 实验检测HUVECs 垂直向迁移能力
先用胰酶消化DPSCs,用混合培养液将其重悬为4×103个/孔的细胞悬液,每组设置3 个复孔,按照分组设置分别在24 孔板下室中加入500 μL 含或不含SCF的培养液。然后用胰酶消化HUVECs,无血清内皮细胞培养基将其制备成2×104个/孔的细胞悬液,均匀接种于上室中,将24 孔板置于孵箱中培养48 h。孵育完成后,于各孔上下室加入4%多聚甲醛固定30 min,PBS 冲洗3 遍后加入0.1%结晶紫染色30 min,用干净的棉签轻轻擦去上室未穿过聚碳酸酯膜的细胞,将上室放于显微镜下随机取5 个视野观察并拍照计数。
1.6 体外基质胶管形成实验检测血管形成能力
将所需基质胶插入冰盒,置于4 ℃冰箱过夜备用。向经过预冷处理的96 孔板中加入60 μL/孔基质胶,每组设置3 个复孔,放入37 ℃孵箱预凝胶化30 min。在此期间,用胰酶分别消化HUVECs 和DPSCs,按照分组要求向铺胶的孔板内每孔加入100 μL 含1.2×104个细胞的悬液。完成上述操作后,将孔板置于37 ℃孵箱中培养,分别在第3、6、9、12 h 后,于显微镜下观察并拍照记录管状结构的形成情况,使用Image J 软件量化各组管状结构的分支数量和分支总长度进行统计分析。此外,将用细胞示踪剂CMFDA 标记的DPSCs、CM-DiI 标记的HUVECs 按照1:5 的比例接种于凝胶化的Matrigel 基质胶上,用于观察两种细胞的分布情况。
1.7 酶联免疫吸附实验检测VEGFA 的浓度
采用双抗体夹心ELISA法检测上清液中VEGFA的浓度。依照分组将3×105个/孔的细胞悬液均匀接种于6 孔板中,每组设置3 个复孔,培养3 d。收集细胞培养上清液后在4 ℃,1 000×g 条件下离心20 min,除去杂质及细胞碎片,取上清加入抗人VEGFA 抗体包被的酶标板上进行检测。用酶标仪在450 nm 波 长 处 测OD 值,VEGFA 浓 度 与OD450值之间成正比,通过绘制标准曲线计算出样品中VEGFA 的浓度。
1.8 Western blot 实验检测成血管相关蛋白的表达水平
Western blot 检测不同分组的细胞中CD31、CD34 和VEGFA 蛋白表达情况。按照分组将3×105个/孔的细胞悬液均匀接种于6 孔板中,待细胞完全贴壁后72 h 加入细胞裂解液(RIPA∶PMSF=100∶1),分组收集于EP 管中超声裂解,离心后提取细胞总蛋白,BCA 法进行蛋白浓度测定。用10%Tris-甘氨酸SDS 聚丙烯氨酸凝胶电泳后,湿转法转至PVDF 膜上,5%封闭蛋白粉室温封闭2 h,4 ℃冰箱过夜孵育一抗CD31(1∶1 000)、CD34(1∶1 000)、VEGFA(1∶1 000)和GAPDH(1∶1 000)。取出洗膜后加入二抗,室温孵育1 h,使用超敏ECL发光试剂盒,FC3 显影仪检测显影,图像采用ImageJ 软件进行灰度值分析,GAPDH 为内参。
1.9 统计学分析
使用GraphPad Prism 8 软件进行分析,计量资料以均数± 标准差表示。采用单因素方差分析进行多组间比较,P<0.05 认为差异有统计学意义。
2 结 果
2.1 DPSCs 与HUVECs 共培养可提高细胞的增殖能力
CCK-8 增殖实验结果显示(图1),第1、5、7 天DPSCs+HUVECs 组的细胞增殖能力高于HUVECs组(P<0.05),SCF+DPSCs+HUVECs 组在第5 天时增殖能力显著优于HUVCs 和SCF+HUVECs 组(P<0.001,P= 0.001),第7 天时SCF+DPSCs+HUVECs组增殖能力依旧高于HUVCs 和SCF+HUVECs 组(P= 0.003,P= 0.003),但加或不加SCF 组间无显著差异(P= 0.999,P= 0.892)。

Figure 1 The proliferative ability of the cells was measured by the CCK-8 assay图1 CCK-8 法检测细胞的增殖能力
2.2 SCF 促进共培养的DPSCs 和HUVECs 划痕愈合
为检测SCF 和DPSCs 与HUVECs 直接共培养时,对各组细胞迁移能力的影响,进行了细胞划痕实验。首先,于显微镜下对0、12、24 h 各组细胞的迁移情况拍照观察(图2a)。划痕实验的量化结果显示12、24 h 后,相较于其他三组,SCF +DPSCs+HUVECs 组的细胞向划痕处迁移明显(HUVECs 组vs.SCF +DPSCs+HUVECs 组,12 h:P<0.001,24 h:P<0.001;SCF+HUVECs 组vs.SCF +DPSCs+HUVECs 组,12 h:P= 0.001,24 h:P<0.001;DPSCs+HUVECs 组vs.SCF +DPSCs+HUVECs 组,12 h:P=0.029,24 h:P<0.001),DPSCs+HUVECs 组划痕愈合面积百分比大于HUVECs 组(12 h:P= 0.003,24 h:P<0.001)。24 h,SCF+HUVECs 组的愈合面积百分比大于HUVECs 组(P<0.001)(图2b)。

Figure 2 Effect of SCF on migration capacity of DPSCs and HUVECs under direct coculture conditions图2 SCF 对DPSCs 和HUVECs 直接共培养条件下迁移能力的影响
2.3 SCF 和DPSCs 促进HUVECs 迁移
为检测SCF 和DPSCs 与HUVECs 间接共培养时,二者对HUVECs 迁移能力的影响,进行了Transwell 迁移实验。图3a 是48 h 后各组具有代表性的迁移图像。实验结果显示,与下室只加入培养液的对照组相比,单独加入SCF 或DPSCs 组可诱导上室HUVECs 的迁移(P<0.001),当SCF 和DPSCs 共同作用时,HUVECs 的迁移数量显著多于二者单独使用时(P<0.001)(图3b)。
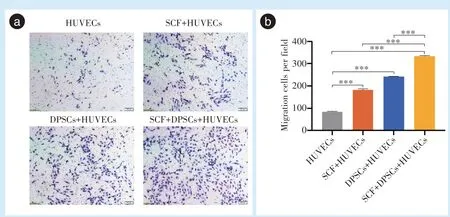
Figure 3 Effect of SCF and DPSCs on HUVECs migration capacity图3 SCF 和DPSCs 对HUVECs 迁移能力的影响
2.4 SCF 作用于共培养的DPSCs 和HUVECs 促进管状结构的形成
体外基质胶管形成实验结果中显示,3 h 各组开始形成小管样结构,6、9、12 h 管状结构进一步成熟稳定,管腔直径增加(图4a)。SCF+DPSCs+HUVECs 组与其他组相比,形成的小管样结构分支数目多,分支的总长度也相对较长。通过对4 个时间节点管状结构分支的数量进行统计分析(图4b),结果发现SCF+HUVECs 组和DPSCs+HUVECs组分支数目高于HUVECs 组(HUVECs 组vs.SCF +HUVECs 组,3 h:P<0.001,6 h:P= 0.002,9 h:P=0.017,12 h:P= 0.021;HUVECs 组vs.DPSCs+HUVECs 组,3 h:P<0.001,6 h:P<0.001,9 h:P=0.001,12 h:P= 0.001),SCF+DPSCs+HUVECs 组管状结构的数目高于其他三组(P<0.001)。从对各组管状结构分支总长度的统计分析结果中(图4c)发现,管状结构形成的12 h 后,SCF+DPSCs+HUVECs 组分支总长度显著高于其他三组(HUVECs组vs.SCF +DPSCs+HUVECs 组,P<0.001;SCF+HUVECs组vs.SCF+DPSCs+HUVECs组,P<0.000 1;DPSCs+HUVECs 组vs.SCF +DPSCs+HUVECs 组,P= 0.001)。

Figure 4 Effect of SCF on the vascular formation capacity of cocultured DPSCs and HUVECs图4 SCF 对共培养的DPSCs和HUVECs 成血管能力的影响
虽然SCF 和DPSCs 单独与HUVECs 培养也可促进管状结构的形成,但促进效果低于SCF 作用于共培养的DPSCs 和HUVECs 的情况。将活细胞示踪剂CMFDA 标记的DPSCs(绿色荧光)、CM-DiI 标记的HUVECs(红色荧光)按照1∶5 的比例接种于凝胶化的Matrigel 基质胶上,分别在3、9 h 于荧光显微镜下拍照,用于观察两种细胞的分布变化情况。在3 h,DPSCs 多分布于管状结构交叉点处,随着小管的进一步成熟稳定,到9 h,DPSCs 会慢慢由交叉点处向分支上转移,发挥周细胞样细胞的功能,维持管状结构的稳定(图4d)。
2.5 SCF 促进DPSCs 和HUVECs 共培养组中血管生成相关蛋白的表达
ELISA 结果显示,经100 ng/mL SCF 处理的DPSCs 和HUVECs 共培养组上清液中VEGFA 的浓度高于其他三组(P<0.001),DPSCs+HUVECs 组的VEGFA 浓度也显著高于HUVECs 单独培养组(P<0.001)(图5a)。通 过Western blot 检 测CD31、CD34 和VEGFA 这三种血管生成相关蛋白的表达情况。SCF+DPSCs+HUVECs 组血管生成相关蛋白的表达量多于其他三组(图5b)。与HUVECs 组相比,SCF+HUVECs 组、DPSCs+HUVECs 组 和SCF+DPSCs+HUVECs 组中CD31 的表达水平均有所提高(P<0.001),SCF+DPSCs+HUVECs 组 中CD34 和VEGFA 的表达水平高于SCF+HUVECs 组和DPSCs+HUVECs 组(P<0.001,P<0.001)(图5c)。因此,与对照组相比,单独使用SCF 或DPSCs 作用于HUVECs,也可促进成血管相关蛋白表达水平的提高,但作用不如二者共同作用时明显。

Figure 5 Effect of SCF on angiogenesis-related proteins expression of cocultured DPSCs and HUVECs图5 SCF 对共培养的DPSCs 和HUVECs 血管形成相关蛋白表达的影响
3 讨 论
牙髓是一种发育成熟的非矿化牙体组织,仅通过牙体硬组织包绕形成的狭窄根尖孔与根尖周组织建立联系,当其暴露于机械创伤和致龋环境中时会导致根管内或根尖周组织的感染[15]。在牙髓再生中,根尖孔的存在限制了宿主向整个根管系统供血的能力,为了弥补这一局限性,潜在实验策略是将干细胞与能够诱导血管生成的生长因子协同应用,从而促进更多牙髓血管的生成[16]。
DPSCs 被认为是牙髓再生的重要细胞来源[17],主要通过两种方式诱导牙髓血管的生成。一种方式是DPSCs 和内皮细胞通过旁分泌途径分泌促血管生成因子,从而增强细胞的增殖迁移和管形成能力[18-20]。Kim 等[21]证明DPSCs 与HUVECs联合使用可显著增加后肢缺血动物模型中微血管的数量,且DPSCs 分泌的VEGF 能够促进HUVECs的增殖和新血管的形成。本实验中,DPSCs 和HUVECs 共培养组与单独的HUVECs 相比,细胞的增殖、迁移能力以及管状结构形成能力均显著增加。另一种方式是DPSCs 利用其多向分化潜能分化为周细胞样细胞直接参与管状结构的形成[22-23]。据报道,DPSCs 表达周细胞标记物,并且在与内皮细胞共培养血管生成模型中稳定形成的管状结构[24]。本研究使用活细胞示踪剂分别对DPSCs 和HUVECs 进行标记,通过荧光显微镜拍照观察共培养组细胞在3 h 和9 h 的细胞分布动态变化,发现DPSCs 由管状结构的节点向分支方向转移,包绕在管腔周围,依附于HUVECs 类似周细胞样细胞,稳定管状结构。根据以上实验结果分析,DPSCs 代表了周细胞的有效来源,适当的培养条件可以产生具有稳定血管和促进血管成熟能力的群体。
SCF 既可以发挥促进细胞血管形成的作用,也可以诱导干细胞的自我更新、迁移和存活[25-26]。本研究中,SCF 明显促进了HUVECs 的迁移,使其形成更多的血管样结构。Cucco 等[27]发现DPSCs 表达SCF 和CD117,证实了SCF 信号通路可通过CD117 调控DPSCs 中Bmi-1 基因的表达,进而促进DPSCs 的自我更新。在本实验中,当SCF 作用于共培养的DPSCs 与HUVECs 时,迁移能力和成管能力显著高于其他组,同时对血管生成标志物的检测结果表明,SCF+DPSCs+HUVECs 组中CD31、CD34和VEGFA 三种蛋白的表达水平最高,即SCF 的应用可进一步促进DPSCs 和HUVECs 成血管相关蛋白表达的增加,提高细胞的血管形成能力。
SCF 作用于共培养的DPSCs 和HUVECs 时,形成的管状结构的数目更多且更加稳定,血管形成相关蛋白的表达水平也较高,即SCF 可促进共培养DPSCs 和HUVECs 的迁移,增强细胞的血管形成能力。下一步的目标是研究此过程中涉及的成血管的具体信号通路和作用机制,以及如何在体内应用形成富含血管样结构的牙髓组织,从而成功实现临床转化。
【Author contributions】Ji HJ performed the experiment, analyzed the data and wrote the article.Xu LL, Ding WT , Li PH and Wang YJ performed the experiment, analyzed the data and revised the article.Pan S designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
