偏穗鹅观草RT-PCR内参基因筛选及验证
2023-08-01张宝蓉解继红金丹青汪军成姚立蓉司二静尚勋武王化俊李葆春
张宝蓉, 解继红, 金丹青, 汪军成, 姚立蓉,司二静, 尚勋武, 王化俊, 李葆春*
(1.甘肃农业大学生命科学技术学院,兰州 730070; 2.甘肃农业大学甘肃省干旱生境作物学国家重点实验室,兰州 730070; 3.中国农业科学院草原研究所,呼和浩特 010010; 4.甘肃农业大学农学院,兰州 730070)
偏穗鹅观草(Roegneria komaroviiNevski)为小麦族(Triticeae)鹅观草属(Roegneria)植物,为小麦近缘种,是小麦的三级基因源,其优异的基因可拓宽小麦遗传基础,提高小麦抗病、抗逆等特性[1]。罗粤川等[2]对31份鹅观草种质资源进行田间抗赤霉病鉴定,发现鹅观草抗侵入性中等、抗扩展性优异、体抗性表现良好。周永红等[3]对鹅观草、大麦以及其属间杂种进行了赤霉病抗性鉴定,表明鹅观草的抗赤霉病基因在杂种中得到部分表达,可将鹅观草抗赤霉病种质用于麦类作物育种中。陈景芋等[4]利用不同水平NaCl溶液对偏穗鹅观草、大芒鹅观草、肃草进行胁迫处理7 d,综合分析各项生物学指标发现偏穗鹅观草耐盐性最好,由此表明偏穗鹅观草中含有耐盐基因。万永芳等[5]用单花和多花注射接种法对小麦近缘野生植物16个属80个种276份材料进行了抗赤霉病鉴定和分析,结果表明鹅观草属既高抗侵入又高抗扩展,进一步为挖掘小麦抗病性基因提供理论支撑。赵富强等[6]对来自国内外的34份鹅观草种质资源条锈病及白粉病抗病性进行了鉴定和评价,发现鹅观草属种质资源抗病能力存在多样性,筛选出6份高抗条锈病资源、12份高抗白粉病资源及2份(ZY 1007和Pr 87-88344)兼抗条锈病和白粉病资源,为合理利用抗病材料及抗病育种提供资料。马玉宝等[7]搜集386份野生鹅观草属材料在四川、云南、甘肃及内蒙古等地区进行适应性评价,发现鹅观草属抗逆性强,适应性范围广。
研究功能基因的表达模式最常用的方法为实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR),该方法需要选用表达稳定的参考基因进行校准,这些基因被称为内参基因。理想的内参基因在植物不同生长发育阶段、不同器官中均能稳定表达,不受环境影响[8]。常见内参基因在所有细胞中均能稳定表达,通常选用基因组中的管家基因(housekeeping gene),包括肌动蛋白、微管蛋白、甘油醛-3-磷酸脱氢酶等基因。
内参基因在不同物种间没有绝对的通用性,不同物种间同源内参基因的稳定性不同,同一物种中内参基因的稳定性也是相对的,不同的内参基因在不同条件下的表达通常不是恒定不变的,研究者必需结合各自的试验条件和样品类型来选择合适的内参基因[9],否则会导致试验数据出现偏差,影响目的基因表达水平的分析。为保障基因表达分析结果的可靠性,筛选偏穗鹅观草适宜的内参基因,对于其抗逆性基因筛选及在小麦中的应用等研究具有重要意义。本研究选取小麦中8个常用候选内参基因[10],验证候选内参基因在偏穗鹅观草根、茎、叶等不同器官及不同胁迫处理环境下的表达,并借助geNorm、BestKeeper软件对这些内参基因表达的稳定性进行评价,以期筛选最佳内参基因,为后续偏穗鹅观草基因表达、功能及调控等相关研究提供参考,对进一步研究小麦三级资源库材料具有重要意义。
1 材料与方法
1.1 植物材料
供试材料中国春、偏穗鹅观草由甘肃省作物遗传改良与种质创新实验室提供,种植于甘肃农业大学玻璃温室,采用栗钙土与蛭石(质量比3∶1)混合土培方式,分别播种在口径23 cm、高15 cm塑料花盆中。分别采取供试材料各处理组的根、茎、叶样品,液氮速冻后转-80 ℃冰箱保存。
1.2 植物基因组DNA提取
参照Rogers等[11]方法提取提取中国春及偏穗鹅观草DNA。利用Nanophoto meter Pearl微量紫外分光光度计(德国)测定DNA样品230、260及280 nm的光吸收值,确定纯度及含量。
1.3 植物总RNA提取及cDNA第1条链合成
采用Trizol试剂盒 (TIANGEN,北京)植物总RNA提取试剂盒提取偏穗鹅观草不同处理的不同器官(根、茎、叶)RNA。采用1%琼脂糖凝胶电泳及Nanophoto meter pearl微量紫外分光光度计测定RNA样品230、260及280 nm的光吸收值,检测其含量及纯度。参照天根公司逆转录试剂盒FastQuant RT Kit(with gDNase)说明书合成 cDNA第1条链,保存于-20 ℃冰箱中。
1.4 候选内参基因选择及引物设计
选取肌动蛋白(Actin1、Actin2、Actin3)、微管蛋白(Beta-Tubulin,BTUB)、亲环素(Cyclophilin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate,GAPDH)、组蛋白(Histone H3)、延伸因子(elongation factor-1-alpha-subunit,EF1α1)的编码基因,运用NCBI获得候选内参基因序列并根据编码序列(coding sequence,CDS)保守区段设计引物(表1)。
1.5 候选内参基因引物特异性分析
用内参基因引物,以偏穗鹅观草各样DNA为模板进行PCR扩增。反应体系:DNA模板1 μg;上下游引物各1 μL(10 μmol·L-1);2×TaqPCR Master Mix 25 μL,加水至50 μL。反应条件:94 ℃ 5 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。通过2%的琼脂糖凝胶电泳检测引物的特异性及产物大小。
1.6 序列分析
PCR扩增产物均使用AxyPrep DNA凝胶回收试剂盒回收,并由北京擎科生物有限公司完成测序。将测序所得结果提交NCBI数据库并用MEGA6和DNAMAN软件进行氨基酸比对。
1.7 内参基因的qRT-PCR分析
qRT-PCR扩增采用天根SuperReal PreMix Plus(SYBR Green)试剂盒,反应体系20 μL:cDNA模板1 μL;上下游引物各0.6 μL;2×SuperReal PreMix Puls (SYBR Green) 10 μL; 50×ROX Reference Dye 0.4 μL; RNase-Free ddH2O 7.4 μL。反应程序: 95 ℃ 5 min; 95 ℃ 10 s,60 ℃32 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min; 95 ℃15 s。每个样品设置3个重复。
1.8 数据处理与分析
分别以根、茎、叶不同器官及盐处理RNA为模板进行qRT-PCR得到的Ct值,利用geNorm及BestKeeper软件进行候选基因的表达丰度分析及差异显著性分析。
2 结果与分析
2.1 引物特异性分析
以偏穗鹅观草叶片为材料提取的总RNA经Nano photo检测OD260/280均在1.8~2.13之间,说明总RNA纯度较好。通过1%琼脂糖凝胶电泳检测其完整性,所有样品28S及18S条带完整清晰(图1A),说明总RNA完整性较好,达到后续试验要求。以偏穗鹅观草及中国春叶片样品DNA为模板,利用8个特异性引物进行扩增。扩增产物经电泳检测,8个候选内参基因在偏穗鹅观草(图1B)及中国春(图1C)中均扩增出目的条带,并且扩增产物条带大小符合预期,引物特异性良好,可对扩增产物进行测序。
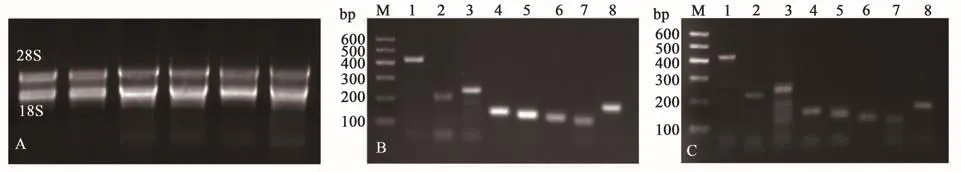
图1 RNA监测及候选基因扩增Fig.1 RNA detection and candidate gene amplification
2.2 候选基因测序结果分析
在NCBI数据库比对结果如图2所示,偏穗鹅观草候选内参基因和小麦、大麦、蒙古冰草、粗山羊草、二粒小麦、大麦草等相似性在82%~96%,同属小麦族物种,内参基因具有一定的保守性。
图2 偏穗鹅观草部分候选内参基因序列对比Fig.2 Comparison of the sequence of some candidate internal reference genes
应用DNAMAN软件中对偏穗鹅观草与中国春内参基因序列进行相似性比对,各候选内参基因出现多个位点单碱基突变(single nucleotide polymorphism,SNP)。
2.3 候选内参基因表达丰度分析
分别以不同组织及处理的偏穗鹅观草cDNA为模板进行qRT-PCR分析。8个候选内参基因在偏穗鹅观草不同器官中Ct值介于20.87~32.70之间(表2)。由于Ct值越大,其表达丰度越小,Actin1、BTUB、Actin2、Actin3、Histone H3的Ct值均大于25,表明其在偏穗鹅观草中根、茎、叶器官中表达丰度小,Cyclophilin、EF1a1及GAPDH在根、茎、叶中的Ct均小于25,表明其在偏穗鹅观草中根、茎、叶器官中表达丰度较大,优先考虑这3个基因作为内参基因。

表2 8个候选内参基因在偏穗鹅观草不同器官中的Ct值范围Table 2 Range of Ct values of 8 candidate internal reference genes in different organs of Roegneria komarovii
2.4 偏穗鹅观草候选内参基因稳定性分析
2.4.1 geNorm 分析 geNorm 软件是Vandesompele等[12]编写的专门用于qRT-PCR中筛选内参基因及确定最适内参基因数目的程序,其利用各内参基因Ct值换算成Q值进行分析,依据计算的每个基因表达稳定性(M值)来筛选出稳定性较好的内参基因。M值与内参基因稳定性呈负相关,且geNorm默认值为1.5,M<1.5时认为是理想内参;M值>1.5时则认为极其不稳定且不应作为内参基因。因此判定标准为M值越小稳定性越好,反之,则稳定性越差。geNorm软件分析结果显示,在CK组中8个内参基因的M值均小于1.5,说明这些候选内参基因稳定性好,表达稳定性由高到低排序依次为EF1a1=GAPDH>Cyclophilin>Actin3>Actin2>Actin1>BTUB>HistoneH3;同上,在盐处理组中:GAPDH=Histone H3>Cycliophilin>Actin3>EF1a1>Actin1>Actin2>BTUB; 在干旱组中:GAPDH=Actin2>EF1a1>Actin3>Actin1>BTUB>Histone H3;在高温组中:EF1a1=Cycliophilin>Actin3>GAPDH>Actin2>HistoneH3>Actin1>BTUB(图3)。
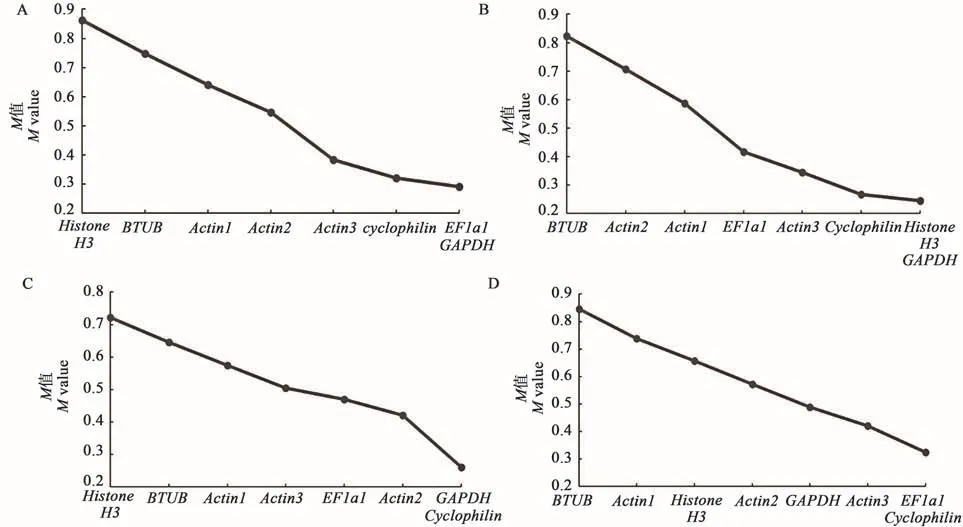
图3 geNorm分析候选内参基因表达稳定性Fig.3 Analysis of the expression stability of candidate reference genes by geNorm
geNorm软件可以通过配对差异系数(Vn/n+1)确定最适内参基因数目,软件默认Vn/n+1阈值为0.15,阈值小于0.15时,最适内参基因个数为n个,大于0.15时,最适内参基因个数为n+1个。在此试验中对候选内参基因的配对差异值分析发现(图4),CK组、盐处理组及高温组中,V2/3分别为0.101、0.084、0.147,均小于0.15,说明最适内参基因个数为2个;干旱处理组中,V3/4为0.114,说明最适内参个数为3个。
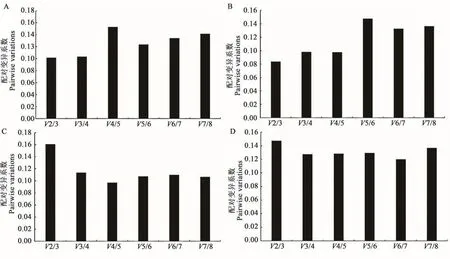
图4 geNorm分析确定候选内参基因数目Fig.4 Determined the optimal number of candidate reference genes by geNorm
2.4.2 BestKeeper分析 BestKeeper是由Pfaffl等[13]编写的针对内参基因和目标基因表达量分析的程序,计算比较基因的CV值和s值来评价内参基因稳定稳定性,CV和s越小,说明该内参基因稳定性越好;若s>1则说明该内参基因表达不稳定。BestKeeper软件分析结果(表3)显示,8个内参基因s值均小于1,说明8个候选基因的表达稳定性较好;CK组中稳定性由高到低排序为GAPDH>EF1a1>Actin3>Cyclophilin>Actin1>Actin2>Histone H3>BTUB;盐处理组中,EF1a1>Actin3>Cyclophilin>GAPDH>HistoneH3>Actin1>Actin2>BTUB;干旱处理组中Cyclophilin>GAPDH>Actin3>Actin1>Actin2>EF1a1>HistoneH3>BTUB;高温处理组中Actin3>Histone H3>EF1a1>cyclophilin>GAPDH>Actin1>Actin2>BTUB。
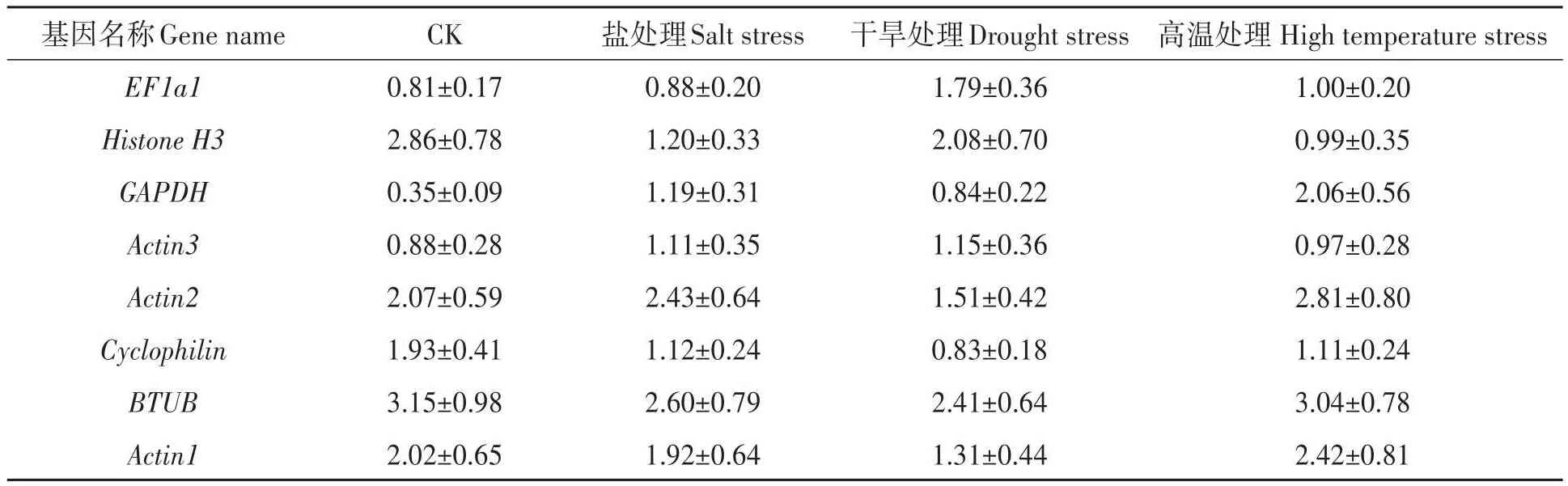
表3 BestKeeper分析候选内参基因表达稳定性排名Table 3 Expression stability values of candidate reference genes determined through BestKeeper
2.4.3 内参基因表达稳定性验证
盐、干旱等非生物胁迫可迅速激活植物SnRK2家族蛋白激酶[14],为验证筛选的内参基因表达稳定性,用综合稳定性排名高的Cyclophilin为参照分别对不同处理偏穗鹅观草的SnRK2的表达水平进行分析。结果显示,以Cyclophilin为参照,SnRK2在偏穗鹅观草不同非生物胁迫处理中上调表达(图5)。
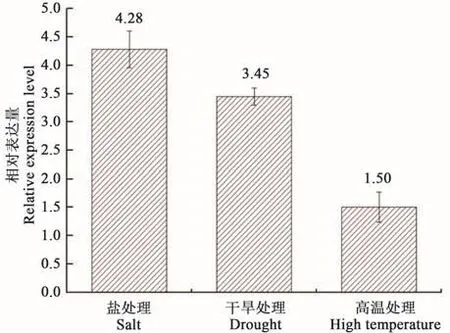
图5 Cyclophilin分析偏穗鹅观草不同非生物胁迫处理中SnRK2表达水平Fig.5 Expression level of SnRK2 in Roegneria komarovii under different abiotic stress treatments using Cyclophilin
3 讨论
qRT-PCR是目前研究基因表达应用最为普遍的技术,但其准确性受到样品起始RNA的质量和含量、cDNA 合成效率以及PCR扩增效率等多因素的影响[15],常规qRT-PCR采用相对定量进行分析,选择合适的内参基因进行校正和标准化至关重要。理想的内参基因表达水平在不同组织、不同生理与环境条件下保持稳定不变[16],但已有研究表明,生物体内并没有真正的、完全稳定的内参基因,大多数传统内参基因已不能满足qRT-PCR准确定量的要求[17]。齐香玉等[18]研究发现,内参基因的表达差异不仅仅存在于不同物种间,即使同一物种,由于组织、生长阶段和环境等不同,内参基因表达的稳定性也存在差异。某种植物中较为理想的内参基因并不一定适合在其他植物中使用。本文基于8个表达较稳定的小麦内参基因筛选偏穗鹅观草的同源内参基因也出现了相似的结果。因此,为获得准确的基因表达数据,在进行研究试验之前,筛选出试验条件下特异性的内参基因,控制和减少实验误差对获得准确的基因表达结果至关重要[19-20]。
目前,筛选内参基因常采用的软件有geNorm、NormFinder及BestKeeper,已用于马铃薯[21]、小麦[8]、大豆[22]等候选基因的稳定性评估,并确定了不同条件下的内参基因。本文通过geNorm及BesteKeeper软件对偏穗鹅观草不同器官及盐胁迫条件下进行内参基因的表达稳定性进行评估。geNorm软件分析原理是将RT-qPCR所得到的Ct值转为基因的相对表达量Q值,筛选出试验样品中任意数量的内参基因,通过该程序分析可以筛选出合适内参基因以及确定最适内参基因数目,而BestKeeper软件直接以Ct值作为分析数值,计算出标准偏差(SD)和变异系数(CV)来评价内参基因稳定性,CV和SD越小,说明该内参基因稳定性越好,其优势在于可比较多个样品中内参基因和目标基因的表达水平,2个软件最终都可以获得较为稳定的内参基因[23]。本研究结果显示,Actin1、Actin2、Actin3、HistoneH3在偏穗鹅观草中表达丰度较低,不适宜作为偏穗鹅观草的内参基因,EF1a1、GAPDH、Cyclophilin在偏穗鹅观草中表达丰度相对较高。在CK组中EF1a1、GAPDH、Cyclophilin在2个软件分析中稳定性较好,表达丰富高,优先考虑其作为偏穗鹅观草的候选内参基因;在盐处理组中Cyclophilin、GAPDH及EF1a1稳定性出现差异,该现象在凤丹、Citrus reticulata[24]的内参基因筛选中也有报道,可能与计算机内置统计学算法不同有关,但Cyclophilin比其他的稳定性较为理想;在干旱处理组中Cyclophilin、GAPDH稳定性较好;在高温处理组中,EF1a1、Cyclophilin稳定性较好。试验结果表明,根据不同的试验条件可以选择合适的内参基因,Cyclophilin基因为偏穗鹅观草最佳内参基因,试验结果为其他后续基因表达、功能及调控等相关研究供参考。
