大鼠90 天重复灌胃三乌胶丸毒性研究
2023-07-30张海江周利琴
张海江 周利琴
三乌胶丸是云南黑药代表,由生草乌、生川乌、何首乌、生白附子、附子(附片)、冰糖、乳香、鲜猪蹄共八味中药组成,具有祛寒除湿、祛风通络、活血止痛、强筋健骨之功效,被用于治疗风寒湿邪、风痰、淤血引起的风湿麻木、骨关节疼痛、陈伤劳损、中风偏瘫、口眼歪斜等疾病[1,2]。现代药理学研究也显示,三乌胶丸具有良好的抗炎、镇痛、抗免疫等作用[3]。然而,三乌胶丸因其成分复杂且含有包括乌头碱、次乌头碱、滇乌碱等多种乌头类毒性物质,使毒性难于控制[4~6]。三乌胶丸现行质量标准中也仅收载了何首乌和乳香薄层鉴别数据及何首乌乌头碱和挥发性碱性物质的含量测定,使现行质量标准不能保障三乌胶丸使用的安全性[7~9]。因此,为进一步探讨三乌胶丸重复给药有无毒性、脏器受累等情况,本试验以《药物非临床研究质量管理规范》[10]为依据,参照实验室前期急性毒性期实验结果,对SD 大鼠进行为期90d 的持续灌胃给药,判断三乌胶丸重复给药的毒性靶器官或靶组织;确定其无毒副反应水平(NOAEL),为制订该产品临床用药方案提供一般毒性评价的临床前实验资料。
1 材料与方法
1.1 供试品、对照品、主要试剂及仪器①三乌胶丸生产单位:云南金乌黑药制药有限公司,批号:200205,规格:5g/袋,含量:每粒含干浸膏0.05g(相当于生药0.151g)。②对照品纯水使用TCHRO/20C 型纯水仪自制。③毒麻精放类药品异氟烷生产单位:江苏恒丰强生物技术有限公司,批号:20190801,规格:100mL/瓶。④主要试剂:质控品包括全血质控品中值、质控血浆、质控血清3、尿分析阴阳性试纸;血液学检验试剂均来源于迈瑞南京生物技术有限公司;尿液检验试剂均来源于艾康生物技术有限公司;凝血检验试剂购自上海太阳生物技术有限公司;生化检验试剂盒主要购自迈克生物股份有限公司、日本和光纯药工业株式会社、南京普朗医用设备有限公司。⑤仪器:全自动血凝仪(日本希森美康株式会社,型号:CA-620);血液分析仪(日本希森美康株式会社,型号:XN-1000V[B1]);全自动生化分析仪(迈瑞南京生物技术有限公司,型号:BS800);尿液分析仪(桂林优利特医疗电子有限公司,型号:URIT180);称重仪器(PL1501-S 型电子天平)。
1.2 实验动物按云南金乌黑药制药有限公司研发中心(后文简称研发中心)标准操作程序(SOP)规定向湖南斯莱克景达实验动物有限公司进行实验动物SPF 级SD 大鼠订购,80 只SD 大鼠雌雄各半,体重176.8~223.5g,实验动物生产许可证号:SCXK(湘)2019-0004,实验动物质量合格证号:NO.1107272011001387。
1.3 剂量设置供试品的配制:称取三乌胶丸干浸膏粉所需量,加适量纯水配制成0.550g 干浸膏/mL(24.915g 生药/kg)设置为高剂量组、0.275g 干浸膏/mL(12.458g 生药/kg)设置为中剂量组、0.138g 干浸膏/mL(6.251g 生药/kg)设置为低剂量组,现用现配。配制体积根据每周大鼠体重变化进行调整。三乌胶丸临床剂量为每日服用生药量30.2g,按成人平均体重60kg 计算,为30.2÷60 ≈0.503g 生药/kg,按体表面积换算成大鼠等效剂量为30.2g 生药/日×0.018/0.2kg=2.718g 生药/kg。本试验参考《药物重复给药毒性试验技术指导原则》[11]和研发中心相关SOP 规定,综合药物临床使用剂量及前期试验结果进行剂量设置,三乌胶丸低、中、高剂量组分别为6.251g 生药/kg、12.458g 生药/kg、24.915g 生药/kg,分别约相当于成人临床使用剂量(按成人公斤体重计算)的12、25、50 倍,约相当于临床使用剂量(按体表面积计算)的2.3、4.6、9.2 倍。同时设空白对照组(纯水),4 组给药体积均为15mL/kg。
1.4 动物分组与识别分组当日选用检疫合格的SD 大鼠80 只,体重176.8~223.5g,雌雄各半,雌雄分笼饲养,每笼5 只,当某笼大鼠平均体重超过500g 时,如此笼大鼠为雄性,则将每组雄性大鼠分笼饲养,每笼2~3 只;如为雌性则将所有雌性大鼠分笼饲养,每笼2~3 只。2020 年5 月12 日称重后经计算发现2 只雄性大鼠平均体重分别为510.4g和507.0g,则对所有雄性大鼠分笼饲养,每笼2~3只。分组后,按研发中心SOP 规定采用标记系统进行2 次编号,笼号编通号,即第1 笼、第2 笼、第3笼、第4 笼,......,以此类推,分组时参考随机分组顺序号,先组间排组别顺序,再组内按顺序排笼号(即若每笼5 只大鼠,则第1 笼大鼠编号为1~5 号,第2笼为6~10 号,第3 笼为11~15 号,第4 笼为16~20号,......,以此类推;若每笼3 只大鼠,则第1 笼大鼠编号为1~3 号,第2 笼为4~6 号,第3 笼为7~9 号,第4 笼为10~12 号,......,以此类推)。分组后,将空白对照组笼卡设为白色、低剂量组设为蓝色、中剂量组设为黄色、高剂量组设为红色,后按15mL/kg体积灌胃给药,1 次/d,连续给药90d,停药后观察4 周。
1.5 指标检测及时间
1.5.1 一般物理检查
1.5.1.1 一般临床观察 ①对试验期大鼠进行一般笼旁症候观察,并及时记录,1 次/d。观察指标:大鼠外观、行为活动、呼吸、分泌物、排泄物、饮食情况、死亡情况(死亡时间、濒死前反应)等。如出现临床症状,增加观察次数,以详细观察大鼠中毒反应的症状、起始时间、严重程度、持续时间以及是否可逆。如发现大鼠死亡或濒死,按照研发中心相关SOP 规定及时对大鼠进行解剖观察并进行详细病理学检查。②体重、摄食量测定:每周称量1 次,如果试验期间大鼠体重变化明显,可增加称量次数,所用仪器为PL1501-S 型电子天平。
1.5.1.2 眼科检查 于给药第90 天及恢复期第4 周使用KJ8B 型直接检眼镜对大鼠进行眼科检查,包括外观、结膜、巩膜、角膜、前房、瞳孔、虹膜等部位。
1.5.1.3 大鼠行为学观察 于给药第90 天及恢复期第4 周使用GAS-2 型大小鼠步态分析处理系统对大鼠进行步态分析,包括支撑时长、足迹平均面积、足迹平均强度、推进时长、制动时长。
1.5.2 大鼠处理与生物样本采集
1.5.2.1 非计划死亡大鼠 所有非计划死亡的大鼠(包括濒死大鼠)均应进行大体解剖。濒死大鼠尽量采集血液做临床血液检查。非工作时间死亡的大鼠可将尸体于2℃~8℃保存,待次日进行大体解剖,本试验过程中无非计划死亡大鼠。
1.5.2.2 大体解剖 给药末期及恢复末期分别解剖大鼠40 只。大鼠解剖前一天下午开始禁食(不禁水)。按照中心相关SOP 规定进行麻醉,诱导麻醉时异氟烷气体浓度为1%~4%,维持麻醉时异氟烷气体浓度为0.25%~2%。大鼠采血后安乐死进行解剖,取各脏器组织和骨髓。①血液样本的采集:进行腹腔主动脉采血3 份,其中1.0~2.0mL 血液加入EDTA-K2 抗凝管进行血液学指标检测,1.6~2.0mL血液加入柠檬酸钠抗凝管进行凝血指标检测及3.0~5.0mL 血液加入普通管进行生化指标检测。②脏器组织采集:大鼠采血完毕后处死(腹腔主动脉放血),解剖,剖检,取材,后固定于10%中性福尔马林中。③骨髓样本采集:先解剖大鼠剥离出胸骨,将胸骨剪断,然后将其断面的骨髓挤在有稀释液(同种大鼠的血清)的玻片上,混匀涂片。
1.5.3 样本检查指标 血液学指标:①白细胞计数(WBC)、血红蛋白(HGB)、红细胞压积(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白量(MCH)、红细胞平均血红蛋白浓度(MCHC)、血小板计数(PLT)、白细胞分类[包括中性粒细胞(Neu)百分比、淋巴细胞(Lym)百分比、嗜酸性粒细胞(Eos)百分比、嗜碱性粒细胞(Bas)百分比、单核细胞(Mon)百分比]、网红细胞计数(RET)。②生化指标:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰基转移酶(GGT)、尿素氮(BUN)、肌酐(CRE)、总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、总胆红素(TBIL)、总胆固醇(CHO)、甘油三酯(TG)、肌酸磷酸激酶(CK)、钠(Na+)、钾(K+)、氯(Cl-)、钙(Ca2+)。③凝血指标:凝血酶原时间(PT)、纤维蛋白原(Fbg)、活化部分凝血活酶时间(APTT)。④尿液指标:颜色、性状、白细胞(LEU)、亚硝酸盐(NIT)、尿胆原(URO)、蛋白质(PRO)、pH 值、隐血(BLD)、尿比重(SG)、酮体(KET)、胆红素(BIL)、葡萄糖(GLU)。⑤骨髓检查:红细胞系统、粒细胞系统、淋巴细胞系统、单核细胞系统、其他细胞;粒系细胞系统总数与红细胞系统总数的比值;巨核细胞全片总数,必要时则应作全片巨核细胞计数,观察25 个巨核细胞并作分类。⑥脏器系数:脑、心、肝、脾、肾、肾上腺、胸腺。⑦组织病理学检查:检查大鼠体质、发育和营养状况等,肉眼观察脏器的位置、大小、色泽、有无粘连等,并检查脏器的质地、有无积液和肿瘤等;如大鼠某一组织发生与毒性相关的病理改变,需要对其他剂量组大鼠的相同组织进行组织病理学检查。试验期间,未出现影响研究可靠性和造成研究工作偏离试验方案的异常情况。
1.6 统计学方法采用 SPSS 20.0 统计软件对数据进行分析,体重、摄食量、血液学指标、凝血指标、生化指标及脏器系数等计量资料采用±s表示,系统解剖及组织病理学采用定性指标判断结果。两两比较采用独立样本t检验;多组间比较先进行方差齐和正态性比较,方差齐且符合正态分布时采用LSD-t或Dunnett-t检验,不符合正态分布时采用Non-parametrict检验,符合正态性但方差不齐时采用Dunnett's T3 或Tamhane's T2 检验。尿液检查为等级资料,采用秩和检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 笼旁观察大鼠经口灌胃给予三乌胶丸90d,停药恢复期4 周。笼旁观察结果显示,给药期及停药恢复期大鼠外观体征、行为活动、分泌物、粪便及一般状况未见异常。
2.2 体重三乌胶丸各剂量组大鼠体重分别与同期空白对照组比较,雌雄整体大鼠体重在给药期间及停药恢复期差异均无统计学意义(P>0.05);但雌性动物三乌胶丸中剂量组第6 周、第7 周体重高于空白对照组(P<0.05);高剂量组第3、4、6、7 周体重显著高于空白对照组(P<0.05)。见图1。
2.3 摄食量三乌胶丸各剂量组大鼠摄食量分别与同期空白对照组比较发现,雌雄整体大鼠摄食量在给药期间及停药恢复期差异均无统计学意义(P>0.05);然而,三乌胶丸高剂量组第3~11 周、第13 周摄食量明显低于空白对照组,差异有统计学意义(P<0.05)。见图2。
2.4 给药期步态分析给药期,雌雄整体大鼠三乌胶丸中剂量组左前足迹最大强度、左后足迹最大面积、右后足迹最大强度明显低于同期空白对照组(P<0.05);三乌胶丸高剂量组右后足迹平均面积、右后足迹最大强度、右后足迹平均强度、左后足迹最大面积、左后足迹最大强度明显低于同期空白对照组(P<0.05);雌性大鼠三乌胶丸中剂量组左前足迹最大强度、左前足迹最大面积、左后足迹最大面积、右后足迹平均强度明显低于同期空白对照组(P<0.01);雄性动物三乌胶丸中剂量组左前足迹最大面积、右后足迹平均强度明显低于同期空白对照组(P<0.05)。见图3。
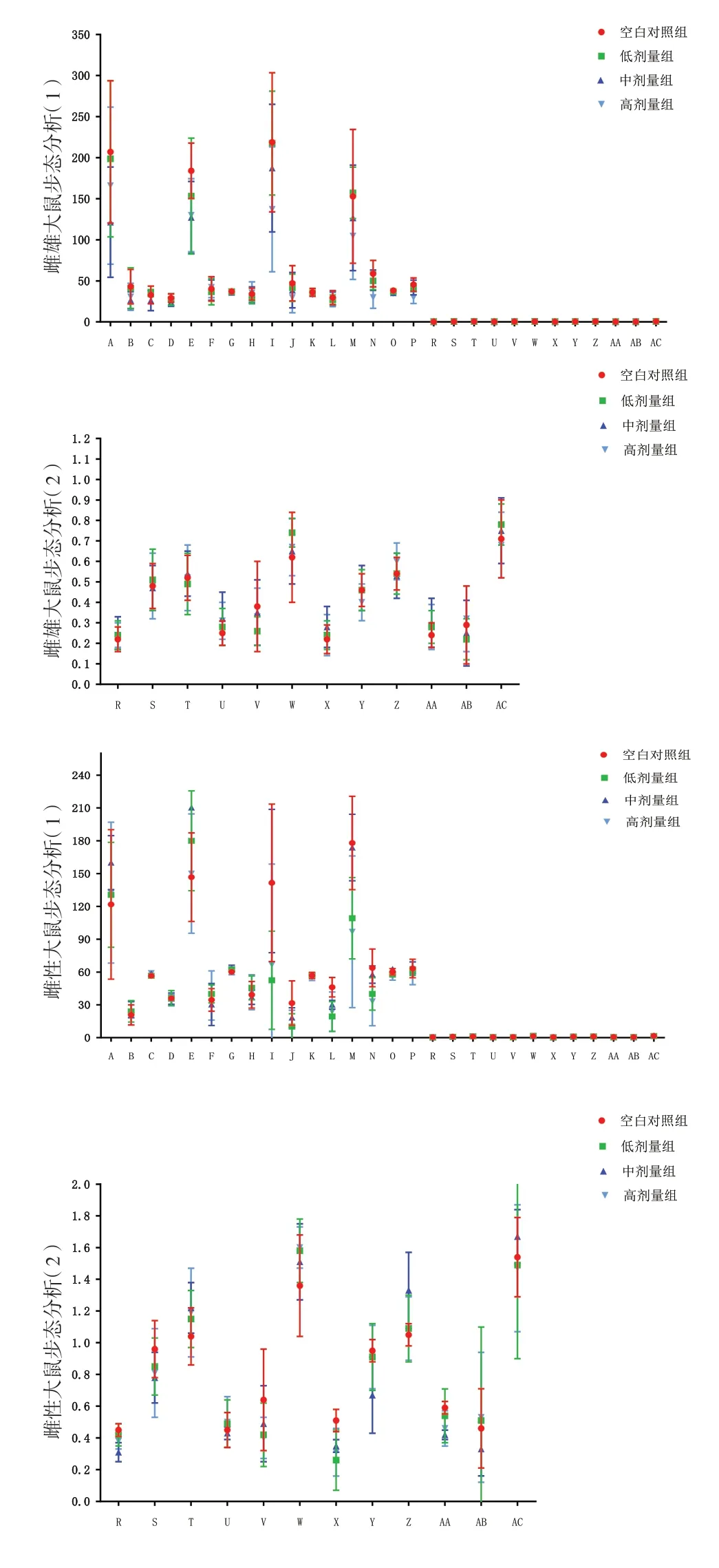
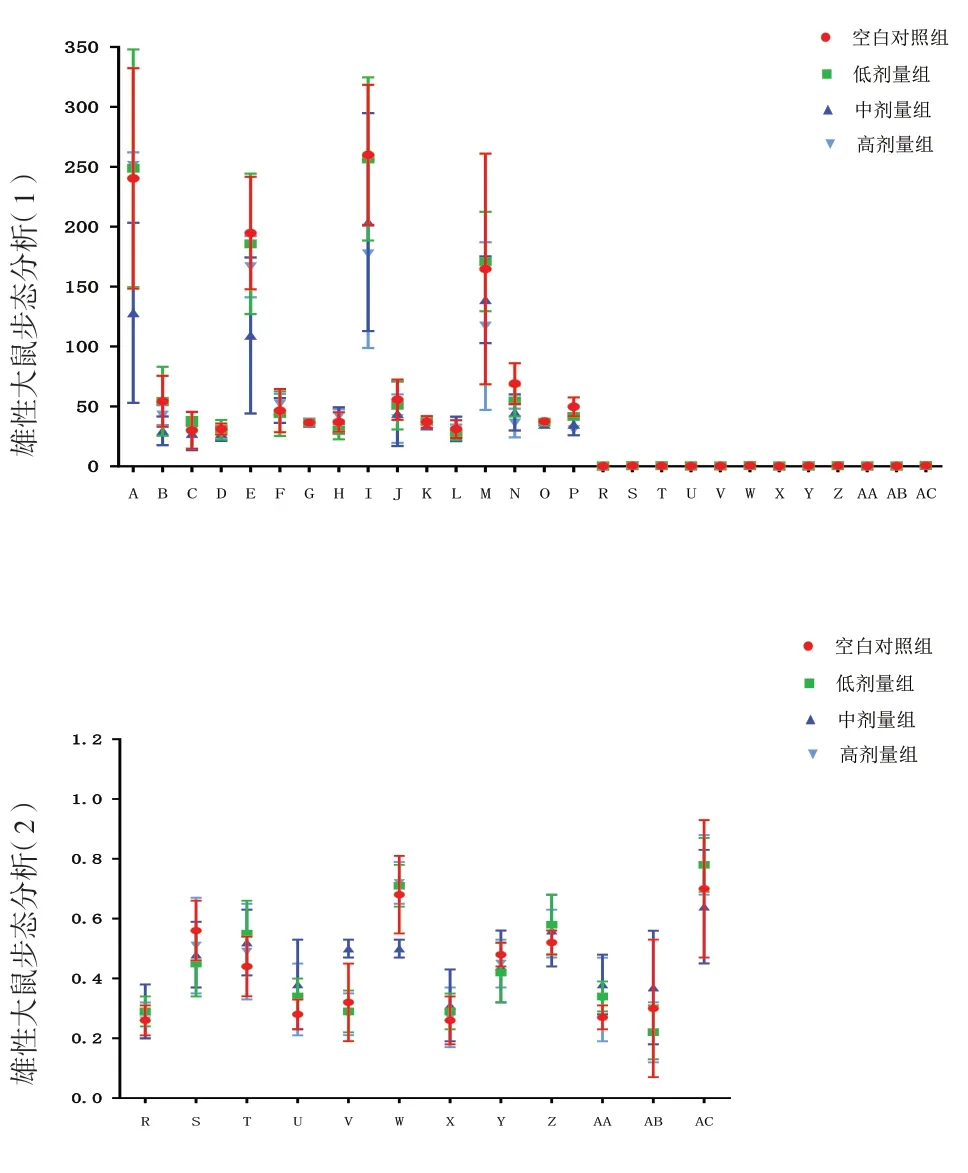
图3 三乌胶丸各剂量组与空白对照组给药期步态指标比较
2.5 血液学检查给药期,雌雄整体大鼠低剂量组MCHC 明显高于同期空白对照组(P<0.01);中、高剂量组HCT 低于同期空白对照组(P<0.05);高剂量组RBC 低于同期空白对照组(P<0.05),Mon 明显高于同期空白对照组(P<0.01)。恢复期,雌雄整体大鼠中剂量组Bas 明显高于同期空白对照组(P<0.01),但无明显剂量规律性特点。见表1。
表1 三乌胶丸对大鼠血液学指标的影响(±s)
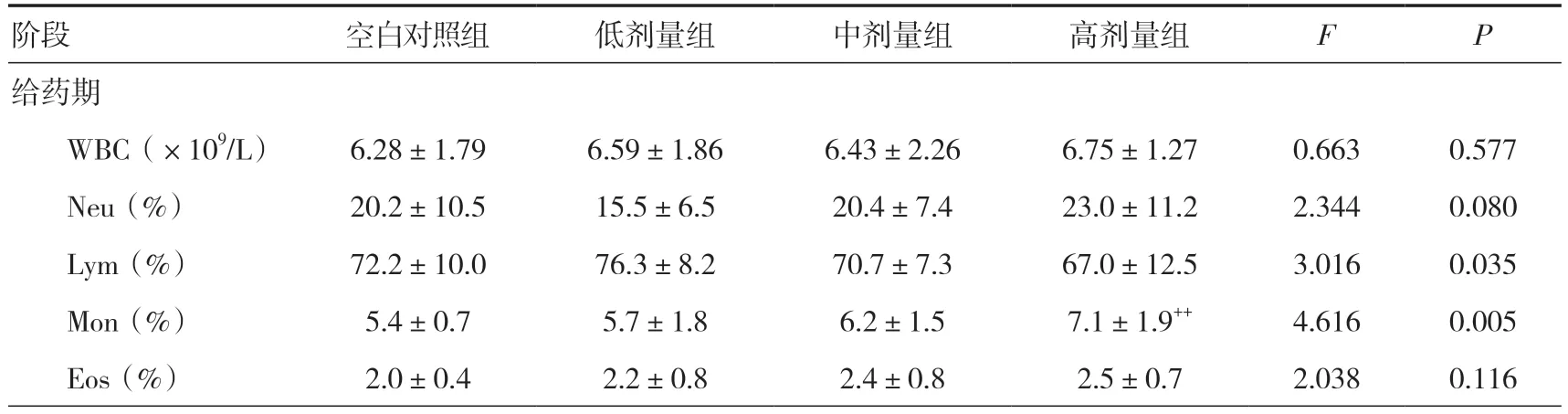
表1 三乌胶丸对大鼠血液学指标的影响(±s)
续表1
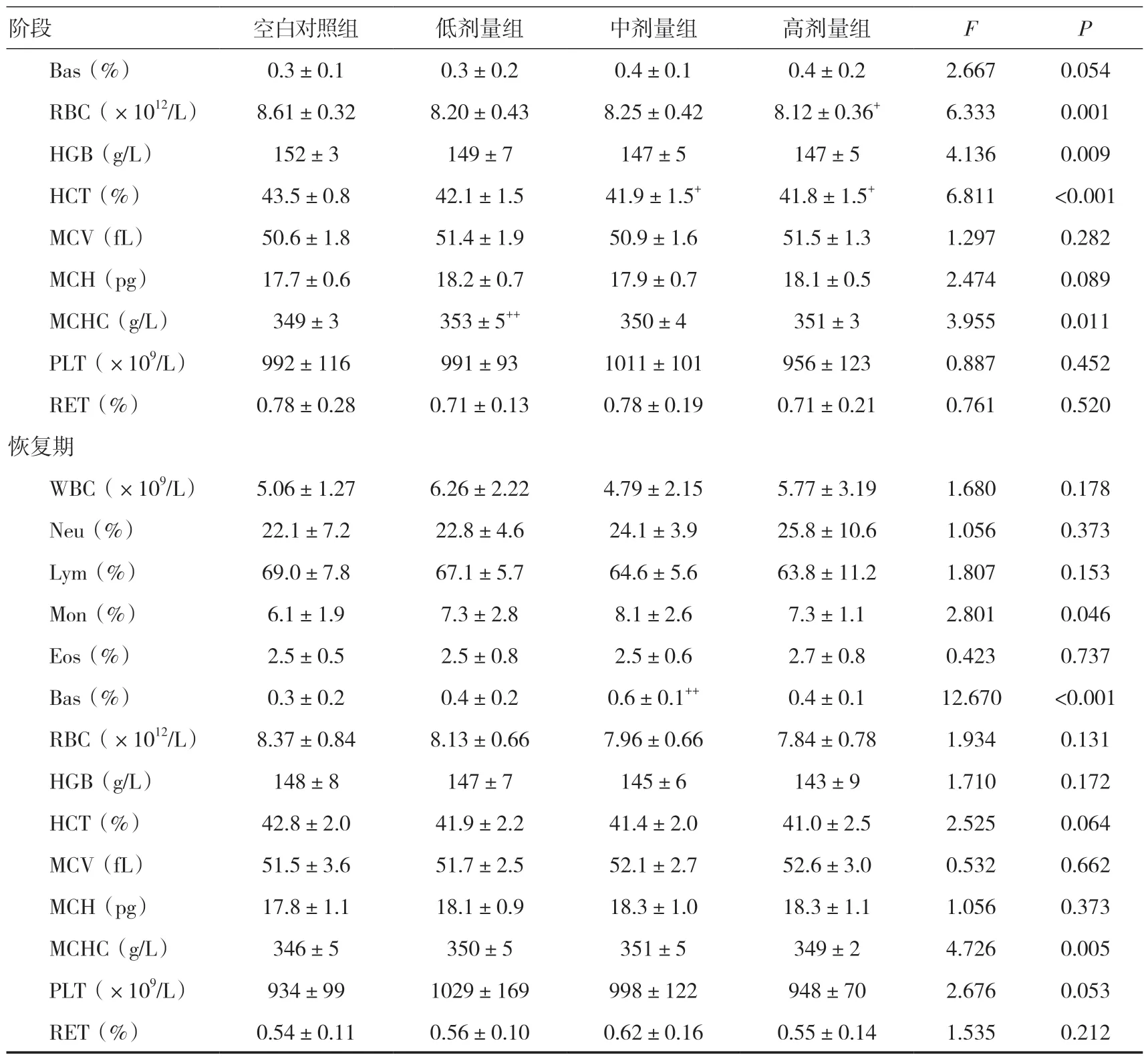
表1 三乌胶丸对大鼠血液学指标的影响(±s)
注:与空白对照组比较,+P<0.05,++P<0.01
2.6 血液生化指标检查给药期,雌雄整体大鼠高剂量组AST 低于同期空白对照组(P<0.05);恢复期,高剂量组BUN 高于同期空白对照组(P<0.05),中剂量组CK 高于同期空白对照组(P<0.05),但其变化范围在正常值范围内。见表2。
表2 三乌胶丸对大鼠血液生化指标的影响(±s)
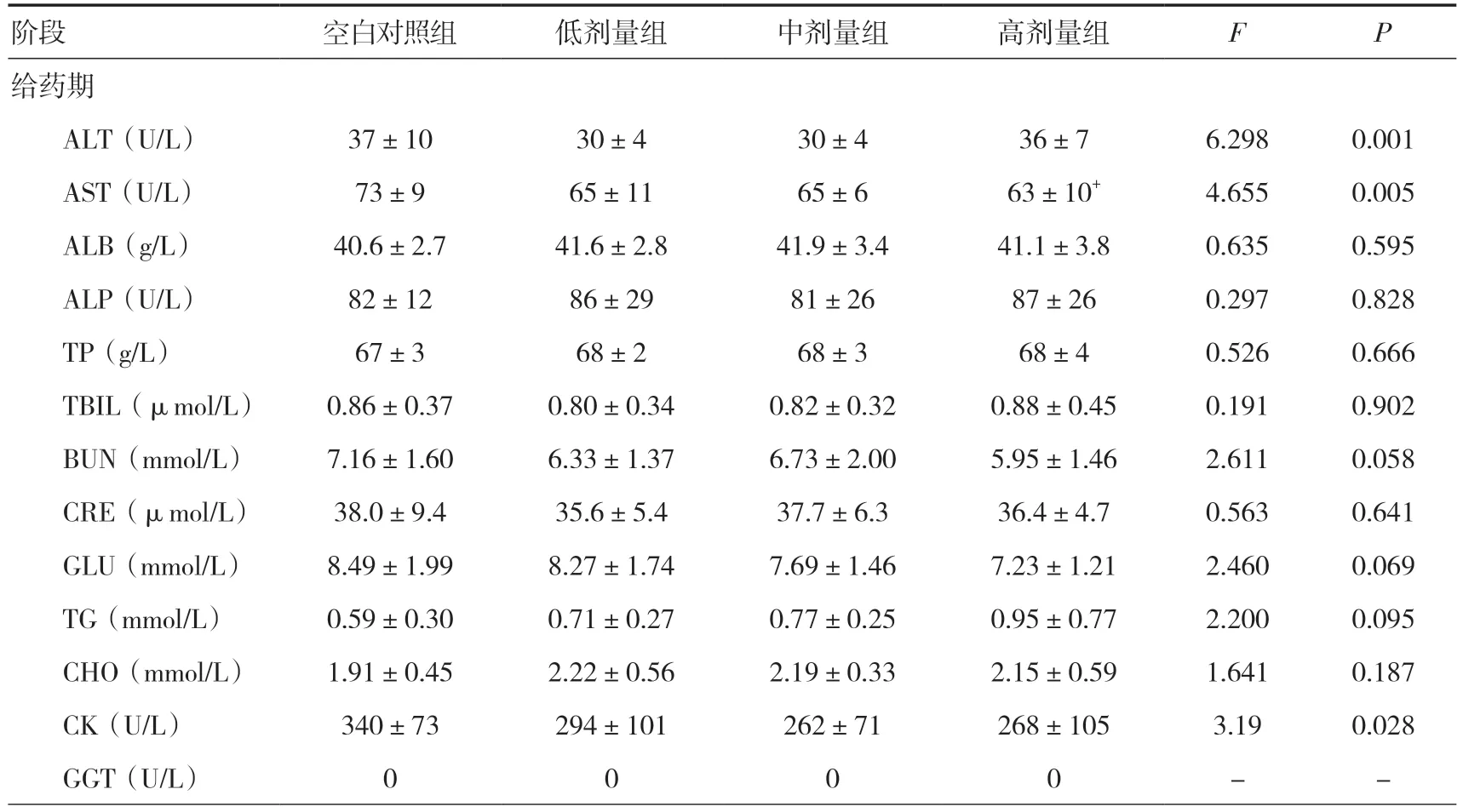
表2 三乌胶丸对大鼠血液生化指标的影响(±s)
续表2
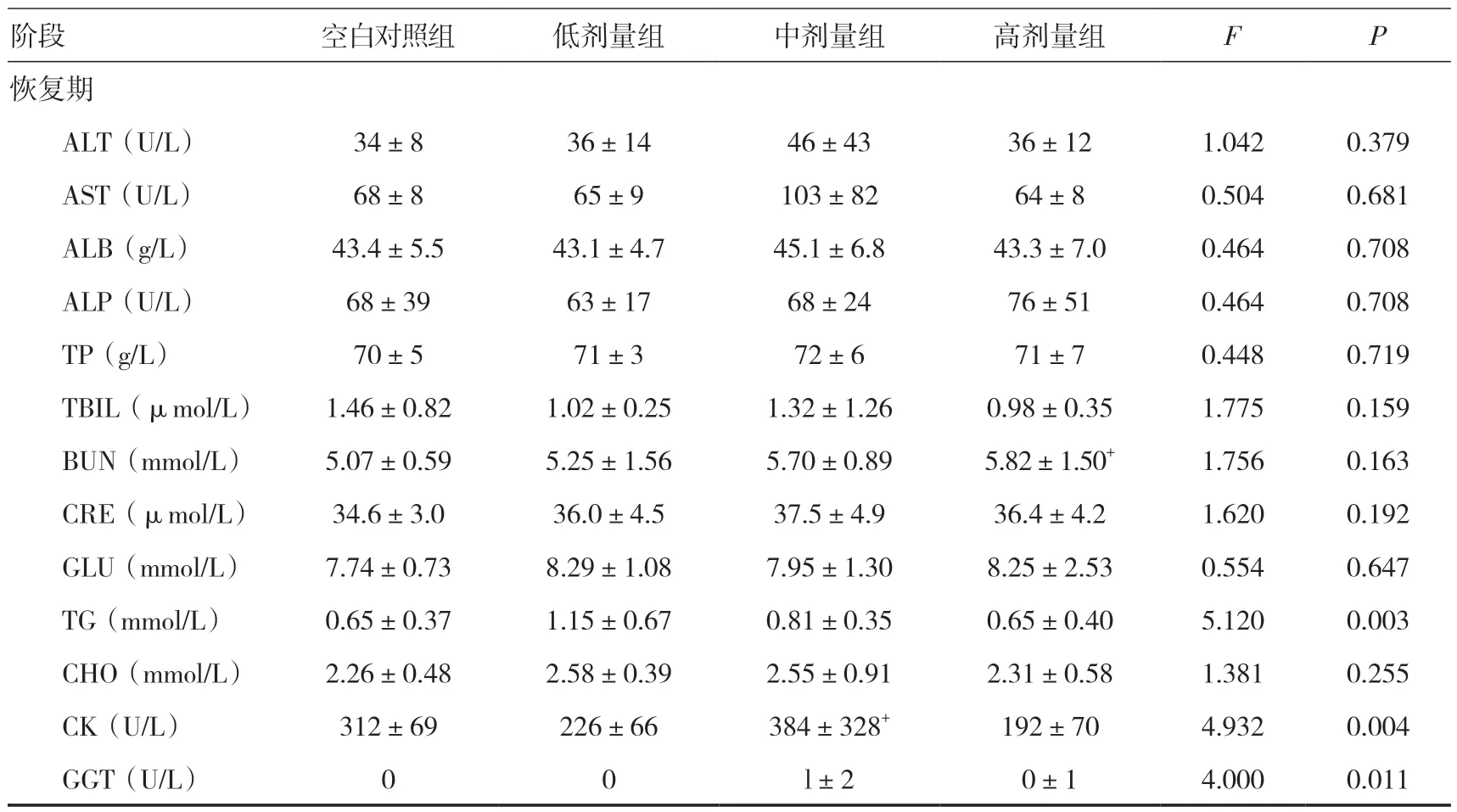
表2 三乌胶丸对大鼠血液生化指标的影响(±s)
注:与空白对照组比较,+P<0.05
2.7 血电解质检查给药期,雌雄整体大鼠高剂量组Ca2+高于同期空白对照组(P<0.05),但均在正常值范围内;恢复期,雌雄整体大鼠血电解质指标差异无统计学意义(P>0.05)。见表3。
表3 三乌胶丸对大鼠血电解质指标的影响(mmol/L,±s)
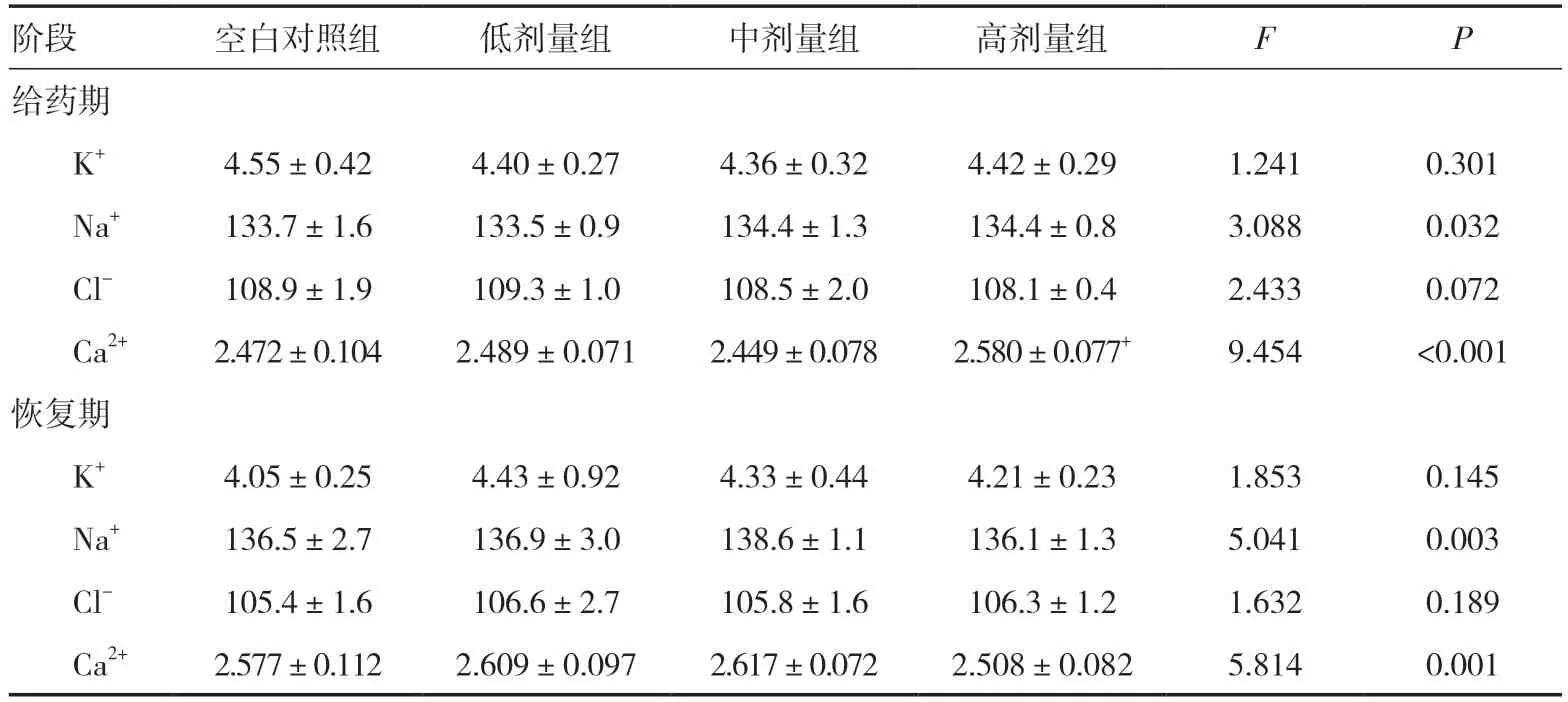
表3 三乌胶丸对大鼠血电解质指标的影响(mmol/L,±s)
注:与空白对照组比较,+P<0.05
2.8 凝血指标检查给药期,雌雄整体大鼠凝血指标与同期空白对照组比较,差异均无统计学意义(P>0.05)。恢复期,雌雄整体大鼠凝血指标与同期空白对照组比较,差异均无统计学意义(P>0.05)。见表4。
表4 三乌胶丸对大鼠凝血指标的影响(±s)
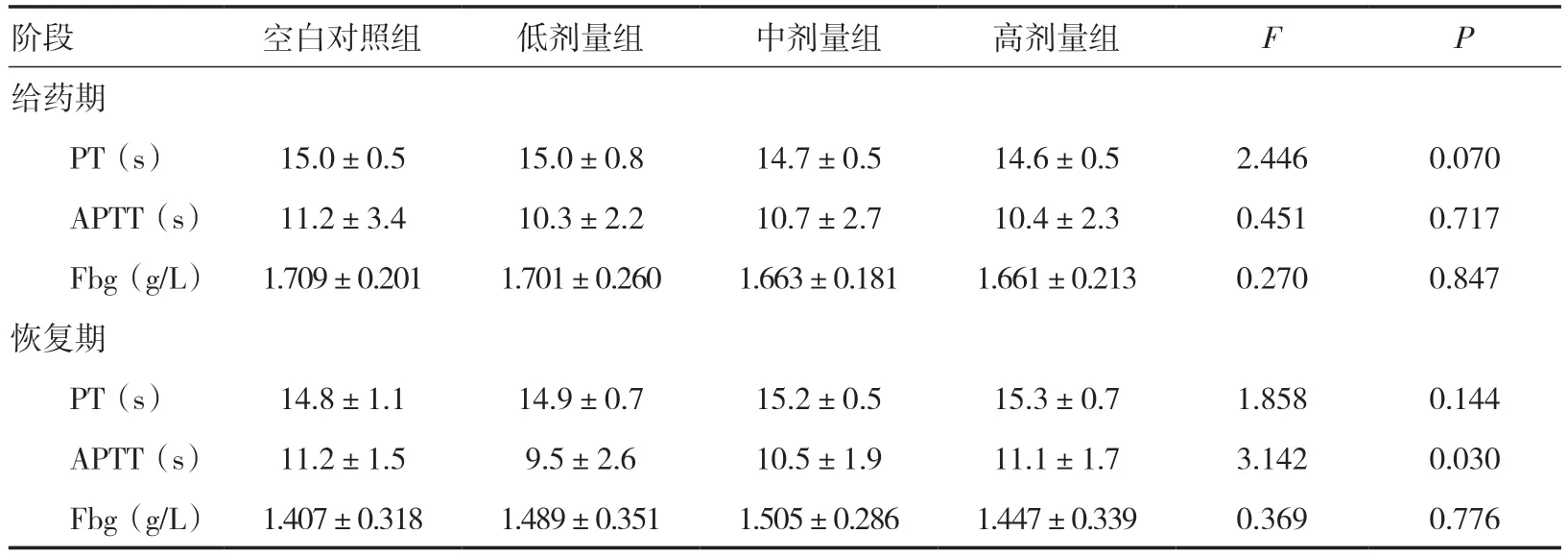
表4 三乌胶丸对大鼠凝血指标的影响(±s)
2.9 骨髓及眼科检查外周血象检查未见与药物毒性有关的异常,故骨髓涂片未进行显微镜下观察;三乌胶丸各剂量组及空白对照组眼科检查均未见明显异常。
2.10 尿液指标检测给药期,雌雄整体大鼠中、高剂量组pH 值低于同期空白对照组(P<0.05),高剂量组SG 明显高于同期空白对照组(P<0.01);高剂量组NIT、PRO、BLD、BIL 阴性只数少于同期空白对照组,但差异无统计学意义(P>0.05)。恢复期,雌雄整体大鼠高剂量组pH 值明显低于同期空白对照组(P<0.01),SG 明显高于同期空白对照组(P<0.01);高剂量组PRO、KET 阴性只数少于同期空白对照组,但差异均无统计学意义(P>0.05)。给药期与恢复期4 组大鼠尿液均呈淡黄色,清亮。见表5、6。
表5 三乌胶丸对大鼠尿液pH 值与SG 的影响(±s)
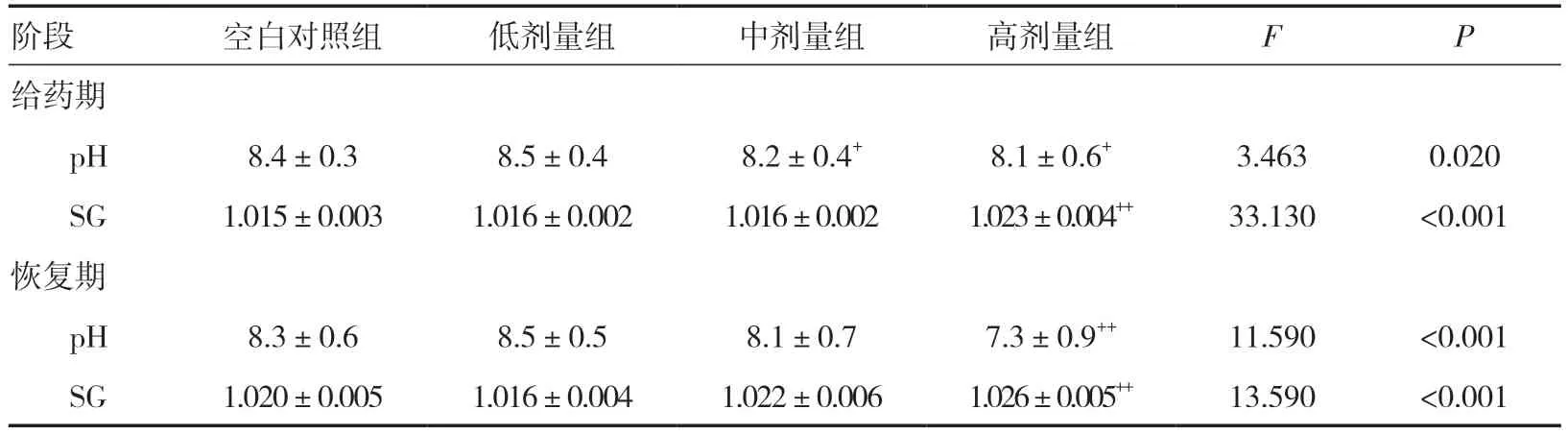
表5 三乌胶丸对大鼠尿液pH 值与SG 的影响(±s)
注:与空白对照组比较,+P<0.05,++P<0.01
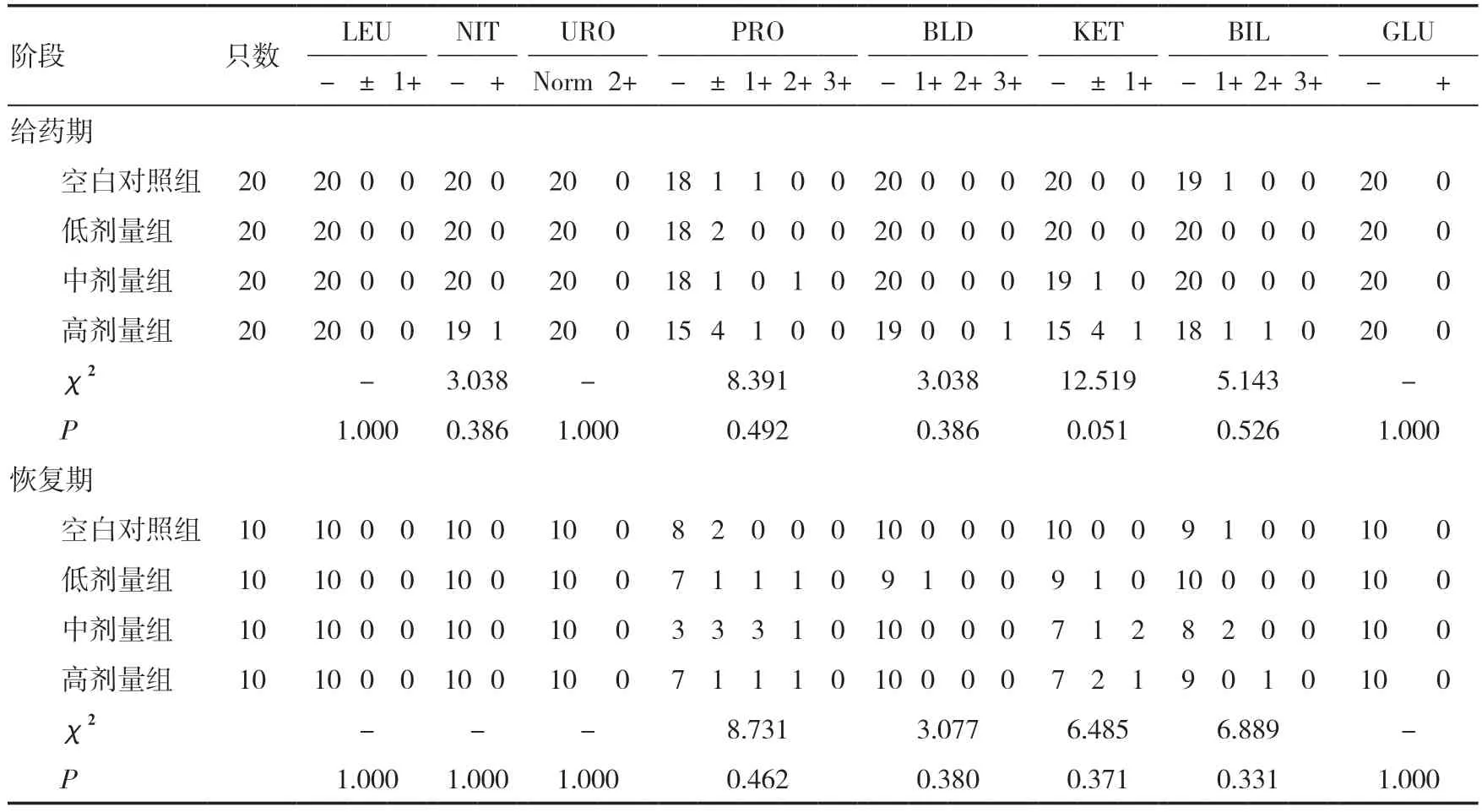
表6 三乌胶丸对大鼠尿常规指标的影响(n)
2.11 脏器系数给药期,各组大鼠脏器系数与同期空白对照组比较,差异均无统计学意义(P>0.05)。见表7。
表7 三乌胶丸对大鼠脏器系数的影响(g/100g,±s)

表7 三乌胶丸对大鼠脏器系数的影响(g/100g,±s)
续表7
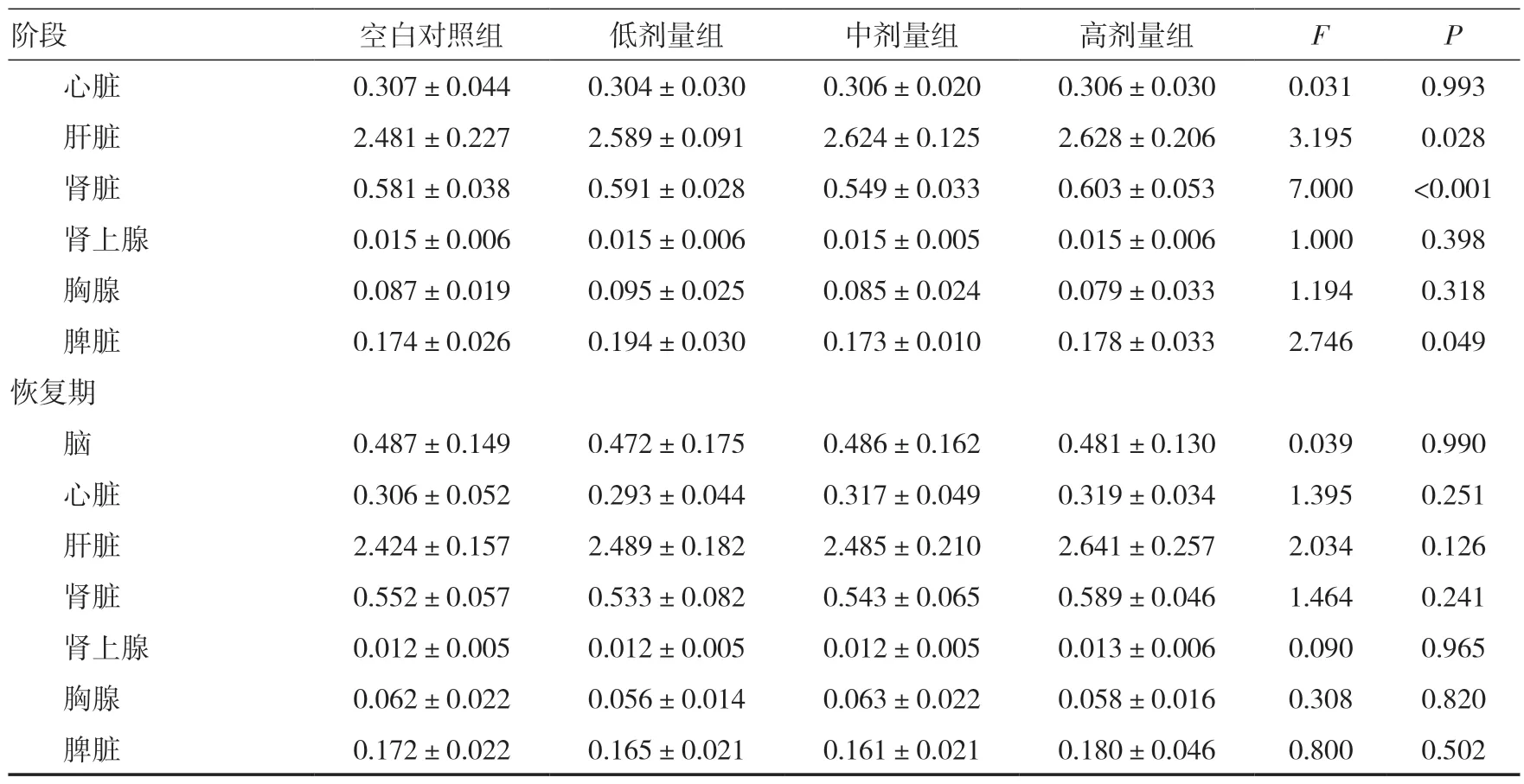
表7 三乌胶丸对大鼠脏器系数的影响(g/100g,±s)
2.12 组织病理学检查本次试验未见动物中途死亡,也未见其他异常。试验各阶段主要背景性病理改变发生情况,见表8。
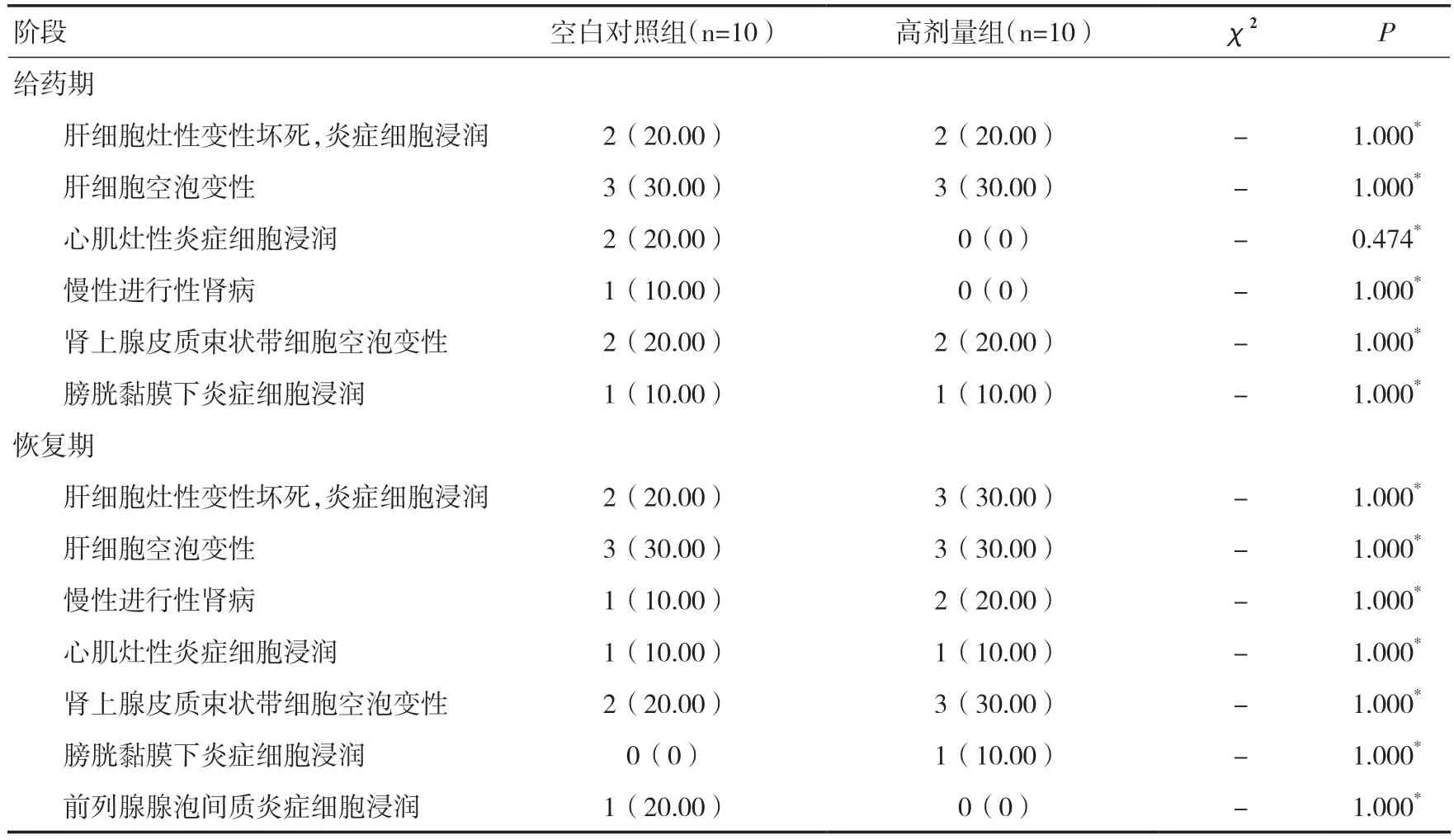
表8 试验各阶段主要背景性病理改变发生情况[n(%)]
3 讨论
三乌胶丸组方遵循“君、臣、佐、使”配伍原则,由生草乌、生川乌、何首乌、生白附子、附子(附片)、冰糖、乳香、鲜猪蹄组成,有活血祛瘀、通经活络、健骨止痛之效[12]。三乌胶丸能有效医治风湿性关节炎及中风偏瘫各症[13,14]。然而,现行质量标准未全面反映三乌胶丸的物质基础,难以保证其使用安全性。为此,本研究在《药物非临床研究质量管理规范》条件下,以SD 大鼠为实验对象,持续90d 重复灌胃三乌胶丸,观察SD 大鼠可能出现的毒性反应及靶器官或靶组织,为三乌胶丸的毒性评价提供参考。
本实验选用SPF 级SD 大鼠作为实验对象,将三乌胶丸按照6.251g 生 药/kg、12.458g 生 药/kg、24.915g 生药/kg 的剂量对大鼠进行重复灌胃给药90d,并设停药恢复期4 周。实验期间,三乌胶丸对大鼠体重、血液学指标、血液生化指标、血电解质指标有轻微影响,但无明显时间、剂量等规律特点,也无毒理学意义;高剂量三乌胶丸对大鼠摄食有一定影响,可能与长期给予大剂量和高浓度的药物有关,但上述变化未引起进一步的机体异常(如体重、精神及营养状态等),故认为上述变化无明显毒理学意义。此外,眼科检查和组织病理学检查均未见与三乌胶丸相关的异常改变。
三乌胶丸能引起大鼠步态变化,本研究观察到三乌胶丸中、高剂量能引起步态足趾支撑强度、面积等的变化。大鼠步态是通过四肢的交互动作移动机体的行为特征,有赖于中枢神经系统、周围神经系统以及肌肉骨骼系统的协调工作[15]。神经传导及神经-肌肉接头传导等的异常、四肢关节改变以及肢体协调性改变等均可能引起步态异常,可表现为足趾压强、足迹面积、足趾支撑时长等改变[16]。三乌胶丸处方中含有生川乌、生草乌、附子等中药,所含的乌头碱等可引起神经-肌肉接头的传导发生异常,引起大鼠肢体及面部神经麻木等不良反应,进而间接引起大鼠的步态改变[17,18]。
本实验还观察到三乌胶丸各剂量组在给药期间尿常规指标可见剂量相关性的异常变化,主要表现为尿SG 随药物剂量升高而略有升高,pH 则不同程度下降,表明三乌胶丸对尿常规指标的影响与给药剂量有关,但在恢复期,影响程度降低,尿常规异常的频率降低,提示上述尿液指标异常可能为大鼠的适应性变化有关[19],其异常变化的毒理学意义需结合肾脏功能和肾脏病理进行综合性分析。然而,本研究未见与三乌胶丸相关的肾功能和肾脏组织病理异常改变,提示三乌胶丸暂未发现可引起肾脏的功能和组织的异常变化。故尿常规异常不考虑有毒理学意义,但临床研究时仍需监测受试者肾功能和尿常规,以保护其用药安全。
本研究未见与三乌胶丸相关的肝和肝脏组织病理异常改变,提示三乌胶丸暂未发现可引起肝脏的功能和组织的异常变化,因此不考虑有肝脏毒理学意义,但临床研究时仍需监测肝脏功能以提高受试者的用药安全性。
综上所述,在本试验条件下,SD 大鼠经口灌胃给予三乌胶丸90d,对大鼠一般状况、体重、血液学和凝血、血液生化和电解质、脏器等均无明显影响,但高剂量能引起大鼠的步态改变,提示临床长期应用时需重点关注感觉神经反应的变化。据此,推断三乌胶丸的NOAEL 应为12.458g 生药/kg,分别约相当于成人临床使用剂量的25 倍(按成人公斤体重计算)和4.6 倍(按体表面积计算)。
