γ-聚谷氨酸对大豆分离蛋白凝胶特性的影响
2023-07-28仵军红谢新华朱盈蕊朱鸿帅
仵军红, 齐 蕾, 谢新华, 李 琴, 朱盈蕊, 朱鸿帅
(郑州市食品药品检验所1,郑州 450006)
(河南农业大学食品科学技术学院2,郑州 450002)
大豆分离蛋白具有凝胶、增稠等功能特性,但在食品工业中,单一蛋白凝胶强度往往较弱,在性质上并不能充分满足食品加工的需要。有研究利用大豆分离蛋白与大豆可溶膳食纤维结合,采用TG酶和钙盐交联形成稳定的蛋白凝胶[1];Molina Ortiz等[2]研究发现κ-卡拉胶可在较低蛋白浓度下加强蛋白分子之间的相互作用,促进蛋白凝胶的形成,提高凝胶强度,且在低离子浓度条件下,形成了新型的凝胶网络结构。γ-聚谷氨酸(r-PGA)具有优良的水溶性及持水性能,也具有增稠及稳定作用,对无机盐及糖类的活性均有一定固定作用,γ-PGA溶于水后会形成具有一定弹性的凝胶[3];Marjan等[4]研究发现利用γ-PGA带有阴离子与壳聚糖带有的阳离子结合,并添加葡萄糖、蔗糖、山梨醇和甘油作为稳定剂形成稳定凝胶;有学者采用γ-PGA和TGase复合使用可显著提高鸡肉肌原纤维蛋白凝胶的凝胶硬度、弹性和保水性[5];大豆分离蛋白和γ-聚谷氨酸为主要原料,通过乙二醇二缩水甘油醚交联的方法制备了一种大豆分离蛋白和γ-聚谷氨酸复合止血膜[6]。为了解γ-PGA与大豆分离蛋白形成凝胶的特性,在中性条件下构建γ-PGA-SPI复合凝胶体系,对不同复合比例下蛋白凝胶微观结构、持水性、质构特性以及流变特性进行分析,为γ-PGA-SPI复合凝胶在食品中的应用提供参考。
1 材料和方法
1.1 实验材料
大豆分离蛋白(蛋白质质量分数为90%)、γ-聚谷氨酸(相对分子质量为70万)。
1.2 仪器与设备
5430R高速冷冻离心机,A1激光共聚焦显微镜,TA-XY2i质构仪,DHR-2旋转流变仪。
1.3 实验方法
1.3.1 γ-PGA-SPI-复合溶液的制备
分别称取SPI和γ-PGA溶于蒸馏水中,在室温下搅拌3 h,调节所有复合溶液的pH至7。选取的实验条件为蛋白质量浓度为10、12 g/100 mL,复合比r=20、10、5。
1.3.2 γ-PGA-SPI复合凝胶的制备
参考文献[7]中的方法并进行适当修改,将制得的溶液在90 ℃水浴条件下加热1 h,使SPI充分变性,将加热后的复合溶液迅速冷却至室温放置1 h,置于4 ℃冰箱中冷藏24 h后进行指标测定。
1.3.3 γ-PGA-SPI复合凝胶的微观结构测定
加入 30 μL 质量浓度为0.2 g/100 mL 的罗丹明 B 荧光染料于 1 mL 的复合溶液中以标记蛋白质,并使用漩涡振荡器将样品充分混匀。取 80 μL 混合后的样品于单凹载玻片中,使用1.3.2 中的处理方式加热载玻片形成凝胶,采用 4倍物镜进行观察[8]。
1.3.4 γ-PGA-SPI-复合凝胶的持水性测定
称取一定质量的γ-PGA-SPI复合凝胶样品于离心管中,以3 000 r/min的速度离心30 min,倒去上清液,并用滤纸将水分吸干,再次对离心管称质量。将未添加γ-PGA的样品作为对照组,所有样品进行3次重复测定,通过公式计算凝胶的持水性[9]。
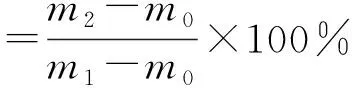
式中:m0为空离心管的质量/g;m1为离心前离心管的质量/g;m2为除去上清液后离心管的质量/g。
1.3.5 γ-PGA-SPI复合凝胶的流变特性测定
称取一定质量的凝胶样品,测定凝胶储能模量(G′)和损耗模量(G″),选用40 mm的平行板,具体参数设置如下:通过在1 Hz的固定频率下在0.01%0.01~100.00%的范围内进行应变扫描,选定恒定应变幅度为0.5%,间隙1 000 μm,频率为0.1~100.0 Hz,记录γ-PGA-SPI复合凝胶的黏弹性随频率的变化[10]。
1.3.6 γ-PGA-SPI复合凝胶的质构特性测定
将样品于室温下平衡1 h,采用TPA对复合凝胶的质构特性进行测定[11]。
1.3.7 数据分析
使用SPSS16.0对所得数据进行统计分析,用Origin2018进行绘图。
2 结果与分析
2.1 复合比对γ-PGA-SPI复合凝胶微观结构的影响
由图1可知,对照组的蛋白(图1中灰色部分是蛋白相,黑色部分是非蛋白相)凝胶球状空隙较大且分布不均匀,具有蛋白连续型的微观结构,质量分数为12%的蛋白凝胶与质量分数为10%的蛋白凝胶相比,球状空隙较小,可以较好地结合水分。当SPI与γ-PGA复合比例为20时,2组浓度下的蛋白凝胶与对照组相比球状空隙均更为均一,随着γ-PGA添加比例持续增大至复合比为10时,凝胶具有较多数量尺寸较小且大小均一的球状空隙,而当复合比为5时,复合凝胶具有明显的颗粒状和粗线状的微观结构,这种结构较为粗糙,具有明显的不规则空隙[12]。其原因可能是在pH 7的条件下,SPI与γ-PGA带有相同的负电荷,体系中静电斥力增大了SPI分子间的距离,使SPI分子间的作用力减弱,在加热过程中γ-PGA中的多肽链随机断裂,暴露出谷氨酸残基与蛋白质分子发生较大程度的交联,形成紧密的凝胶网络结构[13];但当γ-PGA添加过多时,二者之间的过度交联也会减弱凝胶的网络结构,使凝胶结构逐渐粗化[14]。
2.2 复合比对γ-PGA-SPI复合凝胶持水性的影响
由图2可知,质量分数为12%的蛋白凝胶与质量分数为10%的蛋白凝胶相比具有更好的持水性,且复合凝胶在r=10时持水性达到最大,而当复合比,减小到5时,凝胶的持水性能下降,这是因为凝胶的持水性能与其微观结构相关,且凝胶中较高的蛋白含量可对水分子有更强的束缚作用[15]。SPI凝胶中球状空隙较大且分布不均匀,清液易因外力而流出,添加较低浓度的γ-PGA可改善蛋白凝胶的这种微观结构,形成众多数量大小均一的球状空隙,这使得大量水分子被包裹在空隙中,提高了凝胶的持水性能;而当γ-PGA添加量持续增大至复合比为5时,复合凝胶的结构进一步粗化,形成了具有不规则空隙的粗糙结构,且γ-PGA中的羧基会与SPI分子中的亲水性基团竞争性吸水,使蛋白分子结合水分子的能力减弱[16]。
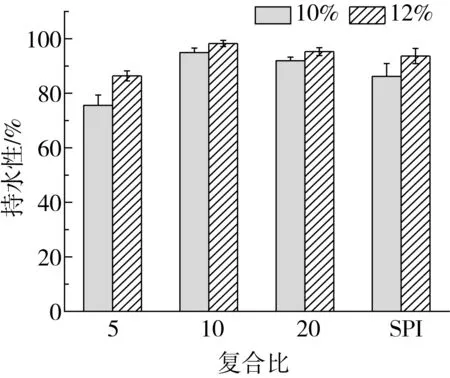
图2 复合比对γ-PGA-SPI复合凝胶持水性的影响
2.3 复合比对γ-PGA-SPI复合凝胶流变学特性的影响
由图3可知,所有样品的G′和G″均随频率的增加而增大,且G′和G″彼此平行,G′始终比G″大,表明样品具有典型的弱凝胶结构[16]。质量分数为12%的蛋白凝胶具有更大的G′和G″且复合比为10的复合凝胶其黏弹性模量达到最大,γ-PGA的进一步增加会降低其G′和G″。其原因可能是高蛋白浓度下
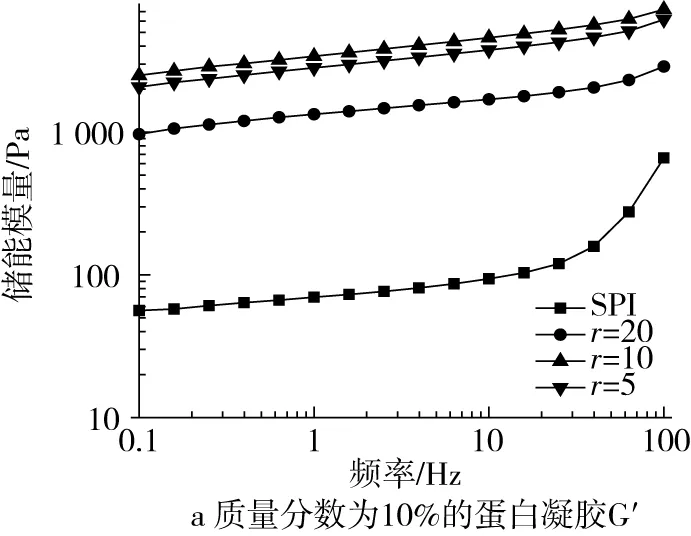
图3 复合比对γ-PGA-SPI复合凝胶频率扫描的影响
凝胶网络结构更强,低浓度γ-PGA的添加对凝胶网络结构的形成具有协同作用,但较高浓度的γ-PGA不利于凝胶网络结构的形成[19]。
2.4 复合比对γ-PGA-SPI复合凝胶质构特性的影响
由表1可知,质量分数为12%的蛋白凝胶与质量分数为10%的蛋白凝胶相比具有更大的硬度值,且在这2组蛋白浓度下,SPI与γ-PGA复合比为10的复合凝胶均具有最大的硬度值,随着γ-PGA的持续增加复合凝胶硬度值反而降低。这可能是因为质量分数为12%的蛋白凝胶中有较多的蛋白分子参与凝胶这一过程,使得凝胶体系强度较大,当少量的γ-PGA添加到SPI中,γ-PGA与蛋白分子的交联有助于增强凝胶的网络结构,而较高浓度的γ-PGA会与蛋白分子过度交联破坏凝胶网络结构,使凝胶强度降低[17,18]。凝胶的弹性、内聚性和胶黏性变化趋势与其硬度数值相似,可见,在较高浓度蛋白和较低浓度γ-PGA的共同参与下,复合凝胶质构性质较好。
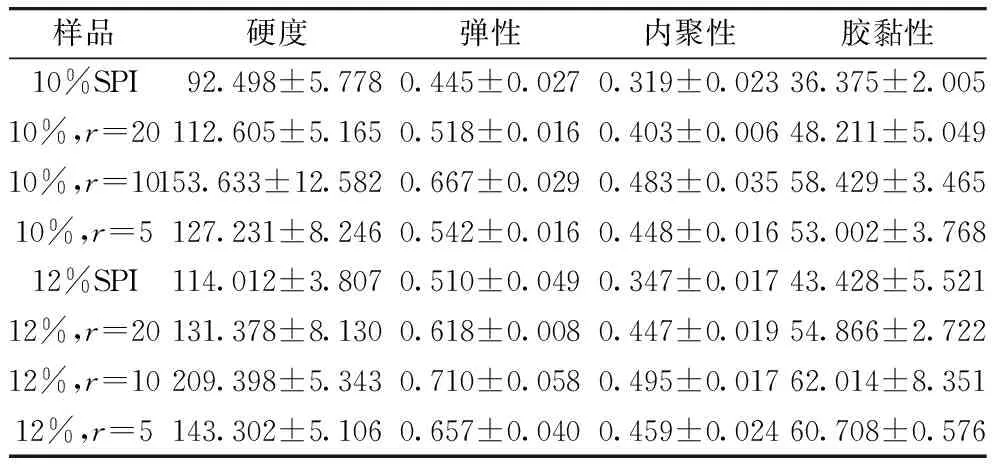
表1 复合比对γ-PGA-SPI复合凝胶质构特性的影响
3 结论
研究结果表明,在质量分数为12%的蛋白浓度下有更多的蛋白分子参与凝胶网络结构的形成,凝胶结构更为致密,持水性较好,黏弹性较好。在复合凝胶体系中,当SPI与γ-PGA复合比为10时,形成的凝胶内部有数量众多、尺寸较小的球状空隙,凝胶微观结构越致密均一,其持水性能越强,质构特性和流变学特性也相应提升。γ-PGA与大豆分离蛋白复合形成凝胶体系,可提高大豆分离蛋白凝胶的强度和持水性,为γ-PGA与大豆分离蛋白形成复合凝胶在食品中应用提供参考。
