羟基脲联合辐射对沉默ATRX 后细胞周期及凋亡的影响
2023-07-18田宏远尹彩云胡沛芸张晨阳李秋月郑清照齐亚莉王志成
田宏远, 尹彩云, 王 丽, 胡沛芸, 张晨阳, 李秋月, 郑清照, 齐亚莉, 方 芳, 王志成
(1.吉林大学公共卫生学院 国家卫健委放射生物学重点实验室,吉林 长春 130021;2.吉林医药学院公共卫生学院流行病学教研室,吉林 吉林 132013)
羟基脲(hydroxyurea,HU)是一种结构简单的化学合成物,对核糖核苷酸还原酶(ribonucleotide reductase,RNR)起抑制作用[1]。RNR 参与DNA 复制和修复的重要环节,核糖核苷酸在RNR 作用下脱氧被还原为DNA 合成过程中所需要的原料[2]。研究[3]发现:HU 诱导骨肉瘤U2OS 细胞凋亡。HU 上调凋亡相关基因和蛋白表达诱发细胞的氧化应激,并在小鼠卵母细胞成熟期间导致细胞凋亡[4]。研究[5-7]报道:α-地中海贫血/精神发育迟滞综合征 X 染色体相关蛋白(α-thalassemia/mental retardation syndrome nondeletion type X-chromosome associated protein,ATRX)是重要的DNA 损伤修复和染色质重塑蛋白。本课题组前期研究[8]结果显示:沉默ATRX可以增强辐射诱导HeLa 细胞的凋亡,可以作为肿瘤辐射增敏的潜在靶点。因此,本研究探讨HU 预处理联合辐射对沉默ATRX 细胞周期及凋亡的影响,并分析相关分子机制,为肿瘤放疗增敏提供新的分子靶点和思路。
1 材料与方法
1.1 细胞、主要试剂和仪器靶向沉默ATRX 的慢病毒由吉林大学国家卫健委放射生物学重点实验室包装和保存,A549 细胞和HEK293T 细胞(上海生命科学学院细胞研究所)。Annexin Ⅴ-PE/7-ADD 凋亡试剂盒(美国BD 公司),ATRX 一抗和ECL 发光试剂盒(美国Santa Cruz 公司),GAPDH、细胞周期分裂因子25B (cell division cyclin 25B,CDC25B)、细胞周期蛋白(Cyclin)B1和细胞周期蛋白依赖性激酶1 (cyclin dependent kinase 1,CDK1)一抗(美国CST 公司),DMEM培养基(美国Gibco 公司),胎牛血清(江苏MRC公司),HU(美国Sigma 公司),其他试剂为国产分析纯。流式细胞仪(美国BD FACS Aria 公司),X 射线辐照仪(X-RAD320iX,美国Precision X-ray股份有限公司)。
1.2 沉默ATRX 细胞模型的制备本课题组[7]前期构建了靶向沉默ATRX 的shRNA 载体,采用HEK293T 细胞包装靶向沉默ATRX 慢病毒,并感染A549 细胞,嘌呤霉素筛选构建稳定沉默ATRX的细胞模型shATRX-A549,荧光显微镜下观察细胞感染情况,采用Western blotting 法检测沉默ATRX 细胞中ATRX 蛋白表达量验证细胞模型,以shNC-A549 细胞作为阴性对照。
1.3 实验分组和处理实验分为对照组、HU 组、辐射组(给予8 Gy X 射线辐射)和HU+辐射组(给予HU+8 Gy X射线辐射)。细胞经0.1 mmol·L-1HU 处理24 h 后给予8 Gy X 射线辐射,剂量率1.02 Gy·min-1,电压180 kV,电流12.0 mA。
1.4 流式细胞术检测各组不同细胞周期A549 细胞百分率和细胞凋亡率将shNC-A549 和shATRXA549 细胞按照每孔2×105个的密度接种于6 孔细胞培养板,待细胞达80%~90%融合,HU 处理细胞24 h 后,8 Gy X 射线辐射,24 h 后加入300 μL无EDTA 的胰酶消化,PBS 缓冲液洗涤1 次后,重悬细胞,加入500 μL 预冷的75%冰乙醇,4 ℃冰箱内固定 2 h,PBS 缓冲液洗涤1 次,重悬细胞,过滤。每管加入终浓度 50 mg·L-1PI 30 μL 和10%Triton X-100 2 μL 混匀。反应条件4 ℃,避光30 min,采用流式细胞术检测各组不同细胞周期细胞百分率,CellQuest 软件收集细胞,ModFit 软件分析结果。细胞消化后,PBS 缓冲液洗涤1 次,加入Binding Buffer 悬浮细胞100 μL,加入AnnexinⅤ-PE 和7-AAD 各5 μL 混匀,避光室温反应10 min,每管补充Binding Buffer 400 μL,吹打混匀后上机检测,细胞凋亡率以百分率表示。
1.5 RNA 测序(RNA-sequencing,RNA-seq)检测沉默ATRX 后A549 细胞中mRNA 表达提取shNC-A549 和shATRX-A549 细胞总RNA,采用试剂盒去除样品中掺杂的核糖体RNA(ribosomal RNA,rRNA),将mRNA 片段化后,采用逆转录试剂盒合成cDNA,修复末端,并在3′端加A 碱基,PCR 扩增后,采用Agilent 2100 Bioanalyzer 对片段进行对比和检测,同时采用Illumina 的测序技术测序,对表达显著差异基因mRNA 通过Gene Set Enrichment Analysis (GSEA)和 Ingenuity Pathway Analysis(IPA)软件对相应的信号通路进行分析和归纳,并进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析(华大基因公司)。
1.6 Western blotting 法检测各组细胞中CDC25B、Cyclin B1 和CDK1 蛋白表达量将shNC-A549 和shATRX-A549 细胞按照每孔1×107个细胞的密度接种于6 孔细胞培养板,待细胞生长至80%~90%融合,0.1 mmol·L-1HU 处理24 h 后,8 Gy X 射线辐射,辐射后24 h 收集细胞,并加入裂解液RIPA 100 μL,提取总蛋白后进行定量,取40 μg 蛋白加入5×Loading Buffer,100 ℃变性10 min 后上样。浓缩胶80 V,分离胶120 V,SDS-PAGE 电泳后转膜缓冲液4 ℃中过夜湿转,5%脱脂奶粉封闭1 h后,GAPDH、CDC25B、Cyclin B1 和CDK1 一抗孵育2 h,TBST 洗涤3 次,每次10 min,加入由TBST 稀释的HRP-二抗后孵育1 h,TBST 洗涤3 次,加入ECL 液A 液和B 液,暗室中曝光,拍照分析。以蛋白条带灰度代表目的蛋白表达量。
1.7 统计学分析采用SPSS 24.0 统计软件进行统计学分析。各组不同细胞周期细胞百分率和细胞凋亡率均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 沉默 ATRX 的 A549 细胞模型建立
HEK293T 细胞包装靶向沉默ATRX 慢病毒后感染A549 细胞,经2 次感染后,荧光显微镜下观察可见shNC-A549 和shATRX-A549 细胞表达绿色荧光蛋白(green fluorescence protein,GFP),表明感染成功,基因未丢失。见图1。Western blotting法检测结果显示:与A549 和shNC-A549 细胞比较,shATRX-A549 细胞中ATRX 蛋白表达量明显减少,表明细胞模型建立成功,可用于后续实验。见图2。

图1 荧光显微镜下观察A549 细胞中GFP 表达(Bar=200 μm)Fig.1 Expression of GFP in A549 cells observed under fluorescence microscope(Bar=200 μm)
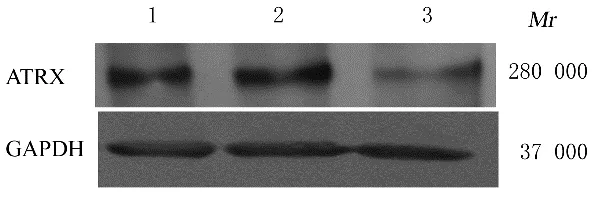
图2 Western blotting 法检测各种细胞中ATRX 蛋白表达电泳图Fig.2 Electrophoregram of expressions of ATRX protein in different kinds of cells in various groups detected by Western blotting method
2.2 各组不同细胞周期细胞百分率与对照组比较,HU 组shNC-A549 细胞中G0/G1期细胞百分率升高(P<0.05),S 期和G2/M 期细胞百分率明显降低(P<0.05 或P<0.01);辐射组shNC-A549细胞中G0/G1和S 期细胞百分率明显降低(P<0.01),G2/M 期细胞百分率明显升高(P<0.01);HU+辐射组shNC-A549 细胞中G0/G1期细胞百分率明显降低(P<0.01),S 期和G2/M 期细胞百分率明显升高(P<0.01)。与对照组比较,HU 组shATRX-A549 细胞中G0/G1期细胞百分率升高(P<0.05),G2/M 期细胞百分率明显降低(P<0.01),S 期细胞百分率差异无统计学意义(P>0.05);辐射组shATRX-A549 细胞中G2/M 期细胞百分率明显升高(P<0.01),G0/G1期和S 期细胞百分率明显降低(P<0.01);HU+ 辐射组shATRX-A549 细胞中G0/G1期细胞百分率明显降低(P<0.01),S 期和G2/M 期细胞百分率明显升高(P>0.01)。与shNC-A549 细胞比较,辐射组shATRX-A549 细胞中G0/G1期细胞百分率升高(P<0.05),G2/M 期细胞百分率降低(P<0.05);HU+辐射组shATRX-A549 细胞中S 期细胞百分率升高(P<0.05)。见图3 和表1 及表2。
表1 各组不同细胞周期shNC-A549 细胞百分率Tab.1 Percentages of shNC-A549 cells at different cell cycles in various groups(n=4,±s,η/%)
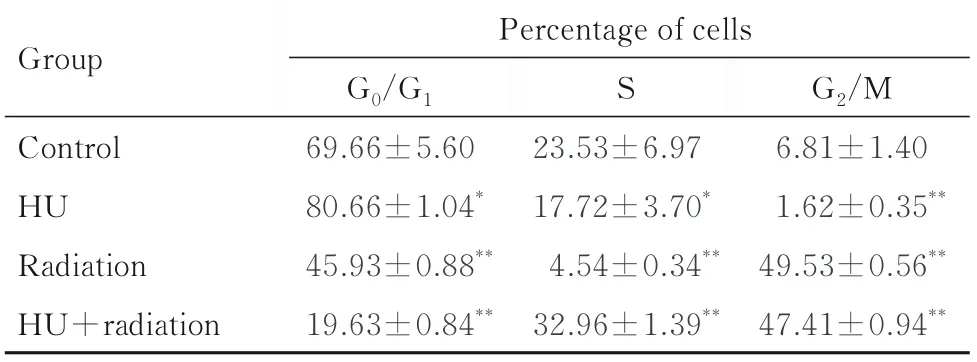
表1 各组不同细胞周期shNC-A549 细胞百分率Tab.1 Percentages of shNC-A549 cells at different cell cycles in various groups(n=4,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group G2/M 6.81±1.40 1.62±0.35**49.53±0.56**47.41±0.94**Percentage of cells G0/G1 69.66±5.60 80.66±1.04*45.93±0.88**19.63±0.84**S Control HU Radiation HU+radiation 23.53±6.97 17.72±3.70*4.54±0.34**32.96±1.39**
表2 各组不同细胞周期shATRX-A549 细胞百分率Tab.2 Percentages of shATRX-A549 cells at different cell cycles in various groups(n=4,±s,η/%)
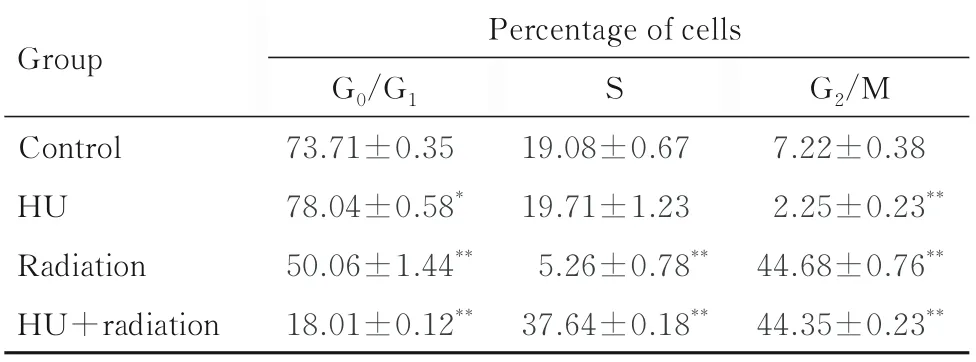
表2 各组不同细胞周期shATRX-A549 细胞百分率Tab.2 Percentages of shATRX-A549 cells at different cell cycles in various groups(n=4,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group S Control HU Radiation HU+radiation Percentage of cells G0/G1 73.71±0.35 78.04±0.58*50.06±1.44**18.01±0.12**G2/M 7.22±0.38 2.25±0.23**44.68±0.76**44.35±0.23**19.08±0.67 19.71±1.23 5.26±0.78**37.64±0.18**

图3 流式细胞术检测各组不同细胞周期A549 细胞百分率Fig.3 Percentages of cells at different cell cycles in A549 cells in various groups detected by flow cytometry
2.3 各组A549 细胞凋亡率与对照组比较,HU组、辐射组和 HU+ 辐射组 shNC-A549 和shATRX-A549 细胞凋亡率均明显升高(P<0.05或P<0.01);与shNC-A549 细胞比较,HU 组和HU+辐射组shATRX-A549 细胞凋亡率升高(P<0.05)。见图4 和表3 及表4。
表3 各组shNC-A549 细胞凋亡率Tab.3 Apoptotic rates of shNC-A549 cells in various groups(n=4,±s,η/%)

表3 各组shNC-A549 细胞凋亡率Tab.3 Apoptotic rates of shNC-A549 cells in various groups(n=4,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control HU Radiation HU+radiation Apoptotic rate 1.91±0.38 6.21±0.68**5.53±0.72*24.37±0.83**
表4 各组shATRX-A549 细胞凋亡率Tab.4 Apoptotic rates of shATRX-A549 cells in various groups (n=4,±s,η/%)

表4 各组shATRX-A549 细胞凋亡率Tab.4 Apoptotic rates of shATRX-A549 cells in various groups (n=4,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control HU Radiation HU+radiation Apoptotic rate 2.88±0.53 9.69±1.28**6.66±1.03*27.86±0.77**
2.4 沉默ATRX 后A549 细胞中mRNA 表达
RNA-seq 结果显示:沉默ATRX 后A549 细胞中mRNA 差异表达主要表现在细胞周期调节等多个环节,且形成互作网络主要以c-Myc、Esp1、Cdc20、Plk1、CycA/B、Cip1 和PCNA 为核心,其与DNA 复制、DNA 损伤和修复应答及细胞周期调节等细胞生物学进程有关。见图5。

图5 RNA-seq 检测沉默ATRX 后A549 细胞中mRNA 的差异表达和相关通路Fig.5 Differential expressions of mRNA in A549 cells after silencing of ATRX detected by RNA-seq and relative signaling pathways
2.5 各组A549 细胞中CDC25B、Cyclin B1 和CDK1 蛋白表达量与对照组比较,HU 组、辐射组和HU+辐射组shNC-A549 和shATRX-A549 细胞中CDC25B、Cyclin B1 和CDK1 蛋白表达量减少。与shNC-A549 细胞比较,对照组和HU 组shATRX-A549 细胞中Cyclin B1 蛋白表达量略有减少,辐射组和HU+辐射组shATRX-A549 细胞中CDC25B、Cyclin B1 和CDK1 蛋白表达量均增加。见图6。

图6 Western blotting 法检测各组细胞中CDC25B、Cyclin B1 和CDK1 蛋白表达电泳图Fig.6 Electrophoregram of expressions of CDC25B,Cyclin B1, and CDK1 proteins in cells in various groups detected by Western blotting method
3 讨 论
《2022 年全国癌症报告》[9]显示:肺癌的发病率和死亡率均占据首位且无性别差异。尽管外科手术仍是肺癌的主要治疗方式,但对于肺癌患者,放化疗结合的综合治疗在安全性和患者接纳度上都因其无创性而更具优势。随着放疗技术、医学影像设备和精准医疗的发展,放射治疗在肺癌治疗中的优势也更受到重视。放疗技术已经被列为早期非小细胞肺癌的一线治疗方法[10]。但放疗术后癌症的转移和复发仍是影响其疗效的主要因素,如何提高放疗的效果非常关键。
细胞周期在电离辐射的暴露下会发生变化[11-13]。辐射后细胞DNA 放射性损伤,细胞周期发生阻滞,有利于细胞损伤的修复。本研究结果显示:暴露在8 Gy 剂量X 射线下,辐射诱导shATRX-A549 细胞积累于G2/M 期,并同时消耗G0/G1期的细胞。而单独采用周期特异性阻滞剂HU 处理shATRX-A549 细胞,HU 能够导致细胞积聚于G0/G1期,发生特异性细胞周期阻滞[14]。HU和辐射联合处理后,观察到细胞在G2/M 和S 期积聚。沉默ATRX 给予A549 细胞更大的DNA 复制压力,DNA 不易修复,损伤也随之增加。HU 与辐射联合处理使周期阻滞效应较分别单独处理更加明显。HU 联合辐射使shATRX-A549 细胞中S 期细胞百分率升高,提示HU 和辐射对于A549 细胞周期阻滞效应不一致,且二者联合处理会进一步扰乱细胞周期进程。
细胞凋亡是放射性杀伤肿瘤细胞的主要途径[15]。当X 射线导致DNA 断裂受损后,一旦细胞无法修复由X 射线造成的DNA 损伤,细胞就进入凋亡进程,对于肿瘤辐射增敏具有正向作用[16-17]。本研究结果显示:与对照组比较,HU 单独处理和HU+辐射联合处理后shATRX-A549 细胞凋亡率升高。研究[18-19]证实:沉默ATRX 可上调凋亡蛋白PAPR1 的表达,激活凋亡过程中Caspase 级联反应并诱导细胞凋亡。HU 作为广泛应用的化疗药物可诱导细胞凋亡途径的发生,单独采用HU 处理和单独辐射处理均可诱导A549 细胞凋亡。对于沉默ATRX 的A549 细胞,在X 射线辐射基础上加用HU 处理,细胞凋亡率较单独辐射处理诱导的细胞凋亡率更高,凋亡作用更加显著,提示HU 增加辐射对shATRX-A549 细胞的促凋亡效应。
DNA 复制与损伤修复相关的生物学进程主要发生在细胞S 期[20-22]。辐射通过诱导DNA 断裂杀伤细胞,因此大部分易被辐射杀伤的细胞处于G1和G2期,而处于S 期细胞可以通过周期检查点的激活减少被阻滞。HU 特异性影响细胞周期进程,使HU 增加辐射诱导的G2/M 期细胞阻滞并诱导发生S 期阻滞,可能与HU 阻碍复制叉活动有关[23]。复制叉停止前进导致共济失调毛细血管扩张RAD3 相关蛋白/细胞周期检查点激酶1 的S 期检查点受到抑制,干扰细胞周期调控[24-25]。本研究对细胞周期检查点相关蛋白进行检测,发现G2/M 期相关蛋白CDK1、Cyclin B1 和CDC25B 蛋白表达量均降低,提示CDC25B/Cyclin B/CDK1 通路参与诱导shATRX-A549 细胞G2/M 和S 期阻滞。综上所述,本研究成功构建了靶向沉默ATRX的A549 细胞,HU 和辐射可以导致细胞周期进程紊乱,且HU 一定程度上促进G2/M 期细胞周期阻滞。RNA 表达测序分析,ATRX 沉默后,细胞周期相关因子表达异常,提示ATRX 的缺失造成了细胞周期紊乱,相关蛋白表达量变化也可验证。HU 和辐射均可诱导细胞凋亡,二者联合作用还可进一步促进shATRX-A549 细胞凋亡。
