参豉糖蛋白提取工艺优化及纤溶活性研究
2023-07-17宋吉鹏孙银玲丁纯洁郑宏宇赵娢孙丹丹陈丽艳
宋吉鹏 孙银玲 丁纯洁 郑宏宇 赵娢 孙丹丹 陈丽艳


摘要 [目的]對参豉中糖蛋白的提取工艺进行考察,并对其纤溶活性进行评价。[方法]以糖蛋白提取率为指标,通过单因素法考察缓冲液、提取温度、料液比、提取时间和提取次数对其的影响,并运用响应面法分析优化参豉糖蛋白的提取工艺,采用蒽酮-硫酸法测定糖蛋白中多糖含量,SDS-PAGE和Tricine-SDS-PAGE凝胶电泳确定糖蛋白的分子量,利用琼脂糖纤维蛋白平板法测定纤溶活性。[结果]缓冲液、提取时间和料液比对糖蛋白提取率影响较大;响应面法优化获得参豉糖蛋白的最佳提取工艺条件为Tris-Base-NaCl缓冲溶液(pH=8.04)、料液比1∶10(g∶mL),于4 ℃提取6 h,参豉糖蛋白提取率为4.85%,其中多糖含量为12.34%;SDS-PAGE、Tricine-SDS-PAGE凝胶电泳结果显示,参豉糖蛋白分子量为4.1~27.0 kD;与豆豉糖蛋白相比,参豉糖蛋白纤溶活性提高了40.6%。[结论]经验证利用响应面法分析测得参豉糖蛋白与模型预测值接近,可用于参豉糖蛋白的提取,且参豉糖蛋白具有较高的纤溶活性,为其进一步开发利用提供依据。
关键词 参豉;糖蛋白;提取工艺;优化;响应面法;蛋白质分子量;纤溶活性
中图分类号 R 284 文献标识码 A 文章编号 0517-6611(2023)12-0147-07
doi:10.3969/j.issn.0517-6611.2023.12.034
Study on Extraction Process Optimization and Fibrinolytic Activity of Glycoprotein from Ginseng-douchi
SONG Ji-peng,SUN Yin-ling,DING Chun-jie et al
(Heilongjiang Academy of Traditional Chinese Medicine, Harbin,Heilongjiang 150036)
Abstract [Objective] The extraction process of glycoprotein in ginseng-douchi was investigated,and its fibrinolytic activity was evaluated.[Method]Taking the glycoprotein extraction rate as an index, the effects of buffers, extraction temperature, solid-liquid ratio, extraction time and extraction times were investigated by one-way method, and optimize the extraction process of ginseng-douchi glycoprotein by the response surface method.The polysaccharide content in glycoproteins was determined by anthraconone-sulfuric acid method,the molecular weight of glycoproteins was determined by SDS-PAGE and Tricine-SDS-PAGE gel electrophoresis, and its fibrinolytic activity was determined by agarose fibrin plate method.[Result] The buffers, extraction time and solid-liquid ratio had a greater impact on glycoprotein extraction rate. The optimal extraction process conditions for obtaining ginseng-douchi glycoprotein were optimized by the response surface method:Tris Base NaCl buffer solution (pH=8.04), solid-liquid ratio 1∶10 (g∶mL), and extracted at 4 ℃ for 6 hours,the extraction rate of ginseng-douchi glycoprotein was 4.85%, and the polysaccharide content in ginseng glycoprotein was 12.34%. SDS-PAGE and Tricine-SDS-PAGE gel electrophoresis results showed that the molecular weight of ginseng-douchi glycoprotein was 4.1-27.0 kD; compared with ginseng-douchi glycoprotein, the fibrinolytic activity of ginseng-douchi glycoprotein increased by 40.6%.[Conclusion] After verification, the ginseng-douchi glycoprotein measured by the response surface method is close to the predicted value of the model, which can be used for the extraction of ginseng-douchi glycoprotein, and ginseng-douchi glycoprotein has a high fibrinolytic activity, which provides a basis for its application.
Key words Ginseng-douchi; Glycoprotein; Extraction process;Optimization;Response surface methodology; Protein molecular weight;Fibrinolytic activity
基金项目 国家自然科学基金项目(U20A20400);现代农业产业技术体系建设专项(CARS-21);黑龙江省财政专项(CZKYF-2021A002);黑龙江省卫生健康委课题(20211313050162)。
作者简介 宋吉鹏(1997—),男,山东青岛人,硕士研究生,研究方向:中药生物工程。
收稿日期 2022-09-29;修回日期 2022-11-23
参豉是依据《圣济总录》中记载的阿胶饮方,以人参和黄豆作为发酵基质,采用枯草芽孢杆菌发酵制成的新型豆豉。前期已对参豉发酵前后人参皂苷和异黄酮糖苷类成分的生物转化进行了研究,并发现黄豆加入人参发酵后纤溶活性明显升高,且具有降低血脂水平、调节脂质紊乱的作用[1-3]。此外,人参和黄豆中分别含有约12%和30%的蛋白质[4-5],而蛋白质在发酵过程中易被微生物分泌的蛋白酶降解为多肽而表现更好的生理活性。研究表明,80%以上蛋白质为糖蛋白,糖蛋白是一种由多肽链和低聚糖链共价结合而成的生物大分子,具有抗凝、溶栓、降低胆固醇、抗氧化等生物活性[6],经预试验发现参豉糖蛋白具有较高的纤溶活性,可能为其益气活血作用的药效物质基础之一。因此该研究对参豉糖蛋白的提取工艺进行优化,并对其分子量及纤溶活性进行考察,为其进一步开发利用提供依据。
1 材料与方法
1.1 试验材料
1.1.1
试材。黄豆购于和粮农业有限公司,经黑龙江省中医药科学院王伟明研究员鉴定为豆科植物大豆[Glycine max(L.)Merr.]的干燥成熟种子;人参(5年生)购自吉林省百济堂参业有限公司,经黑龙江省中医药科学院王伟明研究员鉴定为五加科植物人参(Panax Ginseng C.A.Mey.)的干燥根。
1.1.2 试剂。Tris-Base,Biosharp公司;Tris-HCl、PBS,北京中杉金桥;琼脂糖、蛋白非预染Marker,赛默飞世尔科技(中国)有限公司;纤维蛋白原,北京博奥拓达科技有限公司;凝血酶,中国食品药品检定研究院;BCA蛋白质定量试剂盒、小分子量蛋白凝胶制备试剂盒、高灵敏快速考马斯亮蓝染色试剂盒、SDS-PAGE变性丙烯酰胺凝胶制备试剂盒、小分子蛋白凝胶制备试剂盒、2X Tricine上样缓冲液、蛋白非预染Marker,上海生工生物工程股份有限公司。
1.1.3 仪器与设备。FD-1D-80+型真空冷冻干燥机,北京博医康公司;042BR10580型电泳仪,Bio-Rad公司;BSA224S-CW型电子天平,北京奥利多斯科学仪器有限公司;S210-K型pH计,美国梅特勒-托利多公司;603BR1415型凝胶成像系统,Bio-Rad公司;M200型酶联免疫检测仪,瑞士Tecan公司;MF3型菌落分析仪,杭州迅数科技有限公司。
1.2 试验方法
1.2.1 参豉的制备。参照孙银玲等[7]关于参豉的制备方法,人参和黄豆的质量比为1∶10,以人参水提液浸泡黄豆,待提取液吸收殆尽,灭菌后作为发酵基质,接种枯草芽孢杆菌菌液,于28 ℃发酵96 h,即得参豉样品,经冷冻干燥、粉碎为粗粉,采用石油醚脱脂后进行后续试验。
1.2.2 蛋白标准曲线的绘制。采用水合茚三酮(bicinchoninic acid,BCA)法[8]测定糖蛋白的浓度,牛血清白蛋白(bovine serum albumin,BSA)为标准品,倍比稀释分别得到1 600、800、400、200、100、50、25 μg/mL的BSA系列标准溶液。按试剂盒说明操作,于562 nm波长下测定吸光度。以吸光度为纵坐标、蛋白质浓度为横坐标绘制标准曲线,得到线性回归方程为y=0.000 5x+0.096 1(R2=0.995 9)。
1.2.3
参豉糖蛋白样品浓度的测定。用生理盐水将糖蛋白提取液稀释20倍,按照“1.2.2”的方法及波长检测各样品的吸光度,根据标准曲线计算样品中糖蛋白浓度并计算提取率。
糖蛋白提取率=V×C×Dm×1 000×100%
式中,V为样品溶液的总体积(mL);C为样品糖蛋白浓度(mg/mL);D为稀释倍数;m为称取样品质量(g)。
1.2.4 单因素考察糖蛋白提取率。
1.2.4.1 缓冲液对参豉糖蛋白提取率的影响。配制3种不同pH的缓冲溶液体系:Tris-HCl(25 mmol/L)-NaCl(50 mmol/L)(pH=5.90 mol/L)、PBS(10 mmol/L)(pH=7.30)、Tris-Base(25 mmol/L)-NaCl(50 mmol/L)(pH=8.04)。精密称取参豉粗粉3份各1 g,分别加入3种缓冲液各10 mL,室温浸提6 h,每15 min涡旋振摇一次,在室温条件下于4 200 r/min离心10 min,取上清液再于4 ℃、10 000 r/min离心20 min,取上清液即为参豉糖蛋白粗提液,检测糖蛋白浓度,计算提取率,确定最佳提取缓冲溶液。
1.2.4.2 提取温度对参豉糖蛋白提取率的影响。精密称取参豉粗粉3份各1 g,加入“1.2.4.1”确定的最佳提取缓冲液,其他参数不变,分别于4、25、35、45、60 ℃提取6 h,确定最佳提取温度。
1.2.4.3 料液比對参豉糖蛋白提取率的影响。在最佳提取缓冲液和提取温度的条件下,考察料液比1∶5、1∶10、1∶15(g∶mL)对参豉糖蛋白提取率的影响。
1.2.4.4 提取时间对参豉糖蛋白提取率的影响。根据确定的最佳提取缓冲液、提取温度、料液比,考察提取1、6、18、24 h对参豉糖蛋白提取率的影响。
1.2.4.5 提取次数对参豉糖蛋白提取率的影响。在以上最优参数的条件下,考察提取1和2次对参豉糖蛋白提取率的影响。
1.2.5 响应面法优化参豉糖蛋白提取工艺[9]。结合单因素试验结果,以对参豉糖蛋白提取率有明显影响的因素为因变量,包括提取缓冲液、提取时间和料液比,结合因变量水平覆盖单因素的试验条件,设计三因素三水平响应面分析试验(表1),筛选参豉糖蛋白最佳提取工艺。所有数据均为3次重复的平均值,利用Excel 2007进行数据统计分析[10]。
1.2.6
糖蛋白提取液中多糖含量测定[11]。精密称取105 ℃干燥至恒重的无水葡萄糖标准品10 mg,配制0.1 mg/mL葡萄糖标准品溶液,稀释为浓度0、0.02、0.03、0.04、0.06、0.08、0.10 mg/mL的溶液,吸取不同浓度标准品溶液1 mL置于10 mL具塞刻度试管中,加入0.2%蒽酮-硫酸4 mL,摇匀,置于沸水浴中加热15 min,再于冷水中冷却至室温,放置10 min。于627 nm处测定吸光度,以葡萄糖浓度(x)为横坐标、吸光度(y)为纵坐标进行线性回归,得回归方程y=6.859 5x-0.073 4(R2=0.996 4)。
采用Sevage法[12]脱除糖蛋白提取液中蛋白质,脱蛋白后的提取液中加入95%乙醇,调至溶液乙醇浓度为80%,4 ℃静置过夜,抽滤,取沉淀,依次加入无水乙醇、丙酮洗涤,抽滤,沉淀,为粗多糖样品,干燥后测定重量。
精密称取干燥至恒重的粗多糖样品10 mg,置于100 mL容量瓶中,加入蒸馏水溶解并稀释至刻度,摇匀,获得浓度为0.1 g/L的粗多糖溶液。精密吸取粗多糖溶液1.0 mL测吸光度,由回归方程计算样品的多糖浓度和糖蛋白中多糖含量。
1.2.7 糖蛋白分子量的测定。采用SDS-PAGE和Tricine-SDS-PAGE凝胶电泳测定糖蛋白分子量[13],20%SDS-PAGE凝胶电泳,120 V条件下恒压分离;12%Tricine-SDS-PAGE(小分子)凝胶电泳,4 ℃,150 V条件下恒压分离,分离时要防止小分子蛋白溢出胶外。凝胶采用考马斯亮蓝G-250染色液[14]染色24 h,7%醋酸乙醇溶液脱色至条带清晰,使用Bio-Rad凝胶成像仪对凝胶进行图像采集分析。
1.2.8 纤溶活性评价。采用琼脂糖-纤维蛋白平板法[15]测定糖蛋白纤溶活性,配制酶活力分别为10、20、40、60、80 IU/mL尿激酶标准溶液,上样量为10 μL,37 ℃恒温孵育18 h。利用迅数菌落计数仪测量溶圈直径,计算溶圈面积。以尿激酶标准溶液溶圈面积(y)为纵坐标、酶活力(x)为横坐标绘制标准曲线,得到回归方程y=0.550 3x+180.43(R2=0.985 5)。根据标准曲线回归方程计算各糖蛋白样品纤溶活性。
2 结果与分析
2.1 单因素试验
2.1.1 缓冲液对参豉糖蛋白提取率的影响。从图1可以看出,在其他提取条件一致的情况下,缓冲液Tris-HCl-NaCl(pH=5.90)、PBS(pH=7.30)和Tris-Base-NaCl(pH=8.04)的糖蛋白提取率分别为(1.39±0.03)%、(1.33±0.05)%和(3.90±0.02)%。Tris-Base-NaCl的糖蛋白提取率显著高于Tris-HCl-NaCl和PBS这2种缓冲液的提取率(P<0.05)。Tris-Base-NaCl缓冲液的pH为8.04,表明提取的参豉糖蛋白主要为弱酸性糖蛋白。
2.1.2
提取温度对参豉糖蛋白提取率的影响。从图2可以看出,提取温度为4、25、35、45和60 ℃时,参豉糖蛋白提取率分别为4.02%、3.60%、4.20%、3.80%和4.40%,各组间无显著差异(P>0.05)。虽然60 ℃条件下参豉糖蛋白提取率最高,但经检测,该温度下提取的参豉糖蛋白纤溶活性较低,为(1 146.59±33.78)IU/mL,而4 ℃时纤溶活性为(1 575.36±27.66)IU/mL,因此为保证参豉糖蛋白纤溶活性,选择4 ℃条件下提取糖蛋白为佳。
2.1.3
料液比对参豉糖蛋白提取率的影响。从图3可以看出,随着料液比的增加,糖蛋白提取率呈下降趋势,当料液比为1∶5 时糖蛋白提取率最高,为(5.91±0.12)%,显著高于其他各料液比的提取率(P<0.05);当料液比为1∶15时提取率明显降低,仅为(0.80±0.02)%,而当料液比低于1∶5 时,缓冲液被参豉粉末吸收殆尽,影响后续糖蛋白的提取,故选用1∶5为最佳提取料液比。
2.1.4
提取时间对参豉糖蛋白提取率的影响。从图4可以看出,提取时间1 h时糖蛋白提取率为(4.80±0.01)%,明显低于其他3组(P<0.05)。提取时间6、18和24 h的糖蛋白提取率无显著差异(P>0.05),基于提取成本和提取效率,选择6 h为最佳提取时间,糖蛋白提取率为(5.91±0.12)%。
2.1.5
提取次数对参豉糖蛋白提取率的影响。控制反应条件:Tris-Base-NaCl提取缓冲液,提取温度4 ℃、料液比1∶5、提取时间6 h,考察提取1和2次对糖蛋白提取率的影响。结果表明,提取1、2次的糖蛋白提取率分别为(4.91±0.12)%、(5.05±0.06)%。由于2次糖蛋白總提取率无明显差异,且溶液体积大导致后续糖蛋白溶液脱盐、浓缩过程耗时较久,故选择提取次数为1次。
2.2 响应面试验
以缓冲液(A)、提取时间(B)、料液比(C)为响应变量,参豉糖蛋白提取率为响应值,采用Design-Expert 13软件的Box-Behnken设计进行响应面分析,具体试验设计及结果见表2。
通过对表2的数据进行多元回归拟合,得到回归方程:糖蛋白提取率(Y)=4.44-0.003 8A-0.055 0B+0.648 2C+0.042 5AB-0.005 0AC-0.837 6BC-2.400 0A2-0.986 9B2-0.265 5C2。
回归模型方差及结果见表3,整体模型P=0.001 9<0.05(显著),表明试验方法可靠;方程失拟项P=0.451 9,表明失拟项不显著,未知因素对试验影响较小;R2=0.906 7,说明回归模型与实测值拟合度较好。各因素的影响程度从大到小依次为C>B>A,即料液比>提取时间>缓冲液。显著性检验结果显示,A(缓冲液)、B(提取时间)对糖蛋白提取率的影响不显著(P>0.05),C(料液比)对糖蛋白提取率的影响显著(P<0.05);在二次项中A2影响极显著(P<0.01),B2影响显著(P<0.05)。该方程是参豉糖蛋白提取率与提取工艺各参数合适的数学模型,因此可使用该回归方程进行试验结果分析。
根据回归方程,固定三因素中任意一因素,其他两因素两两交互作用影响参豉糖蛋白提取率,得到等高线平面图及对应响应面图(图5~7)。响应面分析图中曲线趋势图及等高线图可获得各因素对糖蛋白提取率影响的显著程度,曲线越陡峭,等高线越密集,说明该因素对糖蛋白提取率的影响越显著。各因素交互作用显著程度可通过等高线图中心椭圆观察,中心椭圆越接近圆形,交互作用越不显著。二维等高线图显示,参豉糖蛋白提取率随缓冲液、提取时间和料液比的变化而变化,并生成了相应的三维响应面,从而更好地确定3个变量对相应变量的交互关系[16]。等高线近椭圆形或近圆形,表明A(缓冲液)、B(提取时间)、C(料液比)对糖蛋白提取率存在影响,且料液比的影响作用大于缓冲液和提取时间(PC=0.022 7、PA=0.985 9、PB=0.822 2)。
利用Design-Expert 13.0软件进行工艺参数的优化分析,得到预测的参豉糖蛋白提取最佳工艺条件为采用Tris-Base-NaCl(pH=8.04)缓冲液,按照料液比1∶10(g∶mL)于4 ℃提取6 h,此时参豉糖蛋白提取率为4.91%。验证试验的提取工艺条件,进行3次平行试验,取平均值,得到参豉糖蛋白提取率为4.85%,与预测值总体吻合,说明模型能较准确预测参豉糖蛋白提取率,优化工艺条件较可靠。
2.3 参豉糖蛋白中多糖含量
测定多糖溶液吸光度后,通过回归方程计算可得参豉糖蛋白提取液中多糖含量占参豉糖蛋白总量的12.34%,表明提取的参豉糖蛋白中含有少量的多糖。
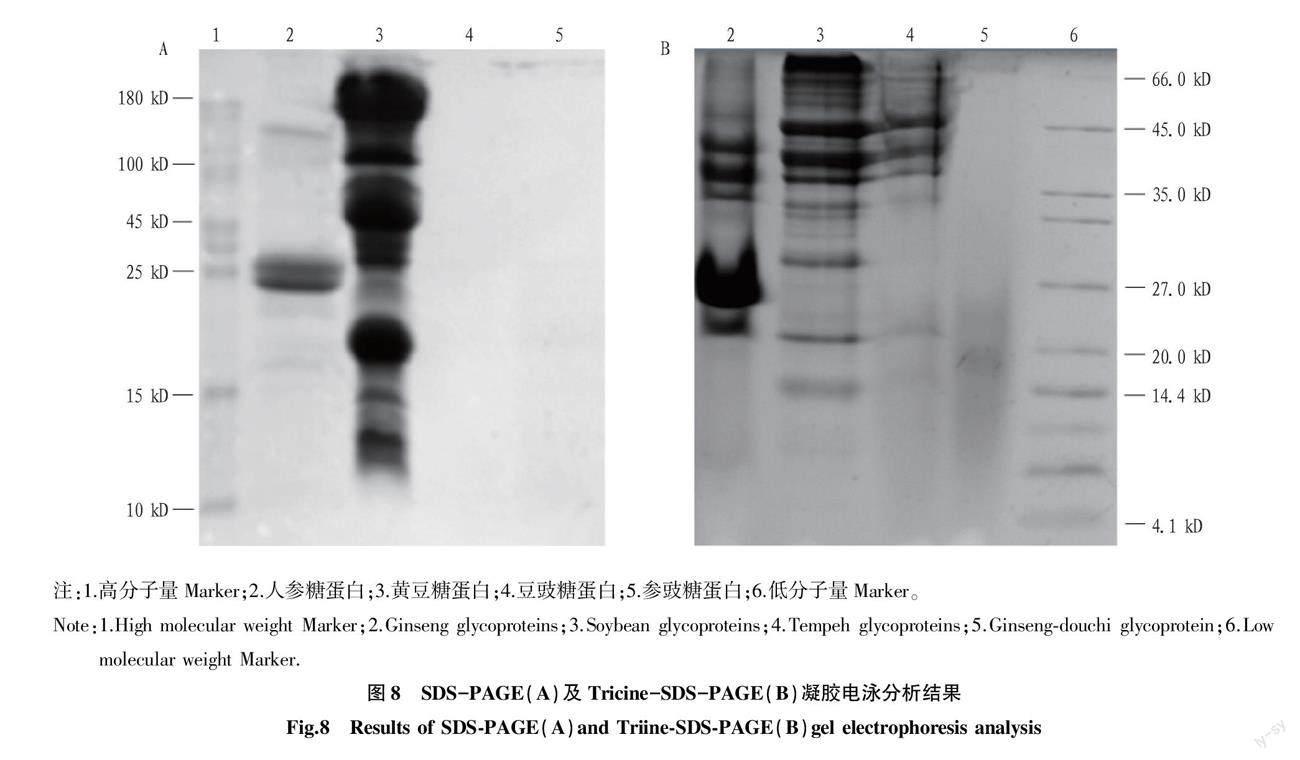
2.4 SDS-PAGE及Tricine-SDS-PAGE凝胶电泳分析
由图8可知,人参糖蛋白分子量大部分为25 kD及以
上,而黄豆糖蛋白浓度较高,糖蛋白分子量在10~180 kD均有分布;在发酵过程中,微生物分泌的酶对人参及黄豆中的
糖蛋白进行降解,使发酵后的豆豉糖蛋白及参豉糖蛋白分子量降低,在Tricine-SDS-PAGE凝胶电泳中可以观察到豆豉糖蛋白及参豉糖蛋白条带,分子量均在66 kD以下,参豉可能由于加入人参共同发酵的原因,其糖蛋白分子量较豆豉糖蛋白分子量更小,分子量均在27 kD以下。
SDS-PAGE凝胶电泳用于分析相对分子量为20~100 kD的样品,而Tricine-SDS-PAGE凝胶电泳,利用三羟甲基氨基甘氨酸(tricine)代替甘氨酸,分离胶中添加甘油,采用Tris-Tricine系统,增加了聚丙烯酰胺的浓度和交联度,能夠有效分离分子质量小于10 kD的小分子蛋白和多肽[17]。罗浩铭等[18]研究报道人参糖蛋白分子量主要集中在35~75 kD,夏秀芳等[19]研究报道黄豆糖蛋白分子量分布在35 kD以上,且多数大于75 kD,与该研究凝胶电泳结果基本一致。黄豆经枯草芽孢杆菌发酵后,糖蛋白类成分发生降解,其分子量降低,多分布在20~66 kD,参豉糖蛋白的分子量小于豆豉糖蛋白,在4.1~27.0 kD,推测是人参与黄豆共同发酵,在微生物的作用下糖蛋白结构发生改变,从而具有更好的活性。
2.5 不同糖蛋白样品纤溶活性对比分析
由于参豉是由人参与黄豆共同发酵制成,该研究同法提取人参、黄豆、豆豉(与参豉相同发酵条件,未加人参提取液)及参豉的糖蛋白并对比其纤溶活性,结果如图9所示。从图9可以看出,人参糖蛋白、黄豆糖蛋白未见纤溶活性,豆豉糖蛋白、参豉糖蛋白均有明显的纤溶溶圈,纤溶活性分别为(1 154.28±37.86)和(1 623.04±29.93)IU/mL,参豉糖蛋白纤溶活性较豆豉糖蛋白提高了40.6%,表明发酵后糖蛋白的结构发生变化而具有明显的纤溶活性。
已有研究表明,人参蛋白有明显的降血脂作用[20-21],大豆发酵制成豆豉后蛋白质含量明显升高,并产生一种具有溶栓作用且安全无毒的豆豉纤溶酶[22-23]。前期研究表明,参豉具有明显的纤溶活性[2],但尚不清楚产生纤溶活性的物质基础。该研究结果初步证实了参豉糖蛋白是其具有纤溶活性的物质基础之一,且糖蛋白是生物体内重要的生物大分子之一,广泛存在于动物、植物和某些微生物中,具有广泛的药理活性[24];参豉糖蛋白的纤溶活性较豆豉高,可能是由于糖蛋白的分子量及结构不同而使两者活性产生差异。
3 结论与讨论
该研究以糖蛋白提取率为指标,通过单因素法考察缓冲液、提取温度、料液比、提取时间和提取次数对其的影响,结合响应面法对参豉糖蛋白的提取工艺进行优化,并对参豉糖蛋白的分子量和纤溶活性进行考察。结果表明,缓冲液、提取时间和料液比对糖蛋白提取率影响较大,响应面法优化获得参豉糖蛋白的最佳提取工艺条件为Tris-Base-NaCl缓冲溶液(pH=8.04)、料液比1∶10(g∶mL),于4 ℃提取6 h,参豉糖蛋白提取率为4.85%,其中多糖含量为12.34%;SDS-PAGE、Tricine-SDS-PAGE凝胶电泳结果显示,参豉糖蛋白分子量为4.1~27.0 kD;与豆豉糖蛋白相比,参豉糖蛋白纤溶活性提高了40.6%。
该研究采用单因素结合响应面法确定了参豉糖蛋白的最佳提取工艺,通过纤溶活性评价证明了参豉糖蛋白是参豉具有纤溶活性的药效物质基础之一,并明确了参豉糖蛋白的分子量范围,为其进一步研究及开发利用提供依据。
参考文献
[1] 孙建锋.人参豆豉复合发酵物成分转化及其降血脂作用机制研究[D].哈尔滨:黑龙江省中医药科学院,2021.
[2] 陈丽艳,崔贝贝,孙银玲,等.人参豆豉的发酵工艺及人参皂苷生物转化研究[J].中国酿造,2020,39(1):124-128.
[3] 肖莹.糖蛋白生物活性研究综述[J].现代农业科学,2009,16(4):31-32.
[4] 霍艺丹,陈文学,郭晓雨,等.不同海拔对人参粗蛋白含量的影响[J].中国现代中药,2011,13(5):16-17,43.
[5] 唐雅楠,韩喜桃,刘子琴,等.中药糖蛋白的研究进展[J].天然产物研究与开发,2021,33(10):1797-1807.
[6] 王铖博,慕星星,石继鹏,等.兰州百合糖蛋白LGP-2的提取纯化及结构表征研究[J].生物学通报,2019,54(4):43-46.
[7] 孙银玲,陈丽艳,陈继亮,等.参豉对气虚血瘀模型大鼠肠道微生物及其代谢多样性的影响[J].微生物学通报,2020,47(3):829-842.
[8] AMINI Y,AMEL JAMEHDAR S,SADRI K,et al.Different methods to determine the?encapsulation efficiency of protein in PLGA nanoparticles[J].Bio-medical materials and engineering,2017,28(6):613-620.
[9] 金昊艺,林洪宇,赵东夫,等.响应面法优化黄精多糖提取工艺[J].食品安全导刊,2022(20):148-150,154.
[10] 杨雄,曾智.Excel在一元线性回归分析中的应用[J].保山学院学报,2021,40(2):66-73.
[11] DYAKOVA N A,SAMYLINA I A,SLIVKIN A I,et al.Development and validation of an express method for assay of water-soluble polysaccharides in common burdock(Arctium lappa L.)roots[J].Pharmaceutical chemistry journal,2015,49(9):620-623.
[12] LONG X Y,YAN Q,CAI L J,et al.Box-Behnken design-based optimization for deproteinization of crude polysaccharides in Lycium barbarum berry residue using the Sevag method[J].Heliyon,2020,6(5):1-8.
[13] 唐雪梅,魏琪,陈璐,等.SDS-聚丙烯酰胺凝胶电泳分析五种种子类中药炒制前后蛋白质成分的变化[J].成都中医药大学学报,2021,44(1):66-70.
[14] AGGARWAL R,KURIEN B T.Destaining coomassie brilliant blue-stained sodium dodecyl sulfate-polyacrylamide protein gels using a household detergent[J].Methods in molecular biology,2018,1853:255-258.
[15] 班建东,廖共山,黄爱民,等.纤维蛋白原平板法测定水蛭素活性[J].广西医科大学学报,2007,24(6):827-828.
[16] SHU G W,SHI X Y,CHEN H,et al.Optimization of goat milk with ACE inhibitory peptides fermented by Lactobacillus bulgaricus LB6 using response surface methodology[J].Molecules,2017,22(11):2001.
[17] WU H Y.Determination of molecular weight distribution of angiotensin converting enzyme inhibitor peptdes from zanthoxylum bungeanum seed protein by Tricine-SDS-PAGE[J].Modern food,2021,9:172-175.
[18] 羅浩铭,王颖,陈英红,等.人参糖蛋白对Aβ25~35诱导SH-SY5Y细胞凋亡的影响[J].中国老年学杂志,2016,36(24):6077-6080.
[19] 夏秀芳,洪岩,郑环宇,等.湿法糖基化改性对大豆分离蛋白溶解性和乳化能力的影响[J].中国食品学报,2016,16(1):167-172.
[20] 李庆利,曾贵荣,谭志超,等.参附注射液对大鼠慢性心力衰竭的保护作用研究[J].中南药学,2017,15(12):1717-1721.
[21] 徐云凤,赵雨,邢楠楠,等.人参蛋白对小鼠抗疲劳作用的研究[J].食品工业科技,2011,32(11):406-407,436.
[22] YUAN J,YANG J,ZHUANG Z H,et al.Thrombolytic effects of Douchi fibrinolytic enzyme from Bacillus subtilis LD-8547 in vitro and in vivo[J].BMC biotechnology,2012,12:1-9.
[23] 高洋,孙艳.豆豉纤溶酶的研究进展[J].现代食品,2018(10):53-55.
[24] 唐嘉诚,包建强,陈彦婕,等.天然糖蛋白研究进展[J].食品与发酵工业,2022,48(14):345-353.
