土壤微生物对环丙氟虫胺的降解研究
2023-07-05王少敏秦子为段米芳谢天晨朱咏华卓睿
王少敏,秦子为,段米芳,谢天晨,朱咏华,卓睿
(湖南大学生物学院植物功能基因组学与发育调控湖南省重点实验室,长沙 410082)
农药是防治农业病虫害和控制杂草的化学药品,也是控制某些昆虫(如蚊、蝇等)的重要药剂[1]。环丙氟虫胺(cyproflanilide),分子式C28H17BrF12N2O2,是由南通泰禾化工股份有限公司以双酰胺类杀虫剂为先导将环溴虫酰胺结构中环甲基引入间二酰胺的骨架中合成的一种间二酰胺类杀虫剂[2],于2019 年获得中国专利授权(专利号ZL201811555432.3),开发代号CAC-I-785,CAS 登录号为2375110-88-4,结构式如图1 所示[3]。该药剂作用机制新颖、杀虫谱广,对鳞翅目二化螟、稻纵卷叶螟、甜菜夜蛾、小菜蛾、草地贪夜蛾、鞘翅目跳甲和部分蓟马防效优异,尤其对水稻二化螟具有杰出的防效[3-4]。其用药量低,对环境安全,但不当使用该杀虫剂对生态系统具有潜在风险。目前对于环丙氟虫胺的微生物降解尚未有研究报道,因此本研究围绕环丙氟虫胺的微生物降解展开探索。
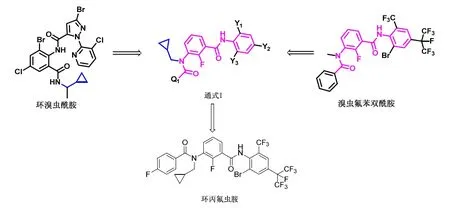
图1 环丙氟虫胺的合成路线
土壤中的细菌、真菌、放线菌、藻类等都具有降解农药的功效[5]。放线菌(actinobacteria)是一类具有丝状结构、以孢子繁殖的革兰氏阳性菌,在自然界中分布广泛,种类繁多,且孢子抗逆性强,多存在于土壤和根际中[6]。研究发现某些放线菌具有降解有机物的能力,如余臣磊等[7]从农药污染场地中分离得到一株对敌百虫具有降解特性的链霉菌属的菌株Lin F-1,此外研究发现该菌株具有较强的广谱降解特性,可降解有机磷和菊酯类农药、部分有机氯农药。细菌由于其基因突变性较强,容易诱导多种突变菌株从而有更强的适应能力,因此被广泛运用于农药降解[8]。研究显示,细菌降解有机物表现优异,如Demequina salsinemorusBJ1 和Pseudomonassp.strain GJY 分别对蒽和HBCD 降解率高达92.00%和85.38%[9-11]。真菌是一类具备较强环境应用潜力的微生物资源,以白腐真菌为例,其具备强大的生物降解能力,可以分泌一系列木质素分解酶和细胞内酶,以进行复杂木质素大分子和异生素的降解和转化[12]。由于白腐真菌特色降解酶系的底物广谱性和环境友好性,被广泛应用于工业废水[13-14]、多环芳烃[15]、农药抗生素[16]、有机污染物的降解修复领域。
本文以环丙氟虫胺为研究对象,首先探究了实验室现有放线菌、细菌和真菌对环丙氟虫胺的降解作用,然后通过平板分离技术,筛选环丙氟虫胺的耐药和降解菌。研究发现实验室现有菌株对环丙氟虫胺有一定的降解效果,此外成功筛选出对环丙氟虫胺有耐受以及降解能力的微生物菌株,最终证明环境微生物具备对环丙氟虫胺的降解能力。这将为环丙氟虫胺防治水稻等农作物上的虫害以及水稻等农作物的保产和增产提供保障,减少该类杀虫剂对环境的不良影响。
1 材料与方法
1.1 试验菌株
2 种放线菌:Amycolatopsissp.MtRt-6(GenBank登录号:GCA_017308975.1,中国普通微生物菌种保藏管理中心保藏号:CGMCC No. 23411),以下简称菌株为MtRt-6;Streptomycessp.CoT10(GenBank登录号:JAIQYX000000000.1,中国普通微生物菌种保藏管理中心保藏号:CGMCC No.22968),以下简称菌株为CoT10。
2 种细菌:Sphingobacterium mizutaiiGEMB-CSS-01(GenBank 登录号:MW832242.1)和Pseudomonas aeruginosaGEMB-CSS-02 (GenBank 登录号:ON025930.1),以下分别简称菌株为CSS-01 和CSS-02。
1 种真菌:白腐真菌Pleurotus ostreatusGEMBPO1(中国典型培养物保藏中心编号:CCTCC NO M2023358),以下简称菌株为PO1。
1.2 试验材料
环丙氟虫胺原药(南通泰禾化工股份有限公司)。
环丙氟虫胺不易溶于培养基,因此试验所选用的以下培养基均加入1%吐温80 助溶剂。
酵母麦芽提取物(ISP2)培养基:麦芽浸粉10 g,酵母浸膏4 g,葡萄糖14 g,琼脂粉20 g,去离子水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
LB 培养基:酵母提取物5 g,蛋白胨10 g,氯化钠10 g,琼脂粉18~20 g,去离子水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
GYP 培养基:葡萄糖20 g,酵母浸膏5 g,蛋白胨5 g,七水硫酸镁1 g,五水硫酸铜0.002 g,去离子水1000mL,磷酸调pH5.0,115℃灭菌20min。
PDA 培养基:称取200 g 马铃薯块,加水煮沸20 min,纱布过滤,加入20 g 葡萄糖,使用去离子水补齐1 000 mL。分装时,每100 mL 培养基内加入1.5~2.0 g 琼脂糖,121 ℃灭菌20 min。
1.3 试验方法
1.3.1 放线菌的培养
MtRt-6、CoT10 分别接种于ISP2 固体培养基上,30 ℃恒温培养,收集成熟孢子制成孢子悬浮液,血球计数板计数后稀释至1.0×107CFU/mL 转接至液体ISP2 培养基,置于摇床,30 ℃、170 r/min恒温培养。
1.3.2 细菌CSS-01 和CSS-02 的培养
CSS-01 和CSS-02 菌株分别划线于LB 固体培养基上,30 ℃培养24 h,挑取单菌落再次于LB 固体培养基划线活化,然后再接种至LB 液体培养基中,30 ℃、180 r/min 培养24 h 作为种子液。
1.3.3 白腐真菌PO1 的培养
平板种:使用无菌的接种环从4 ℃保存的种子管中挑取少量的白腐真菌菌丝于新鲜的PDA 培养基上,28 ℃培养至菌丝生长较快的时期(约5 d),成为平板种。
液体种:用无菌的接种针将平板种上的菌丝和其依托的培养基切成小块,取适量接种于液体的GYP 培养基中,28 ℃、180 r/min摇床培养约7 d,成为一级液体种。用剪口无菌的枪头从一级液体种中取1 mL 到新鲜的GYP 培养基中,28 ℃、180 r/min培养3~4 d,此时为二级液体种。
1.3.4 环丙氟虫胺的降解
原药降解:将环丙氟虫胺(终浓度为20 mg/L)原药添加至生长对数期菌株的液体培养基中,以不接菌含20 mg/L 环丙氟虫胺的空白培养基为对照组(即CK),按照菌株正常生长条件培养,定期取样,利用高效液相色谱仪测定剩余环丙氟虫胺浓度。
高效液相色谱仪检测条件:Shim-pack GIST C18柱,流动相:甲醇∶0.1%磷酸水=75∶25(体积比),流速:1/1.5 mL/min,进样量:10 μL,检测波长:240 nm,柱温:40℃。
环境微生物对环丙氟虫胺的降解率计算:环丙氟虫胺终浓度与环丙氟虫胺初始浓度差与环丙氟虫胺初始浓度比值。
1.3.5 农田土壤中环丙氟虫胺耐受菌的分离及其降解特性
土壤样品采集于湖南省水稻研究所(1 号地)(28°11′52″N,113°4′42″E)和湖南春华金鼎山社区(2 号地)(28°17′42″N,113°15′52″E),用无菌取样勺分别采集水稻所5 个土壤样品和金鼎山社区6 个土壤样品,放入无菌密封袋。
在无菌条件下将土壤样品用无菌水制备成悬液作为分离微生物源,之后梯度稀释涂布于含有不同浓度环丙氟虫胺原药的LB 平板上,筛选并分离其中对环丙氟虫胺有较高耐药性的菌株。将生长状态良好的耐药菌培养至生长对数期转接于含环丙氟虫胺浓度为20 mg/L 的液体培养基(含1%吐温80)中,以不接菌含20 mg/L 环丙氟虫胺的空白培养基(含1%吐温80)为对照组,37 ℃、180 r/min 培养,于第2 天取样,然后采用高效液相色谱仪测定培养基中环丙氟虫胺的剩余浓度。
1.3.6 土壤微生物DNA 提取和鉴定
使用DNA 提取试剂盒(EasyPure Bacteria Genomic DNA Kit,Transgen)对筛选得到的菌株进行基因组DNA 提取,用引物27F (5′-agagtttgatcctggctcag-3′)和1492R(5′-tacggytaccttgttacgactt-3′)扩增其16S rRNA基因后测序,测序结果与NCBI(www.ncbi.nlm.nih.gov/)和EZBioCloud (www.ezbiocloud.net/)中16S rRNA基因序列进行比对。
2 结果与讨论
2.1 放线菌对环丙氟虫胺的降解
Amycolatopsissp.MtRt-6 是实验室前期从经表面消毒后的多年生紫花苜蓿的根部分离得到的一株稀有放线菌,Streptomycessp.CoT10 是实验室前期从湘林系列油茶的根部分离得到的油茶内生放线菌,MtRt-6 和CoT10 对20 mg/L 环丙氟虫胺原药的降解情况如图2 和表1 所示。处理2 d 后,MtRt-6 和CoT10 处理中环丙氟虫胺的检测浓度分别为1.29、1.46 mg/L,MtRt-6 和CoT10 对环丙氟虫胺的降解率分别为62.28%和57.18%。可见,MtRt-6和CoT10 对20 mg/L 环丙氟虫胺原药具有较好的降解能力。

图2 CK、MtRt-6、CoT10 的高效液相色谱图
表1 MtRt-6、CoT10 对环丙氟虫胺原药的降解
2.2 细菌CSS-01 和CSS-02 对环丙氟虫胺的降解
Sphingobacterium mizutaiiGEMB-CSS-01 和Pseudomonas aeruginosaGEMB-CSS-02 是实验室前期从长沙市桃子湖底泥样品中筛选到的能够在含磺胺培养基和含双酚A 培养基上生长的菌株,CSS-01和CSS-02 对20 mg/L 环丙氟虫胺原药的降解情况如图3 和表2 所示。
图3 CK、CSS-01、CSS-02 的高效液相色谱图
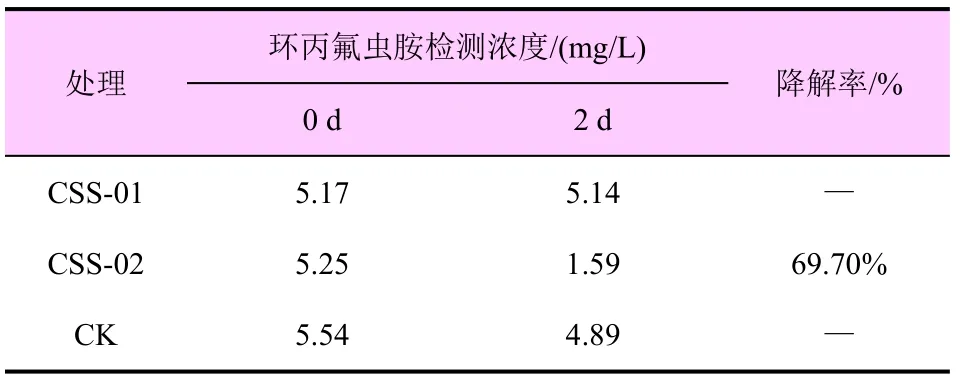
表2 CSS-01 和CSS-02 对环丙氟虫胺原药的降解
CSS-02 对环丙氟虫胺有明显的降解效果,但CSS-01 未显示出对环丙氟虫胺的降解效果。处理2 d 后,CSS-01 和CSS-02 处理中的环丙氟虫胺检测浓度分别为5.14、1.59 mg/L,CSS-02 对环丙氟虫胺的降解率为69.70%。可见,CSS-02 对20 mg/L环丙氟虫胺原药有较好的降解效果。
2.3 白腐真菌PO1 对环丙氟虫胺的降解
白腐真菌Pleurotus ostreatusGEMB-PO1 对20 mg/L 环丙氟虫胺原药的降解如图4 和表3 所示。处理3 d 后,白腐真菌PO1 处理中环丙氟虫胺的检测浓度为1.15 mg/L,对环丙氟虫胺原药的降解率达78.86%。可见,白腐真菌PO1 对20 mg/L 环丙氟虫胺原药有较好的降解效果。
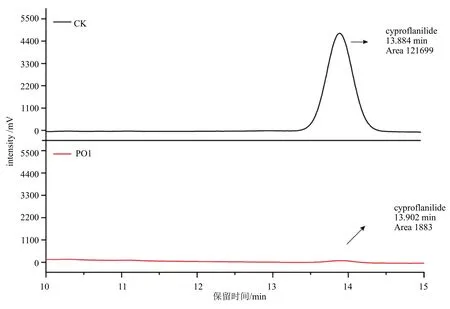
图4 CK、PO1 的高效液相色谱图

表3 白腐真菌PO1 对环丙氟虫胺原药的降解
2.4 农田土壤中环丙氟虫胺耐受菌分离及其降解特性
利用平板筛选技术在无菌条件下将土壤样品用无菌水制备成悬液作为分离微生物源,之后梯度稀释涂布于含20、80、200 mg/L 环丙氟虫胺原药的LB 平板上,筛选并分离其中对环丙氟虫胺有较高耐药性的菌株(图5)。研究发现,在含200 mg/L 环丙氟虫胺的平板中,依然有微生物能够生长并显现出单菌落,最终成功筛选并分离得到12 株在含200 mg/L 环丙氟虫胺的平板上正常生长的菌株。
图5 土壤微生物对环丙氟虫胺的耐药平板
这12 株耐药菌对20 mg/L 环丙氟虫胺原药的降解如图6 所示。不接菌对照组(CK)中环丙氟虫胺的检测浓度为6.00 mg/L;菌株1-21、2-6、2-16 对20 mg/L 环丙氟虫胺原药有明显降解效果,处理2 d后环丙氟虫胺的检测浓度为分别为1.34、2.93、2.45 mg/L,降解率分别达77.67%、51.17%、59.17%。对这3 株有明显降解效果的菌进行DNA 提取并测序,将测序结果与NCBI 和EzBioCloud 数据库进行比较,发现菌株1-21 与高地芽孢杆菌(Bacillus altitudinis)、菌株2-6 与东洋芽孢杆菌(Bacillus toyonensis)、菌株2-16 与蜡样芽孢杆菌(Bacillus cereus)有较高的相似性。此外,已有研究报道高地芽孢杆菌可降解聚氨酯、丁草胺、木质素、有机磷农药等污染物[17-20];东洋芽孢杆菌可降解黑臭水有机污染物[21];蜡样芽孢杆菌可降解原油、短链烷烃、多环芳烃、苯酚、聚乙烯醇、有机磷农药等污染物[22-25]。以上研究证明存在土壤微生物对环丙氟虫胺具有一定的降解能力。
以上研究表明,环境微生物对环丙氟虫胺有一定的降解效果。但是,土壤微生物对环丙氟虫胺的降解机制、降解产物及其毒性分析在本研究中并未得到揭示,将是后续有价值的研究方向。
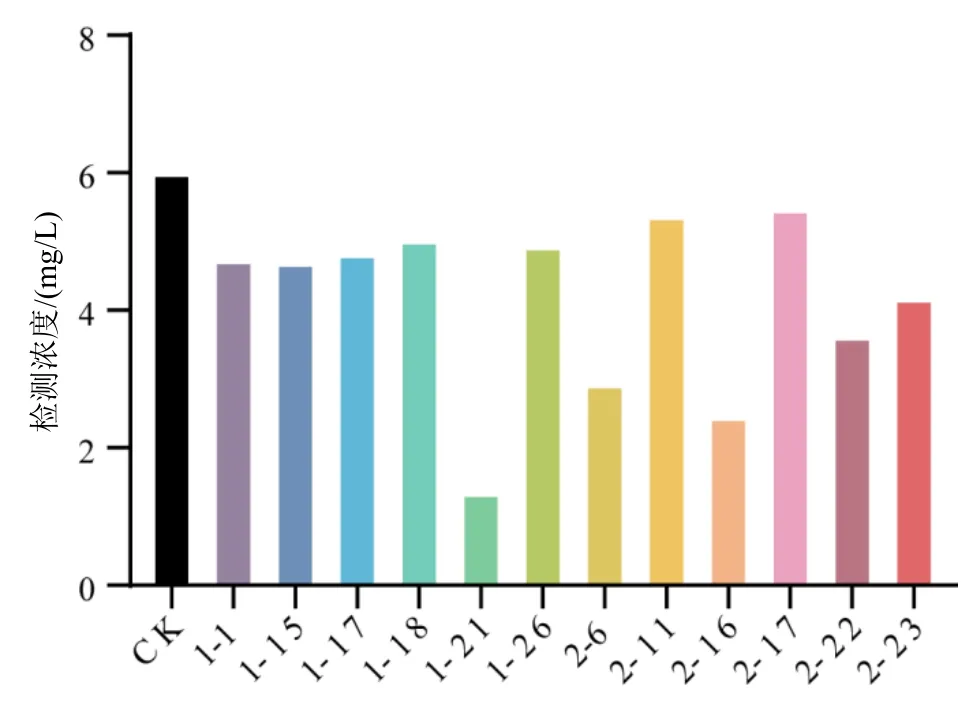
图6 土壤微生物对20 mg/L 环丙氟虫胺原药的降解
3 结论
环丙氟虫胺作为一种间二酰胺类杀虫剂,其作用机制新颖、杀虫谱广,尤其对水稻二化螟具有优异的防效。为应对不当使用该杀虫剂对生态系统存在的潜在风险,本研究首次探究了部分在环境中广泛分布的微生物对于环丙氟虫胺的降解能力;同时,从环境样品中筛选出了环丙氟虫胺的耐受菌,并研究了其对于环丙氟虫胺的降解能力。
研究结果表明,实验室已有的2 株放线菌、2 株细菌、1 株真菌和农田环境中分离得到的3 株环境微生物均具备对环丙氟虫胺的降解能力且降解周期短。环境微生物对环丙氟虫胺的降解将有助于环丙氟虫胺在自然条件下的分解矿化,相关环境微生物降解环丙氟虫胺能力的揭示能够为环丙氟虫胺的微生物降解、环境修复提供有价值的参考信息。但是,也必须要看到,环丙氟虫胺在施用过程中的残留行为以及其在膳食、环境生态和职业暴露风险方面的安全性评价,本研究并未能揭示。同时,微生物对环丙氟虫胺的降解机制、降解产物分析和降解毒理分析,这些都将是有价值的研究方向,有待通过后续进一步的研究加以阐明。
