肿瘤合并肝损伤患者血小板减少症管理中国专家共识(2022版)
2023-07-05中国抗癌协会肿瘤支持治疗专业委员会
中国抗癌协会肿瘤支持治疗专业委员会
血小板减少症通常定义为外周血中血小板计数<100×109/L[1],是肿瘤患者常见并发症。目前,肿瘤治疗所致血小板减少症已有相关指南发布。然而,临床实践中发现,当肿瘤患者合并肝损伤时,因其往往继发门静脉高压和脾功能亢进等,进一步增加了血小板减少症的发生风险及严重程度,使得患者在血小板减少症的管理上面临着更为严峻的挑战。因此,为了填补该领域空白,让肿瘤合并肝损伤患者的血小板减少症得到更科学的管理,中国抗癌协会肿瘤支持治疗专业委员会组织多学科专家讨论制定了首个针对肿瘤合并肝损伤患者血小板减少症管理中国专家共识。共识循证的医学证据等级、推荐等级及定义见表1~2[2]。

表1 循证医学证据等级及定义Table 1 Levels of evidence-based medical proof and definitions

表2 推荐级别及定义Table 2 Recommendation grades and definitions
1 肿瘤合并原发肝病相关血小板减少症
1.1 肿瘤合并原发肝病相关血小板减少症的流行病学
我国肝硬化患者多达700万,每年新增肝癌患者46万[3]。慢性肝病相关血小板减少症患病率介于慢性肝病非肝硬化患者的6%至肝硬化患者85%之间[4-5]。与其他病因所致慢性肝病(毒素/药物性肝炎、酒精性肝炎和非酒精性脂肪性肝炎)相比,乙型肝炎和/或丙型肝炎患者血小板减少症发生率更高[6]。初始血小板减少是乙型肝炎病毒(HBV)相关血小板减少症(hepatitis B virus-associated thrombocyto-penia, HBV-TP)和丙型肝炎病毒(HCV)相关血小板减少症(hepatitis C virus-associated thrombocytopenia, HCV-TP)最显著的危险因素。脾肿大和肝硬化是中度HCV-TP的显著危险因素。高胆红素血症是HBV-TP中、重度的重要危险因素。抗血小板抗体与HCV-TP严重程度相关,这种抗血小板自身抗体可能单独或与脾肿大共同导致血小板减少[7]。目前,肿瘤合并原发肝病患者血小板减少症的流行尚缺乏报道,鉴于肿瘤本身多种因素也会导致血小板减少,肿瘤合并原发肝病患者血小板减少症发生风险会进一步增加。
1.2 肿瘤合并原发肝病相关血小板减少症的病理生理学
肝病患者血小板减少既往被认为主要由脾功能亢进引起。然而,肝病患者血小板减少症是一个复杂和多因素参与的过程,涉及多种不同机制。通常包括血小板生成减少、破坏增加和脾隔离[8-9]。
1.2.1 血小板生成减少 血小板生成素(thrombopoietin, TPO)是促进血小板生成的重要因素,其主要在肝实质和窦状内皮细胞中合成,TPO通过与巨核细胞上的c-Mpl受体结合调节巨核细胞的增殖、分化和成熟,并介导血小板生成[9]。随着肝病进展、严重程度加重,肝脏合成TPO能力下降[10]。此外,肝炎病毒直接的骨髓抑制作用也是血小板生成减少的原因之一[9-10]。酒精对骨髓巨核细胞的毒性作用也可能导致其产生的血小板数量减少[10]。
1.2.2 血小板破坏增加 肝硬化患者血小板相关抗体检出率显著高于健康者[11],针对血小板表面抗原的自身抗体可增强脾和肝网状内皮系统对血小板的清除[12]。此外,肝硬化患者ADAMTS13水平和活性的降低驱动血管性血友病因子(von willebrand factor, vWF)多聚物的积累,这介导了剪切应力诱导的血小板聚集的增强[13-14]。
1.2.3 脾脏隔离 脾脏体积越大提示脾功能亢进越明显,肿大的脾脏内潴留的血细胞越多,脾内巨噬细胞吞噬血细胞作用越强,故脾脏大小与血小板计数成反比[10,15]。除肿大的脾脏对血小板的储存增加外,脾亢导致血小板下降的机制还涉及脾脏释放的血管活性物质和细胞因子增加等[9-10]。
1.3 肿瘤合并原发肝病相关血小板减少症的诊断及评估
1.3.1 诊断标准 原发肝病相关血小板减少症的临床诊断标准包含下述要点:(1)外周血血小板计数<100×109/L;(2)肝病符合原发病因引起的病毒性肝病、酒精性肝病、非酒精性脂肪性肝病及自身免疫性肝病等相关诊断标准[16-21](附表1);(3)排除其他基础疾病和/或合并症导致的血小板减少症,如再生障碍性贫血、白血病、原发免疫性血小板减少症、骨髓肿瘤细胞浸润等;(4)排除抗肿瘤治疗和/或其他药物所致血小板减少,包括放疗、化疗、靶向、免疫治疗、抗生素、抗体偶联药物、肝素等;(5)排除乙二胺四乙酸抗凝剂所致的假性血小板减少症。

附表1~4见二维码
1.3.2 鉴别诊断 肿瘤治疗所致血小板减少症,尤其是放化疗所致血小板减少,患者血小板计数波动往往与肿瘤治疗减停密切相关。基线血小板计数随时间缓慢下降且似乎与肿瘤治疗相关波动无关的患者应考虑肿瘤骨转移或慢性肝病。肿瘤患者由于免疫抑制、留置导管、手术等医源性原因,容易合并感染,感染可通过多种机制导致血小板减少。除肿瘤治疗外,肝素类药物和抗生素等药物也可能导致血小板减少,输血沉淀也可能导致输血后紫癜[22]。因此,详细了解患者血小板减少的临床背景、完善实验室检查有助于明确血小板减少的复杂病因。常规筛查不能明确血小板减少诊断者,可结合病史及临床表现选择确诊实验室检查[1],如,抗血小板特异性抗体对鉴别免疫性与非免疫性血小板减少症具有重要临床意义[23]。血小板减少症鉴别诊断见表3[1,24-26]。

表3 血小板减少症鉴别诊断Table 3 Differential diagnosis of thrombocytopenia
1.3.3 血小板减少症分级 血小板减少最常用的严重程度分级标准是来自美国国家癌症研究所的不良事件术语标准(CT-CAE)。根据CTCAE(v.5.0)不良事件“血小板减少”分级,低于正常范围的下限至75×109/L是1级;<75×109/L~50×109/L为2级;<50×109/L~25×109/L为3级;<25×109/L为4级[27]。通常当患者血小板计数>50×109/L时,出血症状较少见;血小板计数(30~50)×109/L时,患者可表现为皮肤紫癜、瘀斑;血小板计数(10~30)×109/L时,患者会因外伤出血难止;血小板计数<10×109/L时,患者可能出现危及生命的出血风险[28]。
1.3.4 出血严重程度分级 轻中度:无出血症状或仅有皮肤出血点/瘀斑[29]。重度:有出血症状,包括皮肤黏膜出血,消化系统、呼吸系统、泌尿生殖系统及颅内出血等[29]。
1.4 肿瘤合并原发肝病相关血小板减少症治疗
1.4.1 治疗目标 (1)提高血小板计数,降低其所导致的自发性出血风险;(2)减少因血小板减少导致的肿瘤系统治疗减量或延迟;(3)将血小板计数维持在侵入性操作或手术的参考阈值以上,降低围手术期操作或手术相关创伤性出血风险。
1.4.2 治疗原则 肿瘤合并原发肝病相关血小板减少症的治疗首先为病因治疗,并根据是否出血及治疗目标进行分级管理。为避免因为血小板过低引起致命性出血,需考虑及时采取血小板输注、药物(如促血小板生成药物、免疫抑制剂等)或手术(如脾切除、部分脾动脉栓塞等)进行综合治疗。治疗措施的选择需根据患者血小板减少的病因、病理生理机制,兼顾肝损伤的处理,并优选适应证获批及无肝毒性的药物。治疗期间应密切监测血小板计数,避免血小板计数过度提升增加血栓风险。
1.4.3 治疗措施
1.4.3.1 血小板输注 体外研究[30]提示血小板计数高于56×109/L可改善肝硬化患者凝血酶生成,但研究[31]显示血小板输注并未能显著改善肝硬化患者凝血酶生成和出血风险相关粘弹性标志物。美国胃肠病学会建议基于手术类型及手术部位进行风险分层,肝硬化患者无术前出凝血相关常规实验室检查的安全界值。处理出凝血时可通过血栓弹力图指导个体化治疗,同时避免非必要的输血和容量过负荷,不建议常规使用血制品(如FFP或PLTs)预防出血[32-33]。美国临床肿瘤学会认为血小板输注的阈值需根据患者的诊断、临床状况和治疗方式进行调整。实体肿瘤患者发生化疗所致血小板减少期间的出血风险与血小板最低值及其持续时间有关。专家组建议预防性血小板输注阈值为10×109/L,发生活动性出血患者血小板输注阈值可高于10×109/L。无相关凝血异常情况下进行高风险侵入性操作时血小板输注阈值为40×109/L~50×109/L,若在术前输注血小板,血小板计数达到侵入性操作或手术要求的安全阈值至关重要[34]。
1.4.3.2 血小板生成素受体激动剂 TPO受体激动剂(TPO receptor agonist, TPO-RA),相较于第一代TPO类似物免疫原性方面得到了改善。目前,国内获批上市的TPO-RAs包括罗普司亭、艾曲泊帕、阿伐曲泊帕、海曲泊帕(表4)[35-36],主要用于治疗免疫性血小板减少症(immune thrombocytopenia, ITP)、重度再生障碍性贫血(sever aplastic anemia, SAA)及慢性肝病(chronic liver disease, CLD)相关血小板减少症[22],其中仅阿伐曲泊帕获批用于肝病相关血小板减少症。

表4 中国获批上市TPO受体激动剂Table 4 TPO-RAs approved for marketing in China
阿伐曲泊帕两项Ⅲ期研究显示:阿伐曲泊帕组无需血小板输注或任何因出血抢救患者比例显著高于安慰剂组,侵入性操作当天血小板计数≥50×109/L患者比例相比安慰剂组更高[37]。艾曲泊帕相比安慰剂显著降低操作前至之后7天血小板输注患者比例,但6例接受艾曲泊帕治疗的患者发生门静脉血栓事件,导致研究提前终止[38]。罗普司亭小样本研究提示术前用于HCV感染相关血小板减少症(血小板计数<50×109/L),可使大部分患者血小板计数≥70×109/L并接受了手术[39]。一项荟萃分析结果显示TPO-RA显著增加术前血小板计数>50×109/L患者比例,降低血小板输注率,未增加血栓形成风险[40]。
1.4.3.3 重组人血小板生成素 重组人血小板生成素(rhTPO)最早在国外进行开发,但由于担心生成中和抗体,开发终止[41]。2005年,rhTPO在中国获批上市,主要用于实体瘤化疗后所致的血小板减少症和原发免疫性血小板减少症的辅助治疗。一项回顾性分析显示肝病相关血小板减少症患者,术前接受 rhTPO治疗,第8天时,血小板计数较基线明显升高;第12天时,血小板计数达到高峰[42]。此外,分析发现无脾肿大肝硬化患者应用rhTPO效果更好[43]。
1.4.3.4 重组人白细胞介素-11(rhIL-11) 1997年,rhIL-11正式被美国食品和药品监督管理局(FDA)批准上市,成为首个应用于肿瘤化疗、放疗后特异性升血小板药物[44]。2003年,首个rhIL-11在中国获批上市,主要用于实体瘤、非髓性白血病化疗后3或4级血小板减少症的治疗[45]。rhIL-11用于肝硬化脾功能亢进所致血小板减少症(血小板计数≤75×109/L)患者,治疗结束后血小板计数平均升高幅度仅为(5.95±12.31)×109/L[46]。
1.4.4 肿瘤合并原发肝病相关血小板减少症管理 尽管对于脾肿大/脾功能亢进所致的血小板减少,PSAE、脾切除是有效的治疗选择,但脾切除、PSAE等有创治疗往往面临较高的并发症,甚至死亡风险。目前,已有TPO-RA获批用于慢性肝病相关血小板减少症的治疗,其能够以较低的不良事件发生率提升血小板计数。但具体治疗措施的选择需基于患者血小板减少的病理生理机制,如脾功能亢进/脾肿大严重程度等,治疗目的以及身体状态等综合考虑。有创治疗甚至可能需要通过多学科讨论后在特定人群中有条件应用。肿瘤合并原发肝病相关血小板减少症管理流程见图1。
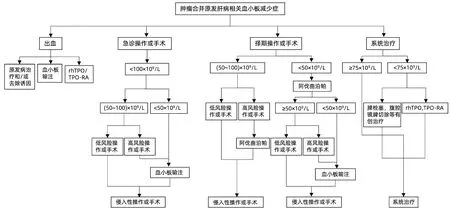
图1 肿瘤合并原发肝病相关血小板减少症管理流程Figure 1 Management of thrombocytopenia in cancer patients with primary liver disease
推荐意见1:肿瘤合并原发肝病相关血小板减少症患者,若发生出血,在积极处理原发病和/或诱因情况下,可考虑给予血小板输注,rhTPO或TPO-RA(证据等级:Ⅲ级,推荐级别:弱推荐)。
推荐意见2:肿瘤合并原发肝病相关血小板减少症患者拟接受侵入性操作或手术患者,紧急情况下给予血小板输注;非紧急情况下可考虑给予肝功能影响较小的TPO-RA(如阿伐曲泊帕)或rhTPO,将血小板计数提升至侵入性操作或手术要求的安全阈值(证据等级:Ⅱ级,推荐级别:推荐)。
推荐意见3:肿瘤合并原发肝病相关血小板减少症患者拟接受系统治疗时,因系统治疗的长期性,对于严重脾功能亢进/脾肿大患者,可考虑脾栓塞、脾切除等有创治疗,存在有创治疗禁忌的患者,可考虑给予rhTPO或TPO-RA治疗(证据等级:Ⅲ级,推荐级别:弱推荐)。
1.5 肿瘤治疗所致血小板减少合并原发肝病患者血小板减少症管理 肿瘤治疗所致血小板减少症合并原发肝病患者血小板减少的管理,可参考《肿瘤治疗所致血小板减少症诊疗指南(2022版)》[29]。《指南》推荐上一个化疗周期血小板计数最低值<50×109/L,或上一个化疗周期血小板计数最低值≥50×109/L,但<75×109/L,同时合并至少1个出血高风险因素患者,可预防性应用促血小板生长因子,以保证化疗的顺利进行[29]。虽然缺乏肿瘤治疗所致血小板减少症合并原发肝病患者二级预防的循证证据,但考虑到肝病本身会影响血小板的生成、破坏及分布,无疑会增加肿瘤治疗所致血小板减少症的发生风险及恢复难度。因此,可采取相对更为积极的二级预防策略。
推荐意见4:针对肿瘤治疗所致血小板减少合并原发肝病患者,制定血小板减少症管理方案时,需选择对肝功能影响较小的药物(如阿伐曲泊帕)。此外,在治疗时机选择等方面也应区别对待,如积极进行二级预防等(证据等级:Ⅲ级,推荐级别:弱推荐)。
1.6 不良反应管理
第一,要在水资源配置中充分考虑农业用水和保障粮食安全的用水需求。水利部会同发改委等部门编制了全国水资源综合规划,明确了水资源配置方案,其中充分考虑了近期、中期和远期农业用水需求。
1.6.1 药物不良反应概述 TPO-RA所致ADR多出现在6个月以内,以循环系统、血液系统为主,临床表现为动、静脉血栓、骨髓纤维化、肝毒性等。该类药物使用剂量和时长与发生血栓的时间、严重程度无明显相关性[55]。但若患者合并血栓性疾病,如:冠状动脉粥样硬化性疾病、心肌梗死、脑卒中时,在使用TPO-RA过程中应严密监测原发病控制情况,并定期复查。Ghanima等[56]总结TPO-RA上市十年的临床应用进展,仅少数患者观察到中等程度的骨髓蛋白纤维化,但该不良事件与治疗药物的种类、剂量或持续时间的相关性尚未明确。文献报道,2例儿童患者接受艾曲泊帕治疗后发生急性肝衰[55,57],FDA和NMPA给予艾曲泊帕肝毒性黑框警告,提示其可能增加出现严重及潜在威胁生命的肝毒性风险,使用过程中应监测患者肝功能并适时调整用药[58]。
rhTPO不良反应主要包括发热、寒战、全身不适、乏力等,总体不良反应程度较轻[59-61]。一项非随机、平行对照研究[62]显示,采用rhTPO后的不良反应发生率为11.4%,而rhIL-11的不良反应发生率为78.4%。
rhIL-11属于炎性反应因子,因此容易引起全身性不良反应,包括乏力、低热、呕吐、关节酸痛和血栓等;同时,rhIL-11对心脏及肾脏也有一定损伤,可造成心动过速、血管扩张、房颤、房扑、体液潴留等;还可累及消化系统、神经系统和呼吸系统,造成严重的过敏反应[63]。
推荐意见5:TPO-RA、rhTPO、rhIL-11不良反应大多数为轻至中度,停药后可迅速消退。一旦出现疑似不良反应,建议鉴别诊断后给予相应对症处理(证据等级:Ⅲ级,推荐级别:推荐)。
1.6.2 血栓形成/血栓栓塞管理 门静脉血栓(portal vein thrombosis, PVT)是肝硬化患者的常见并发症,患病率为10%~25%[64-65]。恶性肿瘤本身是引发静脉血栓栓塞症(venous thromboembolism, VTE)最重要的危险因素,首次发生VTE 的病例中20%~30%与肿瘤相关[66]。肝病相关血小板减少症的药物及有创治疗均有静脉血栓的报道[38,52-53]。《肝硬化门静脉血栓管理专家共识(2020年)》[67]推荐肝硬化PVT患者抗凝治疗前,应进行内镜和血液学检查,充分评估出血风险。抗凝治疗主要适应症为急性症状性PVT、等待肝移植、合并肠系膜静脉血栓形成;伴有近期出血史、重度食管胃静脉曲张( gas-troesophageal varices, GEV) 、严重血小板减少症的肝硬化PVT患者应暂缓抗凝治疗。《2022 EHA指南:肿瘤合并血小板减少症患者抗栓治疗管理》推荐1/2级血小板减少症患者,若血小板计数稳定,继续口服或注射抗凝治疗,若血小板计数不稳定,采用低分子肝素抗凝;3级血小板减少症患者,若血栓风险高且血小板减少预计数周至数月保持稳定,可考虑给予剂量减半低分子肝素抗凝治疗,并且密切监测血小板计数;4级血小板减少症患者应停止抗凝治疗[68]。《肿瘤患者静脉血栓防治指南(2020版)》[69]推荐对于肿瘤合并VTE或具有VTE高风险的肿瘤患者,在治疗过程中需密切监测血小板计数,并根据静脉血栓栓塞症的评估风险进行预防或治疗。
推荐意见6:肿瘤合并原发肝病相关血小板减少症患者治疗期间需密切监测血小板计数,防止血小板计数过度升高,增加血栓形成风险。若发生1/2级血小板减少伴血栓形成,应考虑进行抗凝治疗;3/4级血小板减少伴血栓形成时,抗凝治疗需谨慎(证据等级:Ⅱ级,推荐级别:推荐)。
2 肿瘤治疗继发肝损伤合并血小板减少症
2.1 概述 药物性肝损伤(drug induced liver injury, DILI)患者中抗肿瘤药或免疫调节剂占8.34%[70]。接受奥沙利铂治疗结肠腺癌的患者肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS)发生率达50%[71];5-氟尿嘧啶、伊立替康、巯唑嘌呤、卡莫司汀、环磷酰胺、达卡巴嗪等抗肿瘤药物也会增加HSOS发生风险[72-73]。免疫检查点抑制剂相关肝炎在PD-1/PD-L1抑制剂治疗中的发生率为9%~20%[74]。52%接受仑伐替尼治疗患者血清转氨酶升高[75]。抗体偶联药物(ADCs)治疗后DILI发生率为7.9%[76]。此外,放射治疗亦可导致一种临床亚急性、慢性肝脏损伤,特别是胸腹部肿瘤放疗[77]。
血小板减少症是抗肿瘤治疗常见血液学毒性反应。研究报道化疗所致血小板减少症发生率9.7%[78],不同靶向治疗血小板减少发生率达2%~78%[79-80],免疫检查点抑制剂相关血小板减少症≥3级发生率1.73%[81]。
因此,在肿瘤治疗过程中,继发肝损伤、血小板减少症常常相伴存在。临床常见引起肝损伤的抗肿瘤药物见表5[71-77]。

表5 临床常见引起肝损伤的抗肿瘤药物Table 5 Common anti-cancer drugs causing liver injury in clinical practice
2.2 诊断 DILI的临床诊断依赖排除法,通过收集完整的病史、全面的血液检测、肝胆影像和肝活检等资料,排除其他病因,以推断DILI的诊断。为了降低临床诊断的主观倾向性,目前有一些相对客观的因果评分系统,包括RUCAM(Roussel-Uclaf causality assessment method)量表(附表4)等[82]。血小板减少症的病因诊断往往更加复杂,一方面肿瘤治疗可直接导致血液学毒性发生,同时亦可能与肿瘤治疗继发的肝损伤有关。因此,掌握准确的药物暴露史、肝功能异常和血小板减少的病程非常重要。
2.3 治疗原则及方案 肿瘤治疗继发肝损伤合并血小板减少症的治疗原则[83]:(1)及时停用可疑肝损伤药物,尽量避免再次使用可疑或同类药物;(2)应充分权衡停药引起原发病进展和继续用药导致肝损伤加重的风险;(3)根据DILI的临床类型选用适当的药物治疗;(4)血小板减少症的治疗可参考原发肝病相关血小板减少症和肿瘤治疗所致血小板减少症进行处理。
奥沙利铂免疫诱导综合征(Oxaliplatin im-mune-induced syndrome, OIIS)临床处理措施包括永久停用奥沙利铂,皮质类固醇和IVIG的应用尚未得到证实,但是可以考虑[84]。Jácome等[85]回顾性分析PSE用于化疗所致脾功能亢进,PSE后80%患者血小板计数≥100×109/L,81%患者恢复系统治疗,脾脏梗死比例与血小板计数增加呈线性相关。Overman等[86]开展的一项队列研究显示,在转移性CRC中,以奥沙利铂为基础的化疗中加用贝伐珠单抗可降低脾脏肿大和血小板减少的发生风险。
推荐意见7:肿瘤治疗继发肝损伤合并血小板减少症患者,血小板减少症治疗方案的选择可参考原发肝病相关血小板减少症和肿瘤治疗所致血小板减少症,升血小板药物推荐对肝功能影响较小的药物(如阿伐曲泊帕)(证据等级:Ⅲ级,推荐级别:弱推荐)。
3 肿瘤合并肝损伤患者血小板减少症多学科管理及健康教育
3.1 肿瘤合并肝损伤患者血小板减少症多学科管理
肿瘤合并肝损伤患者血小板减少症病因及发生机制复杂,其诊断和治疗涉及肿瘤科、肝病科、血液科、介入、外科等多个学科。通过多学科的协同诊疗,可最大限度地发挥各个学科的专业优势,使患者获益最大化。血小板减少症病因诊断不明的患者;重度血小板减少且病情危重的患者;经常规治疗血小板计数恢复不佳,影响肿瘤进一步诊疗的患者等,建议上报院内或院际多学科团队协作模式(multi-disciplinary team, MDT),邀请MDT相关专家会诊,制定诊疗方案,并做好追踪随访。MDT执行流程见图2。
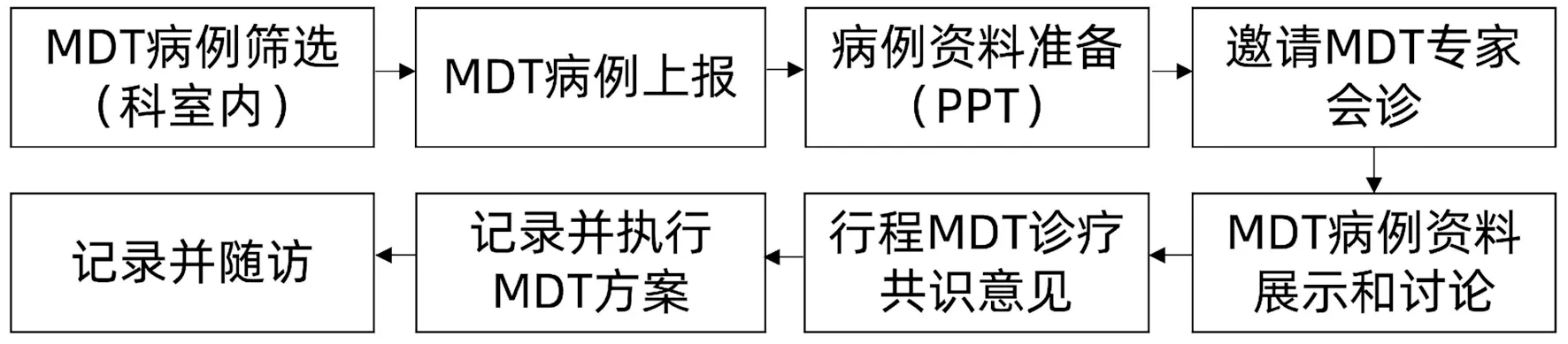
图2 MDT执行流程Figure 2 MDT execution process
推荐意见8:血小板减少症病因诊断不明,重度血小板减少且病情危重,经常规治疗血小板计数恢复不佳的肿瘤合并肝损伤患者,建议通过多学科协同诊疗(证据级别:Ⅳ级,推荐级别:推荐)。
3.2 肿瘤合并肝损伤患者血小板减少症健康教育
肿瘤合并肝损伤患者重度血小板减少引起的出血是导致患者死亡的主要原因之一。同时合并食管胃底静脉曲张破裂、胃和十二指肠消化性溃疡或食道/胃/十二指肠黏膜糜烂病等患者发生急性上消化道出血风险较高,是最常见的消化系统急症。Qdaisat等[87]分析急诊科肿瘤患者颅内出血的特征和结局,发现低血小板计数与住院死亡率和30天死亡率显著相关。因此,加强肿瘤合并肝损伤患者血小板减少症的风险管理和健康教育尤为重要。
3.2.1 风险管理与健康教育
(1)仔细询问病史、月经史、用药史,尤其是肝病相关的既往病史、既往出血史,抗凝、抗血小板等伴随用药情况。
(2)肿瘤治疗期间定期监测血生化、血常规。并根据血小板减少程度进行分级管理。
(3)遵循说明书、临床指南、专家共识合理用药,严格遵循用药指征,避免使用不规范、不适宜和超常处方,避免滥用药物。
(4)加强远程健康管理,实现治疗间歇期的远程照护和管理可以提高患者对医疗支持的可及性。
(5)由于肿瘤患者自身病理生理学特点和抗肿瘤治疗的复杂性,建议对肿瘤合并肝损伤患者行多学科和动态管理。
(6)加强患者风险意识管理,告知患者血小板减少的风险及可能出现的症状;血小板减少时避免过度用力、外伤等;监测血小板,关注皮肤瘀斑、皮肤黏膜出血、牙龈出血、消化道、泌尿道出血等症状;促使患者对血小板减少症保持警觉。
共识编委名单:
顾问:于世英(华中科技大学同济医学院附属同济医院)
主编:袁响林(华中科技大学同济医学院附属同济医院)、巴一(天津医科大学肿瘤医院)
副主编:张俊(上海交通大学医学院附属瑞金医院)、章真(复旦大学肿瘤医院)、熊建萍(南昌大学第一附属医院)、张小田(北京大学肿瘤医院)、王风华(中山大学肿瘤防治中心)
编委(以姓氏汉语拼音为序):安汉祥(厦门大学附属翔安医院)、陈公琰(哈尔滨医科大学附属肿瘤医院)、陈永兵(首都医科大学附属北京世纪坛医院)、戴宇翃(华中科技大学同济医学院附属同济医院)、邓婷(天津医科大学肿瘤医院)、邓艳红(中山大学附属第六医院)、巩平(新疆石河子大学医学院第一附属医院)、黄河(山西医大一附院)、黄梅(华中科技大学同济医学院附属同济医院)、黄元成(华中科技大学同济医学院附属同济医院)、刘巍(北京大学肿瘤医院)、刘波(山东省肿瘤医院)、刘勇(哈尔滨医科大学附属第四医院)、李秋(四川大学华西医院)、李苏宜(安徽省肿瘤医院)、李龙(华中科技大学同济医学院附属同济医院)、罗素霞(河南省肿瘤医院)、赖浩(广西医科大学肿瘤医院)、马虎(遵义医学院附属肿瘤医院)、牛作兴(山东省肿瘤医院)、邱红(华中科技大学同济医学院附属同济医院)、邱萌(四川大学华西医院)、邱文生(青岛大学附属医院)、石汉平(首都医科大学附属北京世纪坛医院)、孙凌宇(哈尔滨医科大学附属第四医院)、宋春花(郑州大学公共卫生学院)、施咏梅(上海交通大学医学院附属瑞金医院)、佟仲生(天津医科大学肿瘤医院)、王畅(吉林大学第一医院肿瘤中心)、夏曙(华中科技大学同济医学院附属同济医院)、肖莉(厦门大学附属中山医院)、袁瑛(浙江大学医学院附属第二医院)、姚庆华(浙江省肿瘤医院)、曾珊(中南大学湘雅医院)、赵岩(辽宁省肿瘤医院)、赵君慧(青海大学附属医院)、朱骥(浙江省肿瘤医院)、朱江(四川大学华西医院)
利益冲突声明:所有作者声明无利益冲突。

参考文献见二维码
