结肠癌患者癌组织中CDCA5的表达变化及机制
2023-07-03牛学敏赵树巧郭争荣韩聪郝津王娜范红伟张晓博张新元
牛学敏 赵树巧 郭争荣 韩聪 郝津 王娜 范红伟 张晓博 张新元
近年来,随着生活水平的提升,我国居民饮食习惯和饮食结构发生了根本性改变,导致我国结肠癌的发病率不断上升。2017《中国大肠癌流行病学及预防和筛查白皮书》显示,结直肠癌居恶性肿瘤发病率第3位,死亡率居第5位[1,2]。研究表明,细胞分裂发生故障可导致癌症,而细胞周期的异常改变可导致癌细胞不受控制地增殖;另一方面许多细胞周期相关基因在癌症中被调控,而这些基因很可能是药物治疗的靶点[3]。细胞分裂周期相关(cell division cycle-associated,CDCA)蛋白家族由8个成员组成,其中CDCA5基因位于人类11号染色体,11q13.1,在间期细胞的细胞核中表达,也会参与细胞的分裂。近年来有研究表明,CDCA5mRNA在多种肿瘤细胞中具有较高的转录水平,如膀胱癌、肝癌、胃癌、肺癌等,提示CDCA5可能与肿瘤细胞较高的恶性增殖活性有关[4]。目前研究表明肿瘤细胞中CDCA5的普遍性高水平表达与细胞增殖、转移、侵袭有关,甚至与肿瘤患者预后有关[5]。CDCA5高表达可能是肿瘤细胞区别与正常组织细胞的特征,有可能成为肿瘤治疗的潜在治疗靶标分子。本研究旨在探讨CDCA5在结肠癌及结肠癌旁组织中的表达水平及其可能的作用机制,为结肠癌靶向治疗提供科学依据。
1 资料与方法
1.1 一般资料 收集2020年1月至2021年12月在我院住院治疗的 30例经病理学检查确诊的结肠癌患者癌组织、癌旁正常组织,部分组织以10%中性甲醛固定后,用于病理学检测,其余组织以液氮快速冷冻后置于-80℃冰箱保存,备提取蛋白及RNA。同时收集结肠癌患者血标本,同期随机选取门诊30例经结肠镜检查正常的血液标本;病例均无术前放化疗、激素治疗病史,且已排除合并其他恶性肿瘤。收集患者性别、年龄、吸烟史、饮酒史、人体测量学指标,包括身高(m)、体重(kg)、腰围(cm)及体重指数(body mass index,BMI),BMI=体重(kg)/身高2(m2)。本研究经医学伦理委员会批准,研究对象均签署知情同意书。结肠癌患者与健康人群的一般资料比较,结肠癌患者发病平均年龄(66.17±13.02)岁,明显高于健康对照组(P<0.01),性别、BMI、饮酒、吸烟方面两者无明显差异(P>0.05),三酰甘油高的人群更容易患结肠癌(P<0.05)。见表1。

表1 年龄、性别比、BMI、饮酒、吸烟、三酰甘油与结肠癌的相关性 n=30
1.2 材料 小鼠抗人β-actin单克隆抗体,小鼠抗人CDCA5单克隆抗体、兔抗人pERK多克隆抗体、兔抗人cyclinB1多克隆抗体、兔抗人P21多克隆抗体购自武汉三鹰生物技术有限公司;小鼠抗人caspase3多克隆抗体购自美国Novus Biologicals公司;山羊抗鼠/兔二抗购自美国ProteinTech公司。
1.3 方法
1.3.1 血清生化学检测:留取空腹静脉血,4℃离心,留取血清,采用日本奥林巴斯 AU 5400全自动生化分析仪检测三酰甘油(triglyceride,TG)水平,严格按照操作规程进行。
1.3.2 结肠组织病理学观察
1.3.2.1 苏木素-伊红(HE)染色:石蜡切片4 μm,脱蜡至水,苏木素染色5 min,蒸馏水洗,1%盐酸-乙醇分化5~10 s,1%氨水返蓝10 s,蒸馏水洗,伊红染色1 min,常规水清洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.3.2.2 结肠癌及癌旁组织CDCA5免疫组织化学染色:石蜡切片脱蜡至水,枸橼酸缓冲修复液(pH值=6.0)抗原修复10 min,3%H2O2孵育20 min,封闭后,滴加一抗鼠抗CDCA5单克隆抗体(1∶100),阴性对照用PBS代替一抗,4℃过夜,滴加羊抗鼠二抗试剂,37℃孵育30 min,DAB显色,复染,封片,棕黄色为阳性染色。
1.3.3 结肠癌及癌旁组织CDCA5、cyclinB1、ERK、P21、caspase3mRNA表达:以Trizol法提取RNA,应用Rever Aid First cDNA Synthesis Kit逆转录合成cDNA,以适量cDNA为模板,以GAPDH为内参照,进行实时定量扩增。每个基因重复操作3次,运用2-ΔΔCT法分析结果。依据Genbank设计引物序列,由上海生物工程公司合成。见表2。
1.3.4 结肠癌及癌旁组织CDCA5、cyclinB1、pERK、P21、caspase3蛋白表达:采用Western Blot法,应用组织裂解液提取组织总蛋白,以紫外分光光度计测定蛋白浓度。取80 μg蛋白,经SDS-PAGE电泳,转移至PVDF膜,封闭, 分别加入鼠抗β-actin单克隆抗体(1∶4 000),小鼠抗人CDCA5单克隆抗体(1∶1 000)、兔抗cyclinB1多克隆抗体(1∶8 00)、兔抗pERK多克隆抗体(1∶1 000)、兔抗P21多克隆抗体(1∶800)、鼠抗caspase3单克隆抗体(1∶1 000)4℃孵育过夜,PBS洗膜3次,加入辣根过氧化物酶标记的羊抗鼠/兔二抗(1∶5 000),常温摇床孵育1 h,PBS洗膜3次,ECL试剂发光,显影及定影。凝胶定量软件Quantity One分析各条带灰度值,以β-actin为内参照计算各组蛋白相对表达量。

2 结果
2.1 CDCA5在结肠癌及癌旁组织中的蛋白表达 免疫组织化学证实CDCA5在结肠癌组织中的表达水平明显高于癌旁正常组织。见图1。
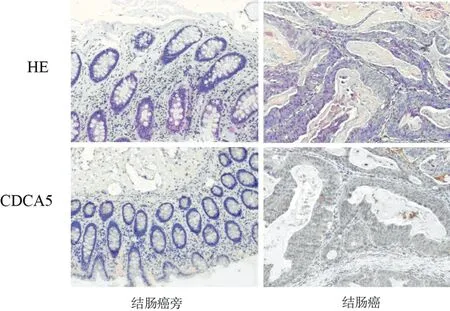
图1 CDCA5在结肠癌及癌旁组织的表达(免疫组织化学×100)
2.2 采用qRT-PCR及WB检测CDCA5的mRNA及蛋白表达 结肠癌组织CDCA5 mRNA的表达水平(0.96±0.13)明显高于癌旁正常组织(0.30±0.46)(P<0.001);结肠癌组织CDCA5蛋白水平(1.46±0.36)较癌旁正常组织明显升高(0.86±0.20)(P<0.001)。见图2,表3。

图2 结肠癌及结肠癌旁组织中CDCA5的mRNA及蛋白水平

图3 结肠癌及结肠癌旁组织中cyclinB1的mRNA及蛋白水平

表3 结肠癌及结肠癌旁组织中CDCA5的表达水平 n=30,
2.4 增殖cyclinB1和P21mRNA及蛋白结肠癌组织中的表达 结肠癌组织中cyclinB1 mRNA的表达水平(1.45±0.22)明显高于癌旁正常组织(0.93±0.22)(P<0.001);其蛋白表达水平结肠癌组织(0.52±0.13)高于癌旁正常组织(0.18±0.06)(P<0.001),结肠癌组织中P21mRNA的水平(1.31±0.19)明显高于癌旁正常组织(0.96±0.09)(P<0.01);其蛋白水平结肠癌组织(0.72±0.11)高于癌旁正常组织(0.31±0.09)(P<0.01)。见表4、5,图4。

图4 结肠癌及结肠癌旁组织中P21的mRNA及蛋白水平

表4 结肠癌及结肠癌旁组织中cyclinB1的表达水平 n=30,

表5 结肠癌及结肠癌旁组织中P21的表达水平 n=30,
2.5 ERK及凋亡因子caspase3的表达 发现具有高水平 CDCA5 的结肠癌患者也具有高ERK磷酸化水平,结肠癌组织中ERK mRNA的表达水平(1.83±0.53)高于癌旁正常组织(0.92±0.12)(P<0.01),其pERK的蛋白在结肠癌中表达水平(0.79±0.14)明显高于癌旁正常组织(0.16±0.07)。 CDCA5高表达的结肠癌患者中caspase3的mRNA及蛋白表达水平较癌旁正常组织较低(P<0.001)。 这表明高表达的CDCA5可以促进结肠癌细胞的增殖并抑制其凋亡。见表6、7,图5、6。

图5 结肠癌及结肠癌旁组织中ERK的mRNA及蛋白水平

图6 结肠癌及结肠癌旁组织中caspase3的mRNA及蛋白水平

表6 结肠癌及结肠癌旁组织中ERK的表达水平 n=30,

表7 结肠癌及结肠癌旁组织中caspase3的表达水平 n=30,
3 讨论
细胞周期调控紊乱是恶性肿瘤的重要生物学特征,可导致恶性细胞凋亡减少、无限增殖和转移。细胞周期中断是恶性肿瘤最重要的原因之一[6]。 许多细胞周期相关基因在癌症中失调,这些基因可能是药物治疗的潜在靶点[7,8]。CDCA5 属于细胞分裂周期相关蛋白家族,其主要作用是促进姐妹染色单体结合并确保准确的姐妹染色单体分离以维持基因组完整性[9]。 CDCA5调节细胞周期相关蛋白和转录因子的活性,促进癌细胞增殖,参与癌细胞凋亡。研究表明肿瘤细胞中CDCA5的普遍性高水平表达与细胞增殖、转移、侵袭有关,甚至与肿瘤患者预后有关[10]。有结果表明,前列腺癌组织中CDCA5的mRNA和蛋白表达水平显著高于癌旁正常组织,CDCA5 的高表达与前列腺癌患者的预后相关。 在体外和体内研究发现CDCA5 表达敲低显著减少了有丝分裂中前列腺癌细胞的数量并抑制了它们的增殖[11]。
本研究结果发现CDCA5在结肠癌组织中的mRNA及蛋白表达水平明显高于癌旁正常组织,说明CDCA5参与结肠癌的发生发展。本研究发现CDCA5在结肠癌组织中高表达,与子宫内膜癌、肝癌组织中高表达CDCA5的发现[12-14]一致。TCGA(The Cancer Genoma Altlas)数据分析显示,与邻近的正常组织相比,CDCA5在胃癌组织中表达显著上调,进一步通过组织芯片分析证实CDCA5的表达上调与更高级别的临床病理特征显著相关,表达水平越高,胃癌进展越快,沉默胃癌细胞内的CDCA5基因将通过下调CyclinE1诱导细胞阻滞在G1期,进而抑制胃癌细胞的增殖[15]。唐军伟等[16]在结直肠癌细胞中采用非对称抑制CDCA5基因改变细胞周期,其明显降低G0/G1期细胞比例,增加G2/M期细胞比例,从而使细胞阻滞在G2/M期,降低肿瘤细胞的增殖能力。顾朝辉等[17]研究结果表明,CDCA5在膀胱癌组织表达上调,且其高表达与临床分期和病理分级升高相关。综上,CDCA5在多种肿瘤中表达明显升高,与肿瘤细胞增殖有关。
真核细胞的增殖主要由细胞周期介导。G2/M的进展是主要的检查点之一,是由cyclinB1/ CDK1的蛋白质复合物密切调节的。CDCA5是在G2/M期将黏附力与染色单体稳定结合所必需的,并且在细胞周期调控中起着至关重要的作用[10,18]。据报道,抑制CDCA5基因的表达会影响肝癌细胞和结直肠癌细胞的细胞分裂周期,导致生存能力下降[18,19]。很多肿瘤组织cyclinBl表达阳性率明显高于正常组织,本研究发现在结肠癌组织的表达明显高于癌旁正常组织,提示cyclinBl可能参与结肠癌的发生、发展。有研究表明细胞质p21促进了乳腺癌细胞的侵袭和转移,免疫组化结果显示细胞质p21的高表达伴随着细胞质cyclinB1的表达上调[20],本研究结果显示P21在结肠癌组织的基因及蛋白水平明显高于癌旁正常组织,由此推测细胞质p21可能通过cyclinB1调控细胞周期并抑制细胞凋亡,但是具体机制还有待进一步研究。
ERK信号通路在多种细胞过程中起着重要作用,参与多种细胞过程的调节,包括增殖、分化、炎症、转录调节和发育[21]。ERK途径的激活与多种肿瘤的发展密切相关,包括结肠癌。由于ERK主要通过磷酸化激活,我们发现高表达CDCA5水平的结肠癌组织中也具有高水平的ERK的磷酸化,这表明ERK通路的激活有助于结肠癌中CDCA5的致癌活性。Ji等[11]研究发现在体内和体外检查了 CDCA5 敲低后前列腺癌细胞中 ERK 磷酸化的水平。 值得注意的是,一旦CDCA5被抑制,ERK的磷酸化水平就会显着降低,该信号通路的活性也会减弱。CDCA5敲低可降低结肠癌细胞中ERK1/2的磷酸化水平和c-jun的表达,这表明ERK通路的激活有助于结肠癌中CDCA5的致癌活性。有一项肺癌的研究中,CDCA5高表达促进肺癌细胞的增殖,抑制CDCA5和ERK激酶间的相互作用,显著降低CDCA5的磷酸化水平,抑制肺癌细胞的生长[22]。现有研究表明CDCA5表达水平越高患者预后越差,并且CDCA5高表达是肺癌患者预后的独立危险因素[23]。
线粒体依赖性凋亡是主要的凋亡途径,使用慢病毒介导的shRNA对CDCA5基因进行敲除后通过ERK信号通路抑制肿瘤细胞增殖,诱导细胞凋亡[15,18]。凋亡发生是一个由caspase家族成员介导的蛋白酶级联反应过程,不同蛋白酶分别切割并激活caspase3酶原。在这项研究中,我们发现凋亡因子caspase3在结肠癌组织中处于低水平,说明结肠癌组织中细胞凋亡减低,这些发现表明CDCA5通过破坏癌细胞中增殖、凋亡的平衡而产生致癌活性。
以上研究结果表明, CDCA5高表达可能是肿瘤细胞区别于正常组织细胞的特征,结肠癌组织中的CDCA5高表达,可能通过调控细胞周期蛋白cyclinB1、P21、ERK及caspase3抑制细胞凋亡,参与结肠癌的发生、发展,CDCA5有可能成为肿瘤治疗的潜在靶标之一。
