特基拉芽孢杆菌WRN032对稻瘟病菌的生物防治潜力
2023-06-25蒋建兰单潇潇乔建军张桂山
蒋建兰,陈 玉,单潇潇,孙 露,乔建军,张桂山
特基拉芽孢杆菌WRN032对稻瘟病菌的生物防治潜力
蒋建兰1, 2,陈 玉1, 2,单潇潇1, 2,孙 露1, 2,乔建军1, 2,张桂山3, 4
(1. 天津大学系统生物工程教育部重点实验室,天津 300072;2. 天津大学化工学院,天津 300072;3. 中国农业科学院农业资源与农业区划研究所,北京 100081;4. 农业部农业微生物资源收集与保藏重点实验室,北京 100081)
植物病原真菌是农作物病害的主要致病菌,导致作物减产,严重阻碍农业发展.病原真菌种类繁多,作用机制复杂,防治难度大,传统化学防治手段无法满足当今发展需求,而生物防治是一种安全、绿色、高效的防控手段.以来源于土壤和植物根茎的多种细菌为研究对象,以菌种的抑菌活性为指标,采用牛津杯法,筛选出一株具有生物防治潜力的细菌WRN032,对黑腐皮壳菌()、禾谷镰刀菌()和稻瘟病菌()的生长均具有不同程度的拮抗作用,其中对稻瘟病菌的抑制作用较强.使用石油醚、正丁醇和乙酸乙酯依次对菌株WRN032的发酵液进行萃取,发现其乙酸乙酯提取物对稻瘟病菌有强拮抗作用.结合生理生化鉴定及16S rDNA序列分析对其菌种进行鉴定,结果表明该细菌为特基拉芽孢杆菌().对特基拉芽孢杆菌WRN032代谢产物中的活性物质进行稳定性试验,表明其在高温、强酸性、中性和弱碱性条件下均具有良好的稳定性,且对紫外光不敏感.采用柱层析法和半制备层析法对特基拉芽孢杆菌WRN032发酵液中的活性物质进行分离纯化,其纯化物对稻瘟病菌的相对抑制率与相同浓度的75%三环唑可湿性粉剂相近.当浓度为100.0µg/mL时,相对抑制率为51.2%,与75%三环唑可湿性粉剂(56.4%)基本相同.研究表明,特基拉芽孢杆菌WRN032具有作为农业生物防治剂的潜力.
特基拉芽孢杆菌;WRN032;稻瘟病菌;分离鉴定;抑菌活性;生物防治
由多种致病真菌引起的疾病给全球粮食安全带来了严重威胁[1].水稻是全球重要的粮食作物[2],因此人们非常重视水稻的发展和产量的提高[3].稻瘟病菌()是一种丝状子囊真菌,是稻瘟病的致病因子,也是水稻长期减产的主要原因[4].目前,常用的稻瘟病防治剂是化学农药.然而,化学农药在控制病原真菌的同时也会造成严重的环境污染[5-6].因此,为了保证稻米品质,保护农业生态环境,迫切需要寻找绿色无污染且高效的稻瘟病防治 措施.
微生物是土壤肥力保持和生态系统循环的关键物质基础[7].利用自然界中发现的微生物对病原体进行生物防治是农业保护的一种有效手段[8-9].芽孢杆菌是一种革兰氏阳性菌,具有丰富的生物资源[10].近年来,它已被引入植物病害生物防治领域[11],在防治植物病害、促进植物生长、提高作物产量等方面具有广阔的应用前景[12].解淀粉芽孢杆菌()G1可以产生表面蛋白作为杀蚜代谢 物[13].枯草芽孢杆菌()RC 218是禾谷镰刀菌的有效拮抗剂,而禾谷镰刀菌是赤霉病的主要病原体[14].苏云金芽孢杆菌()黄粉虫变种(Xd3)的次生代谢物具有较强的抗衰老活性[15].由短小芽孢杆菌()产生的茉莉酸、ABA和赤霉素可以明显促进植物的生长[16-17].墨西哥的Gatson等[18]首先发现了特基拉芽孢杆菌,其形态和基因组序列与枯草芽孢杆菌相似.目前对特基拉芽孢杆菌的研究主要集中在菌株的分离和鉴定上,尚处于初步阶段.从墨西哥谷地的小麦样品中分离出一株菌株TE3(T),其16S rRNA序列与芽孢杆菌()相似,DNA杂交结果表明菌株TE3(T)为特基拉芽孢杆菌[19].随着人们对特基拉芽孢杆菌的逐渐了解,发现该菌株在生物防治方面也具有很大的研究价值.特基拉芽孢杆菌可产生抑菌物质,如脂肽和生物表面活性剂[20],以抑制曲霉菌()[21]、土黄色葡萄球菌()和桃褐腐病菌()[22]的生长.然而,关于特基拉芽孢杆菌作为真菌病原体生物防治剂的研究还相对较少,对其活性代谢物也没有深入的研究.
本文通过筛选试验,研究了11种细菌的发酵提取物对11种常见作物病原菌的抑菌效果,获得了具有拮抗作用的活性菌株及其抑菌谱.其中,特基拉芽孢杆菌WRN032对稻瘟病菌表现出强烈的抑制作用.并设计了一系列初步试验,以评估其作为稻瘟病生物防治剂的潜在价值.
1 试验材料与方法
1.1 试验材料和仪器
1.1.1 菌 株
11种试验菌株(见表1)来源于多个城市的植物根茎及土壤,主要为一些芽孢杆菌和嗜盐单胞菌,由中国农业科学院农业资源与农业区划研究所分离保存;11种靶标菌(见表1)为常见的植物病原真菌,由中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China,ACCC)进行保藏.
1.1.2 仪 器
UV6000 紫外可见分光光度计,上海元析仪器有限公司;ZWY-211B 卧式恒温摇床,上海智城有限责任公司;ME204、ME802 电子分析天平,梅特勒-托利多仪器(上海)有限公司;MJB1-B001-Q3灭菌器,无锡益腾压力容器有限公司;LRH-70恒温生化培养箱、DZF-6050 真空干燥箱,上海一恒科学仪器有限公司;SW-CJ-2FD 洁净工作台,苏州安泰空气技术有限公司;N-1100 旋转蒸发仪,上海爱朗仪器有限公司;3K15 台式冷冻离心机,SIGMA公司;Personal thermal PCR仪,BIO-RAD;DYY-6C电泳仪,北京市六一仪器厂;DYCP-31DN电泳槽,北京市六一仪器厂;Waters e2695-2489高效液相色谱-紫外检测系统,美国沃特世有限公司.
表1 供试菌株与靶标病原真菌信息
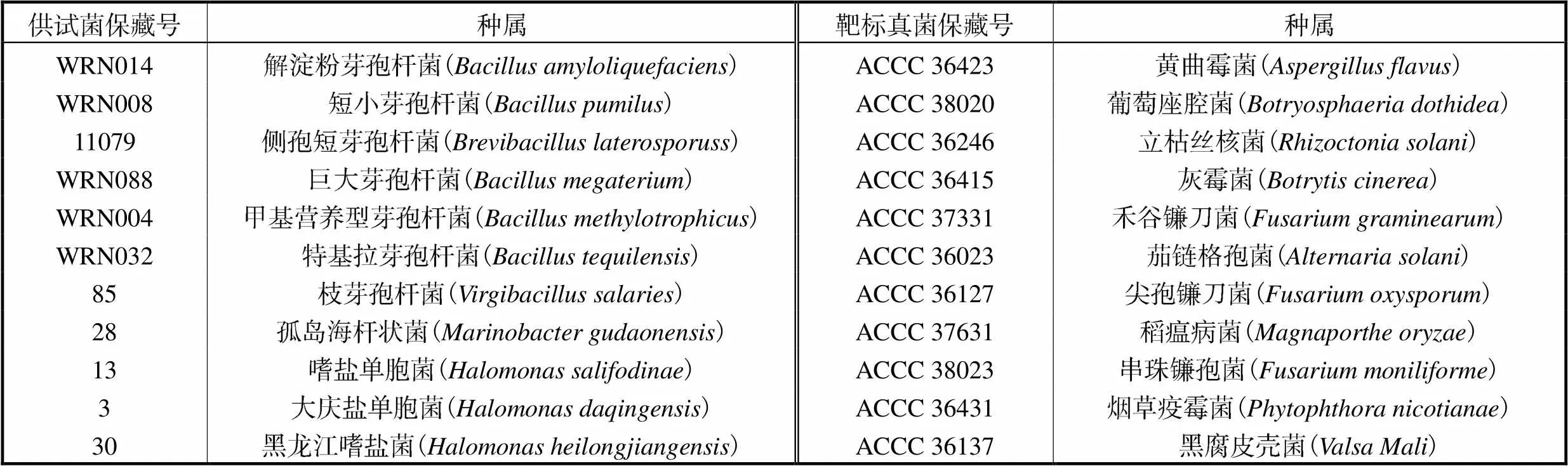
Tab.1 Information of test strains and target pathogenic fungi
1.2 菌株培养条件
试验菌株均在Landy培养基(MgSO4·7H2O 0.500g/L、KH2PO41.000g/L、KCl 0.200g/L、MnSO4·H2O 0.010g/L、FeSO4·7H2O 0.005g/L、CuSO4·5H2O 0.002g/L、酵母提取物 1.000g/L、苯丙氨酸0.020g/L、谷氨酸5.000g/L、(NH4)2SO42.000g/L、柠檬酸钠 0.010g/L、葡萄糖20g/L)中发酵培养48h[23],发酵温度为37℃,转速为180r/min,初始pH值为6.5;病原真菌在PDA培养基(马铃薯淀粉13%,葡萄糖44%,琼脂43%)上进行培养,培养温度为30℃.
1.3 拮抗菌株的筛选
1.3.1 发酵液预处理
每种试验菌株活化18h后,于Landy培养基中再培养48h得到发酵液.取不同试验菌株发酵液各1L,依次用等体积的石油醚、乙酸乙酯和正丁醇对发酵液进行萃取,每种有机溶剂均萃取3次,得到相应的石油醚萃取液、乙酸乙酯萃取液和正丁醇萃取液.将萃取液分别使用旋转蒸发仪进行减压浓缩,然后在真空干燥箱中进行干燥,最终得到33种干燥提取物.将提取物分别置于棕色瓶中,密封后于4℃遮光保存.
1.3.2 牛津杯法抑菌试验
采用牛津杯法对33种干燥提取物进行抗病原真菌菌株的筛选.分别将5.0mg干浸膏溶解于0.1mL DMSO(二甲基亚砜)中,并用无菌水稀释至药液浓度1.0mg/mL.在PDA培养基上等距离边缘放置3个直径均为6mm的牛津杯,在培养基正中间接种病原真菌.每组试验重复3次.其中试验组:向牛津杯中滴加100μL 1mg/mL药液;空白对照:滴加等体积DMSO溶液(DMSO与无菌水体积比为1∶49);阴性对照:滴加等体积无菌水.将培养基在30℃下培养7~14d,测量试验菌株对每种病原真菌的抑菌圈直径,以筛选具有抗菌活性的拮抗菌株.
1.4 拮抗菌株的鉴定
1.4.1 生理生化鉴定
参考东秀珠等[24]的方法,对菌株WRN032进行革兰氏染色试验、明胶液化试验、碳源利用试验、甲基红试验、V-P试验、淀粉水解试验、过氧化氢酶试验、吲哚试验、耐盐性试验共9项生理生化特征分析试验.每组试验重复处理3次,观察现象.
1.4.2 分子生物学鉴定
利用商业试剂盒(TaKaRa MiniBEST Bacteria genomic DNA extraction 68试剂盒3.0版)提取基因组DNA.试验菌株16S rRNA基因组扩增的引物为通用引物:27F:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-TACGGYTACCTTGTTACGACTT-3′.以拮抗菌株WRN032的基因组为模板进行PCR扩增,扩增产物经回收后送至北京擎科生物科技有限公司(中国北京)进行测序.将序列结果在NCBI网站(https://www.ncbi.nlm.nih.gov/)上进行BLAST比对,筛选近源物种的序列,并利用MEGA 6.0软件绘制系统发育树,根据亲缘关系确定菌株WRN032的种属.
1.5 菌株WRN032提取物的抑菌效果稳定性测试
1.5.1 酸碱稳定性
将发酵提取物溶解于二甲基亚砜中,制备浓度为50.0mg/mL,pH值分别为1、3、5、7、9、11、13的7种样品溶液,4℃保持24h后,将每种样品溶液0.5mL与PDA培养基(1∶49,体积比)混合,以制备终浓度为1.0mg/mL的混合物药液.将混合物倒入一次性培养皿中,并在培养皿中心接种稻瘟病菌.以不含提取物的DMSO溶液作为对照,每组试验重复3次.30℃恒温培养7d后,测量稻瘟病菌菌落直径,按照式(1)计算相对抑制率.
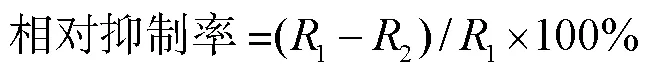
式中:1为对照组菌落直径;2为试验组菌落直径.
1.5.2 热稳定性
制备终浓度为1.0mg/mL的混合物药液,分别在25℃、40℃、60℃、80℃、100℃和121℃下处理30min.冷却至室温后进行热稳定性试验并计算相对抑制率.具体试验步骤与第1.5.1节相同.
1.5.3 紫外线稳定性
制备终浓度为1.0mg/mL的混合物药液,分别在紫外光(24W)照射下处理1h、2h、3h、4h、5h、6h、7h、8h、9h、10h后,进行紫外线稳定性试验并计算相对抑制率.具体试验步骤与第1.5.1节相同.
1.6 活性物质的纯化
采用活性追踪法从发酵液中分离活性物质.用乙酸乙酯提取菌株WRN032的无菌培养滤液,得到粗提物.粗提物通过硅胶(zcx-Ⅱ)柱层析分离,并分别使用比例为99∶1、99∶5、99∶10、99∶99、0∶99(体积比)的CH2Cl2/MeOH进行梯度洗脱,得到5个组分(Fr.1~Fr.5).测量并比较5种组分对稻瘟病菌的抑菌活性.活性最高的Fr.5部分通过半制备液相色谱分离,流动相为CH3CN/H2O(3∶7,体积比),收集分离出的化合物1、2和3.采用牛津杯法筛选3种化合物中对稻瘟病菌抑制作用最强的组分,以供进一步研究.
1.7 活性物质抑菌效果的评估
三环唑是农业上常用的抑制稻瘟病菌生长的抗真菌药物.因此选择75%三环唑可湿性粉剂为阳性对照,对纯化后的活性物质进行抑菌效果的评估.将抑菌效果最强的化合物2以DMSO溶解后与PDA培养基混合,制备药液终浓度分别为100.0µg/mL、50.0µg/mL、25.0µg/mL、12.5µg/mL、6.25µg/mL和3.125µg/mL的混合物培养基.将混合物培养基倒入培养皿中,并在培养皿中心接种稻瘟病菌.以75%三环唑可湿性粉剂为对照组,其处理方法与化合物2相同.每组试验重复3次.30℃恒温培养7d后,测量稻瘟病菌菌落直径,计算相对抑制率.
2 结果与讨论
2.1 拮抗菌株筛选结果
经过363组筛选试验,筛选出5种具有抑菌活性的发酵液提取物.活性发酵液提取物的抑菌圈直径如表2所示.与孙露等[25]合作试验得到,样品药液浓度均为1.0mg/mL时,菌株WRN032发酵液的乙酸乙酯萃取物对黑腐皮壳菌、禾谷镰刀菌和稻瘟病菌的抑菌圈直径分别为9.82mm、10.40mm和22.31mm,表明菌株WRN032的发酵产物对稻瘟病菌具有较强的拮抗作用.稻瘟病是水稻四大病害之一,对水稻产量影响很大.稻瘟病菌是稻瘟病的主要病原菌.因此,可以进一步对菌株WRN032发酵产物进行研究,以评估其作为稻瘟病生物防治剂的潜力.
表2 活性菌株发酵液萃取物的抑菌圈直径
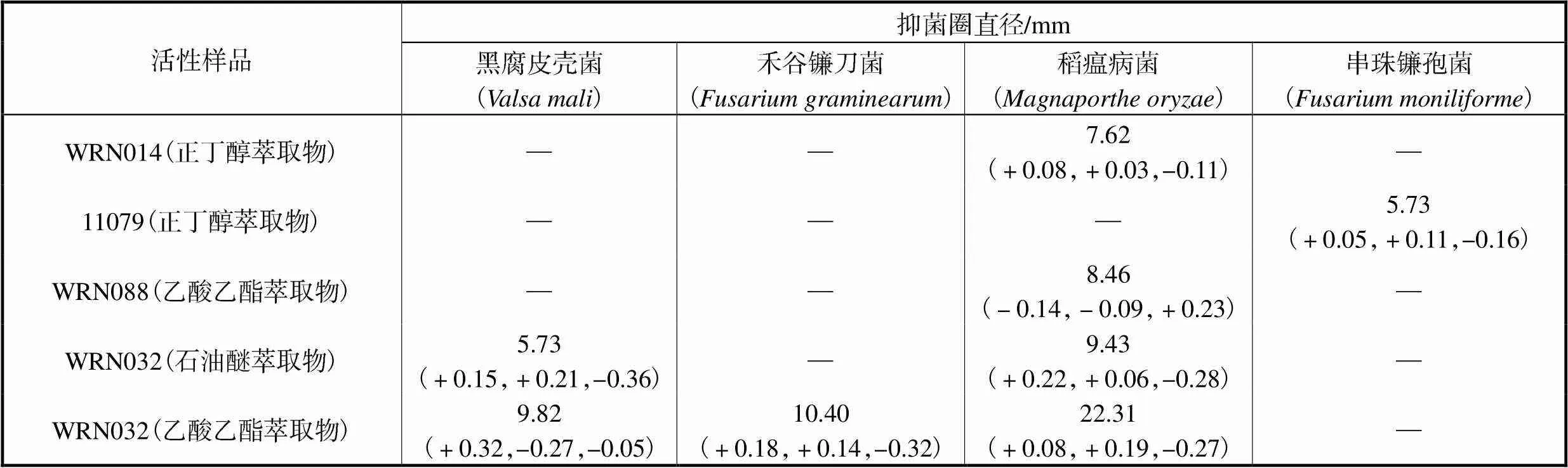
Tab.2 Inhibitory zone diameter of the fermentation broth extract of the active strain
注:表中数据为3次平行试验抑菌圈直径的平均值,括号内数据为对应的3个误差值;“—”表示牛津杯周围无抑菌圈.
2.2 菌株WRN032的生物学特性
2.2.1 生理生化特性
将菌株WRN032染色后进行镜检,细胞呈现紫色,表明该菌株为革兰氏阳性菌.菌株WRN032的生理生化试验结果见表3,显示其能使淀粉水解及明胶液化,同时具有一定程度的耐盐性.
2.2.2 分子生物学鉴定结果
菌株WRN032是从香菇废蘑菇堆肥中分离得到的.根据NCBI上BLAST的16S rDNA比较,菌株WRN032与特基拉芽孢杆菌Y16的相似性约为99.93%.菌株WRN032的系统发育树如图1所示.根据16S rDNA测序和系统发育分析,菌株WRN032被鉴定为特基拉芽孢杆菌.
表3 菌株WRN032生理生化试验结果
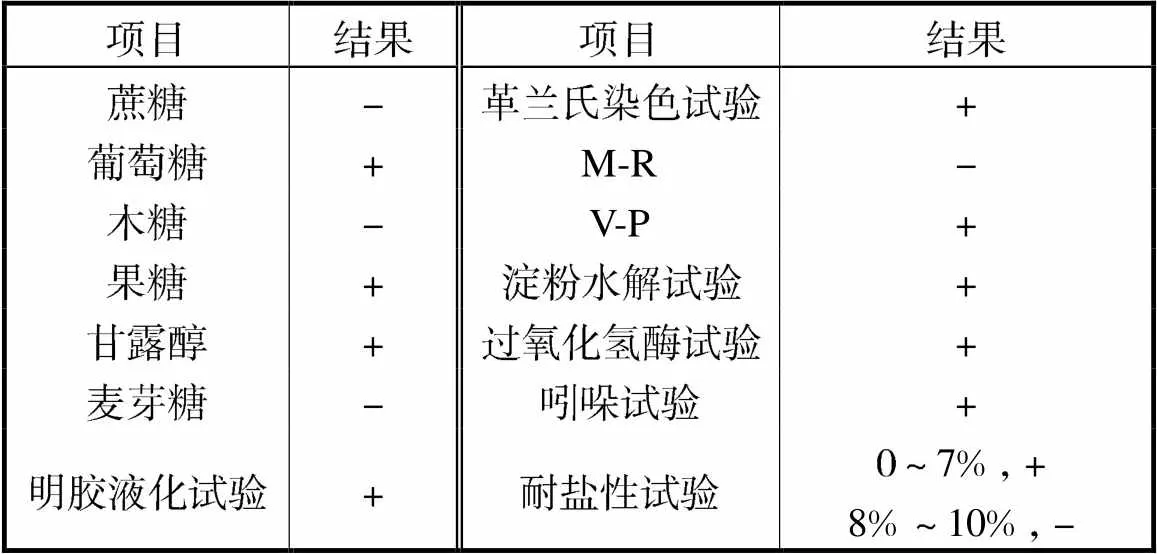
Tab.3 Physiological and biochemical test results for strain WRN032
注:“+”表示阳性;“-”表示阴性.
2.3 菌株WRN032代谢产物抑菌效果的稳定性
pH值在1~7范围内,特基拉芽孢杆菌WRN032代谢物对稻瘟病菌的抑制效果随pH值增加而增加;但随着碱浓度的增加,抑菌效果明显降低(图2(a)).代谢产物的抑菌活性在25~100℃的温度下保持稳定,100℃下处理30min,抑菌率仍能达到41.7%.但当温度为121℃时,抑菌率显著降低(图2(b)).代谢产物在紫外线处理0~10h内都有显著抑菌作用,处理10h时抑菌率仍能达到50%左右(图2(c)).
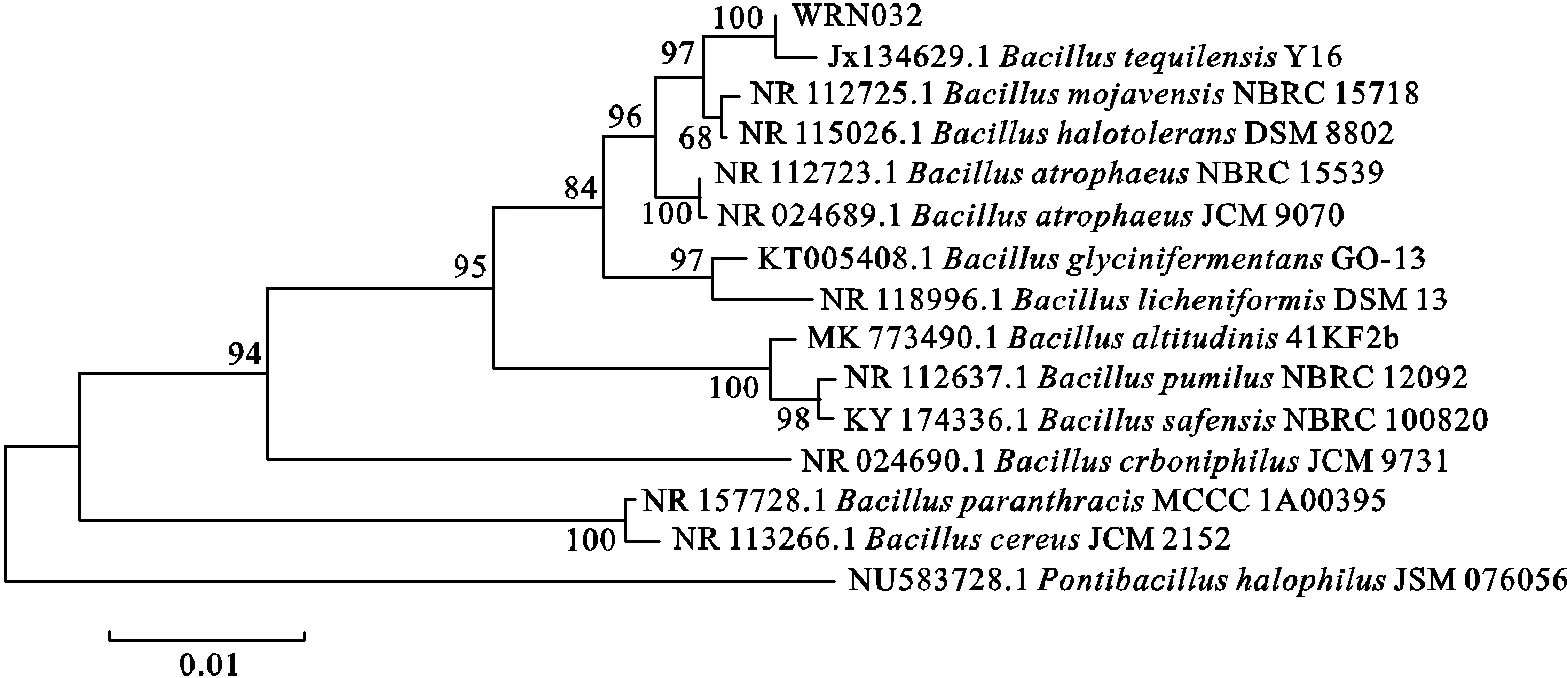
图1 菌株WRN032的系统发育树
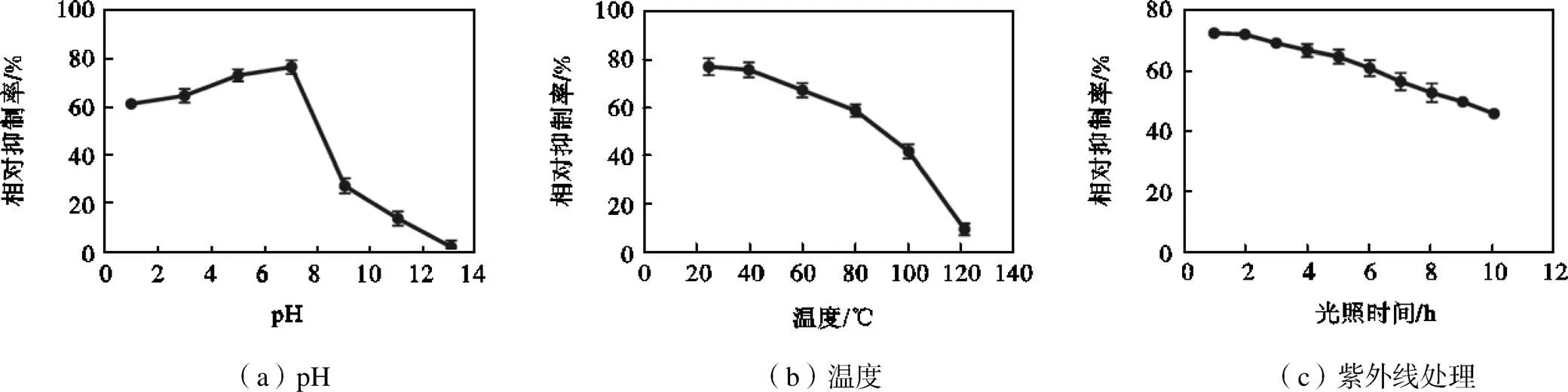
图2 pH、温度和紫外线处理对特基拉芽孢杆菌WRN032发酵液提取物抗真菌活性的影响
2.4 活性物质的分离
发酵液成分复杂,需要对其进行分离纯化,以获得更好的应用所需的活性物质.通过柱层析洗脱,得到5个组分.馏分5用100%甲醇洗脱,具有很强的抑制作用,并被选择用于进一步纯化.如图3所示,通过半制备液相色谱法从馏分5中收集了3种物质.化合物1、化合物2和化合物3的保留时间分别为18.8~21.5min、23.2~25.7min、28.8~32.3min.3种化合物抗真菌效果的比较如图4所示.化合物2表现出较强的活性,保留时间为23.2~25.7min.因此,选择化合物2作为最有效的物质,以进一步评估其对稻瘟病菌的抗真菌活性.
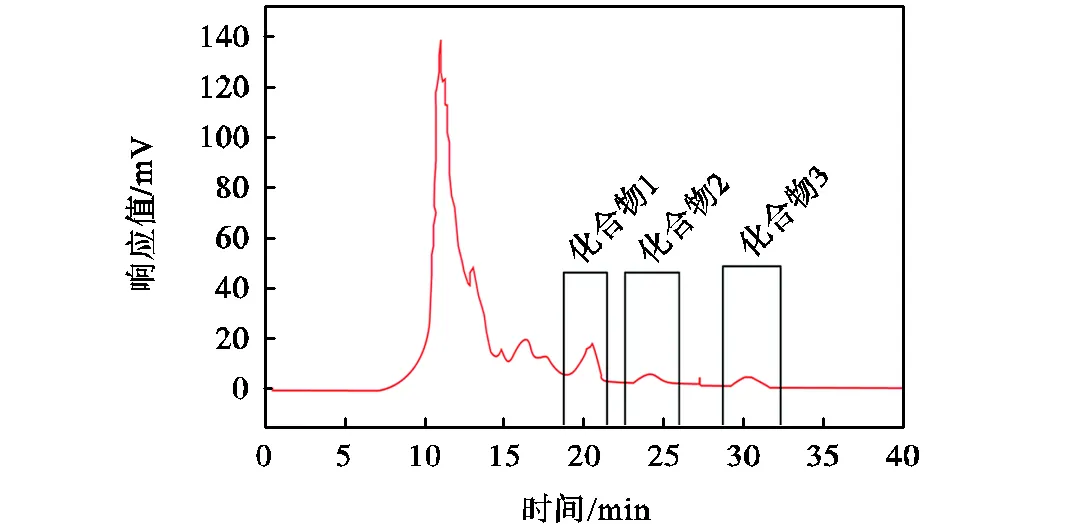
图3 馏分5的半制备色谱图
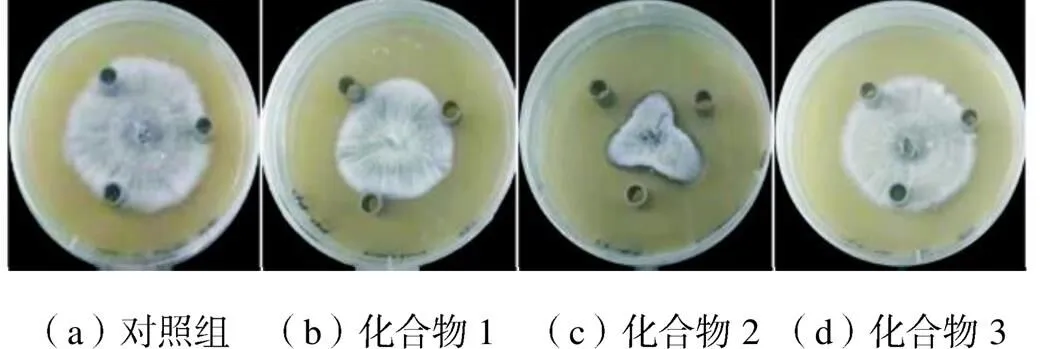
图4 通过半制备色谱分离的3种化合物对稻瘟病菌的抑菌作用
2.5 活性物质的抑菌作用评估
纯化后的活性物质对稻瘟病菌的生长有明显的抑制作用.由图5可知,随着浓度的增加,活性物质的抑菌效果不断增强.在相同浓度下,化合物2和75%三环唑可湿性粉剂对于稻瘟病菌具有相似的抑菌活性.当浓度为100.0µg/mL时,化合物2的抑菌率为51.2%,与75%三环唑可湿性粉剂(56.4%)基本相同.由此可知,纯化后的物质对稻瘟病菌有较强的拮抗作用.因此,特基拉芽孢杆菌WRN032对稻瘟病菌有着较高的生防潜力.
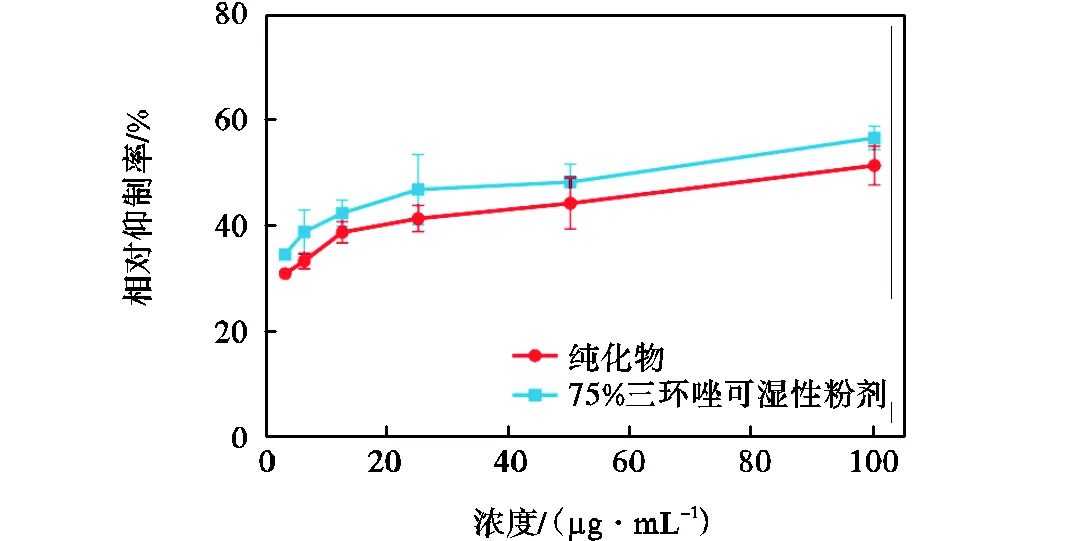
图5 纯化后的活性物质和75%三环唑可湿性粉剂在不同浓度下的相对抑制率
3 结 语
农作物尤其是水稻,是与人类生存紧密相关的植物.稻瘟病菌、灰霉病菌等植物病原真菌给农业经济带来严重损失.因此,开发生物防治方法来控制病原真菌是一种有效手段.
本研究通过大量筛选试验,获得了一种具有生物防治潜力的细菌WRN032及其抗真菌谱,为其生物防治研究提供了理论依据.菌株WRN032对黑腐皮壳菌、禾谷镰刀菌和稻瘟病菌的生长均具有不同程度的拮抗作用,其中对稻瘟病菌的抑制作用较强.通过生理生化试验及16S rDNA序列分析,该菌株被鉴定为特基拉芽孢杆菌.稳定性试验结果表明,菌株WRN032的代谢产物在高温、强酸、中性、弱碱及紫外光照射条件下均能保持较高的活性,意味着其应用范围广,不易因环境影响而失去活性,可以为开发高效稳定的稻瘟病生物防治剂提供了研究基础.通过一系列分离操作,从菌株WRN032的发酵液中获得了高活性的纯物质,其对稻瘟病菌的抑制效果与相同浓度的75%三环唑可湿性粉剂相似.当浓度为100.0µg/mL时,该纯化产物对稻瘟病菌的相对抑制率为51.2%,与同浓度的75%三环唑可湿性粉剂(56.4%)基本相同.综上所述,特基拉芽孢杆菌WRN032对稻瘟病菌有较强的抑制作用,有望成为稻瘟病菌的生物防治剂.
[1] Li Guotian,Zhou Xiaoying,Xu Jinrong,et al. Genetic control of infection-related development in[J]. Current Opinion in Microbiology,2012,15(6):678-684.
[2] Zhang Qifa. Strategies for developing green super rice[J]. Proceedings of the National Academy of Science,2007,104(42):16402-16409.
[3] Miah G,Rafii M Y,Ismail M R,et al. Blast resistance in rice:A review of conventional breeding to molecular approaches[J]. Molecular Biology Reports,2013,40(3):2369-2388.
[4] Jiang Changjie,Shimono M,Sugano S,et al. Abscisic acid interacts antagonistically with salicylic acid signaling pathway in rice—interaction[J]. Molecular Plant-Microbe Interactions,2010,23(6):791-798.
[5] Faria A T,Souza M F,Passos A B R D,et al. Tebuthiuron leaching in three Brazilian soils as affected by soil pH[J]. Environmental Earth Sciences,2018,77(5):1-12.
[6] Marín-Benito J M,Sánchez-Martín M J,Ordax J M,et al. Organic sorbents as barriers to decrease the mobility of herbicides in soils[J]. Modelling of the Leaching Process,2018,313:205-216.
[7] 赵德天,翟恩昱,赵啸宇,等. 设施农业中微生物农药施用情况及发展前景[J]. 生物资源,2019,41(3):195-203.
Zhao Detian,Zhai Enyu,Zhao Xiaoyu,et al. Application and development prospect of microbial pesticides in facility agriculture[J]. Biological Resources,2019,41(3):195-203(in Chinese).
[8] Nagayama K,Watanabe S,Kumakura K,et al. Development and commercialization ofSKT-1(Ecohope®),a microbial pesticide[J]. Journal of Pesticide Science,2007,32(2):141-142.
[9] Xia Yanfei,Li Shen,Liu Xueting,et al.strain LYSX1-induced systemic resistance against the root-knot nematodein tomato[J]. Annals of Microbiology,2019,69(12):1227-1233.
[10] Toymentseva A A,Pudova D S,Sharipova M R. Identification of secondary metabolite gene clusters in the genome ofstrains 7P and 3-19[J]. Bionanoscience,2019,9(2):313-316.
[11] Azizoglu U.as a biofertilizer and biostimulator:A mini-review of the little-known plant growth-promoting properties of Bt[J]. Current Microbiology,2019,76(11):1379-1385.
[12] Ren Jahong,Li Hao,Wang Yanfang,et al. Biocontrol potential of an endophyticJK-SX001 against poplar canker[J]. Biological Control,2013,67(3):421-430.
[13] Yun D C,Yang S Y,Kim Y C,et al. Identification of surfactin as an aphicidal metabolite produced byG1[J]. Journal of the Korean Society for Applied Biological Chemistry,2013,56(6):751-753.
[14] Palazzini J M,Dunlap C A,Bowman M J,et al.RC218 as a biocontrol agent to reducehead blight and deoxynivalenol accumulation:Genome sequencing and secondary metabolite cluster profiles[J]. Microbiological Research,2016,192:30-36.
[15] Eski A,Demir I,Sezen K,et al. A new biopesticide from a localvar.(Xd3) against alder leaf beetle(Coleoptera:Chrysomeli-dae)[J]. World Journal of Microbiology & Biotechnology,2017,33:95-1-95-9.
[16] Joo G J,Kim Y M,Kim J T,et al. Gibberellins-producing rhizobacteria increase endogenous gibberellins content and promote growth of red peppers[J]. Journal of Microbiology,2005,43(6):510-515.
[17] Forchetti G,Masciarelli O,Alemano S,et al. Endophytic bacteria in sunflower (L. ):Isolation,characterization,and production of jasmonates and abscisic acid in culture medium[J]. Applied Microbiology and Biotechnology,2007,76(5):1145-1152.
[18] Gatson J W,Benz B F,Chandrasekaran C.sp. nov. ,isolated from a 2000-year-old Mexican shafttomb,is closely related to[J]. International Journal of Systematic and Evolutionary Microbiology,2006,56(7):1475-1484.
[19] Villalobos S D,Robles R I,Cota F I P,et al.sp. nov.,an endophytic plant growth promoting bacterium isolated from wheat(subsp.)in the Yaqui Valley,Mexico[J]. International Journal of Systematic and Evolutionary Microbiology,2019,69(12):3939-3945.
[20] Pradhan A K,Pradhan N,Mall G,et al. Application of lipopeptide biosurfactant isolated from a halophile:CH for inhibition of biofilm[J]. Applied Biochemistry and Biotechnology,2013,171(6):1362-1375.
[21] Wang Kai,Yan Peisheng,Ding Qinglong,et al. Diversity of cuhurable root-associated endophytie bacteria and their chitinolytic and aflatoxin inhibition activity of peanut plant in China[J]. World Journal of Microbiology and Biotechnology,2013,29(1):1-10.
[22] 袁 雪,侯 旭,胡 晓,等. 桃褐腐病拮抗细菌的筛选、鉴定及生防作用[J]. 北京农学院学报,2018,33(4):7-13.
Yuan Xue,Hou Xu,Hu Xiao,et al. Screening and identification of antagonistic bacteria and its control effect against the peach brown rot[J]. Journal of Beijing University of Agriculture,2018,33(4):7-13(in Chinese).
[23] Landy M,Warren G H,Rosenman S B,et al. Bacillomyci:An antibiotic fromactive against pathogenic fungi[J]. Proceedings of the Society for Experimental Biology and Medicine,1948,67(4):539-541.
[24] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
Dong Xiuzhu,Cai Miaoying. Manual of Systematic Methods of Determinative Bacteria[M]. Beijing:Science Press,2001(in Chinese).
[25] 孙 露,单潇潇,蒋建兰,等. 一株对稻瘟病菌有抗菌活性的特基拉芽孢杆菌 WRN032的筛选及发酵条件优化[J]. 天然产物研究与开发,2020,32(5):860-866,881.
Sun Lu,Shan Xiaoxiao,Jiang Jianlan,et al. Screening ofWRN032 withand its optimization of fermentation conditions[J]. Natural Product Research and Development,2020,32(5):860-866,881(in Chinese).
Biological Control Potential ofWRN032 Against
Jiang Jianlan1, 2,Chen Yu1, 2,Shan Xiaoxiao1, 2,Sun Lu1, 2,Qiao Jianjun1, 2,Zhang Guishan3, 4
(1. Key Laboratory of Systems Bioengineering(Ministry of Education),Tianjin University,Tianjin 300072,China;2. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;3. Institute of Agricultural Resources and Regional Planning,Chinese Academy of Agricultural Sciences,Beijing 100081,China;4. Key Laboratory of Microbial Resources Collection and Preservation,Ministry of Agriculture,Beijing 100081,China)
Plant pathogenic fungi are the main pathogens of crops that reduce crop yield and hinder agricultural development. Many kinds of pathogenic fungi have been identified with complex mechanisms of action leading to prevention and control difficulties. Traditional chemical control methods do not meet the needs of agriculture today,but biological control is a safe,green,and efficient means of prevention and control. We selected a variety of bacteria from soil and plant rhizomes as research objects and used the antibacterial activity of the bacteria as an index. The bacterial strain WRN032 with biological control potential was screened using the Oxford cup method. WRN032 has antagonistic effects on the growth of,,and,among which the inhibitory effect onwas strong. The fermentation broth of strain WRN032 was extracted with petroleum ether,n-butanol,and ethyl acetate,in turn. The ethyl acetate extract of strain WRN032 had strong activity against. The strain was identified using physiological and biochemical methods and 16S rDNA sequence analysis. The results showed that the bacterium was. A stability test of the active substance in the metabolites ofWRN032 revealed good stability under high temperature,strong acid,neutral,and weak alkali conditions and was not sensitive to ultraviolet light. The active substance in theWRN032 fermentation broth was isolated and purified by column chromatography and semi-preparative chromatography. The relative inhibition rate of the purified products against rice blast was similar to that of 75% tricyclazole wettable powder at the same concentration. When the concentration was 100.0µg/mL,the relative inhibition rate was 51.2%,which was similar to the 75% for tricyclazole wettable powder(56.4%). This study shows thatWRN032 has potential as an agricultural biological control agent.
;WRN032;;isolation and identification;antibacterial activity;biological control
10.11784/tdxbz202205014
Q939.9
A
0493-2137(2023)09-0935-07
2022-05-10;
2022-09-19.
蒋建兰(1972— ),女,博士,研究员,jljiang@tju.edu.cn.Email:m_bigm@tju.edu.cn
张桂山,zhangguishan@caas.cn.
国家自然科学基金资助项目(31670113);国家重点研发计划资助项目(2017YFD0201401).
the National Natural Science Foundation of China(No. 31670113),the National Key Research and Development Program of China(No. 2017YFD0201401).
(责任编辑:田 军)
