川芎对衰老大鼠脑保护作用及对PI3K/AKT/HIF-1α通路的影响
2023-06-23刘尧张建军李振皓朱映黎张睿乐娜陈彦陈亚文陶然王淳李明焱王林元
刘尧 张建军 李振皓 朱映黎 张睿 乐娜 陈彦 陈亚文 陶然 王淳 李明焱 王林元

摘要 目的:通過构建衰老合并血瘀大鼠模型,探讨川芎小剂量久服对于延缓衰老脑保护的药效及作用机制,为川芎的临床用药提供依据。方法:将66只SD大鼠分为空白组、模型组、维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组,每组11只。除空白组外各组腹腔注射D-半乳糖(300 mg/kg)连续42 d,同时继续造模并给药14 d,第15天冰水浴20 min,连续14 d,最后1 d注射0.1%肾上腺素0.8 mg/kg。WST-1法检测血清超氧化物歧化酶(SOD)、比色法检测谷胱甘肽过氧化物酶(GSH-Px)活性、总抗氧化能力(T-AOC),TBA法检测脂质过氧化产物丙二醛(MDA),酶联免疫吸附试验检测蛋白质羰基(PC)含量,酶联免疫吸附试验检测脑组织一氧化氮(NO)、内皮型一氧化氮合酶(eNOS)、血栓素B2(TXB2)、内皮素(ET)-1含量。蛋白质印迹法(Western Blotting)测定检测脑组织磷脂酰肌醇3激酶(PI3K)蛋白、蛋白激酶B(AKT)蛋白、缺氧诱导因子-1α(HIF-1α)表达量。结果:与空白组比较,模型组体质量下降(P<0.001),血清SOD、GSH-PX、T-AOC含量降低(P<0.001,P<0.01,P<0.01),MDA、PC含量升高(P<0.001),脑组织NO、TXB2、ET-1含量升高(P<0.001,P<0.05,P<0.001),eNOS含量降低(P<0.01),HIF-1α表达量降低(P<0.05);与模型组比较,川芎2 g及4 g能升高血清GSH-Px含量,增加T-AOC,降低脑组织NO、TXB2、ET-1含量,升高eNOS(P<0.01),川芎4 g可以增加HIF-1α蛋白表达量(P<0.01)。川芎1 g与人参1 g配伍后进一步升高血清SOD、GSH-Px含量,降低血清MDA、PC含量,降低脑组织NO、TXB2、ET-1含量(P<0.001,P<0.05,P<0.001),升高eNOS(P<0.001),增加HIF-1α蛋白表达量(P<0.01)。结论:对衰老合并血瘀大鼠模型,川芎小剂量久服即可改善内皮功能,抑制氧化应激,发挥抗氧化作用;川芎剂量减少并与人参配伍后可以起到协同增效作用,可能通过HIF-1α通路对脑起到保护作用。
关键词 川芎;久服;剂量;衰老;活血化瘀;抗氧化
Protective Effect of Ligusticum chuanxiong on Brain of Aging Rats and Its Impact on PI3K/AKT/HIF-1α Pathway
LIU Yao1,ZHANG Jianjun1,LI Zhenhao2,ZHU Yingli1,ZHANG Rui1,YUE Na1,CHEN Yan1,CHEN Yawen1,TAO Ran1,WANG Chun1,LI Mingyan2,WANG Linyuan1
(1 Beijing University of Chinese Medicine,Beijing 100029,China; 2 Zhejiang Engineering Research Center of Rare Medicinal Plants,Wuyi 321200,China)
Abstract Objective:To observe the protective effect and mechanism of low-dose Ligusticum chuanxiong for long-term administration on delaying aging brain by constructing an aging rat model with blood stasis,to provide a basis for clinical medication of L.chuanxiong.Methods:A total of 66 SD rats were divided into blank group,model group,vitamin E group,2 g L.chuanxiong group,4 g L.chuanxiong group and 2 g L.chuanxiong+Panax ginseng group,with 11 in each group.All groups,except the blank group,were given D-galactose(300 mg/kg,ip) for 42 consecutive days,during which drugs were administered for 14 days.On the 15th day,the rats were given ice water bath for 20 minutes for 14 consecutive days,and 0.1% of 0.8 mg/kg adrenaline was injected on the last day.Serum superoxide dismutase(SOD) was detected by WST-1 assay,and the glutathione peroxidase(GSH-Px) activity and total antioxidant capacity(T-AOC) was detected by colorimetry.Malondialdehyde(MDA),a product of lipid peroxidation,was detected by thiobarbituric acid(TBA) method.Enzyme-linked immunosorbent assay was performed to determine the content of protein carbonyl compounds(PC) and the contents of nitric oxide(NO),endothelial nitric oxide synthase(eNOS),thromboxane B2(TXB2) and endothelin-1(ET-1) in brain tissue.Western blot was used to detect the expressions of phosphatidylinositol 3-kinase(PI3K),protein kinase B(AKT) and hypoxia-inducible factor 1α(HIF-1α) in brain tissue.Results:Compared with the blank group,the model group had decreased body weight(P<0.001),lowered SOD,GSH-Px and T-AOC(P<0.001,P<0.01,P<0.01),eNOS(P<0.01) and HIF-1α(P<0.05) and increased MDA and PC(P<0.001) and NO,TXB2 and ET-1(P<0.001,P<0.05,P<0.001).Compared with the model group,2 g and 4 g L.chuanxiong up-regulated GSH-Px,enhanced T-AOC,reduced NO,TXB2 and ET-1,and elevated eNOS(P<0.01).In addition,4 g L.chuanxiong increased HIF-1α(P<0.01).After combination of 1 g L.chuanxiong and 1 g P.ginseng,SOD and GSH-Px were elevated,while MDA and PC were lowered; there was a decrease in NO,TXB2 and ET-1(P<0.001,P<0.05,P<0.001) while an increase in eNOS(P<0.001); HIF-1α was increased(P<0.01).Conclusion:For the aging rat model with blood stasis,low-dose L.chuanxiong can improve endothelial function and inhibit oxidative stress,exerting an antioxidant effect.L.chuanxiong at a reduced dose plays a synergistic role with P.ginseng,which may protect the brain through HIF-1α pathway.
Keywords Ligusticum chuanxiong Hort; Long-term administration; Dose; Aging; Activating blood and resolving stasis; Antioxidation
中图分类号:R282文献标识码:Adoi:10.3969/j.issn.1673-7202.2023.01.008
川芎味辛,温。主治中风入脑、头痛、寒痹、筋挛缓急。能上行头目,下行血海。通肝经,为血中之气药也[1]。现代研究表明川芎对脑血管系统具有抗衰老[2]、扩张血管[3]、抗动脉粥样硬化[4]、增强脑内血流量、改善微循环[5]等作用。随着人口老龄化的到来,脑部疾病等与衰老相关的神经退行性疾病严重影响老年患者的生活,如缺血性脑卒中、阿尔茨海默病、血管性痴呆等[6]。现代研究表明其与氧化应激有关,同时伴随着明显的血管衰老表现[7]。中医“因瘀致衰”理论认为老年多气虚,易造成瘀血,瘀血内阻致脏腑功能失调,血瘀加重疾病的发生发展[8]。中药久服对于老年患者心脑血管慢性疾病,如慢性脑缺血,以及脑梗死后遗症,比较西药对症治疗,能起到一定的改善症状、缓解病情、延缓病情、提高预后的作用。与久服相伴的是对药物剂量、服用时间、药效及药物安全性的探讨[9]。
川芎作为活血化瘀类药物单味即可改善脑部血液循环,减轻脑缺血损伤,对缺血再灌注损伤脑组织有保护作用,以其為核心的补阳还五汤、芎汤等临床常用来治疗脑血管疾病[10]。但川芎辛温升散,久服易散真气,能否通过降低剂量或者合理配伍改善内皮功能,抑制氧化应激延缓脑衰老,发挥对脑的保护作用有待研究。本实验通过构建衰老合并血瘀大鼠模型首次研究川芎不同剂量及配伍应用条件下“久服”对延缓脑组织衰老的作用,探讨川芎对衰老合并血瘀大鼠脑保护作用及机制,为其临床用药提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 无特定病原体(Specific Pathogen Free,SPF)级8周龄雄性SD大鼠66只,体质量180~220 g,购自斯贝福(北京)实验动物科技有限公司,许可证号:SCXK(京)2019-0010。饲养于北京中医药大学动物房,大鼠自由饮水、摄食,12/12 h日灯光模拟白天黑夜,以标准普通饲料喂食。本研究通过动物福利伦理委员会批准(伦理审批号:BUCM-4-2021032401-1052)。
1.1.2 药物 D-半乳糖(上海源叶生物有限公司,批号:R24O11H128688);肾上腺素注射液(天津金耀药业有限公司,批号:2107262);维生素E软胶囊(天津市中央药业有限公司,批号:210211);川芎配方颗粒(北京康仁堂药业有限公司,批号:21010061);人参配方颗粒(北京康仁堂药业有限公司,批号:21006942)。
1.1.3 试剂与仪器 超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒(批号:20220303)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)试剂盒(批号:20211123)、总抗氧化能力(Total Antioxidant Capacity,T-AOC)试剂盒(批号:20211123)、丙二醛(Malondialdehyde,MDA)试剂盒(批号:20220304)、总蛋白定量测定试剂盒(批号:20211223)、ATP酶测试盒(批号:20220506),以上试剂盒购自南京建成生物工程研究所;蛋白质羰基(Protein Carbonyl,PC)酶联免疫吸附试验试剂盒(批号:202203),购自上海酶联生物科技有限公司;一氧化氮(Nitric Oxide,NO)(批号:20220705)购自北京普利莱基因技术有限公司;内皮素-1(Endothelin 1,ET-1)试剂盒(批号:20220629)、血栓素B2(Thromboxane B2,TXB2)试剂盒(批号:20220629)由北京康佳宏原生物科技有限公司提供。磷脂酰肌醇3激酶(Phosphoinositide 3-Kinase,PI3K)抗体(CST公司,美国,货号:4257)、蛋白激酶B(Protein Kinase,AKT)抗体(CST公司,美国,货号:9272)、缺氧诱导因子-1α(Hypoxia-Inducible Factor 1α,HIF-1α)抗体(Abcam公司,美国,货号:AB179483),β肌动蛋白(β-actin)抗体(CST公司,美国,货号:4967),酶标分析仪(赛默飞世尔科技,美国,型号:Multiskan MK3)、凝胶成像系统(上海勤翔科学仪器有限公司,型号:620013-9Q)。
1.2 方法
1.2.1 分组与模型制备 动物适应性喂养7 d后,随机分为空白组(n=11)和造模大鼠(n=55)。造模大鼠从造模第1天起按每10 g体质量腹腔注射0.1 mL D-半乳糖(300 mg/kg),连续42 d,于第43天眼眶取血,检测大鼠血清MDA含量。后随机分为模型组、维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组,每组11只。同时继续造模并给药14 d,第15天开始冰水浴20 min,连续14 d,最后1 d注射0.1%肾上腺素0.8 mg/kg。空白组每日给予普通饲料喂食,腹腔注射等剂量生理盐水,共70 d。
1.2.2 给药方法 各给药大鼠分别灌胃给予相应药物,维生素E组(0.02 g/kg,相当于人日用量0.2 g/d)、川芎2 g组(0.20 g/kg,相当于人日用量2 g/d),川芎4 g组(0.40 g/kg,相当于人日用量4 g/d),川芎配伍人参2 g组(0.20 g/kg,相当于人日用量2 g/d),空白组、模型组每天灌胃双蒸水,连续28 d。
1.2.3 检测指标与方法
1.2.3.1 观察大鼠体质量 给药后每2周记录体质量变化。
1.2.3.2 大鼠血清SOD、GSH-Px、T-AOC、MDA、PC含量检测 最后1次给药后,大鼠腹主动脉取血,室温静置4 h,4 ℃,3 500 r/min,离心半径6 cm,离心15 min,分离血清,按试剂盒检测血清SOD、GSH-Px、T-AOC、MDA、PC含量。
1.2.3.3 大鼠脑组织NO、内皮型一氧化氮合酶(Endothelial Nitric Oxide Synthase,eNOS)、TXB2、ET-1含量检测 取大鼠脑组织,按组织重量体积比1∶9加入预冷0.9%生理盐水,并匀浆,分别制备成10%的组织匀浆,4 000 r/min,离心半径6 cm,离心15 min,取上清液。利用总蛋白质定量试剂盒(BCA法)测定蛋白浓度后,按试剂盒检测脑组织中NO、eNOS、TXB2、ET-1含量。
1.2.3.4 蛋白质免疫印迹(Western Blotting)法检测PI3K、AKT、HIF-1α蛋白表达 取大鼠脑部分,按组织重量体积比1∶9,在冰上加入含有蛋白酶抑制剂的放射免疫沉淀法裂解液裂解,机械研磨匀浆后12 000 r/min,离心半径6 cm,离心15 min,取上清液,用BCA法测定蛋白浓度。按照1∶4加入5×Loading Buffer,10%SDS聚丙烯酰胺凝胶电泳分离后电转至聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜,用含5%脱脂奶粉的TBST缓冲液封闭1 h,分别加入PI3K(1∶1 000稀释)、AKT(1∶1 000稀释)、HIF-1α(1∶1 000稀释)、β-actin(1∶1 000稀释),4 ℃孵育过夜,洗涤缓冲液(Tris Buffered Saline Tween,TBST)洗3次,10 min/次。加入二抗(1∶10 000稀释)室温温育1 h,TBST洗3次,10 min/次,电化学发光液显影,凝胶成像仪曝光。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,数据进行正态检验和方差齐性检验,符合正态分布且方差齐性,采用单因素方差分析,组间比较采用最小显著性差异法(LSD)。以P<0.05为差异有统计学意义。
2 结果
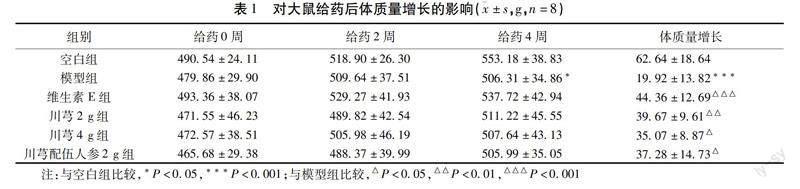
2.1 对大鼠体质量的影响 给药4周后,与空白组比较,模型组大鼠体质量增长显著下降(P<0.001);与模型组比较,维生素E组能显著提高大鼠体质量(P<0.001),川芎2 g组、川芎4 g组、川芎配伍人参2 g组均能提高大鼠体质量,差异有统计学意义(P<0.01、P<0.05、P<0.05)。见表1。
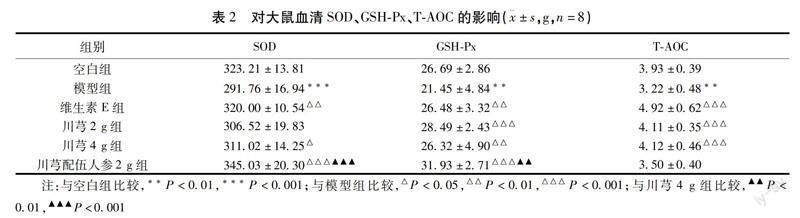
2.2 对大鼠血清SOD、GSH-Px、T-AOC的影响 与空白组比较,模型组大鼠血清SOD含量降低(P<0.001);与模型组比较,维生素E组、川芎2 g组与川芎配伍人参2 g组均能显著升高SOD含量(P<0.01、P<0.05、P<0.001);與川芎4 g组比较,川芎配伍人参2 g组显著升高SOD含量(P<0.001)。与空白组比较,模型组大鼠血清GSH-Px含量降低,差异有统计学意义(P<0.01);与模型组比较,维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组均能够升高GSH-Px含量(P<0.01、P<0.001、P<0.01、P<0.001);与川芎4 g组比较,川芎配伍人参2 g组显著升高GSH-Px含量(P<0.01)。与空白组比较,模型组大鼠血清T-AOC含量降低(P<0.05);与模型组比较,维生素E组、川芎2 g组、川芎4 g组均能够升高T-AOC含量(P<0.001、P<0.001、P<0.001)。见表2。
2.3 对大鼠血清MDA和PC的影响 与空白组比较,模型组大鼠血清MDA含量明显升高(P<0.001);与模型组比较,川芎4 g组、川芎配伍人参2 g组均能够降低MDA含量(P<0.01、P<0.01)。与空白组比较,模型组大鼠血清PC含量明显升高(P<0.001);与模型组比较,维生素E组、川芎2 g组及川芎配伍人参2 g组均能显著降低PC含量(P<0.001、P<0.05、P<0.05)。见表3。
2.4 对大鼠脑组织NO、eNOS的影响 与空白组比较,模型组大鼠脑组织NO含量显著降低(P<0.001);与模型组比较,各组均能组显著降低NO含量(P<0.05,P<0.001)。与空白组比较,模型组大鼠脑组织中eNOS含量明显降低(P<0.01);与模型组比较,维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组均能够升高eNOS含量(P<0.05、P<0.01、P<0.01、P<0.001)。见表4。
2.5 对大鼠脑组织TXB2、ET-1的影响 与空白组比较,模型组大鼠脑组织内TXB2含量显著升高(P<0.05);与模型组比较,维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组均能降低TXB2含量(P<0.05、P<0.05、P<0.05、P<0.01)。与空白组比较,模型组大鼠脑组织ET-1含量升高(P<0.001);与模型组比较,维生素E组、川芎2 g组、川芎4 g组、川芎配伍人参2 g组均能显著降低其含量(P<0.01、P<0.01、P<0.001、P<0.001)。见表5。
2.6 对大鼠脑组织PI3K、AKT、HIF-1α蛋白表达量的影响 与空白组比较,模型组大鼠心脏组织中PI3K、AKT表达有降低趋势,差异无统计学意义(P>0.05)。HIF-1α表达显著增加(P<0.01);与模型组比较,维生素E组、川芎4 g、川芎配伍人参2 g中HIF-1α表达显著增加(P<0.01),PI3K、AKT表达有所增加,但差异无统计学意义(P>0.05)。见表6,图1。
3 讨论
脑卒中、阿尔茨海默病、血管性痴呆、帕金森病等脑部疾病在老年人群中呈高发病率的趋势,影响老年健康及生活。现代研究发现脑部退行性疾病与衰老密不可分[11],机体或细胞内自由基失衡导致的氧化应激被认为是造成衰老的重要因素,从而使神经元内积累聚集性蛋白质和脂质过氧化产物[12]。此外衰老致内皮功能紊乱、血管生成受损,微循环产生障碍[13]。中医认为衰老多由气血失调引起,气虚无力推动血液运行致瘀血形成。《血证论》中有:“血在上,则浊蔽而不明矣。”《医林改错》中亦云:“凡有瘀血也令人善忘。”可见瘀血可致“呆病”“健忘”[14]。研究表明,在高血压及其并发症、阿尔茨海默病等发病过程中伴有明显的血瘀,血瘀又加重疾病进程[15-16]。中医久服多用于慢性病调理,能在一定程度上延缓病情,通过延长给药时间达到疗效。具体给药时间以临床起效为主。
川芎具有活血行气、祛风止痛的功效。川芎中主要活性成分川芎嗪(Tetramethylpyrazine,TMP)、阿魏酸具有抗血小板凝集、扩张血管、改善脑部血液循环、减轻脑缺血损伤等作用[17]。研究表明,TMP可能通过抑制炎症和改善神经元核蛋白表达来增强神经细胞增殖,减轻脑缺血再灌注损伤[18]。此外还可通过调节血栓素A2,/前列环素(Thromboxane A2,TXA2/Prostacyclin,PGI2)失衡状态,起到抗血栓作用。因此本实验通过腹腔注射D-半乳糖,通过冰水浴及注射肾上腺素构建衰老合并寒凝血瘀氧化损伤模型,给予川芎2 g、4 g剂量28 d,探讨川芎在小剂量及配伍应用下久服延缓脑衰老的作用及机制。
研究表明,当机体处于衰老状态时,SOD及GSH-Px活性明显降低,MDA及PC含量升高[19]。本实验表明模型组血清中SOD、GSH-Px的含量降低,MDA、PC含量上升,提示大鼠处于衰老状态。与模型组比较,川芎2 g、4 g组升高血清中SOD、GSH-Px含量及降低血清MDA、PC含量,从而减轻大鼠体内氧化应激。血管内皮功能障碍是血管衰老的早期病理改变,可引起内皮细胞(Endothelial Cell,EC)分泌的血管调节因子水平发生改变,ET-1、NO作为血管收缩和舒张物质,能够维持基础血管张力与心血管系统稳态[20]。NO由神经元型一氧化氮合酶(Neuronal Nitric Oxide Synthase,nNOS)、誘生型一氧化氮合酶(Inducible Nitric Oxide Synthase,iNOS)和eNOS3种一氧化氮合酶(Nitric Oxide Synthase,NOS)催化底物L-精氨酸而生成。低浓度的NO具有舒张血管、抑制血小板黏附聚集,防止血栓形成等作用[21]。eNOS产生的NO可能通过清除活性氧而具有脑神经保护作用[22]。然而血瘀造成脑血流量减少,氧化应激下活化的iNOS可合成并分泌大量的NO,刺激ET-1生成,并使神经胶质和神经元细胞释放炎症介质,引起神经血管单位功能障碍,导致血管的收缩与舒张功能受损[23]。TXB2可促进血小板黏附、聚集、血管收缩,促进血栓形成。随着脑内血栓素的含量升高,ET浓含量增加,使缺血区血管产生强烈、持久性收缩,加重缺血和脑组织损伤[24]。研究发现在动脉硬化闭塞症血瘀证、气虚血瘀型脑梗患者中存在血管EC增殖活性降低,EC损伤,ET、NO的含量明显增高等[25]。
本实验表明,模型组下调eNOS,上调NO、ET-1、TXB2含量,提示大鼠脑氧化损伤,这可能与NO可刺激EC凋亡,造成血管壁局部的血栓形成有关[26]。与模型组比较,川芎2 g、4 g组降低脑组织中NO,ET-1、TXB2含量,升高eNOS含量,从而改善内皮功能紊乱,抑制NO含量升高引起的氧化应激。PI3K/AKT信号通路参与调控炎症反应、氧化应激、细胞凋亡及自噬,其激活是缺血后机体的保护机制之一,eNOS是该信号通路的下游靶点[27],细胞内底物如血管内皮生长因子等均可通过激活受体酪氨酸激酶使PI3K磷酸化,产生第二信使磷脂酰肌醇-3,4,5-三磷酸(Phosphatidylinositol 3,4,5-trisphosphate,PIP3),其与细胞内的信号蛋白AKT及3-磷酸肌醇依赖性激酶-1(3-phosphoinositide-dependent Kinase 1,PDK1)结合,活化后的AKT可调控eNOS、NO的生成[28],另有研究表明其活化后激活核因子E2相关因子2(Nuclear Factor E2-related Factor 2,Nrf2)蛋白表达[29]。HIF-1由α、β亚单位组成,HIF-1α在低氧中稳定表达,对缺血坏死后新生血管的形成起关键调控作用[30]。另有研究证实NO参与调控HIF-1α的活化表达,作用机制可能是阻断Fe2+绑定脯氨酰羟化酶,从而阻断α亚基的降解[31]。本实验表明模型组HIF-1α蛋白表达显著上升,PI3K/AKT蛋白表达呈下降趋势,与模型组比较,川芎2 g、4 g组激活HIF-1α蛋白表达。研究进一步说明活血化瘀药川芎可能是在一定程度上改善内皮功能紊乱,改善脑血管微循环,推动气血运行,减轻血瘀状态,抑制氧化应激反应,进而延缓衰老,保护脑功能。
川芎辛温升散,通过中医传承辅助平台建立处方数据库,运用数据挖掘得出临床用于治疗头痛等脑部疾病时汤剂中川芎平均用量为11.68 g[32]。更有研究表明单药川芎给予7.5 g时,可以升高D-半乳糖衰老模型脑组织中SOD、GSH-Px含量,降低MDA、MAO含量,具有良好的延缓衰老的作用[33]。川芎单用能显著降低脑缺血-再灌注大鼠皮层TNF-α含量[34]。《景岳全书》记载川芎多服久服,令人走散真气,能致暴亡。“久服”药物需具备很高的安全性,需要缓缓以小剂量药物扶持,产生较为温和的干预作用,由量变到质变从而维护健康[9]。老年气虚,素体虚弱,用药不宜多量,本实验表明,川芎2 g,4 g小剂量下对血清抗氧化指标可产生一定作用,并能改善脑内皮功能。通过进一步降低剂量至1 g并与补气药人参1 g配伍益气活血,其效果优于单味川芎2 g及4 g。《本草备要》认为川芎单服则脏有偏胜,久服则过剂生邪,故有此失。若有配合节制,则不至此矣[35]。因此川芎临床应用中,多以药对或方剂形式应用。配伍是中药发挥药效的有效形式。川芎多与补虚药、活血化瘀药、清热药等相配伍。如黄芪、当归、丹参、赤芍等。川芎-赤芍既能活血化瘀,又可借气增加行血之力,使行血破滞的功效倍增[36];川芎、当归可以滋养血脉、活血行气,使清阳之气上行,为血不配气头痛之专用方[37]。临床以此类方为基础辨证治疗慢性脑缺血。川芎龙蛭汤以川芎地龙为主,能降低TNF-α、降钙素原水平,进而改善脑梗死气虚血瘀证微循环,减轻炎症反应,促进神经功能重建[38]。文献研究表明川芎治疗脑部疾病等配伍补虚药频率最高[32]。本实验以人参为例,人参扶正固本,大补元气,制约川芎“久服散真气”。“脑为髓之海,真气之所聚”,大脑神经之思维等属于真气的功能表现[39]。本实验表明川芎配伍人参2 g组对抗氧化指标及脑组织血管内皮功能起到改善作用,川芎剂量由2 g减少为1 g并与1 g人参合用后可以改善内皮功能,减轻氧化应激从而使抗氧化作用增强,优于将单味川芎剂量增加到4 g,且益气活血对于氧化损伤改善明显。研究表明,人参-三七-川芎提取物可以延缓血管ECs的衰老,其机制可能与激活沉默信息调节因子1自噬通路,提升自噬水平有关[40]。因此推测其发挥作用可能与人参补气推动血液运行,减轻血瘀带来的氧化应激,延缓内皮衰老起到协同增效的作用。
人口老齡化日益严重,老年人作为特殊人群,中药临床安全应用尤为重要,如何发挥中医药优势防治老年病,显得十分必要[41]。
综上所述,本研究通过构建衰老合并血瘀氧化损伤模型,针对老年血瘀状态下,探讨川芎小剂量下久服对于延缓脑衰老的药效及作用机制,比较单味药不同剂量下及配伍后其药效,从而阐明川芎的用药配伍规律,为临床用药的安全性、有效性、合理性提供依据。
利益冲突声明:无。
参考文献
[1]钟耀欣.解读《神农本草经》(109)[J].开卷有益:求医问药,2022,32(10):51-52.
[2]邓彩霞,蓝贤俊,农文田,等.川芎对衰老小鼠脑组织SOD和MDA及羟自由基的影响[J].医学理论与实践,2012,25(5):499-500.
[3]于博文,胡艳红,杨静,等.人参-三七-川芎提取物对内皮微粒介导HUVECs衰老的干预作用[J].中国实验方剂学杂志,2021,27(8):50-56.
[4]ZHANG H,TANG W,WANG S,et al.Tetramethylpyrazine Inhibits Platelet Adhesion and Inflammatory Response in Vascular Endothelial Cells by Inhibiting P38 MAPK and NF-κB Signaling Pathways[J].Inflammation,2020,43(1):286-297.
[5]Gao J,Ren J,Ma X,et al.Ligustrazine prevents coronary microcirculation dysfunction in rats via suppression of miR-34a-5p and promotion of Sirt1[J].Eur J Pharmacol,2022,929:175150.
[6]黎健.脑衰老及其干预新策略[J].中国临床保健杂志,2022,25(4):438-445.
[7]张健莉,雷爱弟.脑血管内皮细胞功能障碍与血管性痴呆[J].中国老年学杂志,2021,41(11):2451-2457.
[8]崔京,李逸雯,刘玥,等.因瘀致衰与血管衰老[J].中国中西医结合杂志,2022,42(4):487-491.
[9]于倩,周鹏,张建军,等.从《神农本草经》“久服”药物探源中药保健功效[J/OL].中国中药杂志:1-7[2022-12-03].DOI:10.19540/j.cnki.cjcmm.20220608.401.
[10]王岩玲,任明,张翔宇,等.慢性脑缺血证候分布和辨证用药规律的文献研究[J].中国中医基础医学杂志,2022,28(3):394-397.
[11]刘雨欣,秦雪梅,高丽.脑细胞衰老在阿尔茨海默症发病机制中的潜在作用[J].药学学报,2022,57(7):1946-1953.
[12]ELZI DJ,SONG M,SHIIO Y.Role of galactose in cellular senescence[J].Exp Gerontol,2016,73:1-4.
[13]袁蓉,信琪琪,施伟丽,等.血管衰老加剧动脉粥样硬化主要机制及中医药干预作用[J/OL].中国中西医结合杂志:1-5[2022-12-03].http://kns.cnki.net/kcms/detail/11.2787.R.20220413.1657.008.html.
[14]李红,李方玲,李金辉,等.养心益气活血方治疗血管性痴呆气虚血瘀证的临床研究[J].中西医结合心脑血管病杂志,2022,20(12):2164-2167.
[15]林祥芝.益气活血治疗老年气虚血瘀引起的H型高血压临床观察[J].医药论坛杂志,2022,43(13):107-109.
[16]程越,于漫,王彩霞.阿尔茨海默病之气血津液辨治[J].中医学报,2021,36(3):482-485.
[17]ZHANG Y,MA C,HE L,et al.Tetramethylpyrazine Protects Endothelial Injury and Antithrombosis via Antioxidant and Antiapoptosis in HUVECs and Zebrafish[J].Oxid Med Cell Longev,2022,2022:2232365.
[18]FENGMENG T,MEIHONG S,LEI W,et al.Ultrasound/microbubble-mediated Tetramethylpyrazine for neuroprotection against cerebral Ischemia/reperfusion-injured rat brain[J].Applied Acoustics,2021,183:108330.
[19]HHN A,WEBER D,JUNG T,et al.Happily(n)ever after:Aging in the context of oxidative stress,proteostasis loss and cellular senescence[J].Redox Biol,2017,11:482-501.
[20]FANG X,CRUMPLER RF,THOMAS KN,et al.Contribution of cerebral microvascular mechanisms to age-related cognitive impairment and dementia[J/OL].Physiol Int,2022,109(1).[2022-0302].https://akjournals.com/view/journals/2060/109/1/article-p20.xml.[published online ahead of print Mar 10,2022].
[21]何鹏,唐巍,童明月,等.電针对脑缺血大鼠缺血皮质区内皮型一氧化氮合酶及血清中一氧化氮含量的影响[J].安徽中医药大学学报,2020,39(4):56-60.
[22]曾静,李丹丹,赵弘轶,等.eNOS解偶联对大脑中动脉栓塞后大鼠神经血管单元的作用及机制[J].中风与神经疾病杂志,2017,34(6):500-503.
[23]党英男,贾舒婷,赵伟,等.红景天对脑缺血-低氧大鼠血流动力学及神经元凋亡作用机制[J].脑与神经疾病杂志,2021,29(12):727-732.
[24]万浩芳,万海同,韩进,等.生芎配伍方对脑缺血性损伤大鼠的抗栓纤溶作用[J].中国中医急症,2016,25(1):1-3.
[25]李鑫,李大勇,吕延伟,等.血瘀型动脉硬化闭塞症血清代谢物和炎症反应相关因子的变化及意义[J].时珍国医国药,2015,26(4):996-998.
[26]张再丰,王秀丽,张赏月,等.内源性一氧化氮对血管内皮细胞超氧化物歧化酶1活性及细胞凋亡的影响[J].中华实用儿科临床杂志,2021,36(15):1176-1180.
[27]QU XY,ZHANG YM,TAO LN,et al.XingNaoJing injections protect against cerebral ischemia/reperfusion injury and alleviate blood-brain barrier disruption in rats,through an underlying mechanism of NLRP3 inflammasomes suppression[J].Chin J Nat Med,2019,17(7):498-505.
[28]蔡亮,张炳东.PI3K/AKT信号通路在脑缺血再灌注损伤中的研究进展[J].广西医科大学学报,2021,38(10):2012-2016.
[29]唐赫鹏,车楠,刘函晔,等.连翘酯苷A通过抑制PI3K/Akt通路并激活Nrf2/HO-1通路抑制LPS诱导的炎症及氧化应激[J].免疫学杂志,2021,37(5):390-396.
[30]毕胜,盛宝英,韩凤,等.缺氧诱导因子1α参与大脑中动脉闭塞模型大鼠的脑损伤与脑保护[J].中国组织工程研究,2021,25(35):5644-5649.
[31]董越,王朝驹,王德伟,等.一氧化氮诱导星形胶质细胞HIF-1α活化的实验研究[J].解放军医药杂志,2020,32(10):19-23.
[32]田广宇.基于数据挖掘的国医大师应用活血类药物的剂量及相关研究[D].武汉:湖北中医药大学,2020.
[33]刘颖,李花,刘旺华,等.川芎对D-半乳糖衰老模型小鼠的抗衰老作用研究[J].湖南中医杂志,2021,37(2):147-149.
[34]喻斌,沈祥春,梁涛,等.基于脑区特异性不同剂量冰片与川芎配伍抗脑缺血的研究[J].中国医院药学杂志,2017,37(18):1792-1796.
[35]汪昂.本草备要(中医临床实用经典丛书大字版)[M].北京:中国医药科技出版社,2018:244.
[36]马进,甘雨,袁媛,等.川芎赤芍对脑缺血大鼠血管生成素及低氧诱导因子表达的影响[J].中国医药导报,2016,13(17):8-11,15.
[37]熊永辉.基于医籍文献人用历史的痹病用药规律挖掘[J].医学理论与实践,2022,35(20):3431-3435.
[38]孙锡萍,王念龙,刘天易,等.川芎龙蛭汤对脑缺血损伤模型大鼠血清中TNF-α、Ang-1和VEGF水平影响及作用机制[J].中国老年学杂志,2022,42(13):3267-3271.
[39]吴以岭.气络—NEI网络研究[C].第十一届国际络病学大会论文集.河北石家庄,2015:47-51.
[40]修成奎,付莹坤,王强,等.人参-三七-川芎提取物对过氧化氢诱导内皮细胞衰老SIRT1自噬通路的机制研究[J].中国中药杂志,2021,46(23):6216-6223.
[41]王林元,王淳,张建军,等.辨证保健理论体系的构建[J].中华中医药杂志,2022,37(9):4993-5000.
(2022-11-15收稿 本文编辑:吴珊)
基金项目:国家重点研发计划(2018YFC1706800)作者简介:刘尧(1996.09—),女,硕士研究生,研究方向:中医药基本理论与物质基础研究,E-mail:lyao611@163.com通信作者:王林元(1961.10—),男,硕士,教授,博士研究生导师,研究方向:中医药基本理论与中药新技术,E-mail:wangly@bucm.edu.cn;李振皓(1987.07—),男,博士,副研究员,研究方向:中药药理药效研究,E-mail:zhenhao6@126.com