小麦-滨麦衍生系18DM134的分子细胞遗传学及赤霉病抗性鉴定
2023-06-20尚立辉刘文豪王斯文杨晓莹程小方邓平川陈春环赵继新王长有吉万全
尚立辉,刘文豪,王斯文,杨晓莹,程小方,邓平川,陈春环,赵继新,王长有,吉万全
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.农业部作物基因资源与种质创制陕西科学观测实验站,陕西杨凌 712100)
小麦赤霉病(Fusarium head blight, FHB)是由禾谷镰刀菌(FusariumgraminearumSchwabe)引起的真菌性病害,是世界范围内小麦生产的主要病害之一[1]。小麦赤霉病严重影响小麦产量,一般可导致小麦减产10%~30%,严重时甚至颗粒无收[2]。使用化学药剂对赤霉病进行防治,对环境造成污染的同时,也会导致生产成本增加。选育抗病品种是防治赤霉病最经济、有效的方法。目前世界范围内的抗赤霉病种质资源较为匮乏,生产中使用的抗源主要局限于苏麦3号、望水白、Frontana等少数几个品种及其衍生系,严重阻碍了抗病品种的选育[3]。
挖掘新的抗赤霉病种质资源,是培育抗病品种的基础。小麦野生近缘种含有丰富的抗病基因,利用染色体工程等技术可将外源种属的有益基因导入到普通小麦中,创制新的抗病种质材料。滨麦(Leymusmollis(Trin.) Pilger, 2n=4x=28, NsNsXmXm)是赖草属的一个多年生四倍体物种,具有抗寒、抗旱、耐盐碱等优良特性,同时对小麦的多种真菌病害均具有良好的抗性,是普通小麦遗传改良的重要基因资源[4-5]。国内关于普通小麦和滨麦的杂交研究开始于20世纪80年代,1985年陈漱阳等[6]通过对杂种F1进行幼胚培养和秋水仙素加倍,首次获得了小麦-滨麦新种质八倍体小滨麦(Tritileymus);随后傅 杰等[7-8]和王献平等[9]对八倍体小滨麦的形成和染色体构型进行了详细分析。目前育种学家通过染色体工程等方法获得了一系列对条锈病具有良好抗性的小麦-滨麦衍生系材料[10-12],但有关抗赤霉病的小麦-滨麦衍生系报道较少。
本课题组前期从八倍体小滨麦M842和硬粒小麦D4286(Triticumturgidum)的杂交后代中筛选出一个抗赤霉病的衍生系18DM134,本研究运用细胞学、原位杂交、液相芯片、分子标记等技术对其染色体组成进行鉴定,并对其农艺性状和赤霉病抗性进行调查,以期为小麦品种改良和赤霉病抗性育种提供候选种质。
1 材料与方法
1.1 材料
普通小麦7182和苏麦3号(Triticumaestivum, 2n=6x=42,AABBDD),硬粒小麦 D4286(2n=4x=28, AABB),八倍体小滨麦M842(2n=8x=56, AABBDDNsNs)和小麦-滨麦衍生系18DM134均于2020-2022年种植于西北农林科技大学试验田。M842是由普通小麦7182与滨麦杂交,经幼胚拯救和染色体加倍,又与7182回交、自交选育的不完全双二倍体材料[6];18DM134是从八倍体小滨麦M842与D4286的杂交F6代中筛选获得 。华山新麦草(PsathyrostachyshuashanicaKeng, 2n=2x=14, NsNs)全基因组DNA、滨麦全基因组DNA和大赖草(Leymusracemosus, 2n=4x=28, NsNsXmXm)全基因组DNA分别用于基因组原位杂交探针制备和分子标记分析。以上所有材料均保存于西北农林科技大学农学院小麦远缘杂交与染色体工程实验室。赤霉病菌生理小种PH-1由西北农林科技大学植物保护学院提供。
1.2 方法
1.2.1 细胞学鉴定
于3月下旬和4月中旬,在田间取供试材料的根尖和幼穗,对根尖体细胞有丝分裂中期Ⅰ的染色体数目和花粉母细胞减数分裂中期Ⅰ和减数分裂后期Ⅰ的染色体构型进行观察。根尖和幼穗的取样、固定和镜检参照Wang等[13]的方法。使用Olympus BX-43(Japan)相差显微镜观察并拍照。
1.2.2 原位杂交鉴定
根尖处理和染色体制片:将供试材料种子置于培养皿中浸泡至露白,在23 ℃恒温培养箱中黑暗培养2~3 d,待根长为2~4 cm时取根尖分生区组织,根尖的处理与固定参照Pang等[14]的方法进行,染色体制片参照Han等[15]的方法。
原位杂交分析:参照李荣华等[16]的方法提取供试材料的全基因组DNA,稍作调整。基因组原位杂交(genomicinsituhybridization, GISH)参照Wang等[17]的方法,用Fluorescein-12-dUTP (绿)分别标记滨麦和华山新麦草全基因组DNA作为探针;荧光原位杂交(fluorescenceinsituhybridization, FISH)参照Yang等[18]的方法,用寡核苷酸Oligo-pSc119.2(绿)和Oligo-pTa535(红)作为探针。参照杨晓菲等[19]报道的普通小麦7182 FISH带型对供试材料的核型进行分析。用Olympus BX-53(Japan)荧光显微镜观察并拍照,用cellSens(Olympus,Japan)和Photoshop 2021(Adobe, USA)分析处理图像。
1.2.3 小麦-华山新麦草液相芯片分析
用本课题组联合博瑞迪生物技术有限公司开发的小麦-华山新麦草液相芯片(GenoBaits○RWheatplusPh)对18DM134的染色体组成进行分析。由博瑞迪生物技术有限公司使用18DM134的全基因组DNA进行DNA文库制备及探针杂交,用Illumina HiSeq X进行测序,并对测序数据质量进行检测;用BWA软件将测序数据与参考基因组进行比对,用bamdst (v.1.0.6)计算每个探针的测序深度,用R package进行绘图。
1.2.4 分子标记分析
使用分布于小麦7个部分同源群上的SSR、EST和PLUG标记,对18DM134中所携带滨麦染色体的部分同源群归属进行鉴定。SSR标记信息参照网站http://wheat-urgi.versailles.inra.
fr和https://graingenes.org/cgi-bin/GG3/browse.cgi,EST标记信息参考网站https://wheat.pw.usda.gov/SNP/new/pcr_primers.shtml,PLUG标记信息参照Ishikawa等[20]的报道。标记均由北京奥科鼎盛生物技术有限公司合成。按照Yin等[21]的方法进行PCR扩增和凝胶电泳分析。
1.2.5 农艺性状调查
2022年6月收获植株后,调查并记录18DM134及其亲本的株高、分蘖数、穗长、小穗数、小穗粒数和千粒重。使用SPSS 22(IBM, USA)对数据进行统计分析。
1.2.6 赤霉病抗性鉴定
分别于2021和2022年4月至5月在田间环境条件下,参照Yang[22]的方法采用单花滴注法进行接种,每个材料随机接种 20 个单穗,套袋保湿 3 d。于2022年9月至10月在温室中对供试材料的赤霉病抗性进行鉴定,方法与田间环境条件下相同。
接种28 d后,以苏麦3号为抗病对照,参照《小麦区域试验品种抗赤霉病鉴定技术规程:NY/T 2954—2016》的方法对材料接种穗的发病程度进行调查和记载,计算供试材料的平均严重度和病小穗率[23]。依据材料的平均严重度判断其对赤霉病的抗性水平,划分标准:平均严重度=0,免疫 (I);0<平均严重度<2.0,高抗 (HR);2.0≤平均严重度<3.0,中抗 (MR);3.0≤平均严重度<3.5,中感 (MS);平均严重度3.5,高感 (HS)。
平均严重度=Σ(各病级穗数×相应病级数)/总调查穗数;
病小穗率= 病小穗数/总小穗数×100%。
1.2.7 赤霉病抗性基因检测
利用Qi等[24]报道的大赖草7Lr#1S染色体上与赤霉病抗性基因Fhb3连锁的3个EST分子标记BE404728、BE585744和BE586111及其PCR扩增和凝胶电泳分析方法,检测18DM134中是否含有Fhb3基因。所用标记的引物信息见表1。
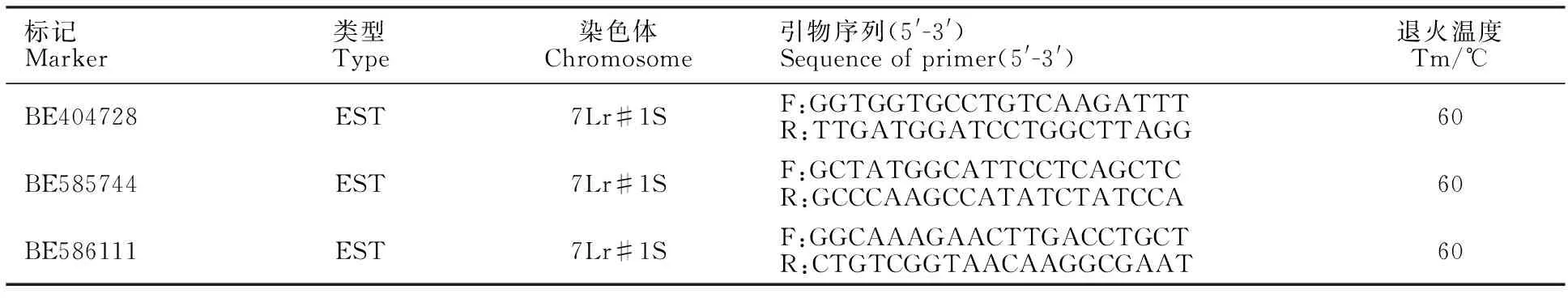
表1 与Fhb3基因连锁的特异分子标记Table 1 Specific molecular markers linked to Fhb3 gene
2 结果与分析
2.1 细胞学鉴定结果
根尖分生区细胞染色体数目观察结果显示,18DM134体细胞在有丝分裂中期含有42条染色体(图1a)。花粉母细胞观察结果显示,18DM134在减数分裂中期Ⅰ染色体配对构型为2n=21Ⅱ(图1b),未观察到多价体的形成;在减数分裂后期Ⅰ同源染色体可以均等分离,未观察到落后染色体(图1c)。这说明18DM134是一个在细胞学上具有稳定性的材料。

a:有丝分裂中期;b:减数分裂中期Ⅰ;c:减数分裂后期Ⅰ。a: Mitotic metaphase; b: Meiotic metaphase Ⅰ; c: Meiotic anaphase Ⅰ.图1 18DM134的细胞学观察结果Fig.1 Cytological observation of 18DM134
2.2 原位杂交鉴定结果
用滨麦全基因组DNA为GISH探针(绿色),对18DM134的根尖体细胞染色体进行鉴定,结果(图2a)显示,18DM134含有2条完整的外源染色体和2条易位染色体。进一步用华山新麦草全基因组DNA为GISH探针(绿色),对18DM134的根尖体细胞染色体进行鉴定,结果(图2b)与用滨麦全基因组DNA为GISH探针的结果相同。这表明18DM134中的外源染色体为Ns染色体。

a:用滨麦全基因组DNA为探针(绿色)对18DM134根尖染色体进行GISH分析;b:用华山新麦草全基因组DNA为探针(绿色)对18DM134根尖染色体进行GISH分析。a: GISH analysis of 18DM134 root tip chromosomes using whole-genomic DNA of L. mollis as probes(green); b: GISH analysis of 18DM134 root tip chromosomes using whole-genomic DNA of P. huashanica as probes(green).图2 18DM134的GISH结果Fig.2 GISH analysis of 18DM134
以寡核苷酸Oligo-pTa535(红)和Oligo-pSc119.2(绿)为FISH探针,以华山新麦草全基因组DNA为GISH探针对18DM134进行FISH-GISH分析。结果(图3a,图3b)显示,18DM134体细胞中含有38条小麦染色体、2条完整外源染色体和2条易位染色体。

a:18DM134的FISH分析;b:18DM134的GISH分析;c:18DM134的核型;d:7182的FISH分析;e:7182的核型;f:7182和18DM134中特殊染色体比较。a和b图中*指示完整的外源染色体,箭头指示易位染色体;c图中T表示易位染色体。a: FISH analysis of 18DM134; b: GISH analysis of 18DM134; c: Karyotype of 18DM134; d: FISH analysis of 7182; e: Karyotype of 7182; f: Comparison of special chromosomes in common wheat 7182 and 18DM134. In figures a and b, * indicates the intact alien chromosome, and arrow indicates the translocation chromosome; In figure c, T represents the translocation chromosome.图3 18DM134的FISH-GISH分析结果Fig.3 FISH-GISH analysis of 18DM134
参照杨晓菲等[21]报道的7182 FISH带型,发现18DM134中除了6A、3D和5D染色体外,其他染色体均能被准确鉴别出来(图3c、图3d和图3e)。2条完整外源染色体显示出Oligo-pTa535探针的红色带型,分布在短臂端部和长臂的中部与端部,该带型与6D染色体带型相似;1条易位染色体只在短臂端部显示出较强的Oligo-pTa535探针红色带型和较弱的Oligo-119.2探针绿色带型,长臂端部不显示带型(图3c),短臂端部带型与3D染色体的短臂端部带型相似,推测该易位染色体为3DS染色体与部分Ns染色体片段发生了易位;同时发现另一条易位染色体长度明显增加,其短臂端部显示出3DL染色体端部特异的Oligo-pTa535探针红色带型(图3f),推测3DL染色体易位到5DL染色体上。
2.3 小麦-华山新麦草液相芯片分析结果
小麦-华山新麦草液相芯片检测显示,亲本7182中,小麦21条小麦染色体上均具有明显的检测信号,华山新麦草7条Ns染色体上的检测信号强度极弱(图4a)。M842中,小麦21条染色体和华山新麦草7条Ns染色体上均具有明显的检测信号(图4b)。在18DM134中,小麦6A染色体上的检测信号强度极弱,5D染色体的部分区间强度很高;同时华山新麦草5Ns和6Ns染色体的部分区间的检测信号强度较强,而在其余Ns染色体上强度很低(图4c)。通过比较18DM134、7182和M842中小麦6A和5D染色体上检测信号的分布情况,推测18DM134中小麦6A染色体全部缺失,5D染色体部分缺失(图4d);同时通过比较18DM134和M842中5Ns和6Ns染色体上检测信号的分布情况,推测18DM134中含有完整的6Ns染色体和部分5Ns染色体片段。

a:7182;b:M842;c:18DM134;d:7182、M842和18DM134中5D、6A、5Ns和6Ns染色体的信号比较。紫色表示外源Ns染色体的检测信号。a: 7182; b: M842; c: 18DM134; d: Comparison of 5D, 6A, 5Ns and 6Ns chromosome signals in 7182, M842 and 18DM134. Purple represents the detection signal of alien Ns chromosome.图4 18DM134的小麦-华山新麦草液相芯片分析结果Fig.4 Liquid array analysis results of wheat-P. huashanica for 18DM134
2.4 分子标记分析结果
使用分布于小麦7个部分同源群的 EST、SSR和PLUG分子标记,对18DM134及其亲本7182、D4286和华山新麦草进行分析。从中筛选到位于第5部分同源群的3个SSR标记以及位于第6部分同源群的3个EST标记、1个EST-SSR标记和1个PLUG标记(表2),以上标记在18DM134中均可以扩增出与华山新麦草相同的特异条带,而在亲本7182、D4286中未扩增出目标条带(图5)。分子标记分析结果与小麦-华山新麦草液相芯片分析结果相一致,表明18DM134中外源染色体涉及5Ns和6Ns染色体。

M:DL2000;1:7182;2:D4286;3:华山新麦草;4:18DM134;a1:BQ159615;a2:CD453502;a3:BQ167073;a4:Swes123;a5:TNAC1748-Taq Ⅰ;b1:Xgpw8092;b2:Xcfd81;b3:Xgwm410。箭头指示特异条带。M: DL2000; 1: 7182; 2: D4286; 3: P. huashanica; 4: 18DM134; a1: BQ159615; a2: CD453502; a3: BQ167073; a4: Swes123; a5: TNAC1748-Taq Ⅰ; b1: Xgpw8092; b2: Xcfd81; b3: Xgwm410. Arrow indicates specific band.图5 8个多态性标记对18DM134及其亲本的凝胶电泳分析Fig.5 Electrophoresis analysis of 18DM134 and its parents using eight polymorphic markers

表2 18DM134中与滨麦染色体连锁的特异分子标记Table 2 Specific molecular markers linked to L. mollis chromosomes in 18DM134
为确定18DM134中5D染色体部分片段缺失的位置,使用分布在5D染色体不同区间的标记进行分析。结果(表3)显示,位于5DS染色体和着丝粒位置的标记只在普通小麦7182中表现出多态性,位于5DL染色体的标记在18DM134和7182中表现出相似的多态性,表明18DM134中5DS染色体缺失。推测18DM134的染色体组成为12A+14B+10D+2(6Ns)+2(T3DS-5Ns片段)+2(T3DL-5DL)。

表3 5D染色体不同区间标记在试验材料中的多态性分析Table 3 Polymorphism analysis of marker in different bin of 5D chromosome in the test materials
2.5 农艺性状调查和赤霉病抗性鉴定结果
农艺性状调查结果显示,18DM134的株高与亲本D4286接近,但显著低于亲本M842和7182(表4,图6a );18DM134的分蘖数、穗长和千粒重均显著高于亲本,而小穗数则显著低于亲本(表4);18DM134的芒长和芒色(图6b)、粒形(图6c)与亲本D4286接近。赤霉病抗性鉴定结果显示,18DM134和亲本M842对赤霉病表现为高抗,而亲本7182和D4286对赤霉病表现为高感(图6d,表5),推测18DM134的赤霉病抗性来源于其携带的Ns染色体。总体来看,滨麦染色体的导入使18DM134的株高降低、分蘖增多以及千粒重提高,同时使其具有良好的赤霉病抗性。因此,18DM134可以作为中间桥梁材料用于抗赤霉病新材料的创制。

a:植株;b:小穗;c:籽粒;d:赤霉病抗性表型(接种后28 d);1:7182;2:M842;3:D4286;4:18DM134;5:苏麦3号。a: Plants; b: Spikelets; c: Seeds; d: FHB resisttance phenotype(28 days after inoculation); 1: 7182; 2: M842; 3: D4286; 4: 18DM134; 5: Sumai 3.图6 18DM134及其亲本的农艺性状和赤霉病抗性鉴定表型Fig.6 Evaluation of agronomic traits and FHB resistance phenotype of 18DM134 and its parents

表4 18DM134及其亲本的主要农艺性状比较Table 4 Comparison of the main agronomic traits of 18DM134 and its parents

表5 供试材料的赤霉病抗性鉴定统计结果Table 5 Statistical results of identification of FHB resistance in the test materials
2.6 赤霉病抗性基因检测结果
利用大赖草中与赤霉病抗性基因Fhb3连锁的3个标记BE404728、BE585744和BE586111对18DM134的抗性基因进行检测。结果在18DM134中未扩增出与大赖草相同的目标条带,推测18DM134中外源染色体上携带的赤霉病抗性基因不同于Fhb3,可能为新的赤霉病抗性基因(图7)。

M:DL2000;1:大赖草;2:7182;3:D4286; 4: 滨麦;5:18DM134;a:BE404728;b:BE585744:c:BE586111。箭头指示Fhb3基因的特异条带。M: DL2000; 1: L. racemosus; 2: 7182; 3: D4286; 4: L. mollis; 5: 18DM134; a: BE404728; b: BE585744; c: BE586111. Arrow indicates the Fhb3 gene-specific band.图7 8DM134中Fhb3基因的检测结果Fig.7 Fhb3 gene detection result in l8DM134
3 讨论
近年来随着寡核苷酸探针的发展,FISH技术有了巨大进步,通过不同探针的组合,可以获得高分辨率的染色体核型图谱,在鉴定植物外源染色体和识别植物同源染色体方面具有重要作用[25]。本研究用寡核苷酸Oligo4-pTa535(红)和Oligo-pSc119.2(绿)作为FISH探针,用华山新麦草全基因组DNA作为GISH探针对18DM134进行FISH-GISH分析。结果显示,18DM134中6A染色体被来自滨麦的2条Ns染色体完全替换,2条Ns染色体片段易位到3DS染色体上,同时3DL染色体易位到5DL染色体上;此外,6Ns染色体短臂端部以及长臂中部与端部显示出Oligo-pTa535探针的特异带型,可用于小滨麦衍生系中6Ns染色体的鉴定。
分子标记技术在植物外源基因组成鉴定以及同源群归属分析等方面具有重要作用[26]。根据不同的检测原理结合其在染色体上的特性,可以将分子标记划分为不同的类型,如基于PCR和凝胶电泳技术的SSR和EST标记,基于限制性内切酶和PCR技术的RFLP、AFLP和PLUG标记,基于高通量测序或芯片杂交技术的SNP标记[27]。本研究利用小麦-华山新麦草液相芯片(GenoBaits○RWheatplusPh)以及分布于小麦7个部分同源群上的分子标记,对18DM134的染色体组成进行分析。结果显示,18DM134中整条6A染色体和5DS染色体缺失,同时18DM134中含有的外源染色体涉及整条6Ns染色体和部分5Ns染色体片段。结合FISH-GISH结果,推测18DM134的染色体组成为12A+14B+10D+2(6Ns)+2(T3DS-5Ns片段)+2(T3DL-5DL)。
农艺性状调查结果显示,18DM134的植株较矮,且具有长穗、高千粒重等优良农艺性状;赤霉病抗性鉴定结果显示,18DM134在田间和温室环境下均对小麦赤霉病表现出良好的抗性,根据系谱分析和Fhb3基因连锁标记检测结果,推测该衍生系携带的6Ns染色体和部分5Ns染色体片段可能携带新的赤霉病抗性基因。目前由于缺少6Ns和5Ns的代换系,暂时无法准确确定18DM134中赤霉病抗性基因所在的染色体位置。同时由于18DM134含有较多的外源染色体,染色体组成较为复杂,在遗传过程中可能会由于染色体联会配对错误,造成外源染色体丢失,导致其失去对赤霉病的抗性。易位系因仅导入外源染色体的片段,可减少不良基因的带入以及外源染色体所引起的普通小麦遗传背景的不协调,具有良好的遗传稳定性[28]。因此,在小麦和近缘种属杂交培育附加系和代换系的基础上,需进一步利用组织培养、Ph1b基因突变体诱导部分同源重组、辐射诱变处理、杀配子等技术获得臂间易位系或小片段易位系[29-30],其中60Co-γ电离辐射[31]和Ph1b诱导部分同源重组[32]产生易位系的效率最高,应用最为广泛。在后续研究中可通过60Co-γ电离辐射和Ph1b诱导部分同源重组的方法对18DM134进行处理,诱导产生抗赤霉病的小片段易位系材料,然后通过连续的回交和自交,获得新的抗赤霉病种质材料。
