基于TCGA 数据库构建肝细胞癌铜死亡相关lncRNA 预后模型
2023-06-17吴燕如赵婉彬于俊岩
吴燕如 赵婉彬 于俊岩
肝癌是一种常见的恶性肿瘤,在全球癌症中发病率居第6 位,死亡率居第3 位[1]。肝细胞癌(Hepatocellular carcinoma,HCC)作为肝癌的主要组织学类型,占肝癌诊断和死亡的绝大多数[2]。近年来HCC 的诊断和治疗虽取得了许多进展,但患者的生存率仍然很低[3]。因此,寻找HCC 的生物标志物帮助指导个体化预后和治疗至关重要。
铜死亡(Cuprotosis)是2022 年3 月由Tsvetkov等[4]提出的一种新型细胞死亡方式,由铜离子与三羧酸循环脂化组分的直接结合所介导。这一结合导致脂酰化蛋白聚集和铁硫簇蛋白丢失,进而导致蛋白质毒性应激,最终诱导细胞死亡,为肿瘤治疗提供了新思路。
长链非编码RNA(long non-coding RNA,lncRNA)是一种长度>200 个核苷酸且一般不具备蛋白编码能力的 RNA 分子。lncRNA 在表观遗传修饰、转录及转录后水平调节基因表达[5]。研究显示,lncRNA在HCC 的发生发展中起着至关重要的作用[6]。但铜死亡相关lncRNA 在HCC 中的作用尚不清楚。本研究基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,通过Cox 回归和LASSO 分析构建铜死亡相关lncRNA 预后风险模型并对其预测效能进行评估。
1 材料与方法
1.1 数据下载与处理从TCGA 数据库(https://portal.gdc.cancer.gov/)下载HCC 转录组、基因突变和相应的临床信息数据并整理,根据人类基因注释文件提取lncRNA。
1.2 铜死亡相关lncRNA 的筛选通过文献检索获得19 个铜死亡相关基因[4,7~9],采用Pearson 相关性分析筛选铜死亡相关lncRNA(Pearson 相关系数>0.4,P<0.001)。
1.3 构建预后风险模型及评估采用 R 软件“caret”包将样本按1:1 分为训练集和验证集。在训练集中采用Cox 回归分析和LASSO 回归构建预后风险模型。风险评分公式如下:
β 表示回归系数,Exp 表示lncRNA 表达水平,n 为参与模型构建的lncRNA 数量。根据风险评分的中位值,将训练集和验证集患者分为高、低风险组,采用R 软件“survival”包绘制Kaplan-Meier 生存曲线,“survival ROC”包绘制受试者工作特征曲线(Receiver operating characteristic curve,ROC),计算曲线下面积(Area under curve,AUC)。使用R 软件“scatterplot3d”包绘制主成分分析(Principal component analysis,PCA)图评估高、低风险组之间的潜在差异。
1.4 构建列线图将临床病理特征与风险评分纳入单因素和多因素Cox 回归分析,评估影响HCC 患者预后的独立因素。使用R 软件构建列线图,预测和分析HCC 患者1、3、5 年生存率。校正曲线用于检验列线图的准确性。
1.5 功能富集分析采用 R 软件“ limma”包,以|log2FC|>1,FDR<0.05 为标准,筛选高、低风险组差异表达基因并绘制热图。使用“clusterProfiler”包进行基因本体论(Gene ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析。基于单样本基因集富集分析(single sample gene set enrichment analysis,ssGSEA)对免疫细胞的浸润及功能进行评估。
1.6 计算肿瘤突变负荷(Tumor mutational burden,TMB)评分使用R 软件“maftools”包对基因突变数据进行分析绘制瀑布图。“ limma”、“ggpubr”包用于绘制高、低风险组小提琴图。根据中位截断值将HCC 患者分为高、低TMB 组,使用“survival”包绘制生存曲线。
1.7 统计学分析采用R 软件4.2.1 进行Pearson 相关性分析、Cox 回归、LASSO 回归、Kaplan-Meier曲线分析。计数资料采用χ2检验,计量资料采用Wilcoxon 秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 铜死亡相关lncRNA 的鉴定从374 例HCC 组织样本和50 例正常肝脏组织样本RNA 测序数据中提取出16 773 个lncRNA,通过共表达分析获取381 个铜死亡相关lncRNA,见图1。
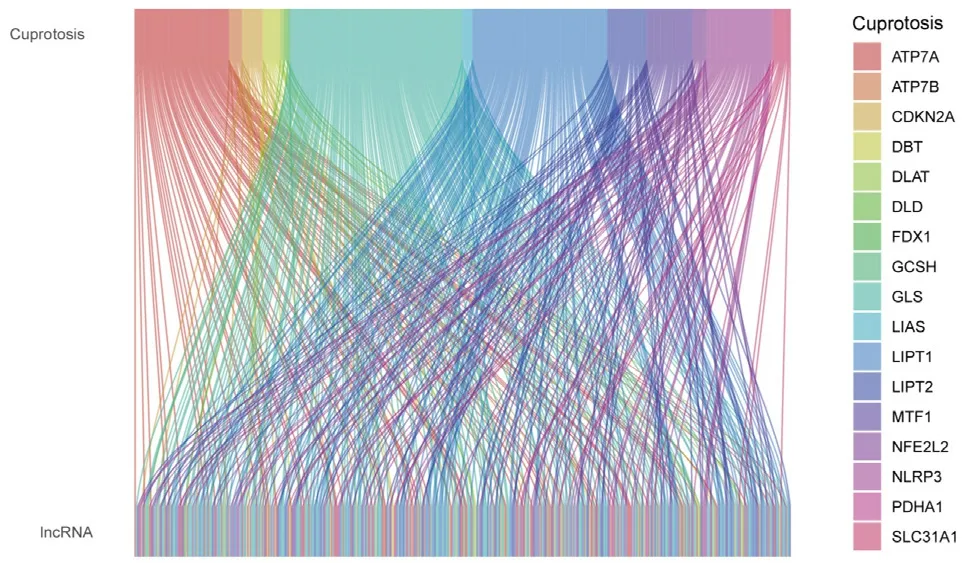
图1 铜死亡相关基因与铜死亡相关lncRNA 桑基图
2.2 构建铜死亡相关lncRNA 预后风险模型及评估将370 例有完整信息的样本分为训练集(185 例)和验证集(185 例),χ2检验结果显示两组间一般资料比较,差异无统计学意义(P>0.05),见表1。在训练集中行单因素Cox 回归分析获得41 个显著影响预后的铜死亡相关lncRNA(图2A),纳入LASSO 回归筛选出16 个lncRNA(图2B),多 因素Cox 回归分析进一步确定7 个基因构建风险模型,其中AC105020.1、CHASERR 是HCC 患者预后保护因素,FOXD2-AS1、MIR4435-2HG、NRAV、RNF216P1、SNHG3 是预后危险因素。根据风险评分中位值将训练集和验证集患者分为高、低风险组,生存相关图形(图3)显示高风险组HCC 患者的预后较低风险组差(P<0.05)。ROC 曲线结果显示训练集(图4A)1、3、5 年的AUC 值分别为0.819、0.822、0.814,验证集(图4B)AUC 值为0.737、0.651、0.659。整个测试集中风险评分的AUC 值最高,提示风险模型较临床病理特征可更好地预测HCC 患者预后(图4C)。PCA 图显示所有基因(图4D)、铜死亡相关基因(图4E)、铜死亡相关lncRNA 的表达(图4F)均未能区分出高、低风险组的差异。HCC患者根据参与模型构建的7 个铜死亡相关lncRNA的表达情况被分为两个不同的集群(图4G)。
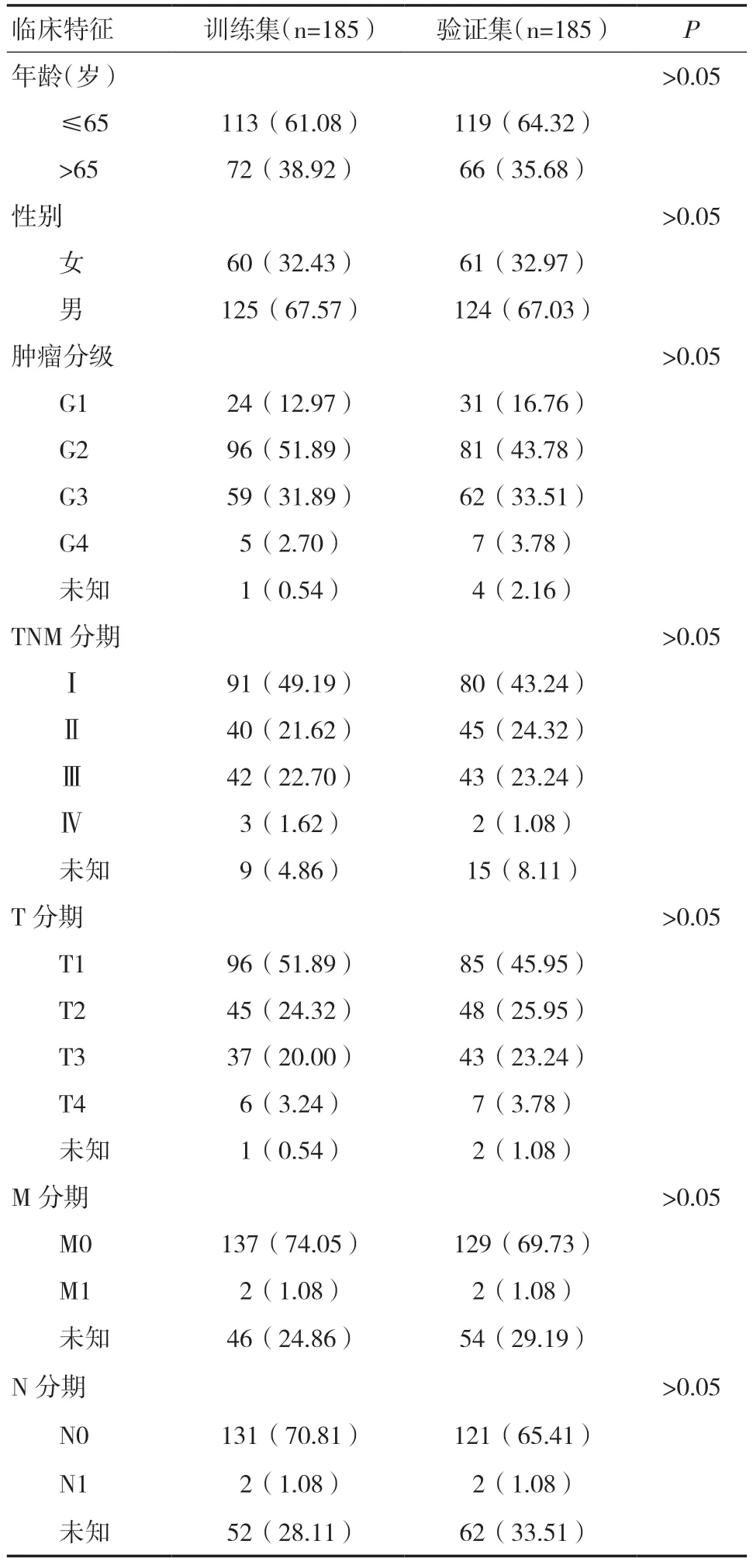
表1 训练集和验证集HCC 患者的临床特征[n(%)]
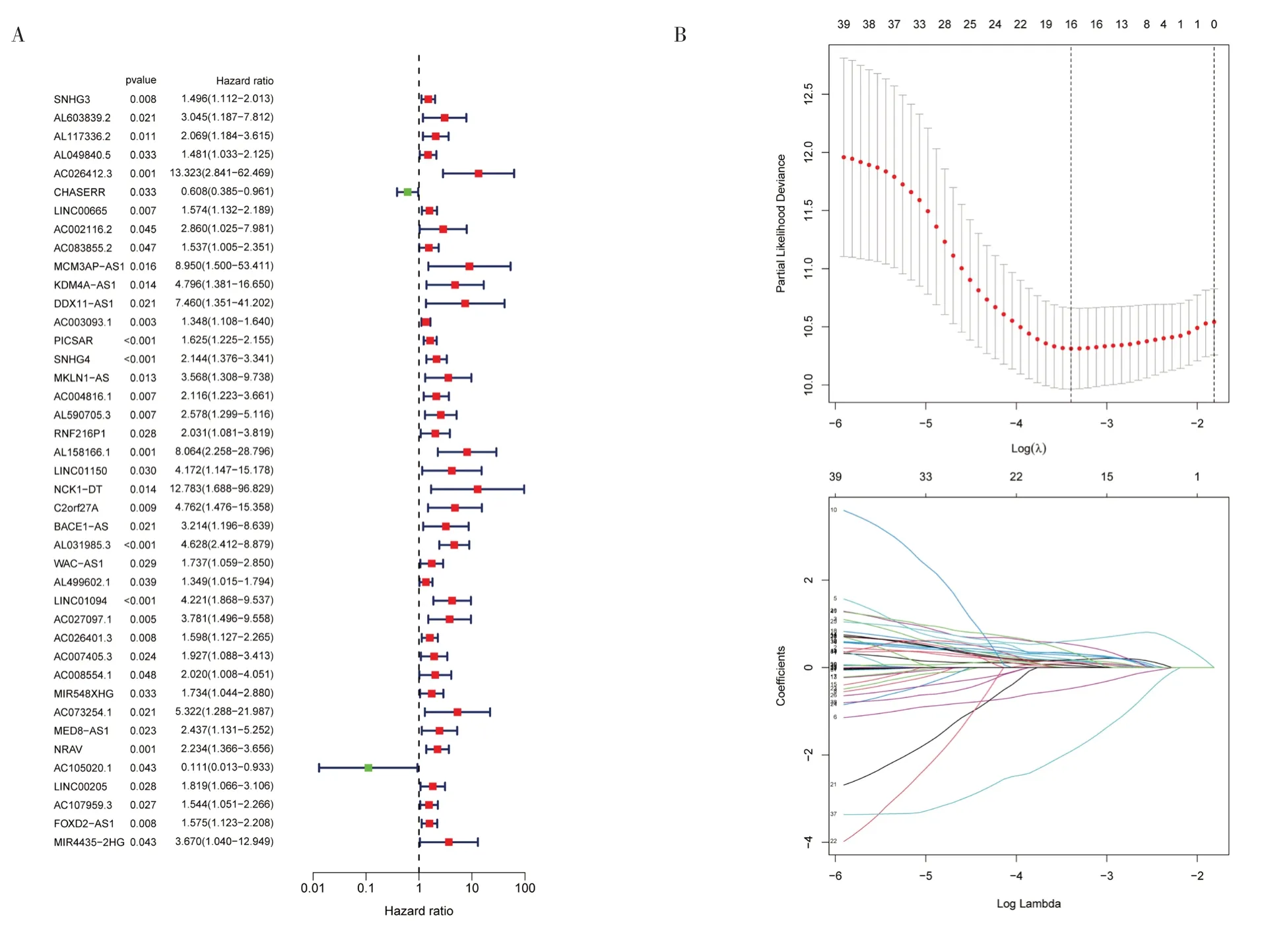
图2 7 个铜死亡相关lncRNA 的筛选
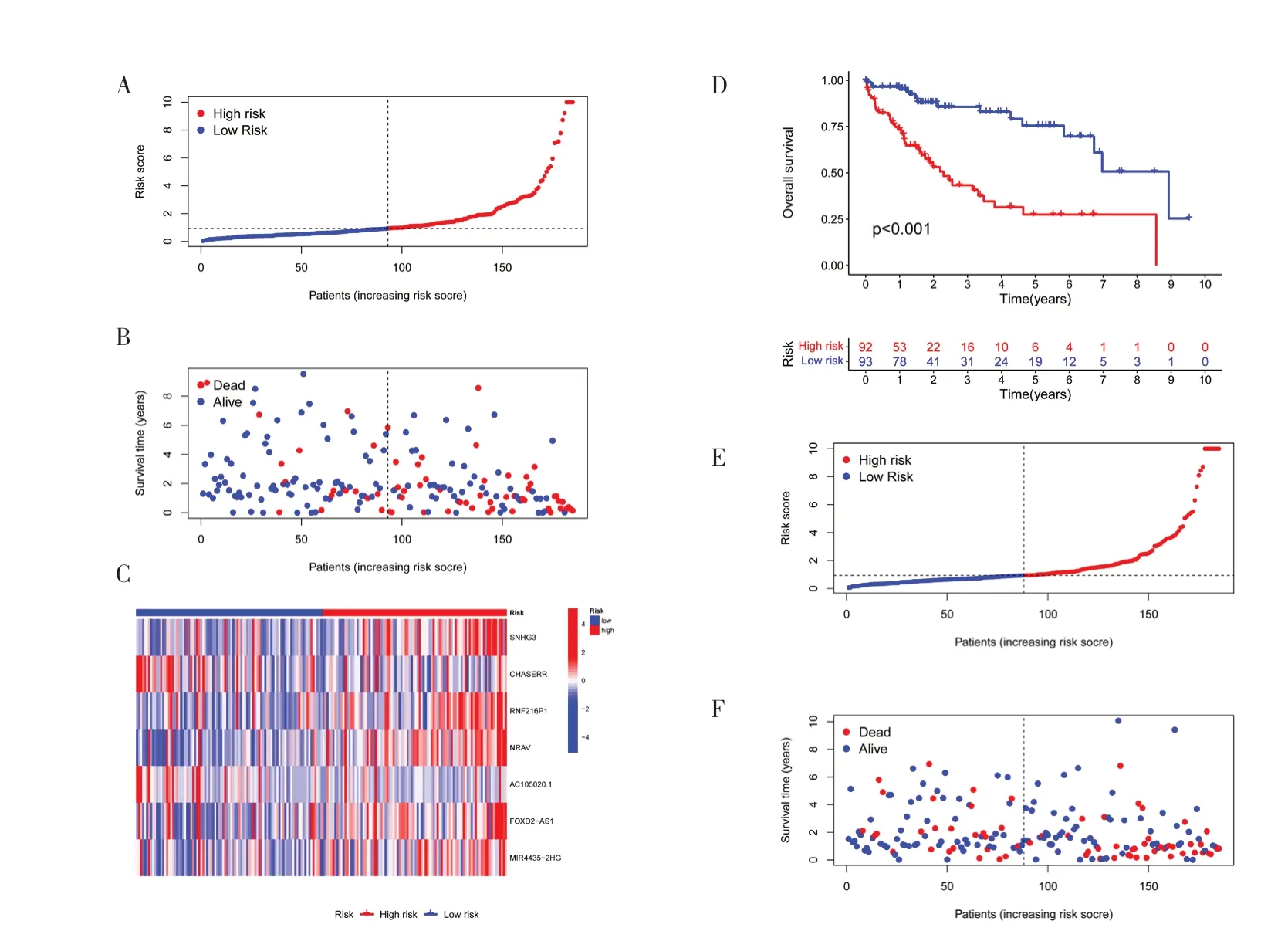
图3 训练集和验证集高、低风险组生存相关图形
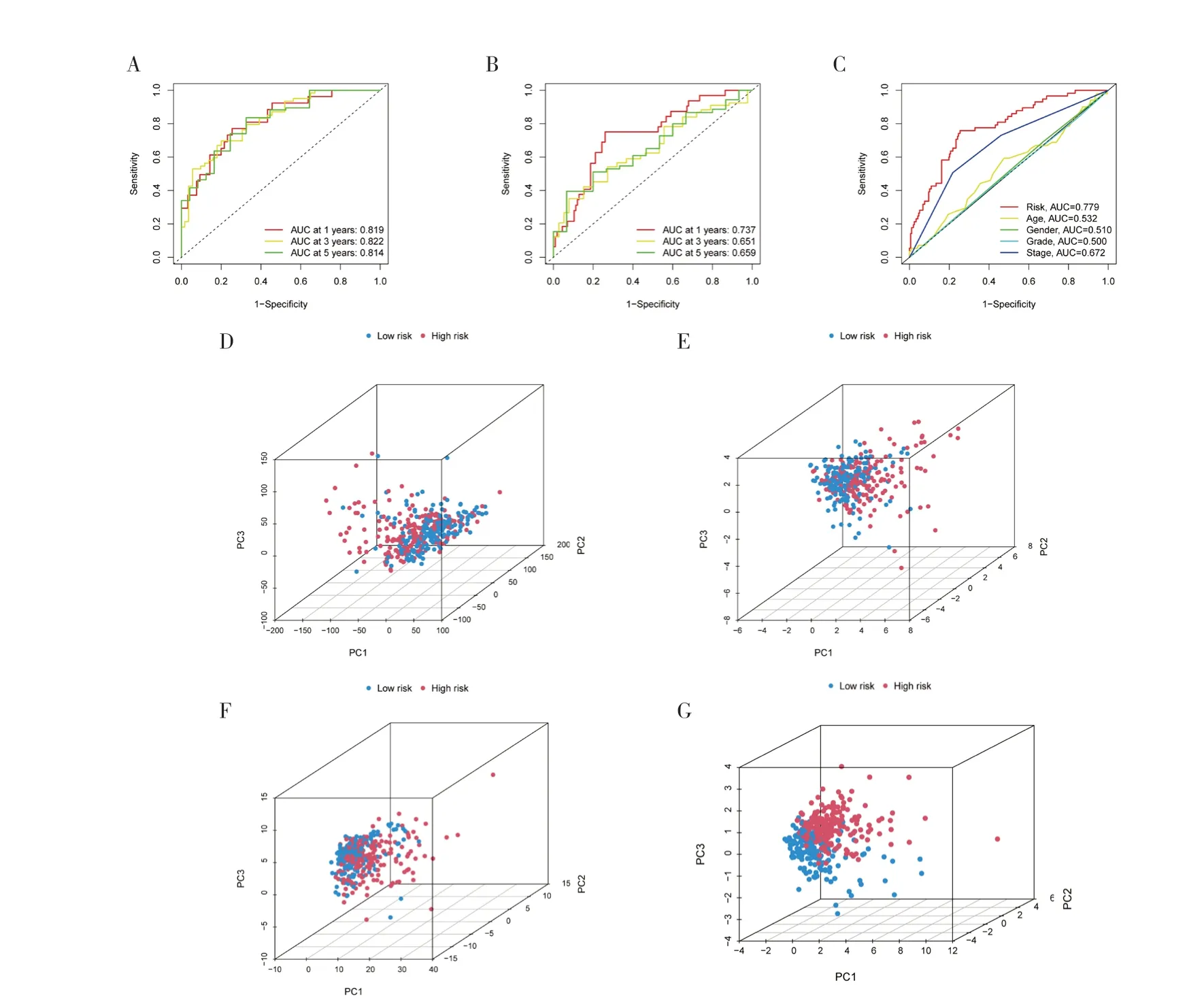
图4 ROC 曲线及PCA 图
2.3 筛选HCC 患者预后独立危险因素单因素和多因素Cox 回归分析(图5A、图5B)结果显示,风险评分和病理分期为影响HCC 患者预后的独立危险因素(P<0.05)。结合临床病理特征和风险评分建立列线图(图5C)预测HCC 患者1、3、5 年的生存率。校正曲线(图5D)证实了预后模型的预测能力。
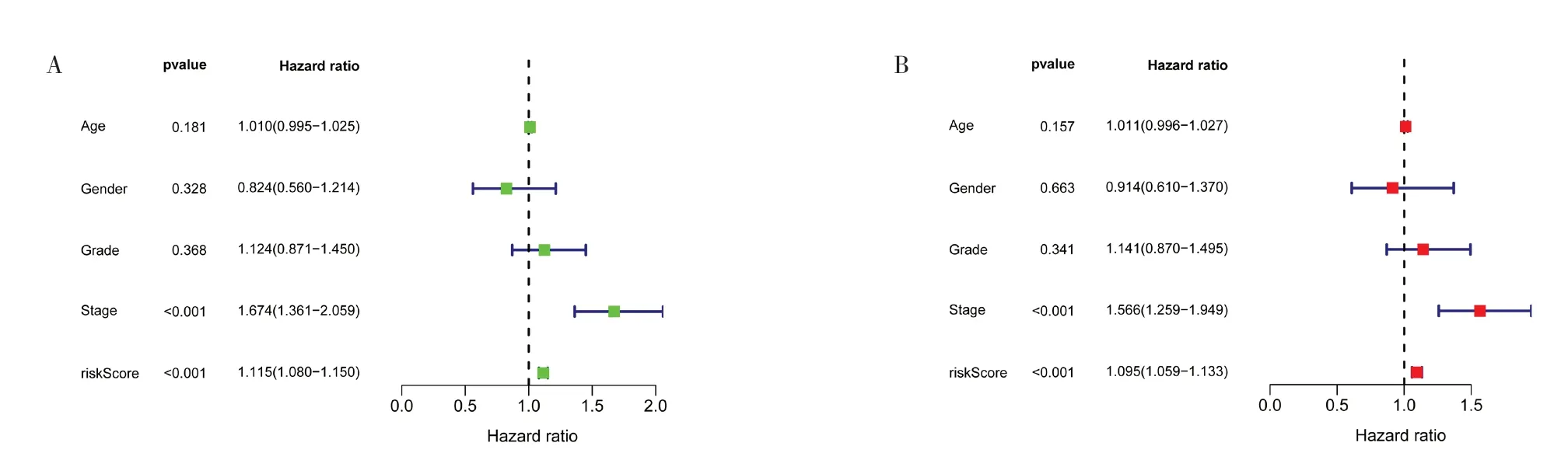
图5 风险模型验证
2.4 GO 富集分析、KEGG 信号通路分析及免疫功能分析对高、低风险组基因表达进行分析,筛选出482 个差异表达基因。GO 富集分析结果显示,差异表达基因主要涉及细胞器裂变、核分裂、有丝分裂等生物学过程,主要富集的细胞成分包括染色体、纺锤体、凝聚染色体,分子功能主要富集在微管结合、血红素结合、四吡咯结合(图6A)。KEGG 信号通路分析结果显示差异表达基因主要参与细胞周期、细胞衰老、卵母细胞减数分裂等通路(图6B)。免疫功能分析(图6C)结果显示,树突状细胞、巨噬细胞、肥大细胞、调节性T 细胞、Ⅱ型干扰素和MHC Ⅰ类在高、低风险组中差异有统计学意义,表明铜死亡可能与肿瘤免疫有关。
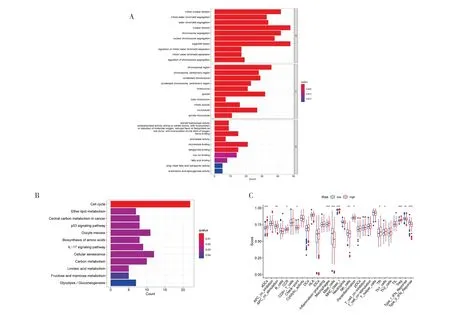
图6 功能富集分析
2.5 评估高、低风险组TMB 整理HCC 患者基因突变数据,计算TMB 评分。图7A 所示高风险组突变负荷比低风险组高。瀑布图(图7B、图7C)结果显示高、低风险组突变率分别为85.95%、76.14%,突变频率最高的基因分别为TP53、CTNNB1。高、低TMB 组生存曲线结果显示高TMB 组患者生存率低(图7D)。联合生存分析结果显示TMB 和风险评分对HCC 患者生存期有显著影响(图7E)。
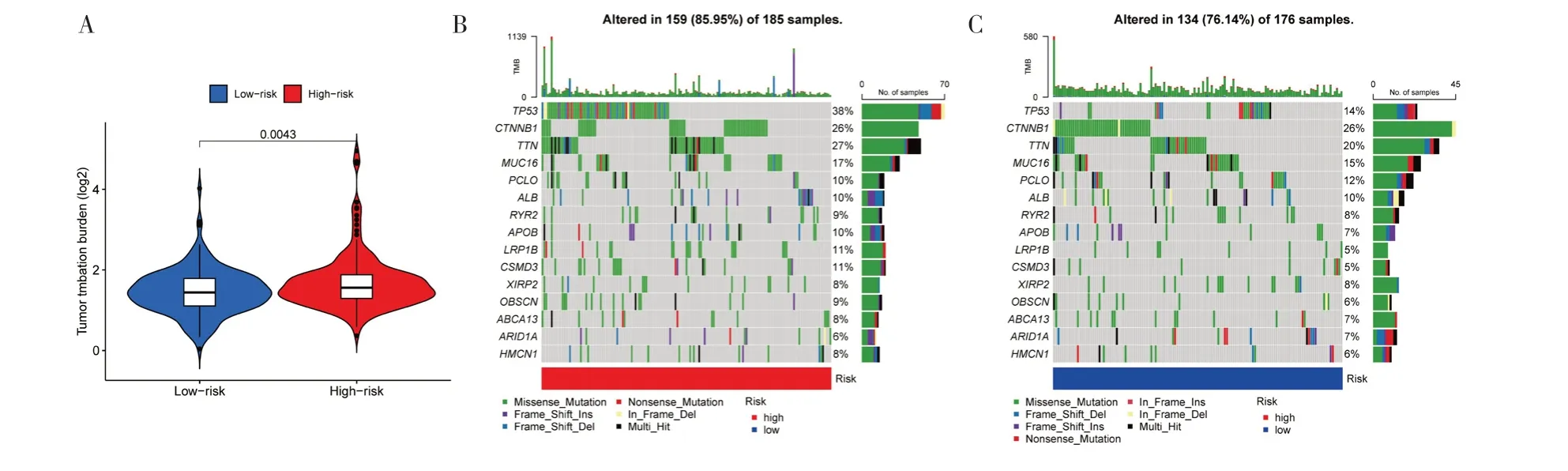
图7 TMB 分析
3 讨论
铜死亡是新发现的一种程序性细胞死亡方式,参与肿瘤的发生和进展。lncRNA 可在癌症发展过程中调节细胞增殖、凋亡、侵袭、转移及代谢,参与重塑肿瘤微环境[10]。目前很少有研究探索铜死亡相关lncRNA 在HCC 中的作用。
本研究中,首先我们通过共表达分析得到与铜死亡相关的lncRNA,并进行单因素和多因素 Cox回归分析及LASSO 回归分析,建立了铜死亡相关lncRNA 预后风险模型。然后,通过生存分析、ROC曲线、PCA 图评估了该模型的准确性,结果显示高风险组患者具有更差的预后,该模型可以有效预测HCC 患者1、3、5 年生存率,AUC 值均大于0.65。PCA 图直观地显示了高、低风险组之间的差异。随后,采用单因素和多因素Cox 回归分析进一步探讨了临床病理特征和风险评分对HCC 预后的影响,结果显示风险评分、病理分期是HCC 的独立预后因素。另外,利用列线图构建个体化预后预测模型,校准曲线显示实际和预测的生存期高度一致。基于上述结果,我们认为本研究中构建的预后风险模型是HCC 患者有效的预后指标。此外,为了探索差异表达基因的潜在作用机制,我们进行了功能富集分析。GO 和KEGG 分析表明,这些差异基因主要富集在细胞周期、细胞衰老中。免疫功能分析结果显示,在高、低风险组中树突状细胞、巨噬细胞、肥大细胞、调节性T 细胞、Ⅱ型干扰素和MHC Ⅰ类差异有统计学意义,表明铜死亡可能与肿瘤免疫有关。最后,通过对基因突变数据进行分析发现高风险组TMB 高于低风险组,提示免疫治疗可能对HCC 高风险组患者更有益。
纳入模型的7 个lncRNA 中大部分已被证实与HCC 的进展相关。文献报道,FOXD2-AS1 通过调控miR-206/MAP3K1 轴、miR-185/AKT 轴从而促进HCC 的进展[11,12]。MIR4435-2HG 可以上调B3GNT5、miRNA-487a 的表达进而诱导肝癌的发生[13,14]。NRAV 通过靶向miR-199a-3p 调控CISD2 进而激活Wnt/β-catenin 信号通路,从而导致肝癌细胞增殖和侵袭[15]。SNHG3 过表达可以促进HCC 的增殖、迁移和上皮-间质转化,通过miR-326/SMAD3/ZEB1轴促进肝细胞肿瘤的进展[16]。我们的研究结果显示,FOXD2-AS1、MIR4435-2HG、NRAV、SNHG3在高风险组中高表达,与HCC 患者生存状态差有关,这与以往研究结果一致。另有文献报道,CHASERR 的缺失使CHD2 mRNA 和蛋白质水平大幅增加,进而通过抑制高表达基因下游的启动子导致转录干扰,影响小鼠存活时间[17]。本研究中CHASERR 作为低风险基因,有利于HCC 患者预后,其作用机制有待进一步研究。
综上,本研究构建了一个包含7 个铜死亡相关lncRNA 的预后模型,具有良好的预测效能,Cox 回归分析结果显示,风险评分与病理分期是HCC 患者预后的独立危险因素,为HCC 患者个体化治疗提供参考。本研究有一定的局限性,该风险模型是基于公开数据库创建的,且在同一个数据库中进行验证,缺乏新的临床样本和数据,需在临床试验中进一步验证。
