老年骨髓增生异常综合征患者基因突变特点分析
2023-06-15张晓华王亚楠尼罗帕尔吐尔逊秦玉婷郝建萍
张晓华, 王亚楠, 赵 芳, 尼罗帕尔·吐尔逊, 秦玉婷, 王 欢, 江 明, 郝建萍
(新疆医科大学第一附属医院血液病中心,新疆血液病研究所, 乌鲁木齐 830061)
骨髓增生异常综合征(MDS)是一种常见的血液系统恶性疾病,其发病率为5~30/10万,中位发病年龄为68岁,50~59岁人群发病率为5.3/10万,60~69岁为15/10万,70~79岁为49/10万,大于80岁为89/10万,其治疗手段有限,异基因造血干细胞移植是根治MDS的唯一方法,但大多数患者已丧失移植机会。随着高通量测序技术被广泛应用于髓系肿瘤,学界对MDS进展有了更深入的认识,可帮助临床医生建立准确的诊断和细致的预后评估。依据2022年WHO发布的老年人年龄新标准,年龄≥65岁为老年人,因此本课题组在前期研究的基础上,对102例年龄≥65岁的老年MDS患者进行74种髓系肿瘤相关基因突变的检测,初步研究这类患者的分子学特点及对预后的影响。
1 对象和方法
1.1 研究对象共收集2017年1月至2022年4月期间在新疆医科大学第一附属医院血液病中心明确诊断的老年MDS患者102例。其中男性54例,女性48例,年龄65~86岁,中位年龄72岁。102例老年MDS患者均根据MDS诊断与治疗中国专家共识(2019年版)进行诊断与分型,其中MDS伴单系血细胞发育异常(MDS-SLD) 14例,MDS伴多系血细胞发育异常(MDS-MLD) 34例,MDS伴原始细胞增多1型(MDS-EB-1)26例,MDS伴原始细胞增多2型(MDS-EB-2) 20例,MDS伴环状铁粒幼红细胞(MDS-RS) 8例。
同期确诊的<65岁的MDS患者181例,包括男性109例,女性72例,年龄15~64岁,中位年龄51岁。其中MDS-SLD 8例,MDS-MLD 86例,MDS-EB-1 26例,MDS-EB-2 51例,MDS-RS 10例。
1.2 方法
1.2.1 靶基因突变检测 样本均送北京海斯特医学检验实验室,检测流程参照骨髓增生异常综合征基因突变特征及突变负荷相关临床分析[1]。共检测74种基因:ASXL1、BCOR、BCORL1、CALR、CBL、CEBPA、CSF3R、DNMT3A、ETV6、ETNK1、EZH2、FLT3、IDH1、IDH2、JAK2、KIT、KRAS、MPL、NF1、NPM1、NRAS、PHF6、PIGA、PTPN11、RUNX1、SETBP1、JAK3、DDX41、ANKRD26、GATA2、CUX1、GATA1、NFE2、PTEN、PPM1D、ATG2B、GSKIP、SAMD9、SAMD9L、STAT3、JAK1、NOTCH1、PDGFRA、SUZ12、ATM、BRAF、CSMD1、EP300、GNAS、IKZF1、RAD21、SF1、SF3B1、SRSF2、STAG2、TET2、TP53、U2AF1、WT1、ZRSR2、SH2B3、ABL1、SRP72、SF3A1、SMC1A、SMC3、U2AF2、ASXL2、ZBTB7A、SETD2、ATRX、KDM6A、USH2A、MED12。按照基因功能分类,主要包括表观调节相关基因:TET2、ASXL1、DNMT3等;剪切因子相关基因:SF3B1、U2AF1、SRSF2等;转录因子相关基因:BCOR、RUNX1、CEBPA等;信号转导相关基因:NF1、PTPN11、JAK2等;细胞周期与凋亡相关基因:TP53、NPM1、ABL1等。
1.2.2 随访 采用电话随访,随访时间为初次诊断MDS至患者死亡或观察结束,截止时间为2022年4月1日。从疾病诊断到死亡或观察最终时间为总生存期(OS)。
1.3 统计学方法统计分析使用SPSS23.0软件进行。非正态分布的计量资料用中位数表示,用Mann-WhitneyU检验进行比较;计数资料的组间比较采用卡方检验;生存分析采用Kaplan-Meier方法,并绘制生存曲线,P<0.05为差异有统计学意义。
2 结果
2.1 老年MDS患者基因突变特点102例老年MDS患者中83例发生基因突变,检出率为81.3%,1个、2个和≥3个基因突变检出率分别为23.5%(24例)、19.6%(20例)和38.2%(39例)。大于10%的基因突变的检出率由高到低依次为TET2、ASXL1、TP53、SF3B1、BCOR和DNMT3A。按照基因功能划分,表观调节、剪切因子、转录因子、信号转导和细胞周期与凋亡相关基因的突变检出率分别为56.9%(58例)、33.3%(34例)、23.5%(24例)、22.5%(23例)和20.6%(21例)。
2.2 不同年龄组MDS患者中基因突变比较比较两组患者的基因突变特点,结果显示,与非老年组相比,老年组有更高的基因突变检出率,≥3个基因突变的检出率明显增高(P<0.05)。在单个基因突变频率中,老年组TET2突变检出率最高(P=0.000),其余常见突变基因在两组间的表达无明显差异(P>0.05)。在基因功能方面,老年组患者主要以表观调节基因突变为主(P=0.001),其他基因功能的表达在两组间的差异无统计学意义(P>0.05)。结果见表1。

表1 不同年龄组MDS患者常见基因突变比较/例(%)
2.3 基因突变对老年MDS患者生存的影响老年组中,16例失访,53例死亡。中位随访时间 47个月(1~70个月)。非老年组中,48例失访,60例死亡。中位随访时间 45个月(1~93个月)。比较两组患者常见基因突变对生存的影响,结果显示,两组患者合并TP53基因突变者中位生存期(OS)均短于未突变者(P<0.05),非老年组合并SF3B1基因突变者中位OS长于未突变者(P<0.05),老年组合并SF3B1基因突变者中位OS与未突变者未见明显差异(P>0.05),见图1~4。两组患者ASXL1、TET2、DNMT3A和BCOR基因突变者中位OS与未突变者比较差异均无统计学意义(P>0.05),见表2。根据基因突变的数量,分析两组患者的生存状况,结果显示,老年组中存在0个基因突变的中位OS为未达到;1个基因突变的中位OS为31个月;≥2个基因突变中位OS为27个月(95%CI: 16.79~37.21)。非老年组中存在0个和1个基因突变的中位OS均为未达到,≥2个基因突变中位OS为37个月(95%CI: 6.00~68.00)。经Kaplan-Meier检验分析显示,两组患者中不同基因突变数目的中位OS有明显差异(P=0.014;P=0.007),即随着基因突变数目的增多,患者的OS明显缩短。分别见图5、6。
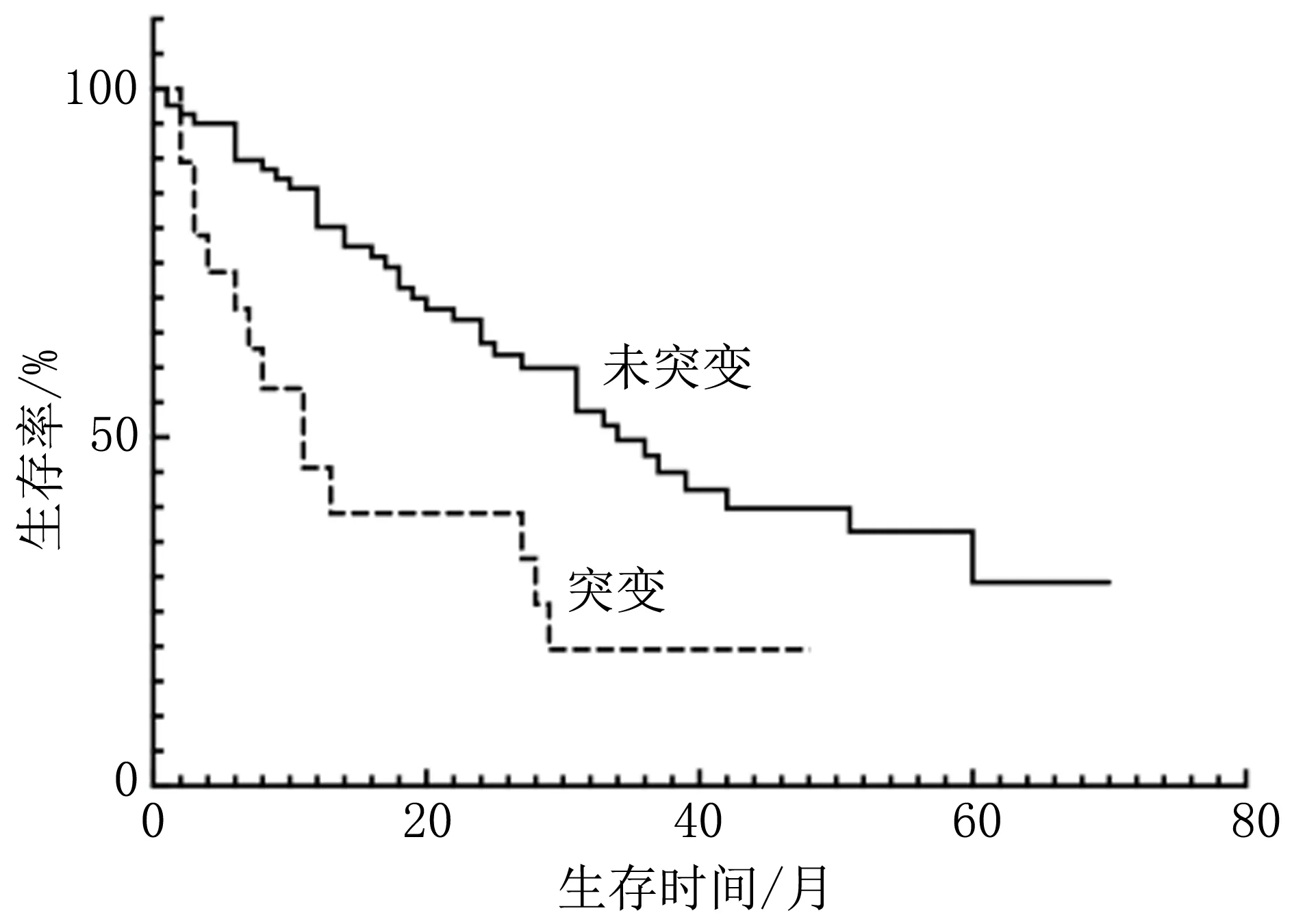
图1 TP53是/否突变的老年组MDS患者生存曲线
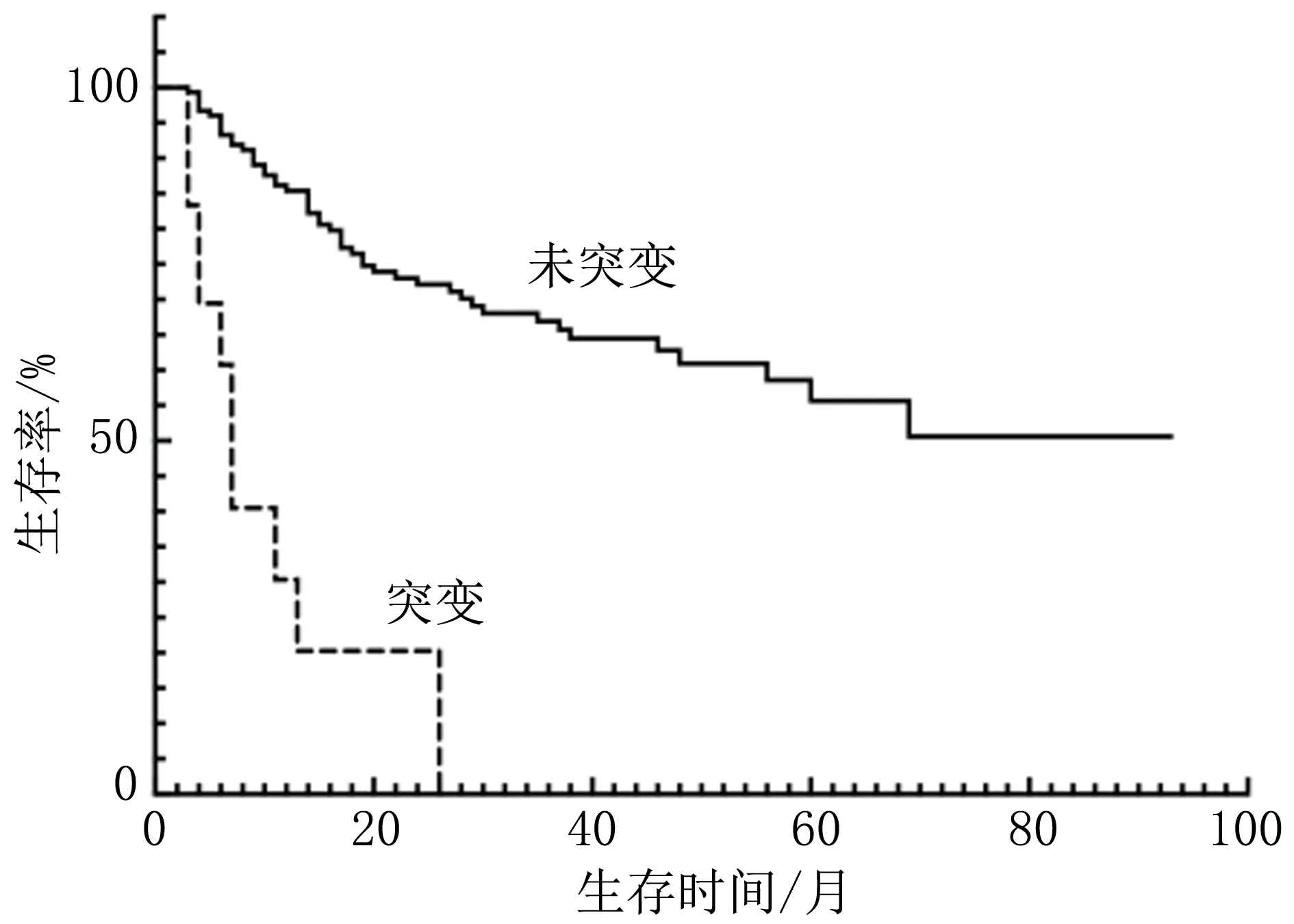
图2 TP53是/否突变的非老年组MDS患者生存曲线

图3 SF3B1是/否突变的老年组MDS患者生存曲线

图4 SF3B1是/否突变的非老年组MDS患者生存曲线

图5 老年组不同基因突变数目分组的生存曲线

图6 非老年组不同基因突变数目分组的生存曲线

表2 两组不同基因突变者与未突变者中位生存时间比较(M,月)
3 讨论
MDS是一组起源于造血干细胞的异质性髓系克隆性疾病。其发病年龄随着人口老龄化而呈上升趋势,老年患者脏器功能下降,基础疾病较多,大部分老年MDS患者已丧失移植机会,主要以药物治疗为主,以改善患者生活质量、延长生存期,但总体预后差。各种基因突变的重要性在过去的各项研究中被不断发现,并在MDS的诊断、预后评估和实施靶向治疗等方面发挥着越来越重要的作用。
2022年WHO骨髓增生异常性肿瘤新命名和分类进一步强调了遗传学在疾病定义中的重要性[2],要求在确诊MDS之前首先要确定患者是否有明确致癌机制的驱动性分子生物学或细胞遗传学特征,并依此将MDS的诊断分为伴特定遗传学和形态学异常。因此,高通量测序技术(NGS)检测起到了至关重要的作用。而老年患者随着年龄的增长,合并不良预后因素的比例更高,携带突变基因和预后不良基因的数目也会增加,与年轻患者的基因突变谱存在差异[3],因此准确和完整地识别各种基因改变显得更加重要。
近年来,国内外几项大规模的关于MDS患者二代基因测序的研究显示,80%~90%的MDS患者至少存在1个突变基因;检出率大于10%的基因包括SF3B1、TET2、SRSF2、ASXL1、DNMT3A和RUNX1;最主要的基因突变功能组是剪切因子和表观调节[4-6]。本研究对老年组(≥65岁)和非老年组基因突变谱进行比较,结果显示老年患者的基因突变检出率为81.3%,表明老年患者的突变检出率并没有随着年龄的增长明显增加,今后还需要通过扩大样本量,以及基因检测数量和检测的深度来进一步验证。老年患者中常见的基因突变为TET2、ASXL1、TP53、SF3B1,BCOR和DNMT3A ,这与吕晓东等[1]报道的突变谱系结果基本一致,但突变检出率略有差异,这可能与所选人群的不一致以及不同MDS亚型基因突变频率特点不同有关。本研究结果显示,按基因功能组分类方面,老年患者表观调节功能的基因突变检出率明显高于非老年患者(P=0.001)。
相关研究表明,以TET2、ASXL1和DNMT3A基因突变为主要标志的克隆性造血的发生率随着年龄的增长而明显增加,40岁以下的人群突变罕见(<1%),65岁以上的人群中克隆性造血的发生率可高达10%,70岁以上可达10%~20%[7-9]。MDS的发病率亦随着年龄的增长而升高,预示造血细胞的老化和由此产生的克隆异常与MDS的致病机制有关[10]。Sperling等[11]研究认为,初始造血干细胞的起始基因(TET2、ASXL1、DNMT3A)发生突变,最后发展为克隆性造血,最终转化为MDS或MDS继发性急性髓系白血病。老年人的克隆造血功能异常可能是导致表观调节占主导地位的一个主要原因。Haferlach等[4]对944例MDS患者的104种肿瘤基因进行靶向测序结果显示,平均每例患者至少携带 3 种基因突变,最多可达12种基因突变共存。Tefferi等[12]对179例中位年龄为73岁的MDS患者进行了二代测序检测,其中2个和≥3个基因突变检出率分别为27%和23%。本研究数据显示,老年组中2个和≥3个基因突变检出率分别为19.6%和38.2%,表明随年龄增加合并基因突变的数目也明显增加,符合老年患者疾病的特点。
MDS患者的预后与基因突变密切相关[13],Jung等[14]研究发现,随着患者预后风险分层的进展,≥3个基因突变的检出率明显增加,表明随着疾病进展,基因突变数目呈递增趋势。本研究根据基因突变数目分析患者的中位OS,发现随着基因突变数目的增多,患者的OS明显缩短。本研究进一步比较了老年组与非老年组患者的基因突变对预后的影响,结果显示,在老年组和非老年组中合并TP53基因突变患者的中位生存时间均明显短于未突变者,在非老年组中合并SF3B1基因突变患者的中位生存时间长于未突变者,老年组合并SF3B1基因突变者中位OS与未突变者未见明显差异。因本研究的样本量小,随访时间短,今后尚需扩大样本量,进一步探讨MDS相关基因突变与老年患者预后的相关性。
总之,应用高通量测序技术对老年MDS患者进行基因突变检测,可以进一步了解老年MDS患者的生物学特征,为其临床诊断和预后判断提供参考。
