海藻酸钠固定化果糖基转移酶的催化特性及其合成低聚果糖的研究
2023-06-15肖余俊叶婷娥余超凡何文锦郑毅
肖余俊 叶婷娥 余超凡 何文锦 郑毅
摘 要:果糖基转移酶是酶法生产低聚果糖的关键催化剂,固定化酶具有催化特性稳定、重复使用及节省用酶成本的优势,开展固定化果糖基转移酶催化特性的研究对其工业化应用提供数据依据。以海藻酸钠为载体,采用包埋法固定化果糖基转移酶,探究其最适催化温度、热稳定性,最适反应pH及pH稳定性、酶催化动力学等催化特性,并对固定化果糖基转移酶催化合成低聚果糖的应用进行初步研究。结果表明:海藻酸钠包埋法固定化果糖基转移酶的最适催化温度为50℃,pH值为5.0,酶学动力学米氏常数Km值为0.03 mg·mL-1,采用该固定化酶以蔗糖为底物可制得48.03%纯度的低聚果糖。海藻酸钠固定化果糖基转移酶相对游离酶具备更好的与蔗糖底物的亲和性、更佳的温度与pH稳定性,具备更好的工業应用潜力。
关键词:海藻酸钠;果糖基转移酶;催化特性;低聚果糖
中图分类号:Q 814 文献标志码:A 文章编号:0253-2301(2023)03-0045-06
DOI: 10.13651/j.cnki.fjnykj.2023.03.008
Abstract: Fructosyltransferase was a key catalyst for the enzymatic production of fructooligosaccharides. The immobilized enzyme had the advantages of stable catalytic properties, repeated use and saving the enzyme cost. The study on the catalytic properties of immobilized fructosyltransferase could provide data basis for its industrial application. The fructosyltransferase was immobilized by using the embedding method with sodium alginate as the carrier. Then, the catalytic characteristics such as the optimum catalytic temperature, thermal stability, optimum reaction pH, pH stability and enzymatic kinetics were investigated. The application of immobilized fructosyltransferase in the catalytic synthesis of fructooligosaccharides was also preliminarily studied. The results showed that the optimum catalytic temperature of fructosyltransferase immobilized by the sodium alginate embedding method was 50℃, the pH value was 5.0, and the michaelismenten constant (Km) of enzymatic kinetics was 0.03 mg·mL-1. 48.03% purity of fructooligosaccharides could be prepared by using the immobilized enzyme and sucrose as the substrate. Compared with the soluble enzyme, the sodium alginate immobilized fructosyltransferase had better compatibility with sucrose substrate, better temperature and pH stability, and had better potential for the industrial application.
Key words: Sodium alginate; Fructosyltransferase; Catalytic properties; Fructooligosaccharides
低聚果糖(Fructooligosaccharides,简称FOS)是一种功能性低聚糖,同时也是一种益生元。FOS属于非还原性糖,其甜度和热值均比蔗糖低,且FOS的甜度随着其聚合度的增加而降低[1]。当人食用低聚果糖后,人体消化系统的酶无法将其分解成葡萄糖等能引起血糖升高的小分子单糖,而是通过胃和小肠直接进入大肠,选择性地促进双歧杆菌Bifidobacterium、乳酸杆菌(Lactobacillus)等益生菌大量增殖[2-4]。肠道益生菌的数量增多及其产生的一些物质能够有效抑制各种有害菌的繁殖,改善肠道环境。食用低聚果糖不会引发龋齿,变异链球菌(Streptococcus mutans)等口腔微生物无法将低聚果糖转化为酸和不溶于水的β葡聚糖[5-6]。FOS已被证实是唯一同时具有超强双歧因子和水溶性膳食纤维的双生理学特性的功能性低聚糖[7-8]。
目前酶法生产是工业化生产FOS的主要方法,该方法以蔗糖为底物,利用微生物来源的果糖基转移酶(Fructosyltransferase,简称Ftase)的催化作用合成FOS。但如果直接使用游离的果糖基转移酶进行催化反应,则会出现酶对环境条件非常敏感、酶只能使用一次等诸多不利的情况。而固定化酶技术可以改善这种情况,利用物理或化学方法将游离酶固定在一定的空间内,相对于游离酶不仅保留了酶的催化活性,也提高了稳定性,对环境条件的变化更有耐受性,还能回收和重复利用,降低生产成本。本研究采用海藻酸钠包埋法制备固定化果糖基转移酶,研究其催化特性及其合成FOS的应用,以期为进一步工业应用提供数据依据。
1 材料与方法
1.1 试验材料
1.1.1 酶源 由福建师范大学生命科学学院实验室黑曲霉(Aspergillus niger)ZY1023制备的果糖基转移酶。
1.1.2 主要试剂 海藻酸钠(化学纯)购自国药集团化学试剂有限公司;氯化钙(分析纯)购自国药集团化学试剂有限公司;蔗糖(分析纯)购自天津市致远化学试剂有限公司。
1.2 试验方法
1.2.1 海藻酸钠包埋法固定化果糖基转移酶的制备 配制浓度为1.5%的海藻酸钠溶液,与等体积的果糖基转移酶溶液混合并充分搅拌均匀。将混合溶液吸入注射器内,逐滴打入到一定浓度的CaCl2溶液中,得到大小均匀、形状规则的凝胶微球,并将微球置于4℃冰箱中硬化2 h。用去离子水反复冲洗微球,测量固定化酶的酶活,将剩余的固定化酶置于4℃冰箱中保存备用。
1.2.2 固定化果糖基转移酶催化特性
(1)最适催化温度及热稳定性。使用由pH 5.0的乙酸乙酸钠缓冲液配制的0.1 g·mL-1的蔗糖溶液,分别置于40℃、45℃、50℃、55℃、60℃、65℃的温度下进行游离果糖基转移酶和固定化果糖基转移酶酶促反应1 h。然后分别测定每个温度下的酶活,计算出相对酶活,绘制温度-相对酶活曲线。(2)游离果糖基转移酶和固定化果糖基转移酶酶促反应。将游离果糖基转移酶和固定化果糖基转移酶分别置于30℃、35℃、40℃、45℃、50℃、55℃、60℃的温度下水浴1 h,再分别与0.1 g·mL-1的蔗糖溶液(由pH 5.0的乙酸-乙酸钠缓冲液配制)进行游离果糖基转移酶和固定化果糖基转移酶酶促反应1 h。以未处理酶的酶活作为100%,测定水浴后游离果糖基转移酶和固定化果糖基转移酶的相对酶活,绘制热稳定性曲线。(3)最适反应pH。分别用由pH 4.0、4.5、5.0、5.5、6.0、7.0的乙酸乙酸钠缓冲液配制的0.1 g·mL-1蔗糖溶液,在55℃下分别进行游离果糖基转移酶和固定化果糖基转移酶酶促反应1 h,然后分别测定每个pH值下的酶活,计算出相对酶活,绘制pH值相对酶活曲线。(4)pH稳定性。将游离果糖基转移酶和固定化果糖基转移酶分别置于pH 3.0、pH 4.0、pH 5.0、pH 6.0、pH 7.0、pH 8.0的乙酸乙酸钠缓冲液中,过夜处理后测定残留酶活力。以未处理酶的酶活作为100%,测定过夜处理后游离果糖基转移酶和固定化果糖基转移酶的相对酶活,绘制pH稳定性曲线。(5)催化动力学。在酶促反应体系中(游离酶:55℃、pH 5.5;固定化酶:50℃、pH 5.0)改变蔗糖底物浓度[S],使其在反应体系中的浓度分别为0.15、0.20、0.25、0.30 g·mL-1。测定酶促反应的初速度V,以蔗糖底物浓度1/[S]对1/V作图,绘制LineweaverBurk图,从直线截距分别获得游离果糖基转移酶和固定化果糖基转移酶催化蔗糖底物的米氏常数Km。
1.2.3 固定化果糖基轉移酶催化合成低聚果糖的应用 在60%的蔗糖溶液按照6 U·g-1蔗糖的加酶量添加固定化果糖基转移酶,在反应温度为55℃、pH 5.0(乙酸乙酸钠缓冲液)进行催化合成,分别在催化反应的第2、4、8、12、16、20、24 h取样检测低聚果糖含量。
1.3 指标测定
1.3.1 低聚果糖的测定 按照国家标准GB/T 23528-2009《低聚果糖》[9]中的HPLC法进行测定。
1.3.2 酶活力的测定 量取0.1 g·mL-1的蔗糖溶液20 mL于三角瓶中,加入酶液(或固定化酶),在55℃、pH 5.0的条件下,于200 r·min-1的恒温水浴振荡器中反应1 h。反应结束后置于沸水浴中灭酶10 min终止反应,用HPLC法检测蔗果三糖含量,计算酶活力。酶活力定义:在上述酶催化反应条件下,每分钟生成1 μmol蔗果三糖所需的酶量为1个酶活力单位(U)。
2 结果与分析
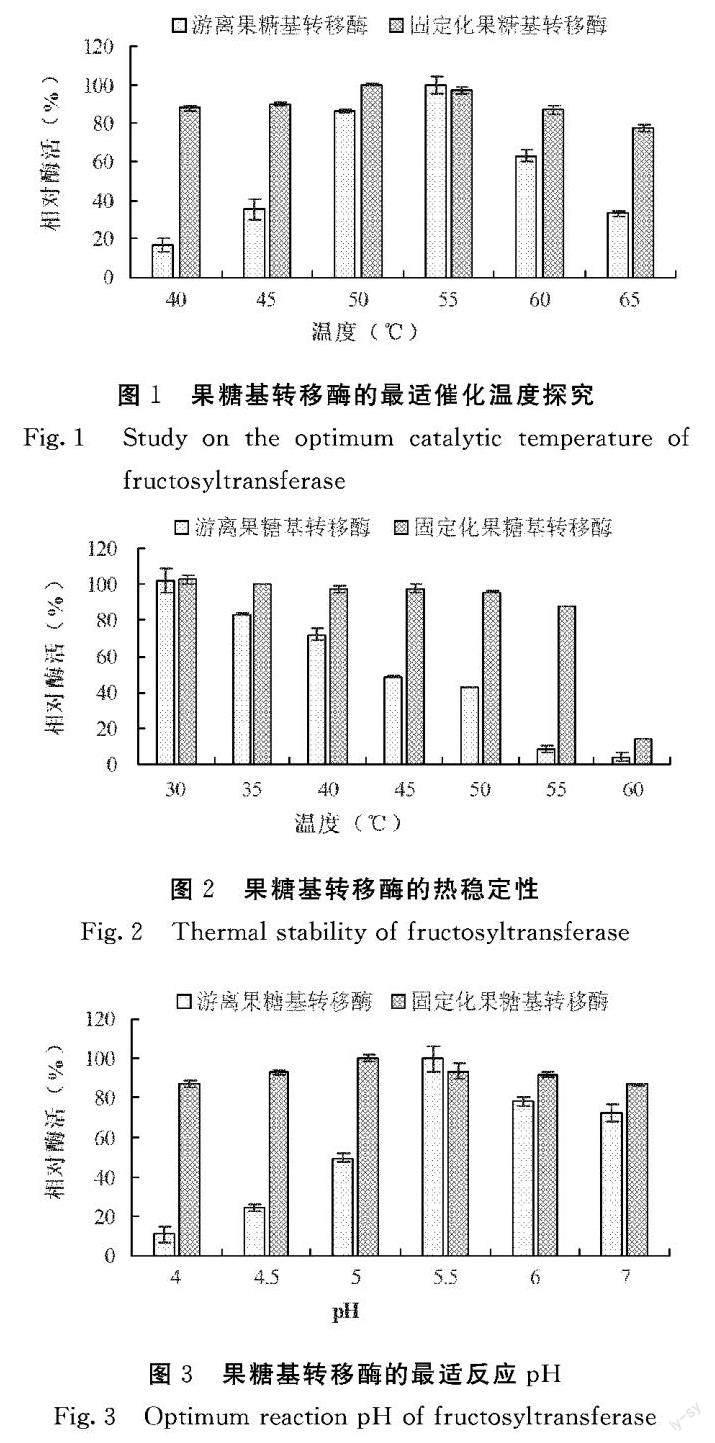
2.1 固定化果糖基转移酶的最适催化温度
由图1可知,游离果糖基转移酶和固定化果糖基转移酶的最适催化温度分别为55℃和50℃,各自的相对酶活达到最大,经固定化后的果糖基转移酶最适催化温度较游离果糖基转移酶降低5℃。固定化果糖基转移酶的相对酶活在除了55℃之外的其他温度下均高于游离果糖基转移酶。当温度越偏离各自的最适温度时,其相对酶活就越低。游离果糖基转移酶对温度的变化非常敏感,其相对酶活随温度变化的幅度较大;而固定化果糖基转移酶的相对酶活整体变化幅度则小于游离酶。固定化果糖基转移酶的相对酶活在研究的各个温度下均维持在70%以上;而游离果糖基转移酶在40℃、45℃、65℃时的相对酶活则已经低于40%。
2.2 固定化果糖基转移酶的热稳定性
从图2可知,固定化果糖基转移酶在30~55℃温度区间的相对酶活均维持在80%以上,到60℃时其相对酶活才大幅下降。游离果糖基转移酶在环境温度稍偏高一点时其相对酶活就开始快速下降,45℃时的相对酶活已经低于50%,在55℃及以上几乎失去活性。固定化果糖基转移酶可能是由于自身载体的保护作用,使其活性损失明显小于游离果糖基转移酶,对热变性作用不敏感,热稳定性增加。
2.3 固定化果糖基转移酶的最适反应pH
从图3可知,游离果糖基转移酶和固定化果糖基转移酶的最适反应pH值分别为5.5和5.0,各自的相对酶活达到最大,经固定化后的果糖基转移酶最适反应pH值较游离果糖基转移酶降低了0.5。当环境pH越偏离各自的最适pH值时,其各自的相对酶活就越低。固定化果糖基转移酶的相对酶活在除了pH 5.5之外的其他pH值下均高于游离果糖基转移酶的相对酶活。固定化果糖基转移酶的相对酶活随pH变化的幅度不大,这是由于固定化载体海藻酸钠包埋的作用,影响了酶的活性部位。游离果糖基转移酶在pH 5.5以下的相对酶活受pH影响较大,在pH 5.5~7.0区间变化幅度较小。游离果糖基转移酶对酸性较强的环境非常敏感,当pH值为5.0及以下时,游离果糖基转移酶的相对酶活均低于50%。
2.4 固定化果糖基转移酶的pH稳定性
从图4可知,固定化果糖基转移酶的相对酶活在除了pH 3.0之外的其他pH值下均维持在70%以上,而游离果糖基转移酶在pH 8.0时的相对酶活低于50%。与游离果糖基转移酶的相对活性相比,固定化果糖基转移酶的相对酶活整体变化幅度不大,即固定化果糖基转移酶在pH变化范围内能够保持相对较高的酶活,相比游离果糖基转移酶具有较好的适应性。这可能是由于载体网状结构的作用,影响了固定化果糖基转移酶的活性部位,对pH变性作用不敏感,pH稳定性增加。
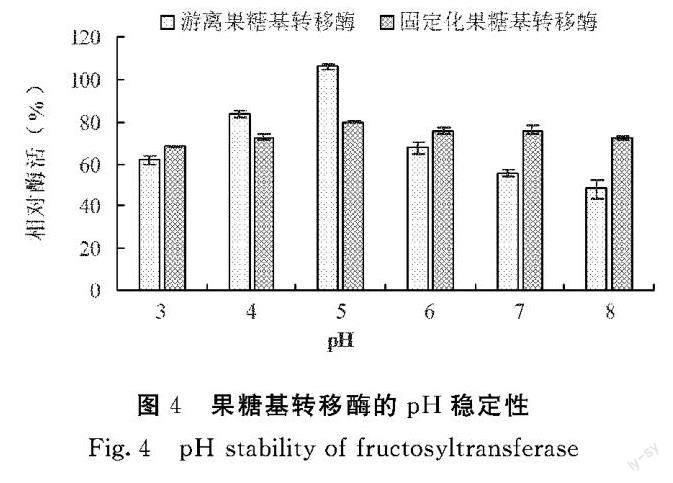
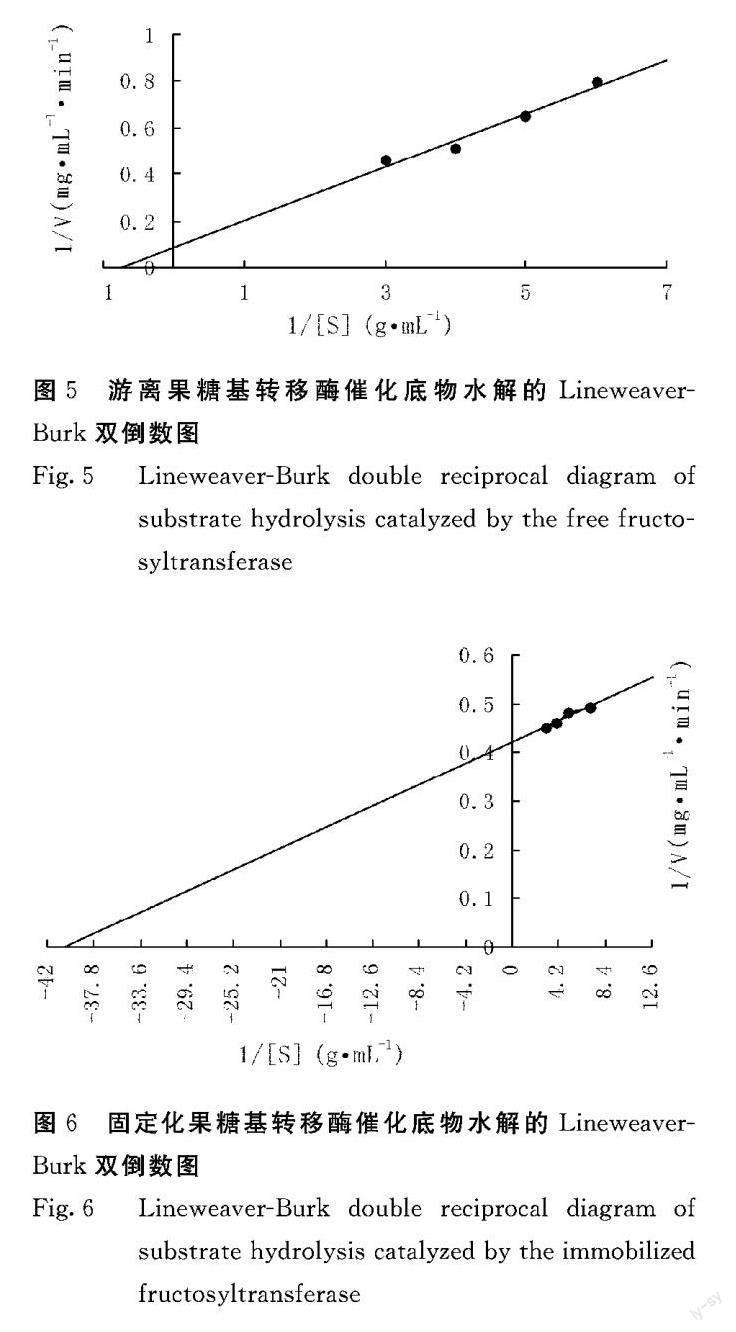
2.5 果糖基转移酶的催化动力学
利用LineweaverBurk作图法以1/V对1/[S]作图,按照直线在横轴上的截距(-1/Km)求米氏常数Km,得到图5、图6的双倒数图。游离果糖基转移酶的米氏方程为:y=0.115x+0.0845(y代表1/V,x代表1/[S],下同),固定化果糖基转移酶的米氏方程为:y=0.0105x+0.4219。结合米氏方程,由图5、图6可知游离果糖基转移酶和固定化果糖基转移酶的米氏常数Km值分别为1.36、0.03 mg·mL-1。固定化果糖基转移酶的米氏常数远小于游离果糖基转移酶,说明固定化果糖基转移酶对蔗糖底物更具有亲和性,这可能是由于海藻酸钠的凝胶网络与果糖基转移酶分子间物理或化学反应作用。
2.6 固定化果糖基转移酶催化合成低聚果糖的应用
由图7可知,低聚果糖的产率随着固定化果糖基转移酶催化时间的延长呈持续增加的趋势。在催化反应最开始的0~4 h期间增加得最快,第4 h的低聚果糖产率为21.66%。第4 h仅用整个催化反应时间的1/6,就已达到最终低聚果糖产率的45%。在催化反应进行到第16 h后,低聚果糖产率的增加幅度逐渐趋于平缓,除了底物减少和有害代谢物积累的原因之外,还与产物的反馈抑制有关。低聚果糖的产率在催化反应结束的第24 h达到最大,为48.03%。
从低聚果糖合成液的HPLC色谱图(图8)可知,在反应时间13 min和19 min分别出现了蔗果三糖和蔗果四糖的峰,在反应时间6 min和8 min分别出现了葡萄糖和蔗糖的峰。进一步证实固定化果糖基转移酶催化反应及低聚果糖产率受到了副产物葡萄糖的抑制,且残存未反应完的蔗糖。葡萄糖和蔗糖均能使人体血糖升高,这会导致糖尿病等患者无法使用该产品,降低了产品的功能特性,所以去除葡萄糖是提升低聚果糖产率的关键。
3 讨论与结论
本研究采用海藻酸钠包埋法制备固定化果糖基转移酶,研究其催化特性及其合成FOS的应用。研究结果表明,海藻酸钠固定化果糖基转移酶的最适催化温度为50℃,pH值为5.0,酶学动力学米氏常数Km值为0.03 mg·mL-1。固定化果糖基转移酶在55℃及以下能保持较高的酶活,到60℃时酶活大幅下降,在pH 3.0~8.0区间内均能保持較高的酶活。采用该固定化果糖基转移酶以蔗糖为底物可制得48.03%纯度的低聚果糖。
固定化果糖基转移酶相对于游离果糖基转移酶具备更好的与蔗糖底物的亲和性、更好的温度及pH稳定性等优良特性,主要原因是其固定化载体的结构和功能在发挥作用,在一定程度上能够抵挡不利的外界环境,保护里面的酶分子,且不会阻碍其发挥催化功能。但在储存和应用固定化果糖基转移酶时依然要注意环境条件,尤其要避免高温环境,否则酶容易失活。经海藻酸钠固定化后的果糖基转移酶在连续催化反应过程中没有出现明显的破碎脱落现象,表明其固定化载体的结构具有良好的机械强度和稳定性,进而说明该固定化果糖基转移酶可以重复使用。
本研究结果还发现,固定化果糖基转移酶催化合成低聚果糖的反应进行到后期时,反应速率明显减缓,低聚果糖产率的增幅越来越少。其中副产物葡萄糖是抑制催化反应的重要因素。随着催化反应时间的增加,葡萄糖逐渐累积,低聚果糖产率的增加也越发困难。无论是游离酶还是固定化酶,其催化反应均会受到葡萄糖的抑制。葡萄糖的存在不仅抑制着催化反应的进行、抑制产物低聚果糖的产量,还会降低产品的功能特性,限制产品的推广。目前市场上大多数产品的低聚果糖含量仅50%~60%,只有少数产品能达到90%以上。已有研究人员考虑加入葡萄糖氧化酶(GOD)将葡萄糖转化为葡萄糖酸和H2O2(葡萄糖+O2
GOD 葡萄糖酸+H2O2),但H2O2能使GOD失活,不利于反应的进行,因此还需添加过氧化氢酶(CAT)来消除H2O2,葡萄糖酸则通过离子交换或与钙结合形成葡萄糖酸钙除去[9-11]。通过GOD和CAT的协同作用能大量消除葡萄糖,增加低聚果糖的产率,但酶的价格较昂贵。也有利用葡萄糖异构酶(GI),但效果不理想,不能有效降低体系中葡萄糖的含量[12-13]。此外,研究人员还利用酵母等微生物选择性消化葡萄糖且不会降解低聚果糖,将葡萄糖发酵代谢成乙醇等物质[14]。本研究对固定化果糖基转移酶催化合成低聚果糖的过程中如何消除葡萄糖的影响并未进行相关探索,下一步将继续深入研究,以进一步提高低聚果糖产率,为加快低聚果糖产品的工业化生产提供科学依据。
参考文献:
[1]SINGH S P,JADAUN J S,NARNOLIYA L K,et al.Prebiotic Oligosaccharides:Special Focus on Fructooligosaccharides,Its Biosynthesis and Bioactivity[J].Applied Biochemistry and Biotechnology,2017,183(2):613-635.
[2]GOH Y J,KLAENHAMMER T R.Genetic mechanisms of prebiotic oligosaccharide metabolism in probiotic microbes[J].Annual Review of Food Science and Technology,2015,6(1):137-156.
[3]OJWACH J,ADETUNJI A I,MUTANDA T,et al.Oligosaccharides production from coprophilous fungi:An emerging functional food with potential healthpromoting properties[J].Biotechnology Reports,2022,33(6):e00702.
[4]ZHANG N,JIN M,WANG K,et al.Functional oligosaccharide fermentation in the gut:Improving intestinal health and its determinant factorsA review[J].Carbohydrate Polymers,2022,284(12):119043.
[5]MUTANDA T,MOKOENA M P,OLANIRAN A O,et al.Microbial enzymatic production and applications of shortchain fructooligosaccharides and inulooligosaccharides: recent advances and current perspectives[J].Journal of Industrial Microbiology and Biotechnology,2014,41(6):893-906.
[6]李元.黑曲霉生物转化甘蔗糖蜜生产低聚果糖研究[D].南宁:广西大学,2022.
[7]李成林.短梗霉菌发酵生产低聚果糖的研究[D].南宁:广西大学,2021.
[8]陈又铭,李宁,袁卫涛,等.低聚果糖的功能性质及其在食品中的应用[J].中国食品添加剂,2022,33(1):11-15.
[9]国家质量监督检验检疫总局,国家标准化管理委员会. 低聚果糖:GB/T 23528-2009[S].北京:中国标准出版社,2009.
[10]NOBRE C,SIMES L,GONALVES D,et al.Fructooligosaccharides production and the health benefits of prebiotics[J].Current Developments in Biotechnology and Bioengineering,2022,109-138.
[11]KOVCS Z,BENJAMINS E,GRAU K,et al.Recent developments in manufacturing oligosaccharides with prebiotic functions[J].Advances in Biochemical Engineering/Biotechnology,2014,143:257-295.
[12]MARTINS G N,URETA M M,TYMCZYSZYN E E,et al.Technological Aspects of the Production of Fructo and GalactoOligosaccharides.Enzymatic Synthesis and Hydrolysis[J].Frontiers in Nutrition,2019(6):78.
[13]王雪.果糖基轉移酶及低聚果糖生产研究进展[J].粮食与油脂,2009(5):45-48.
[14]郁蓉,王岁楼. 酶法制备功能性低聚糖的研究进展[J].中国食物与营养,2009(12):32-35.
(责任编辑:林玲娜)
