脂肪酸通过内质网应激促进脂肪细胞miR-4431表达及释放的作用及机制研究
2023-06-12李梦环马丁凌唐意涵袁成钢王翠喆张君
李梦环,马丁凌,唐意涵,袁成钢,王翠喆,张君
(石河子大学医学院/新疆地方病与民族高发病教育部重点实验室,新疆 石河子 832000)
糖尿病患病率在世界范围内呈持续增长状态,并已成为世界第5位死亡主因[1]。根据《IDF全球糖尿病地图(第 10 版)》数据显示,预计到2045年,全球糖尿病患病人数将达7.83亿人,其中2型糖尿病(Type2 Diabetes Mellitus, T2DM)约占90%[2]。肥胖是胰岛素抵抗(Insulin Resistance, IR)和T2DM发生发展的重要诱因,80%的T2DM患者伴有肥胖[3-4]。尽管多项研究显示肥胖是产生IR的根源,也是T2DM发生的重要原因,但肥胖诱发T2DM的具体分子机制尚不十分明确。
最近的研究显示,脂肪组织是循环外泌体微小核糖核酸(microRNAs, miRNAs)的一个重要来源,作为新式脂肪因子miRNAs可调节邻近或远处组织中受体细胞的功能[5]。已有研究表明:肥胖个体血清和组织中miRNAs的含量发生变化,可通过影响相关基因的表达诱发IR,在T2DM、心血管疾病和代谢综合征等发病过程中发挥重要作用[6-9]。作为新型脂肪因子,miRNAs对于预防和治疗肥胖相关代谢性疾病具有广阔的应用前景。课题组前期研究发现:肥胖受试个体及饮食诱导的肥胖小鼠血清中miR-4431含量显著增加,并且在体外细胞实验中证实:miR-4431可通过抑制糖代谢关键基因TRIP10 和PRKD1的表达,诱发肝细胞IR和糖耐量受损[10]。然而,有关肥胖导致miR-4431含量增加的原因,尚未见文献报道。
肥胖后,脂肪组织过度蓄积,导致脂解作用增强,进而引起血浆中游离脂肪酸(Free fatty acids,FFAs)含量增加。过量的血清FFAs水平会减少外周葡萄糖摄取,增加肝脏葡萄糖生成,可诱发脂肪组织炎症和IR[11]。课题组已有研究结果表明:无论在正常体重还是肥胖个体血浆中,长链脂肪酸棕榈酸(Palmitic acid,PA)的含量在34种FFAs中丰度最高,并且肥胖个体血浆中PA含量高于正常体重个体,提示PA可能在肥胖导致相关代谢性疾病的发病过程中发挥重要作用[12]。内质网是绝大部分细胞中的重要细胞器,在维持细胞代谢稳态与生物大分子合成中起着关键作用。已有文献表明,肥胖后脂肪酸和葡萄糖等营养物质过量可破坏内质网功能稳态,导致内质网应激(Endoplasmic Reticulum Stress,ERS)的发生,而这种反应与IR和T2DM的发展过程密切相关[13-17]。肥胖后PA含量增加是否通过内质网应激途径导致miR-4431的含量增加,尚未见文献报道。
本研究在收集正常体重及肥胖受试个体腹部脂肪组织,以及构建饮食诱导肥胖小鼠模型的基础上,比较受试个体血清中miR-4431的含量差异以及腹部脂肪组织中内质网应激标志物PERK、IRE1α、ATF6及miR-4431的表达差异;在体外培养3T3-L1脂肪细胞的基础上,明确PA处理对内质网应激标志物及miR-4431表达及释放水平的影响,尝试阐明肥胖后miR-4431表达及释放增加的可能原因,为进一步探讨肥胖后脂肪组织源性microRNAs表达及释放增加的分子机制提供理论依据。
1 对象与方法
1.1 研究对象
本研究所涉及的受试个体及实验动物均获得石河子大学医学院第一附属医院医学伦理委员会批准(编号: 2017-049-01;编号: A2017-115-01)。2021年5月~12月,在石河子大学医学院第一附属医院收集12例受试个体腹部脂肪组织样本,包括6例正常体重及6例肥胖受试个体,所有受试个体均签署知情同意书;于湖南斯莱克景达实验动物有限公司购买C57BL/6雄性小鼠12只,分为普通饮食喂养组(n=6)和高脂饮食喂养组(n=6)。
1.2 细胞系及体外培养试剂
本研究所用3T3-L1细胞购自中国科学院典型培养物保藏委员会细胞库。当25T培养瓶中的细胞生长至80%~100%时即可进行传代处理。将细胞接种在六孔板中2~3 d后,细胞密度达到100%时,使用细胞分化诱导液Ⅰ(DMEM高糖培养基、10%胎牛血清、10 μg·mL-1胰岛素、1 μmol·L-1·L-1地塞米松及 0.5 mmol·L-13-异丁基-1-甲基黄嘌呤)刺激细胞48 h后;使用诱导液Ⅱ(含DMEM高糖培养基、10%胎牛血清、10 μg·mL-1胰岛素及1 μmol·L-1·L-1地塞米松)刺激细胞48 h;半换含 DMEM高糖培养基和10%胎牛血清的混合培养基;24 h后,全部更换培养基为DMEM高糖培养基和10%胎牛血清的混合培养基。待细胞成功诱导出大脂滴后,分别使用200 μmol·L-1和500 μmol·L-1PA进行处理。
1.3 棕榈酸溶液(palmitic acid, PA)配制
使用分析天平称取棕榈酸粉末0.025 64 g,溶于1 mL无水乙醇中。将充分溶解的棕榈酸加至20%无脂肪酸BSA溶液,充分混匀后,使用0.22 μm的滤器进行过滤,分装备用,-80 ℃保存。
1.4 组织与细胞RNA提取
提前预冷无酶 EP 管、三氯甲烷、异丙醇、75%酒精及低温超速离心机至 4 ℃。PA处理细胞24 h后,收集细胞培养上清液后,使用1 ml 1×PBS 清洗细胞,Trizol法提取组织及细胞总RNA。
1.5 miRNAs反转录及实时定量PCR
实验所用miRNAs反转录及实时定量PCR试剂盒购买于北京天根公司,根据说明书进行操作,引物序列见表1。

表1 PCR引物序列
1.6 肥胖小鼠模型构建
使用高脂饲料(含5%PA的60%fat Kcal%,购自江苏美迪森生物医药有限公司)喂养雄性C57BL/6小鼠11周,构建肥胖小鼠模型;普通饲料(含10%fat Kcal%,购自江苏美迪森生物医药有限公司)喂养雄性C57BL/6小鼠11周,作为普通饮食对照组。
通过比较小鼠体重及血糖水平判定肥胖模型是否构建成功。高脂饮食喂养组小鼠体重大于普通饮食组20%,血糖显著高于普通饮食组,认为肥胖小鼠模型构建成功。
饲养小鼠11周后,评价小鼠胰岛素敏感性及葡萄糖耐受能力;内眦取血,4 000 r·min-1,离心5 min,收集血清;脱颈处死小鼠后,收集小鼠肝脏及各脂肪组织,称取重量,所有组织-80 ℃保存。
1.7 小鼠葡萄糖耐量(Intraperitoneal Glucose Tolerance Trial, IPGTT)和胰岛素敏感性(Insulin Tolerance Test, ITT)实验
IPGTT实验前,对小鼠进行饥饿12 h,断尾检测血糖,记为0 min。对小鼠进行腹腔注射无水葡萄糖,无水葡萄糖用量:2 g·kg-1(5 g 无水葡萄糖溶于10 mL 生理水,每只小鼠葡萄糖用量=体重(g) ×4 μL);检测小鼠15、30、45、60、90、120 min血糖水平。
ITT实验前,对小鼠进行饥饿6 h,断尾检测血糖,记为 0 min。ITT 诺和灵30R用量:0.5 IU·kg-1(4 μL的 insulin 溶于 2 mL 生理盐水,每只小鼠胰岛素用量=体重(g) ×2.5 μL);测量小鼠15、30、45、60、90、120 min。
实验过程中,倘若小鼠出现抽搐无力,立即大量注射葡萄糖(100 μL·只-1),密切关注小鼠状态 3~5 min,可进行多次注射。
1.8 统计学分析
应用 SPSS 26.0 软件对各组数据进行统计学分析。服从正态分布或方差齐的两组计量数据采用t检验,非正态分布的两组计量数据采用非参数秩和检验,P<0.05 认为差异具有统计学意义。
2 结果
2.1 肥胖个体脂肪组织中内质网应激标志物及miR-4431表达水平增加
比较受试个体一般资料和生化指标后发现:肥胖个体(n=6,男性3例,女性3例)体重和体质指数显著高于正常体重(n=6,男性2例,女性4例)个体(P<0.05),结果见表2。
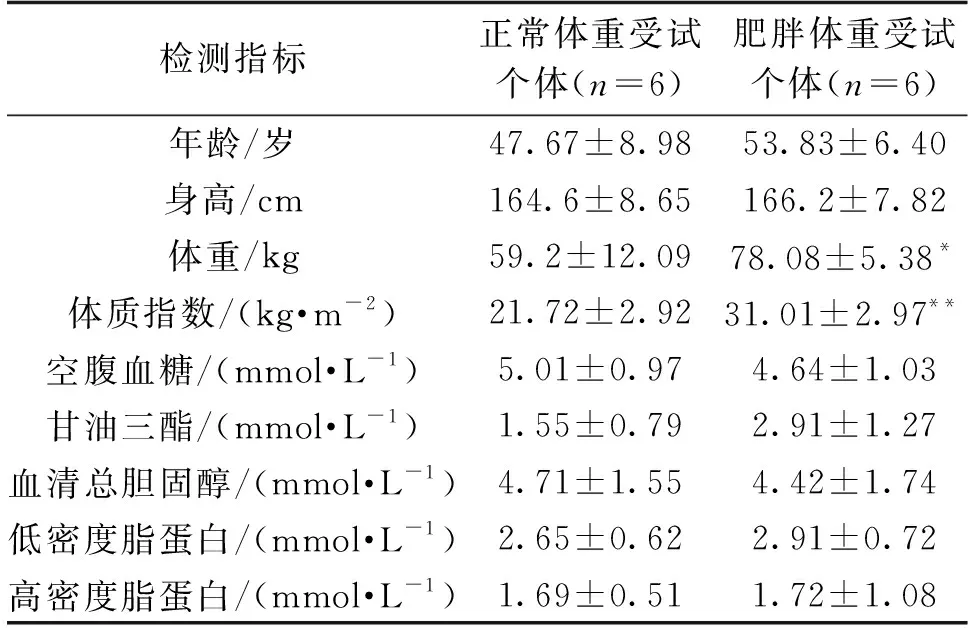
表2 受试个体一般资料
比较受试个体腹部脂肪组织中内质网应激标志物及miR-4431表达水平后发现:与正常体重受试个体相比,肥胖受试个体脂肪组织中内质网应激标志物PERK、IRE1α、ATF6及miR-4431的表达水平均显著增加,差异有统计学意义(P<0.05,图1A~图1D)。相关性分析结果显示:脂肪组织中miR-4431表达水平与受试个体血糖水平、内质网应激标志物PERK、IRE1α、ATF6正相关(图1E~图1H)。

A: PERK;B: IRE1α;C: ATF6;D: miR-4431;E-H:miR-4431与血糖、PERK、IRE1α、ATF6斯皮尔曼相关分析。*P <0.05,**P <0.01, 差异有统计学意义。图1 内质网应激标志物PERK、IRE1α、ATF6及miR-4431在正常(n=6)和肥胖个体(n=6)脂肪组织中的表达水平
2.2 肥胖小鼠脂肪组织中内质网应激标志物及miR-4431表达增加,血清中miR-4431含量增加
高脂饮食喂养雄性C57BL/6小鼠11周后,小鼠体重显著高于普通饮食喂养组(大于20%,P<0.05)(图2A,图2B)。且小鼠血糖水平较普通饮食组相比显著升高,葡萄糖耐量及胰岛素敏感性明显受损(P<0.05)(图2C~图2E)。提示通过含5%的棕榈酸高脂饲料喂养11周后,成功构建肥胖小鼠模型。

A:小鼠大体图片;B:小鼠体重;C:血糖;D:小鼠葡萄糖耐量;E:胰岛素敏感性;F-I:附睾脂肪组织中PERK、IRE1α、ATF6、miR-4431的表达水平;J:血清中miR-4431的释放水平;K-N:miR-4431表达水平与血糖、PERK、IRE1α、ATF6的相关性分析。*P <0.05,**P <0.01, ***P <0.001,差异有统计学意义;斯皮尔曼相关分析,P <0.05,差异有统计学意义。图2 正常饮食(NCD)以及高脂饮食(HFD)喂养小鼠肥胖相关指标、内质网应激标志物及miR-4431含量的比较
比较小鼠附睾脂肪组织中内质网应激标志物PERK、IRE1α、ATF6、miR-4431的表达水平及血清中miR-4431含量后发现:内质网应激标志物PERK、IRE1α、ATF6及miR-4431在肥胖小鼠附睾脂肪组织中显著高表达,同时小鼠血清中miR-4431含量显著增加(P<0.05)(图2F~图2J)。脂肪组织miR-4431表达水平与小鼠血糖水平及内质网应激标志物PERK、IRE1α、ATF6的表达水平均显著正相关(P<0.05)(图2K~图2N)。
2.3 PA促进脂肪细胞内质网应激及miR-4431的表达和释放
体外培养3T3-L1小鼠胚胎成纤维细胞,诱导分化为成熟的脂肪细胞,分别使用200 μmol·L-1和500 μmol·L-1PA处理24 h后,检测细胞脂质合成能力及内质网应激标志物PERK、IRE1α、ATF6的表达水平,以及miR-4431表达和释放水平,结果显示:与NC组相比,200 μmol·L-1及500 μmol·L-1PA处理均可显著促进细胞脂质合成(图3A)及内质网应激标志物PERK、IRE1α、ATF6以及miR-4431的表达水平,同时细胞培养上清中miR-4431的含量也显著升高(P<0.05)(图3B~图3F)。


A:油红O鉴定;B~D:检测细胞内质网应激标志物PERK、IRE1α、ATF6的表达水平;E~F:miR-4431表达和释放水平。*P <0.05,**P <0.01, ***P <0.001,差异有统计学意义。图3 PA处理3T3-L1脂肪细胞对内质网应激和miR-4431表达及释放的影响
2.4 miR-4431上游转录因子调控网络的预测
运用生物信息学数据库TransmiR预测miR-4431上游转录因子,结果显示:DDX5可能为miR-4431的上游转录因子(图4A)。进一步使用hTFtarget数据库预测DDX5的上游转录调控网络后发现。共有205个转录因子可调控DDX5,涉及的通路包括细胞增殖与凋亡、免疫调控、神经系统发育等,其中与内质网应激相关因子包括:XBP1、ETS1、ATF2、ATF3、CEBPA、CEBPB等18个转录因子其具体功能见表3和图4B。

A:miR-4431上游转录调控因子;B:DDX5上游转录调控因子。图4 生物信息学分析miR-4431及DDX5上游转录因子

表3 内质网应激调控的DDX5上游转录因子
3 讨论
2型糖尿病(T2DM)是世界上患病率增长速度最快的代谢性疾病[18]。调查结果显示[19-20],目前中国成年人T2DM患病率达11.6%,并且有50.1%处于前糖尿病状态,已成为全世界T2DM患者最多的国家。肥胖是胰岛素抵抗(Insulin Resistance, IR)和T2DM发生的重要诱因之一,但肥胖诱发T2DM的具体分子机制尚不完全清楚。在过去的几十年里,越来越多的证据表明,脂肪组织已不再是单纯的能量储备器,还是机体最大的内分泌器官[21],可以分泌多种脂肪因子从而参与调节机体生长发育、代谢、免疫应答等生物过程[22]。肥胖状态下,脂肪因子表达谱的改变,对了解肥胖与糖脂代谢紊乱的关系具有一定意义。新式脂肪因子miRNAs自从被发现以来就备受关注,作为一类非编码小RNA,广泛参与基因转录后的表达调控[23]。近年来,随着miRNAs在糖脂代谢领域中的作用越来越受到重视,其作为肥胖相关代谢性疾病的诊断标志物和治疗靶点的应用前景十分广阔。
课题组前期研究发现,miR-4431在肥胖个体血清中的含量显著增加,并与受试个体血糖水平显著正相关,体外细胞实验发现miR-4431可通过抑制下游糖代谢相关基因的表达,诱发靶细胞的IR[10]。最近的研究报道,脂肪组织是循环miRNAs的一个重要来源,大量学者的工作证实:肥胖个体血清和组织中miRNAs的含量发生变化[9]。本研究在肥胖受试个体和饮食诱导的肥胖小鼠脂肪组织中,均发现miR-4431表达量增加,同时肥胖小鼠血清中miR-4431含量也出现相应的增加。以上结果初步提示:miR-4431可能来源于脂肪组织,尚需进一步的研究加以证实。肥胖导致miR-4431高表达的分子机制目前尚不清楚。已有文献报道,miRNAs的生物发生需要Dicer、Drosha等多种剪切酶的参与,Soufi FG等人的研究证明,高血糖患者脐静脉内皮细胞中参与miRNAs成熟的基因Dicer、Drosha、DGCR8和Ago-2的表达水平显著增加[24]。
此外,肥胖后体内游离脂肪酸过度蓄积(以棕榈酸PA的含量最为丰富),可诱发脂肪细胞内质网应激[13-17],而内质网应激反应也可导致miRNAs含量的增加,如Xu等[25]的研究表明内质网应激能够特异性诱导肝细胞中miR-26a的上调,Hiramatsu N的研究同样证实了内质网应激广泛重塑miRNAs转录组,诱导miR-215、miR-483和miR-616的表达[26]。本研究结果表明:肥胖受试个体的脂肪组织中内质网应激标志物显著高表达,相关性分析结果显示:脂肪组织miR-4431表达水平与内质网应激标志物表达水平显著正相关。此外,本研究体外实验结果表明:高浓度PA可上调脂肪细胞内质网应激标志物的表达,同时促进了miR-4431的表达和释放。进一步运用TransmiR数据库预测后发现:在miR-4431的上游转录因子中有18个与内质网应激相关。以上结果提示:肥胖后棕榈酸PA含量的增加可能通过诱发脂肪细胞内质网应激,促进miR-4431的表达和释放,而内质网应激后具体以何种途径发挥上述作用,值得今后更深入的研究加以探索和证实。
综上所述,本研究通过体内外实验发现,肥胖后脂肪组织miR-4431表达及释放水平显著增加,且miR-4431的高表达可能受内质网应激的调控。在本研究基础上,深入开展内质网应激影响miR-4431表达及释放的分子机制研究,将为肥胖及相关代谢性疾病的临床诊断和治疗提供新的理论基础和作用靶点。
