四种南美白对虾常见病原微流控芯片联检方法的测试
2023-06-08王李宝黎慧于志君史文军冯卫赵然沈辉成婕管小平秦亚兵万夕和
王李宝 黎慧 于志君 史文军 冯卫 赵然 沈辉 成婕 管小平 秦亚兵 万夕和

摘要: 為评估微流控芯片法在虾肝肠胞虫(EHP)、致急性肝胰腺坏死病副溶血性弧菌(VpAHPND)、十足目虹彩病毒1(DIV1)和白斑综合征病毒(WSSV)4种南美白对虾常见病原联检中的各项性能,设计针对上述4种病原扩增反应的引物,对已有芯片进行新的功能划分,同时优化该基因芯片的反应体系及恒温扩增条件。结果表明,优化的联检方法可同时检测上述4种病原,特异性好,30 min反应时间即可给出病原联检结果。EHP、 DIV1、WSSV、VpAHPND指标检出限分别为1 μl 0.57拷贝、0.43拷贝、2.12拷贝 、3.18拷贝,已达到甚至超过了环介导等温扩增技术(LAMP)检测的灵敏性。本次测试中的南美白对虾4种病原微流控芯片联检方法所用的检测试剂盒具有操作简便、检测灵敏、特异性强、检测时间短、设备要求简单等特点,适合整个养殖过程中对南美白对虾EHP、VpAHPND、DIV1和WSSV的监测与筛查工作。
关键词: 南美白对虾;病原;微流控芯片;联检
中图分类号: S945.4 文献标识码: A 文章编号: 1000-4440(2023)02-0471-08
Testing of microfluidic chip for joint detection of four common pathogens of Litopenaeus vannamei
WANG Li-bao1, LI Hui1, YU Zhi-jun1,2, SHI Wen-jun1, FENG Wei1, ZHAO Ran1,2, SHEN Hui1, CHENG Jie1, GUAN Xiao-ping3, QIN Ya-bing4, WAN Xi-he1
(1.Jiangsu Institute of Oceanology and Marine Fisheries, Nantong 226007 China;2.National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;3.Yili Yueran Ecological Agriculture Co., Ltd. Yili 835300, China;4.Comprehensive Service Center of Dayu Town, Rudong County, Nantong 226412, China)
Abstract: To evaluate the performance of microfluidic chip method in the joint detection of four common pathogens of Litopenaeus vannamei including Enterocytozoon hepatopenaei (EHP), acute hepatopancreas necrosis disease caused by Vibrio parahaemolyticus (VpAHPND), Decapod iridescent virus 1 (DIV1) and white spot syndrome virus (WSSV), primers for the amplification reactions of the above four pathogens were designed, new functional divisions were made for the existing chips, and the reaction system and constant temperature amplification conditions of the microfluidic chip were optimized. The results showed that, the optimized combined detection method could detect the above four pathogens simultaneously with good specificity, and the joint detection results could be obtained within 30 min reaction time. The detection limits of EHP, DIV1, WSSV and VpAHPND were 0.57 copies/μl, 0.43 copies/μl, 2.12 copies/μl and 3.18 copies/μl, respectively. Some of the limits had reached or even exceeded the testing sensitivity of loop-mediated isothermal amplification (LAMP) method. The detection kit used in the joint detection method of microfluidic chip for the four pathogens of L. vannamei in this test is characterized by simple operation, sensitive detection, strong specificity, short detection time and simple equipment requirements, and is suitable for the monitoring and screening of EHP, VpAHPND, DIV1 and WSSV of L. vannamei in the whole breeding process.
Key words: Litopenaeus vannamei;pathogens;microfluidic chip;joint detection
病害对南美白对虾养殖业的影响与台风、洪涝等自然灾害产生的影响不相上下[1]。对虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)、对虾急性肝胰腺坏死病副溶血性弧菌(AHPND-causing Vibrio parahaemolyticus,VpAHPND)、十足目虹彩病毒1(Decapod iridescent virus 1,DIV1)和白斑综合征病毒(White spot syndrome virus,WSSV)等病原成为许多地区对虾大批量死亡或生长延滞的主要原因之一[2]。简化传统分子检测过程中繁琐的样品处理程序和扩增步骤,研发采样现场适用的便携式分析仪器及配套试剂,实现现场快速即时检测(Point-of-care testing,POCT)是当务之急。该联检方法的研发,将为在养殖各个环节实时监控病原体的携带情况,并有效防控扩散、减少经济损失提供理论基础与技术支撑。
微流控芯片技术(Microfluidic chip technology)是人们为了将样品前处理、分离及检测等过程集成到数平方厘米的芯片上,利用芯片内部流体完成微升/纳升级别的体系反应,最终实现后续分析的自动化、微型化、集成化的一种追求极致的方法技术[3-5]。该技术诞生至今因其反应体系固有的微量化、集约化等优势,应用领域早已遍及医学、生命科学和化学等学科和领域[6-8]。微流控芯片技术在水产养殖领域的应用仍停留在水产致病菌和养殖水体关键环境因子的检测层面[9-11],针对水产养殖常见病原,尤其是对虾常见病毒性和寄生虫性病原的微流控芯片技术应用尚未有相关报道。
目前对虾常见病原体检测仍沿用国家标准或行业标准中的PCR法或巢式PCR(Nested PCR)法,但PCR法的灵敏度不高[12],巢式PCR的操作步骤较为繁琐,检测指标相对单一,且易受到环境气溶胶的污染[13-15]。荧光定量PCR法在核酸提取过程中无法进行质量控制,且熔解曲线易干扰多指标联检的检测结果[16]。与检测成本最高的多通道荧光定量PCR法相比,荧光定量PCR法无法同时检测4个以上病原体指标[17-18],不利于大规模普及。本研究拟设计针对EHP、VpAHPND、DIV1和WSSV的特异性引物,构建微流控芯片与环介导等温扩增技术(Loop mediated isothermal amplification,LAMP)相结合的检测体系,完善一种高效、快速、准确并适应现场检测的针对上述4种病原的联检方法。
1 材料和方法
1.1 试剂和仪器
快速吸附柱法DNA提取试剂盒为宁波爱基因科技有限公司产品,型号:ZMTQ002;对虾微流控芯片4联检快速检测试剂盒由江苏省海洋水产研究所独立研发;微流控恒温扩增仪为宁波爱基因科技有限公司产品,型号:MA2000E。
1.2 樣品
含有EHP、VpAHPND、DIV1和WSSV病原体的对虾组织样本由江苏省海洋水产研究所生物技术研究室保存,无病原体的健康对虾组织样本从南通当地获取。病原体的对虾组织样本经过国家标准方法 《白斑综合征(WSD)诊断规程第2部分:套式PCR检测法》(GB/T 28630.2-2012)[19]、地方标准《南美白对虾肝肠胞虫巢式聚合酶链式反应(PCR)检测方法》(DB32/T 3802-2020)[20]或世界动物卫生组织(OIE)和亚太水产养殖中心网(NACA)推荐方法检测为阳性;无病原体的健康对虾组织经上述检测方法检测为阴性。同时采集江苏省省内的南美白对虾仔虾样品(85份)和成虾样品(100份)进行实测样本验证试验。
1.3 病原DNA提取
样本DNA模板提取方法与步骤参照《快速吸附柱法DNA抽提试剂盒的产品说明书》。仔虾取头胸部组织提取DNA,成虾取鳃和肝胰腺组织混样提取DNA。
1.4 微流控芯片联检方法的建立和结果判定
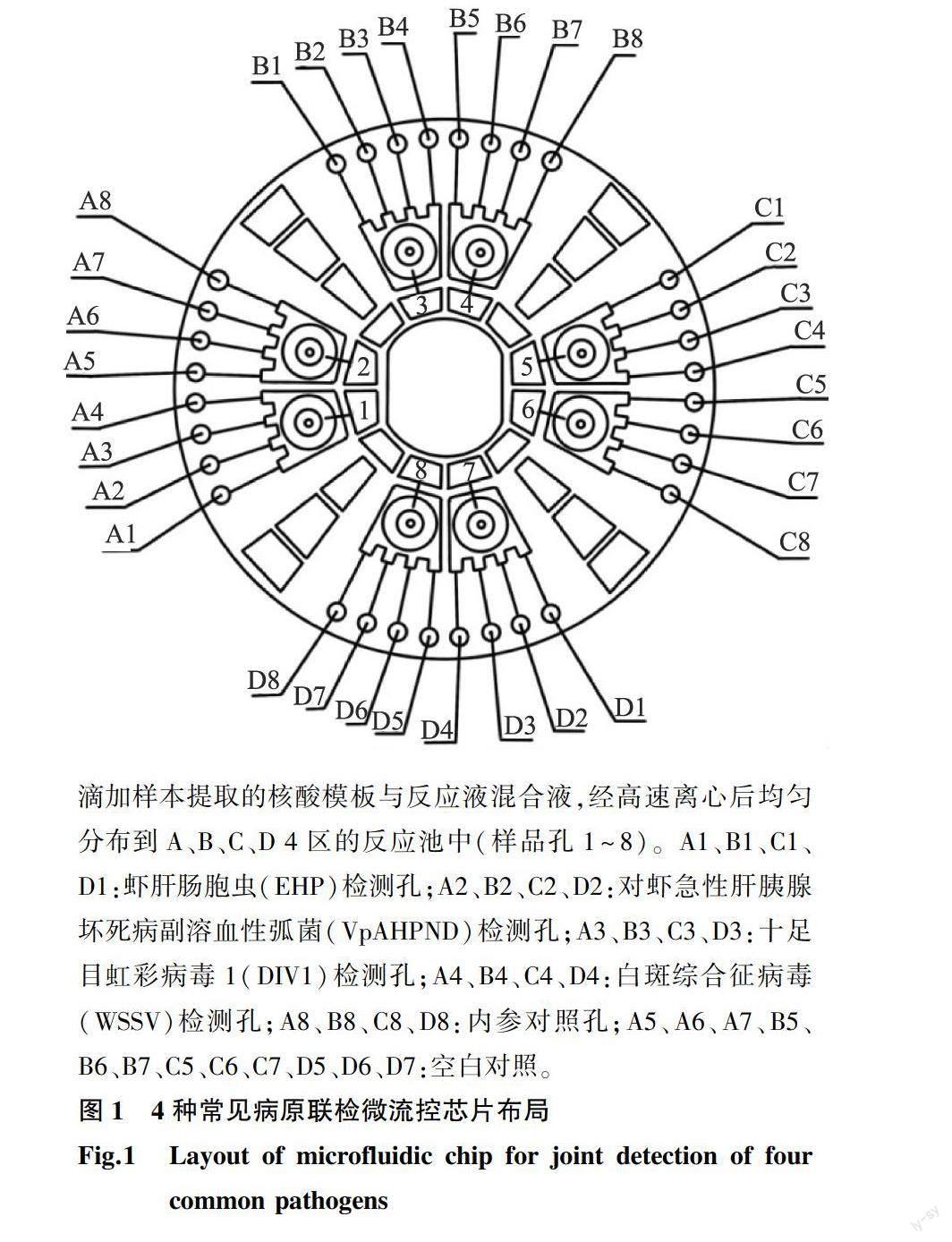
本研究设计针对上述4种病原体扩增的特异性引物(表1),将其预埋至微流控芯片对应的反应池孔内。
芯片含8个加样孔和32个反应池,均匀分布于4个独立单元。加样孔和反应池通过毛细管相连,反应池彼此互不相通。将提取的DNA模板和反应液混匀后注入加样孔,用配套的封口膜封闭微流控芯片,利用离心力驱动反应液分别均匀地注入反应池(图1)。
用微流控恒温扩增仪对封装好的微流控芯片进行恒温扩增,读取反应后的实时荧光数值和循环阈值(Ct值),进行结果判定。30 min内,待检样品出现特异性S形扩增曲线,且Ct值<30时判定为阳性结果;30 min内,待测样品未扩增出特异性曲线,且Ct值<30时判定为阴性结果。
1.5 特异性试验
将上述4种病原的阳性样品提取的DNA模板作为反应液模板,并设定阴性对照组,利用微流控芯片恒温扩增仪进行反应,考察在同一个扩增程序中能否同步特异性地扩增出4种扩增曲线。
1.6 灵敏度和检出限
选择已经确定含有EHP、VpAHPND、DIV1和WSSV病原体的对虾组织样本,按照方法1.3中所述DNA提取方法,提取样本中DNA作为后续灵敏度和检出限试验的模板。经实时荧光定量PCR(Real time fluorescent quantitative PCR,RT-FQ PCR)法确定DNA模板中的目标病原拷贝浓度,并以此已知浓度DNA模板作为灵敏度和检出限测试测验的初始样本,通过对该样本进行10倍梯度稀释以进行下一步灵敏度和检出限测试试验,同时设立阴性空白对照组。以出现特异性扩增曲线的最低稀释浓度的DNA模板中对应病原的拷贝浓度作为最终灵敏度和检出限的结果。
1.7 重复性
按照方法1.3的方法准备4种病原阳性样品,同时设立阴性对照组,对每种阳性样品进行8次测定,以8次样品测定Ct值的变异系数(CV)来评估本检测体系的重复性[21]。
1.8 实测样本验证
采集江苏省省内南美白对虾仔虾样品85份和成虾样品100份,进行微流控芯片法与传统PCR方法检测的结果对比试验。
2 结果与分析
2.1 联检方法的建立
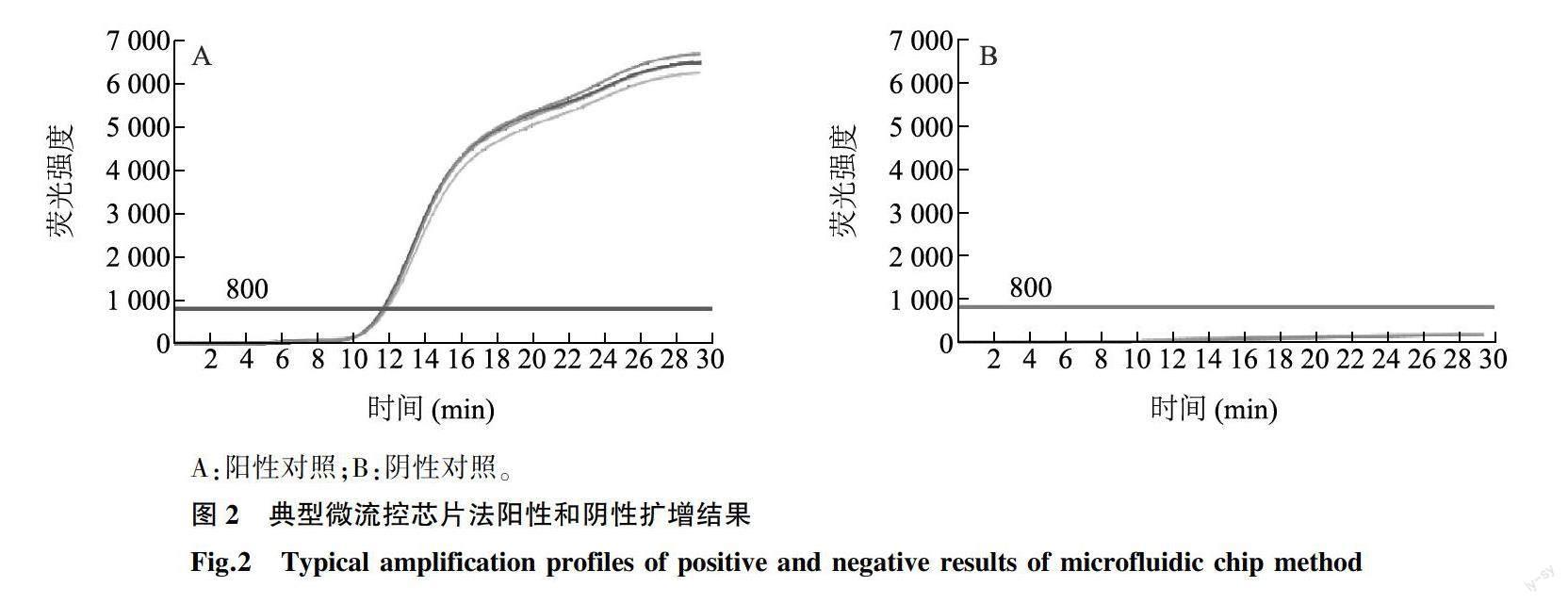
通过反复优化试验条件[包括Mg2+浓度,正反向引物比例和纳米金颗粒(Gold nanoparticles,AuNPs)种类、粒径和浓度等]确定了每个反应池5.0 μl 恒温扩增反应体系,该反应体系中各组分组成如下:20 mmol/L Tris-HCl 0.1 μl,20 mmol/L KCl 0.8 μl,40 mmol/L (NH4)2SO40.3 μl,40 mmol/L MgSO40.3 μl,2.8 mmol/L dNTPs 0.3 μl,8 000 U/ml DNA聚合酶0.2 μl,50 μmol/L SYBR Green熒光染料 0.2 μl,8×10-6mol/L Na3Ct- AuNPs(柠檬酸三钠-纳米金) 0.4 μl,ddH2O 0.4 μl,测试样品DNA模板 1.0 μl。引物浓度均为 50 μmol/L,各0.5 μl,以冻干粉形式提前预埋到反应池内。随后63.5 ℃恒温扩增30 min。在图1样品加样孔位置,加入总反应预混液(15.0 μl荧光预混液和10.0 μl核酸模板)。初步混匀后,用配套的封口膜封闭微流控芯片,将微流控芯片安装入微流控恒温扩增仪,1 500 r/min离心3 min,5 000 r/min离心3 min,将反应液均匀分布到各个反应池中,随后63.5 ℃恒温扩增30 min。如图2所示,阳性对照样品30 min内相应的反应孔出现典型的扩增曲线,且Ct<30;阴性对照相应的反应孔未出现典型扩增曲线,且Ct<30。
2.2 检测结果特异性
根据上述反应体系和恒温扩增程序,将提取的4种对虾病原阳性样品DNA模板按照图1中样品分布孔进行上样分析,在30 min内能在不同的时间点出现特异性的扩增曲线并加以区分(图3)。
本检测体系在同一恒温扩增条件下,对上述4种病原在30 min内均能实现特异性的有效检出,但针对每一种病原检测具体的灵敏度和检测限还需要进一步试验来验证。
2.3 检测结果灵敏度和检出限
用已经确定含有EHP、VpAHPND、DIV1和WSSV病原体的对虾组织样本参照方法1.3提取试验用DNA模板,经实时荧光定量PCR方法确定DNA模板中的EHP、VpAHPND、DIV1和WSSV 4种目标病原拷贝数分别为1 μl 5 736拷贝、3 183拷贝、4 327拷贝和2 117拷贝。将该溶液进行10倍梯度稀释作为灵敏度和检出限的样品,同时设立阴性空白对照组。
根据最低稀释倍数下出现特异性扩增曲线的DNA含量来确定本检测方法针对每种病原检测指标的灵敏度和检出限。结果(图4)显示,4种病原检测指标中DIV1原液出现特异性扩增曲线的时间点最早,但随着阳性样本含量的降低,其特征扩增曲线出现时间会延迟直至消失。
其余病原检测灵敏度和检出限试验结果都呈现出相似的变化趋势,根据出现典型阳性扩增曲线的最大阳性样本稀释倍数,最终本检测方法中VpAHPND、WSSV、EHP和DIV1 4种病原联检的检出限依次为:1 μl 3.18拷贝、2.12拷贝、0.57拷贝和0.43拷贝。结果显示,本检测方法对于EHP和DIV1的检测较为灵敏,并可通过进一步优化反应体系和条件来提升WSSV和VpAHPND检测的灵敏度。
微流控芯片法对EHP的检出限要低于传统PCR方法,据报道传统PCR方法检出限为1 μl 3.30拷贝[22]。而微流控芯片法对VpAHPND的检出限又高于传统PCR方法,据报道用传统PCR方法的检出限为1 μl 0.32拷贝[22]。其他2种病原PCR法的检出限暂未见报道。
2.4 检测结果重复性
为了评估本检测体系的重复性,选择已经确定为病原阳性的样品提取DNA模板,并设立阴性对照,对阳性样品进行8次测定,4种病原阳性样品测定的Ct值的CV值为2.22%~3.47%(表2),均≤5.00%,具有较好的重复性。
2.5 微流控芯片法与PCR方法检测结果的对比
如表3所示,利用微流控芯片法与传统PCR法虾肝肠胞虫(EHP)、对虾急性肝胰腺坏死病副溶血性弧菌(VpAHPND)、十足目虹彩病毒1(DIV1)、白斑综合征病毒(WSSV)的循环阈值(Ct值)的变异系数分别为3.18%、3.47%、2.55%、2.22%。
检测成虾样品100份,虾苗样品85份,在成虾样品中4种病原的微流控芯片法检测结果与传统PCR法检测结果保持了高度的一致性;而虾苗样品中,分别使用微流控芯片法与传统PCR法检测,微流控芯片法阳性检出率略低于传统PCR法。对比两者从DNA模板提取开始到完成4种病原检测所用时间,微流控芯片法(用时1 h)要比传统PCR法(用时6 h)节约近5 h。
3 讨论
20世纪90年代初,微流控芯片技术首次被报道[3],这一技术在微米尺度芯片上实现了制备、反应、分离和检测等基本操作单元的功能集成,在短时间内完成上百个样品的平行自动分析,满足现场快速即时检测的需求[23-24]。随着该技术的不断发展与成熟,至今已衍生出解旋酶依赖性扩增(HDA)微流控芯片、碟式微流控芯片、POC微流控芯片、数字微流控芯片、卡式微流控芯片等多种微流控芯片[25-27]。由于微流控芯片法自身具有微型化、集成化和自动化等特点,以及消耗样品和试剂量少、反应迅速、可大量平行处理等优点,该项技术在生物学、医学、化学和免疫学等领域表现出无限的发展潜力[28-31]。微流控芯片的应用范围从单纯的基因扩增与分析[32]拓展到了细胞培养[33]、蛋白质检测[34]和特征化合物分析[35]等领域。
本病原检测体系是基于微流控芯片与LAMP技术相结合的一种新型检测技术,具有传统LAMP技术所具有的步骤简单、反应时间短、特异性和灵敏度高[36-37]、不需要特殊仪器等特点[38],除了可以用于突发水产疫情的POCT外[39],还可以用于水产养殖日常管理关键时期的病原实时监控。在试验前期本检测体系利用2对特异性恒温扩增引物,并选择柠檬酸三钠-纳米金(Na3Ct- AuNPs)作为提升恒温扩增效率和特异性的辅助剂[40],通过优化恒温扩增体系和扩增温度,4种常见病原在本次微流控芯片联检方法中均出现了特征性扩增,且该检测方法检测限除了 VpAHPND指标外,其他3项指标的最低检测限已经处于较为领先的水平[41-42],可与目前应用较广的Nested PCR [43]和RT-FQ PCR [44]、数字PCR(Digital PCR)和等温聚合酶扩增技术(RPA)等相媲美[45-46]。本检测方法中所用的试剂、仪器、芯片等均享有国内自主知识产权,可以自主化生产,能有效避免国际专利间的技术纠纷,具备良好的适用性和市场价值。
本检测方法在检测结果的重复性和稳定性上优势显著。已有的国家标准方法或者是OIE/NACA推荐的经典PCR方法,尤其是多重PCR(Multiplex PCR)和Nested PCR方法,仍可能产生非特异性扩增,从而影响最终的结果判定。其中气溶胶污染是产生假阳性扩增的主要原因[47],而本联检体系始终在一个相对密闭的环境中进行目的基因序列的恒温扩增,有效降低了气溶胶污染的概率,增强了联检体系的可靠性和稳定性。在本检测方法建立时,检测全程加入4种病原指标的阳性样本用于全程质量控制,既驗证了本检测方法中核酸提取试剂盒的有效性,又进一步验证了后续微流控恒温扩增和病原结果研判的有效性。本检测方法不仅适用于养殖塘口对虾常见病原的POCT,还为对虾大型养殖企业全程监控养殖病害发生提供了技术支持,这为有效预警并控制对虾养殖病害的发生提供了经济、便捷、快速和有效的手段,同时对中国对虾养殖业的绿色健康发展起到了保驾护航的重要作用。
参考文献:
[1] 宋居易,刘昱辰,张苏楠,等. 南美白对虾4种病原体可视化快速检测试剂盒(生物芯片法)的研发[J]. 江苏农业学报, 2020, 36(3): 656-665.
[2] 李 超,马立鸣,曹 洁,等. 2021年度我国北方对虾病害流行情况及下一步防控建议[J]. 中国水产, 2022(2):103-106.
[3] MANZ A, GRABER N, WIDMER H. Miniaturized total chemical analysis systems: a novel concept for chemical sensing[J]. Sensors and Actuators B: Chemical, 1990, 1(1): 244-248.
[4] SRINIVASAN V, PAMULA V K, FAIR R B. An integrated digital microfluidic lab-on-a-chip for clinical diagnostics on human physiological fluids[J]. Lab on a Chip, 2004,4(4): 310-315.
[5] MARK D, HAEBERLE S, ROTH G, et al. Microfluidic lab-on-a-chip platforms: requirements,characteristics and applications[J]. Chemical Society Reviews, 2010, 39(3): 1153-1182.
[6] 朱 琦,王凯娟,曹云霞,等. 基于微流控芯片的胚胎体外培养研究进展[J]. 中华生殖与避孕杂志, 2022, 42(2): 209-212.
[7] 欧英琪,薛 堃. 微流控芯片在昆虫研究中的应用[J]. 应用昆虫学报, 2022, 59(1): 1-15.
[8] 陈 港,张梦丽,魏 渊,等. 纸基微流控芯片的构建及在亚硝酸盐检测中的应用[J]. 华南理工大学学报(自然科学版), 2021, 49(12): 1-7.
[9] 郭建江,张荣标,杨 宁,等. 基于磁控分离的水产致病菌微流控检测方法[J]. 农业机械学报, 2015, 46(4): 277-281, 308.
[10]时家辉,于亚光,杨 普,等. 基于微流控和比色光谱法的水产养殖海水氨氮含量检测[J]. 农业机械学报, 2020, 51(S1): 397-404.
[11]董 峰,时家辉,杨 普,等. 养殖水体氨氮浓度威力克和水杨酸分光光度法检测[J]. 农业机械学报, 2021, 52(S1): 229-236, 343.
[12]TANG K F J, DURAND S V, WHITE B L, et al. Post larvae and juveniles of a selected line of Penaeus stylirostris are resistant to infectious hypodermal and hematopoietic necrosis virus infection[J]. Aquaculture, 2000, 19(3/4): 203-210.
[13]JAROENLAK P, SANGUANRUT P, WILLAMS B A P, et al. A nested PCR assay to avoid false positive detection of the microsporidian Enterocytozoon hepatopenaei (EHP) in environmental samples in shrimp farm[J]. PLoS One, 2016, 11(11): 1-5.
[14]DANGTIP S, SIRIKHARIN R, SANGUANRUT P, et al. AP4 method for two-tube nested PCR detection of AHPND isolates of Vibrio parahaemolyticus[J]. Aquaculture Reports, 2015, 2(2): 158-162.
[15]NATIVIDAD K D T, NOMURA N, MATSUMURA M. Detection of white spot syndrome virus DNA in pond soil using a 2-step nested PCR[J]. Journal of Virological Methods, 2008, 149(1): 28-34.
[16]刘 珍,张庆利,万晓媛,等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR 检测方法的建立及对虾样品的检测[J]. 渔业科学进展, 2016, 37(2): 119-126.
[17]HAN J E, TANG K F J, PANTOJA C R, et al. qPCR assay for detecting and quantifying a virulence plasmid in acute hepatopancreatic necrosis disease (AHPND) due to pathogenic Vibrio parahaemolyticus[J]. Aquaculture, 2015, 442: 12-15.
[18]QIU L, CHEN M M, WAN X Y, et al. Detection and quantification of shrimp hemocyte iridescent virus by TaqMan probe based real-time PCR[J]. Journal of Invertebrate Pathology, 2018, 157: 95-101.
[19]国家质量监督检验检疫总局国家标准化管理委员会.白斑综合征(WSD)诊断规程第2部分:套式PCR检测法:GB/T 28630.2-2012 [S]. 北京:中国标准出版社,2012.
[20]江苏省市场监督管理局.南美白对虾肝肠胞虫巢式聚合酶链式反应(PCR)检测方法:DB32/T 3802-2020 [S]. 北京:中国标准出版社,2020.
[21]邵 靓,陈弟诗,陈 斌,等. 微流控芯片法在非洲猪瘟病毒核酸快速检测中的性能分析[J]. 畜牧与兽医, 2021, 53(7): 107-111.
[22]龚晗悦. 虾肝肠胞虫和急性肝胰腺坏死病双重qPCR/ddPCR检测方法的建立[D]. 广州:暨南大学, 2021.
[23]SANJAY S T, DOU M, SUN J, et al. A paper/polymer hybrid microfluidic microplate for rapid quantitative detection of multiple disease biomarkers[J]. Scientific Reports, 2016, 6(1): 30474.
[24]LIU F F,ZHANG C S. A novel paper-based microfluidic enhanced chemiluminescence biosensor for facile, reliable and highly-sensitive gene detection of Listeria monocytogenes[J]. Sensors and Actuators B: Chemical, 2015, 209: 399-406.
[25]周 杰,黄文胜,邓婷婷,等. 转基因检测微流控恒温扩增芯片的研制[J]. 现代食品科技, 2017, 33(6): 293-302.
[26]COELHO B J, VEIGAS B, GUAS H, et al. A digital microfluidics platform for loop-mediated isothermal amplification detection[J]. Sensors, 2017, 17(11): 2616.
[27]YASMIN R, ZHU H, CHEN Z, et al. A modifiable microarray based universal sensor:providing sample-to-results automation[J]. Heliyon, 2016, 2: e00179.
[28]曹 宁,申炳阳,喻梓瑄,等. 用于3种食源性致病菌核酸提取的微流控芯片制备[J]. 食品与生物技术学报, 2022, 41(1): 28-35.
[29]李 敏,豆小文,熊 丹,等. 新型微流控芯片在循环肿瘤细胞富集与鉴定中研究進展[J]. 中华检验医学杂志, 2021, 44(12): 1195-1198.
[30]徐林龙,金志明,范一强. 微针与微流控芯片的结合应用研究进展[J]. 分析化学,2022,50(4):506-515.
[31]吁子贤,林树靖,王 菲,等. 基于MEMS技术的外泌体磁分离微流控芯片[J]. 维纳电子技术, 2021, 58(6): 496-500.
[32]JALILI A, BAGHERI M, SHAMLOO A, et al. A plasmonic gold nanofilm-based microfluidic chip for rapid and inexpensive droplet-based photonic PCR[J]. Scientific Reports, 2021, 11(1): 23338.
[33]LI R, ZHANG X J, LV X F, et al. Microvalve controlled multi-functional microfluidic chip for divisional cell co-culture[J]. Analytical Biochemistry, 2017, 539: 48-53.
[34]ZHAO Y, HU X G, HU S, et al. Applications of fiber-optic biochemical sensor in microfluidic chips: a review[J]. Biosensors & Bioelectronics, 2020, 166: 112447.
[35]张 昱. 基于分子印迹技术在微流控芯片上检测4-硝基苯酚和四环素[D]. 烟台:烟台大学, 2021.
[36]王 华,王君玮,徐天刚,等. 非洲猪瘟病毒环介导等温扩增诊断方法的建立[J]. 中国兽医科学, 2010, 40(9): 940-944.
[37]田纯见,杨舒展,段喻燕,等. 非洲猪瘟病毒非结构基因实时荧光LAMP 检测方法的建立[J]. 动物医学进展, 2017, 38(11): 1-5.
[38]FANG X E, LIU Y Y, KONG J L, et al. Loop mediated isothermal amplification integrated on microfluidic chips for point of care quantitative detection of pathogens[J]. Analytical Chemistry, 2010, 82(7): 3002-3006.
[39]赵 阳,王 喆,贾舒麟,等. 基于LAMP的微流控芯片病原体快速检测方法研究进展[J]. 中国实验诊断学, 2020, 24(4): 701-704.
[40]姚 晶,林 燕,李 佳,等. 三种纳米金颗粒对聚合酶链式反应扩增效率和特异性的影响[J]. 环境化学, 2012, 31(1): 1-8.
[41]KRISTINE Y, RICHARD F. Real-time quantitative PCR and fast QPCR have similar sensitivity and accuracy with HIV cDNA late reverse transcripts and 2-LTR circles[J]. Journal of Virological Methods, 2008, 153(2): 253-256.
[42]WANG J, WANG J, LI R, et al. Rapid and sensitive detection of canine distemper virus by real-time reverse transcription recombinase polymerase amplification[J].BMC Veterinary Research, 2017, 13(1): 241-247.
[43]杨萱桐. 十二指肠贾第虫ELISA、巢式PCR和LAMP诊断方法的建立[D]. 哈尔滨: 东北农业大学, 2019.
[44]温书香,安利民,赵 协,等. 猪伪狂犬病毒实时荧光定量PCR检测方法的建立与初步应用[J]. 江苏农业科学, 2019, 47(7): 1654-1659.
[45]TADMOR A D, OTTESEN E A, LEADBETTER J R, et al. Probing individual environmental bacteria for viruses by using microfluidic digital PCR[J]. Science, 2011, 333(6038): 58-62.
[46]OLSEN J B, LEWIS C J, MASSEMGILL R L, et al. An evaluation of target specificity and sensitivity of three qPCR assay for detecting environmental DNA from Northern Pike (Esox lucius)[J]. Conservation Genetics Resources, 2015, 7(3): 615-617.
[47]李云龍,张 健,魏艳秋,等.分子诊断实验室去除核酸污染的方法学研究[J]. 生物工程学报, 2021, 37(2): 673-679.
(责任编辑:陈海霞)
