微流控芯片技术检测虾肝肠胞虫及其在浙江省对虾流行病学调查中的应用
2023-06-07孙福英白斐祝波卢先东钱冬
孙福英 白斐 祝波 卢先东 钱冬


摘 要 南美白对虾是浙江省养殖的主要虾类,虾肝肠胞虫感染(Enterocytozoon hepatopenaei,EHP)是南美白对虾养殖中危害最大的疾病,引起严重的生长迟缓,造成极大的损失。虾肝肠胞虫个体微小,给显微镜检测造成较大的困难,因此尝试建立快速、灵敏的定量检测微流控芯片檢测技术。结果表明,所建立的微流控芯片检测方法特异性良好,重复性良好,扩增结果稳定可靠,最低检出限为3.23×100 copies·μL-1。将该检测技术应用于浙江省对虾流行病学特点分析中,发现三门县和舟山市对虾肠胞虫感染率比较高,除嘉兴市未出现对虾通用型传染皮下及造血组织坏死病毒感染,其他地方均有感染。试验证明,微流控芯片快速检测技术有望应用于对虾规模化养殖中虾肝肠胞虫感染的快速检测。
关键词 微流控芯片技术;虾肝肠胞虫;流行病学;浙江省
中图分类号:S945.4 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.06.063
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)
属于真菌界(Fungi)微孢子虫门(Microsporidia)单倍期纲(Haplophasea)壶孢目(Chytridiopsida)肠胞虫科(Enterocytozoonidae)肠胞虫属(Enterocytozoon),是一种可感染多种真核生物的专性细胞内寄生虫[1-3]。EHP主要感染对虾的肝胰腺,感染较严重时也感染中肠、血淋巴、腮和肌肉等组织[4]。对虾感染EHP后,可与急性肝胰腺坏死弧菌共感染,死亡率可明显上升,两者具有累加效应[5]。
EHP个体微小,给显微镜检测造成较大困难,EHP传播迅速,危害大,需要快速、灵敏的检测技术。常规的PCR检测耗时较长,荧光定量PCR灵敏度高,但上述检测技术均需要在实验室完成。微流控芯片技术也叫芯片实验室(lab on a chip,LOC),是一种以在微米尺度空间完成对化学或生物样品的常规化学和生物实验室功能为主要特征的技术平台[6]。其把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程。
为建立快速、便捷、定量检测EHP的方法,方便养殖场现场对EHP的流行规律进行定量评估,本文尝试建立EHP定量检测的微流控芯片检测技术。
1 材料与方法
1.1 仪器与试剂
微流控荧光检测仪,宁波爱基因科技有限公司;荧光定量PCR,瑞士Roche公司;PCR仪,德国Analitik Jena AG公司;NanoDrop微量UV-Vis分光光度计,美国Thermo Fisher公司。
荧光等温扩增液,宁波爱基因科技有限公司;通用SYBR qPCR预混液,南京诺唯赞生物科技有限公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒,美国Omege公司;pMD19-T Vecto专用载体,日本TaKaRa公司。
1.2 实验方法
1.2.1 引物设计和筛选
肠胞虫采用GenBank公布片段,选择高度保守基因序列片段,PrimerExplorV5 在线软件设计引物。一共设计4条引物,每条引物中均包含上/下游外引物F3/B3、上/下游内引物FIP/BIP,具体设计情况见表1。引物由杭州有康生物公司合成,通过加热干燥的方式将预筛选引物包埋于反应室中,筛选出最佳反应引物。
1.2.2 标准质粒的合成
取提取的肠胞虫基因片段的克隆采用高保真酶Pfu预混液,进行EHP目的基因扩增,将获得的PCR产物琼脂糖凝胶电泳后,切胶回收纯化,与pMD19-T载体连接,后转至DH5α感受态细胞,筛选阳性克隆重组质粒,送生物科技有限公司测序鉴定,对于鉴定正确的重组质粒,名为pMD-EHP,对阳性质粒进行浓度测定,拷贝数计算,分装,-80 ℃保存备用。
1.2.3 微流控芯片检测技术标准曲线的建立
样本充分均质,试剂于室温下解冻,充分混匀并短暂离心后使用。严格按照试剂盒说明书进行操作。
微流控芯片检测仪恒温扩增时,仪器会自动实时检测荧光,形成荧光检测扩增曲线。微流控芯片按阈值时间(Ct)判定样品:1)阳性——反应孔出现Ct<60,有明显的S型扩增曲线;2)阴性——反应孔出现
Ct>60,无扩增曲线。
选择肠胞虫(EHP)、对虾通用型传染皮下坏死(IHHNV-U)、虹彩病毒(DIV1)、弧菌(Vibrio)阳性标准质粒加入样本内标孔,按照仪器操作说明书运行程序,构建标准曲线。
1.2.4 微流控灵敏度测试
选择无菌水作为阴性对照,用S01-03-06-18虾病四联(EHP、IHHNV-U、DIV1、Vibrio)微流控芯片快速检测试剂盒QT进行定标,根据优化条件和构建的标准曲线,确定扩增肠胞虫阳性核酸的最低检出限。
1.2.5 微流控反应特异性与稳定性测试
特异性实验是为了检查该方法与其他水生动物病原之间是否存在交叉反应,分别以肠胞虫、急性肝胰腺坏死、对虾通用型传染、对虾感染型传染、对虾白斑综合症、十足目虹彩病毒和罗氏沼虾诺病毒的DNA为模板,使用优化条件检测其特异性。
使用稀释至104 copies·μL-1的标准阳性质粒在1次实验中重复16次,通过分析检测阈值时间(Ct)评价该方法的重复性。
1.2.6 实际样品检测
2020—2022年,分别在浙江省台州市、舟山市、嘉兴市、宁波市、杭州市采样,对调查采集的肠胞虫患病对虾、其他疑似发患病虾、药物治疗后的虾共37批,用微流控芯片进行肠胞虫进行检测,统计肠胞虫阳性检出率。
2 结果与分析
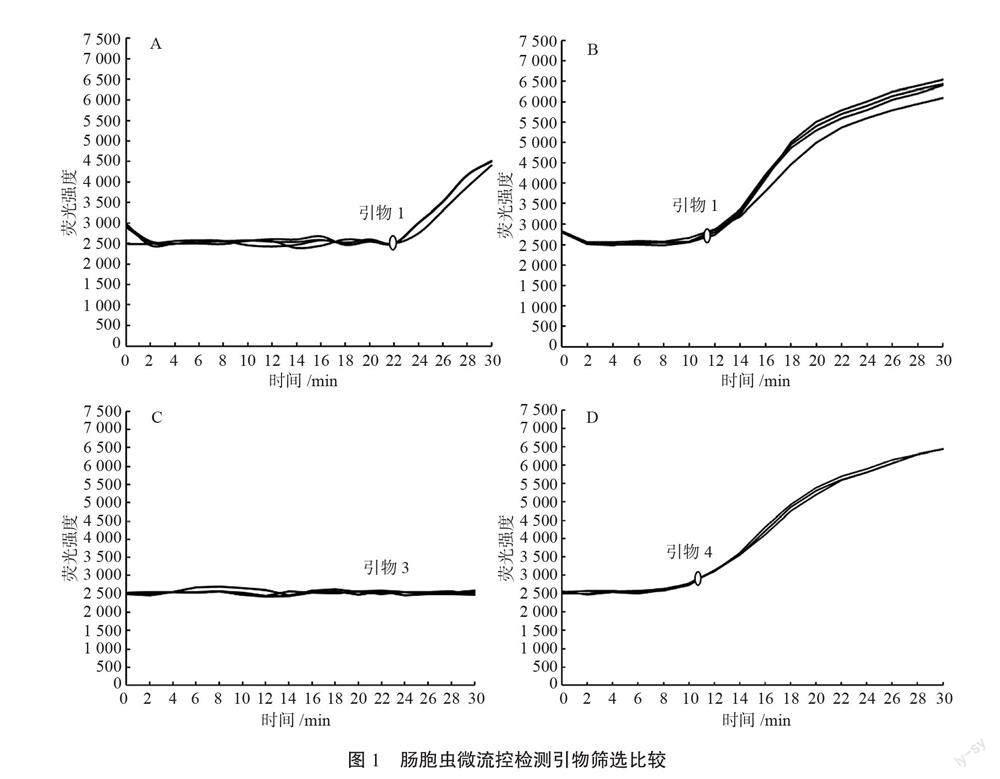
2.1 微流控引物筛选结果
筛选和比较肠胞虫微流控检测的多套引物的Ct值,如图1所示。结果表明,引物1扩增反应时间比较长,Ct值在22 min左右;引物2反应时间短,Ct值在12 min
左右,具有明显的扩增曲线,但曲线比较分散;引物3无扩增峰;引物4反应时间短,Ct值在11 min左右,具有明显的扩增曲线,且曲线比较集中。因此引物4为最佳引物,后续实验均采用引物4。
2.2 EHP微流控芯片检测标准曲线
用S01-03-06-18虾病四联(EHP、IHHNV-U、DIV1、Vibrio)微流控芯片快速检测试剂盒QT进行定标,4种病原标准曲线如图2所示。微流控芯片最低检出限为3.23×100 copies·μL-1。
2.3 微流控特异性与重复性结果
特异性实验结果(图3)显示,除EHP为模板的阳性样品荧光定量出现扩增峰外,其他模板样品均无扩增曲线出现,说明微流控芯片检测方法的特异性良好。重复性结果见图4,取104 copies·μL-1的标准阳性质粒在重复检测16次,Ct值15.40±0.12 min,变异系数0.78,阳性质粒均出现了典型S型扩增,阴性对照均未出現扩增,表明建立的EHP微流控芯片方法有良好的重复性,扩增结果稳定可靠。
2.4 微流控技术在虾肝肠胞虫流行病学研究中的应用
如表2所示,2020—2022年共采集检测样品37批次,感染20批次,肠胞虫的感染率为54.05%。其中,2020年共调查11批次,感染6批次,检出率54.55%;2021年共调查12次,感染9批次,感染率为75.00%;2022年共调查14批次,感染5批次,感染率为35.71%。
对所采集的37批样本进行分区域病原检测,结果如表3所示,肠胞虫的染率达54.05%,对虾通用型传染皮下及造血组织坏死病毒(IHHNV-U)检出率32.43%,弧菌(Vibrio)检出率为45.95%。三门县和舟山市的肠胞虫感染率比较高,其次是宁波市、杭州市。除嘉兴市未出现IHHNV-U感染,其他地方均有感染。
3 结论与讨论
EHP孢子大小仅为0.7 μm×1.1 μm,感染无明确易判断的临床症状,很难观察。雷燕等根据GenBank中对虾肠道上皮细胞的EHP基因保守序列,设计特异性引物,优化PCR扩增条件,建立了EHP的PCR检测方法[7]。Tangprasittipap等利用套式PCR检测方法,开展了EHP诊断和分子流行病学调查[8]。然而PCR具有模板质量和引物设计要求较高、需扩展特定DNA、操作复杂等缺点。刘丹等应用环介导等温扩增(LAMP)同时检测副溶血弧菌与金黄色葡萄球菌[9]。环介导等温扩增(Loop Mediated Isothermal Amplification,LAMP)技术具有检测时间短、灵敏性高和检测结果准确等优势,但由于其预处理时间长,且需要专业的检测人员操作,不易在现场及基层推广[10]。世界卫生组织认为,理想的诊断检测技术应具有敏感性高、特异性强、使用成本低、操作简单快捷、可用于任何环境条件下同时容易获得操作仪器等特点[11]。微流控芯片可以设计多条微通道,且微通道之间结构封闭,同一个微流控芯片可以对同一样本同时进行不同项目的检测,有效避免交叉污染,缩短了检测时间,提高了检测效率[12]。微流控芯片的微型化提高了传热效率,节约了试剂成本和样本,且不需要大量的实验设备,因此大规模生产技术集成的微流体芯片大大降低了生产成本[13]。
对天津市2015年和2016年虾肝肠胞虫的流行情况调查表明,EHP的检出率分别为56.96%、69.52%[14]。2019年,江苏省温室养殖虾类中EHP患病率为56.3%,土塘养殖虾类中EHP患病率为79.5%[15]。本实验室在2020—2022年共采集检测样品37批次,肠胞虫的感染率为54.05%。数据显示,EHP引发的感染病已严重威胁我国虾类的健康养殖。此外,本文针对浙江省不同地区对虾流行病学特点的分析发现,三门县和舟山市的肠胞虫感染率比较高,除嘉兴市未出现对虾通用型传染皮下及造血组织坏死病毒感染,其他地方均有感染。
参考文献:
[1] 邱海洪,何欣怡,李明乾,等.家蚕微孢子虫感染BmN细胞的差异表达基因筛选及Akirin的原核表达[J].蚕业科学,2012,38(4):673-679.
[2] TANG K F J, PANTOJA C R, REDMAN R M,et al. Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei (EHP), a microsporidian parasite infecting penaeid shrimp[J].Journal of Invertebrate Pathology,2015,130:37-41.
[3] 叶键,许婷,施礼科,等.3种虾肝肠胞虫PCR检测
方法的应用比较分析[J].水产科学,2019,38(3):411-415.
[4] 程东远,邱亮,宋增磊,等.凡纳滨对虾感染虾肝肠胞虫的群体及组织间差异性分析[J].渔业科学进展,2018,39(4):83-92.
[5] 杨小娟,陈洁,魏春梅,等.两种分离纯化介质对虾肝肠胞虫孢子发芽率的影响[J].重庆师范大学学报(自然科学版),2020,37(3):46-53.
[6] 姚琳,白亮,吴亮其,等.微流控芯片技术在细胞生物学研究中的应用进展[J].中国细胞生物学学报,2011,33(11):1254-1266.
[7] 雷燕,肖洋,张会军,等.凡纳滨对虾肠道上皮细胞微胞子虫PCR检测方法的建立与应用[J].广东海洋大学学报,2016,36(4):50-54.
[8] TANGPRASITTIPAP A, SRISALA J, CHOUWDEE S,et al. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei [J].BMC Veterinary Research,2013,9:139.
[9] 劉丹,谢加玲,张孟雨,等.基于实时荧光环介导等温扩增技术同时检测副溶血弧菌与金黄色葡萄球菌[J].食品与发酵工业,2022,48(22):255-262.
[10] 姚延禄,曹宁,周新丽.基于环介导等温扩增的离心式微流控芯片检测3种致病菌[J].食品与发酵工业,2022,48(5):255-261.
[11] MORI Y, NOTOMI T. Loop-mediated isothermal amplification (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases [J]. Journal of Infection and Chemotherapy,2009,15(2):62-69.
[12] AFNAN UDA M N,HASHIM U,UDA M N A,et al.Design and fabrication of multichannel PDMS microfluidic[J].Journal of Physics,2021,2129(1):012048.
[13] 胡润林,王立新,任晓龙.基于核酸检测的微流控芯片设计与传热分析[J].微纳电子技术,2022,59(1):58-65.
[14] 许杰.2015—2017年天津市虾肝肠胞虫流行情况调查[J].中国动物检疫,2018,35(8):13-16.
[15] SHEN H,QIAO Y,WAN X H,et al. Prevalence of shrimp microsporidian parasite Enterocytozoon hepatopenaei in Jiangsu Province, China[J]. Aquaculture International,
2019,27(3):675-683.
(责任编辑:刘宁宁)
