大鼠睾丸支持细胞的分离鉴定及低氧对其增殖的影响
2023-06-05蔡朦朦杨习曼张芳秦琴
蔡朦朦,杨习曼,张芳,秦琴*
(1.山西医科大学 基础医学院 生物化学与分子生物学教研室,山西 太原 030001;2.山西医科大学 第五临床医学院,山西 太原 030001)
0 引言
Enrico Sertoli 在1865 年提出“支持细胞”(Sertoli cell,SC)的概念[1]。目前已获得多种永生化的支持细胞系,但这类细胞有着表型改变,对激素的反应不敏感,免疫特性分化等缺点;相比之下,原代支持细胞保留原物种的特性,是基础医学等领域研究的金标准[2]。Cameron 等[3]在20 世纪90 年代创立了大鼠睾丸原代支持细胞的分离培养方法,但有着操作繁琐,培养温度过高,支持细胞纯度低等明显缺陷。在此基础上,国内学者多采用两步酶消化法,37 ℃培养获取大鼠睾丸原代支持细胞[4-5],Bernardino 等[6]采用精细的机械分离和一系列酶消化提取支持细胞,该领域国内外学者普遍采用机械法和酶消化法分离大鼠睾丸支持细胞,但是都存在酶消化时间过度、间质细胞和成纤维细胞无法除尽以及细胞产量低等不足之处。
支持细胞在精子发生过程为生殖细胞提供营养支持、免疫保护、吞噬清除、血睾屏障功能等,被称为生精细胞的“保姆细胞”[7]。精索静脉曲张(varicocele,VC)、睾丸扭转、无精子症、高海拔缺氧等都会引起男性睾丸内供氧不足,损害睾丸细胞的功能、精子的数量和活力[8]。有报道在低氧诱导的动物模型中,睾丸内发生极度缺氧,支持细胞呈现脂滴改变和高度空泡化,与生殖细胞间隙连接被破坏,出现精子数量减少的现象[9-10]。Galardo 等[11]为探索缺氧诱导因子(HIF)是否参与大鼠支持细胞乳酸产生和促卵泡刺激素(FSH)滋养细胞功能,Hao 等[12]为研究缺氧对支持细胞增殖和 occludin 蛋白的表达,分别用氯化钴、梯度氧浓度体外刺激大鼠支持细胞建立了低氧支持细胞模型。本研究拟通过改良过往分离纯化原代支持细胞的方法,优化培养细节,以获取高纯度的原代支持细胞制备低氧支持细胞模型,模拟各种临床男性不育症导致的睾丸内的低氧状态,阐述男性生精障碍的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
18 d-22 d 的健康Sprague-Dawley(SD)雄性大鼠,由山西省人民医院动物中心提供。
1.1.2 主要试剂
DMEM/F12 培养基购自Hyclone 公司,胎牛血清购自美国Gibco 公司;胰酶、DNA 酶、I 型胶原酶、油红O、伊红染液购自北京索莱宝公司;鼠抗-Vimentin 抗体购自Santa Cruz 公司;CY3 羊抗小鼠IgG 二抗购自武汉博士德公司,兔抗-HIF-1α 抗体购自北京博奥森公司,兔抗-PCNA 抗体购自美国Proteintech 公司,羊抗兔IgG 二抗购自武汉爱博泰克公司。
1.1.3 主要仪器设备
CO2培养箱、三气培养箱购自德国美墨尔特公司;普通光学显微镜、荧光显微镜购置日本尼康公司;聚丙烯酰胺凝胶电泳(SDSPAGE)电泳仪/电转仪/半干转仪/凝胶成像分析仪器购自美国Bio-Rad 公司。
1.2 方法
1.2.1 原代支持细胞的分离与纯化
对解剖室进行紫外杀菌后,将SD 雄鼠颈椎脱臼处死,大鼠在体积分数75%酒精中浸泡10 min后取出,无菌器械取出睾丸,置于4 ℃ 预冷磷酸盐缓冲液(prechilled phosphate-buffered saline,PBS)中清洗两遍去除睾丸表面黏液,剪刀剥离睾丸白膜,用镊子机械去除细胞外基质;暴露睾丸实质后,去除其中夹杂的血管杂质,PBS 清洗两次后,用眼科剪将睾丸实质剪碎成约1 mm3的碎块,加入配置的甘氨酸溶液振荡混匀,静置10 min,待组织沉降后移除上清液,加入剩余组织液4 倍体积的体积分数0.25%胰酶(pH 7.4)溶液,37 ℃水浴消化15 min,加入含有体积分数10%胎牛血清的DMEM/F12 培养基(含有2.5 mmol/LL-谷氨酰胺,15 mmol/L HEPES,青霉素100 U/mL,链霉素100 U/ml)终止消化,反复轻轻吹打后,吸取上清液保存,随后将剩余沉淀加入质量分数0.022 5%Ⅰ型胶原酶和质量分数0.005% DNA 酶的混合液(pH 7.4)在37 ℃水浴消化10 min,终止消化后,反复吹打成团的细胞,用400 目过滤筛过滤两次酶消化后的细胞,将收获的细胞用37 ℃预热PBS 和培养基先后分别洗涤3 次,每次1000 r/min,离心5 min,结束后细胞重悬于完全培养基,以2×106/孔均匀铺在6 孔板中,置于35 ℃,体积分数5%CO2二氧化碳培养箱中培养至2 d 后,用20 mmol/L Tris-HCL(pH 7.4)溶液低渗处理去除精原细胞,待支持细胞完全贴壁且生长状态达到最佳,对其进行相应处理用于后续实验。
1.2.2 原代支持细胞的鉴定
1.2.2.1 免疫荧光检测Vimentin 蛋白
24 孔细胞培养板中放置用多聚赖氨酸包被的玻片,将提取的原代支持细胞以4×105/孔接种在培养板中,制作细胞爬片,经过纯化培养4 d 后,预冷PBS 洗涤2 遍,常温下用质量分数4% 多聚甲醛固定细胞30 min;之后用PBS洗涤3 遍,每次5 min,每个细胞爬片加500 μL体积分数0.1% TritonX-100,孵育20 min,PBS洗涤3 遍后,继续加入体积分数3%过氧化氢溶液孵育10 min;换用TBST 洗涤3 次后,用质量分数5% 牛血清白蛋白(5%BSA)封闭细胞1 h,随后加入含有质量分数1% BSA 的PBS 稀释的鼠抗-Vimentin 抗体(1∶100),4 ℃过夜后,细胞用PBS 洗涤三遍,滴加CY3 羊抗小鼠IgG 二抗,室温下在摇床上孵育1 h,PBS 洗涤3 次后,加入DAPI 染核15 min,PBS 洗涤后,在荧光显微镜下观察细胞内Vimentin 蛋白表达并拍照。
1.2.2.2 HE染色
原代支持细胞培养至4 d,质量分数4%多聚甲醛固定30 min,PBS 洗涤3 次,每次2 min,苏木素染细胞核10 min,蒸馏水洗3 次每次5 min,盐酸酒精分化数秒后,自来水洗返蓝,加入伊红染液染色5 min 后,自来水洗后,进行梯度酒精脱水,二甲苯洗涤2 次,每次2 min,最后用中性树胶封片。
1.2.2.3 油红O染色
原代支持细胞培养至 4 d,经质量分数4%多聚甲醛固定,4 ℃预冷的 PBS 洗涤后,油红O 染液在 37 ℃下染色 30 min,用 体积分数60%异丙醇分色至背景无色,PBS 洗3 次,苏木素染核10 min,自来水蓝化 10 min,蒸馏水洗后用质量分数10%甘油封片。
1.2.3 制备低氧支持细胞模型
1.2.3.1 实验分组
随机将处于生长对数期的原代SC 分为3 组,常氧组(对照组,N组)、低氧24 h组、低氧48 h组;N组细胞分别在体积分数21% O2、35 ℃二氧化碳箱继续培养至48 h,低氧24 h 组、低氧48 h 组在1%O2、35 ℃的三气培养箱中分别培养24 h和48 h。
1.2.3.2 免疫荧光检测支持细胞内HIF-1α的表达
3 组SC 经固定、抑制内源性过氧化物、破膜、封闭处理后,加入含1% BSA 兔抗-HIF-1α抗体(1∶100),4 ℃孵育过夜后,加入488-羊抗兔IgG 二抗,孵育1 h 后,洗涤,加入DAPI 染核,封片,荧光显微镜下观察每组细胞爬片HIF-1α 的表达情况,不同批次的SC 重复3 次以上实验。
1.2.3.3 western blot测定HIF-1α、PCNA蛋白
将培养好SC 加入含有蛋白酶抑制剂的裂解液(100∶1),冰上裂解20 min,12 000 r/min、离心15 min 提取SC 内蛋白;进行SDS-PAGE电泳,每孔上样量为50 μg,60 V~80 V 条件下蛋白条带泳至电泳槽底部,将凝胶中的目的蛋白和内参蛋白转移至硝酸纤维素膜,质量分数5%脱脂牛奶封闭1 h,分别加入兔抗-HIF-1α抗体(1∶1000)、兔抗-PCNA 抗体(1∶2000)、HRP 标记的β-actin 抗 体(1∶5000),4 ℃孵育过夜。TBST 洗涤后,加入HRP 标记的羊抗兔IgG 多克隆抗体(1∶8000),室温孵育1 h,TBST 再次洗涤3 次。用凝胶成像分析仪进行条带显影和拍照,Image J 软件分析条带灰度值。计算HIF-1α、PCNA 的平均光密度比值:HIF-1α、PCNA(目的蛋白)光密度值/β-actin(内参蛋白)光密度值。分析3 组蛋白表达差异性,不同批次的SC 重复3 次以上的实验。
1.3 统计学处理
采用统计软件SPSS 22.0 处理数据。各组蛋白表达灰度值以xˉ±S表示,单因素方差分析及LSD 用于组间比较,P<0.05 表示差异有统计学意义。
2 实验结果
2.1 原代支持细胞的形态和特征鉴定
2.1.1 大鼠睾丸原代支持细胞的形态和生长特点
初步提取的支持细胞是体积较小的圆点,呈现较强的折光性,培养2 d 后支持细胞呈梭形,伸出一个或多个突触,几乎完全贴壁,经Tris-HCl 低渗处理后可除去漂浮的生精细胞,培养至第3-4 d,胞体变大呈椭圆形,胞核明显,胞质内出现圆形发亮的脂滴,细胞间互相连接呈网状结构;细胞培养至一周时,整个胞体拉伸变长变大,细胞间连接成单层片状,此后细胞生长速度变慢;传代后支持细胞几乎停止增殖,生长缓慢,显微镜下观察细胞状态不佳,支持细胞的体外生长周期为2 周左右(图1)。

图1 原代支持细胞培养及形态学观察(a)刚提取的原代支持细胞;(b)培养2 d的原代支持细胞;(c)培养3 d的原代支持细胞;(d)培养4 d的原代支持细胞;(e)培养7 d的原代支持细胞;(f)第一代支持细胞(Bar=100 μm)Fig.1 Culture and morphological observation of primary Sertoli cells(a) Freshly extracted primary Sertoli cells; (b) Primary Sertoli cells cultured for 2 days; (c) Primary Sertoli cells cultured for 3 days;(d) Primary Sertoli cells cultured for 4 days; (e) Primary Sertoli cells cultured for 7 days;(f) Sertoli cells of the first generation (Bar=100 μm)
2.1.2 支持细胞内Vimentin蛋白的表达
Vimentin 是支持细胞的特异性结构标志[13],荧光显微镜下细胞胞质内发出明亮的红色荧光,红色荧光几乎布满整个胞质,包裹着圆形或椭圆型的胞核,表示细胞内含有Vimentin 蛋白与Vimentin 抗体发生了特异性结合,即红色荧光的细胞为SC;非特异性DAPI 染色的胞核发出蓝色荧光,代表了全部细胞总数;镜下随机选取15 个不同视野下的支持细胞,每个视野下随机计数200 个细胞,SC 的纯度= Vimentin 阳性细胞/细胞总数×100%,支持细胞纯度约为99.43%(图2)。

图2 Vimentin免疫荧光鉴定睾丸原代支持细胞(a)细胞质中Vimentin阳性表达;(b)细胞核DAPI染色;(c)a与b叠加图片(Bar=50 μm)Fig.2 Vimentin immunofluorescence identification of primary Sertoli cells in testis(a) Vimentin positive expression in the cytoplasm; (b) DAPI staining of the nucleus;(c) superimposed pictures of a and b (Bar=50 μm)
2.1.3 HE染色和油红O染色的支持细胞
HE 染色下的SC 细胞整个胞体呈梭形或不规则状,有一个或多个粗大突起,胞质丰富呈淡红色;油红O 染色下的SC,胞体不规则,细胞内出现大小不一的红色圆形脂滴,胞核呈现圆形或椭圆形淡紫色(图3)。
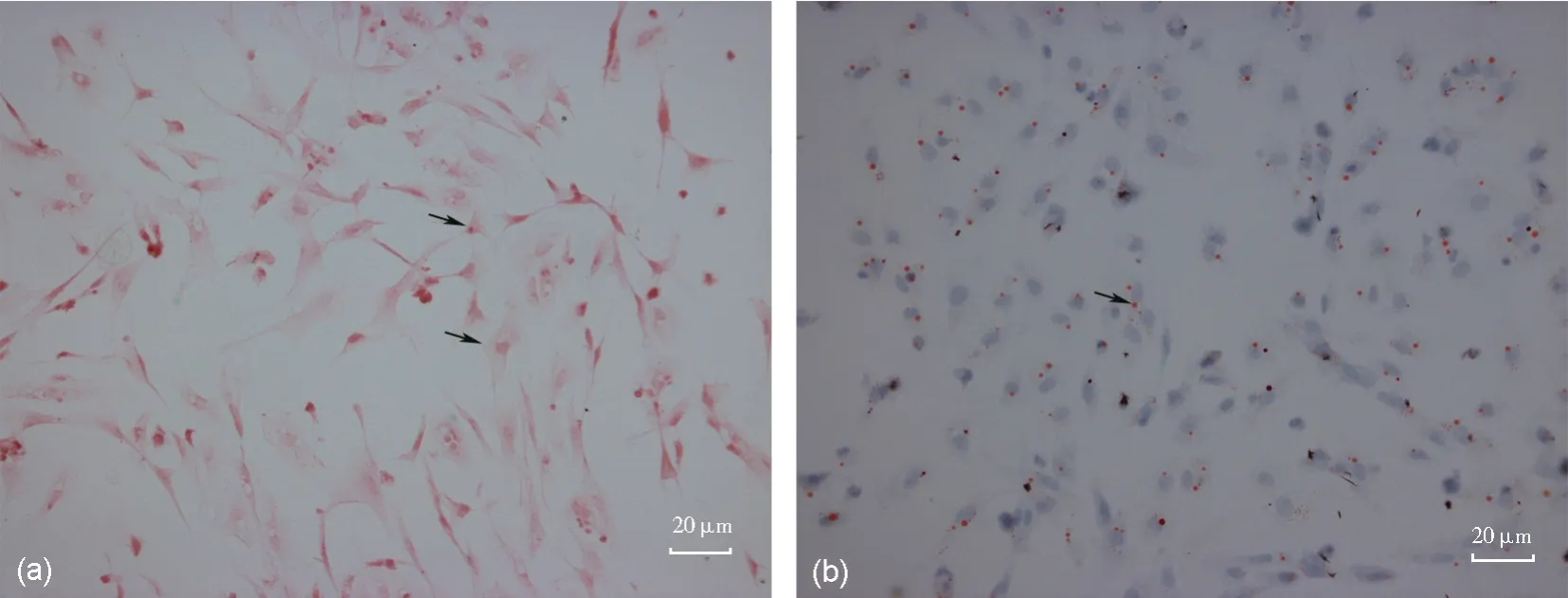
图3 原代支持细胞的HE染色、油红O染色(a)HE染色,“↑”所指为原代支持细胞(200×);(b)油红O染色,“↑”所指为原代支持细胞中的红色脂滴(Bar=20 μm)Fig.3 HE staining and oil red O staining of primary Sertoli cells(a) "↑" points at primary Sertoli cells (200×); (b) "↑" points at the red lipid droplets in the primary Sertoli cells (Bar=20 μm)
2.2 低氧对支持细胞生长和增殖的影响
2.2.1 体积分数1%O2培养的支持细胞生长状态
低氧培养的SC 胞质内颗粒物质增多、胞体回缩、间隙增大、SC 有明显的空泡、生长状态不佳,随着缺氧时间的延长,SC 死亡明显增多(图4)。
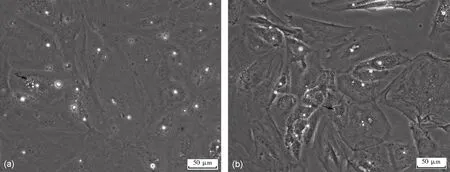
图4 低氧培养24 h、48 h的原代支持细胞(a)低氧培养24 h的原代支持细胞;(b)低氧培养48 h的支持细胞;“↑”所指为支持细胞内的空泡(Bar=50 μm)Fig.4 Primary Sertoli cells cultured in hypoxia for 24 h and 48 h(a) Primary Sertoli cells under 24-hour hypoxia;(b) Primary Sertoli cells under 48 h hypoxia; "↑" refers to vacuoles in Sertoli cells (Bar=50 μm)
2.2.2 低氧下原代支持细胞HIF-1α 和PCNA 的表达
免疫荧光结果显示,常氧时 HIF-1α 在SC胞质中表达。低氧处理24 h 后,部分HIF-1α进入细胞核,48 h 大量HIF-1α 进入细胞核(图5)。western blot 的结果显示,与常氧组相比,低氧24 h 组[(1.30±0.17)vs(0.54±0.17),P<0.05)]和低氧48 h 组[(1.09±0.17)vs(0.54±0.17),P<0.05)]的HIF-1α 表达水平显著升高;PCNA 蛋白在低氧24 h 组[(0.47±0.08vs0.75±0.08,P<0.05)]和低氧48 h 组[(0.23±0.08)vs(0.75±0.08),P<0.05)]随着低氧时间的延长而显著性降低,而低氧24 h组和低氧48 h 组,HIF-1α、PCNA 表达量均无显著性差异(P>0.05)(图6)。
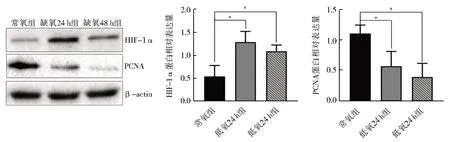
图6 低氧对支持细胞HIF-1α和PCNA蛋白表达的影响Fig.6 Effects of hypoxia on the expression of HIF-1α and PCNA proteins in primary Sertoli cells
3 讨论
国内外学者常用胰酶和胶原酶两步法结合39 ℃或37 ℃的热应激原理诱导生精细胞凋亡法分离纯化大鼠睾丸SC[14-15],但仍存在实验时间长、损伤支持细胞等缺点。在以往研究基础上,我们总结了提高SC 提取效率的关键点:(1)动物选择:出生18-22 d 处于青春前期大鼠,此期大鼠睾丸支持细胞丰富且增殖力较强,生精细胞数量相比于成熟期少,污染率低,睾丸还未下沉到阴囊部位,支持细胞更容易分离纯化[6]。(2)消化过程:生精小管被剪碎后加入甘氨酸溶液随重力下沉,能够更好地释放消除睾丸间质细胞;胰酶消化后保留上清液,目的是防止分离的SC 二次消化过度,提高了SC 产量;二次酶消化过程中,在I 型胶原酶中加入了DNA 酶,相比于大多数学者使用单一的IV 型胶原酶,二次消化酶混合液浓度较低,对细胞的损伤小,同时加快了第一步酶消化形成的黏液团状生精小管分解成单个支持细胞的速率,提高了消化效率。(3)培养温度:人类睾丸内精子发生的最适温度要低于体温的2 ℃~8 ℃[16],如果睾丸温度长期过高,可能引起睾丸内稳态失衡,导致少、弱精子症等男性不育症[17-18]。培养温度过高会损伤支持细胞的结构和功能,我们将分离的SC 培养在35 ℃培养箱中,利用支持细胞贴壁迅速特性,定时低渗处理后换液可有效去除生精细胞。(4)特征鉴定:波形纤维蛋白(Vimentin,一种III 型中间纤维),是支持细胞骨架的主要蛋白成分,影响精子发生[19]。在对支持细胞的鉴定中,通过检测Vimentin 表达、HE 染色、油红 O 染色共同对支持细胞进行鉴定及纯度测定[20-21],分离出的支持细胞纯度较高。表明我们成功分离培养出高纯度的大鼠睾丸SC,为后续的体外实验奠定了基础。
HIF-1α 是目前发现在缺氧状态下可发挥活性的核转录因子,是HIF-1 的活性亚基。缺氧时,HIF-1α 蛋白降解受阻,表达位置从胞浆转移到细胞核,与HIF-1β 结合成为有活性的HIF-1,激活下游基因[22]。据报道,睾丸缺氧是VC 导致男性不育的可能机制,HIF-1α 在VC 大鼠模型睾丸内高表达,激活下游细胞凋亡相关信号通路如Caspase-3/Bcl-2/Bax 的表达,促进了睾丸细胞的凋亡[23]。SC 在青春期停止增殖,最终数量决定了生精细胞的生精能力和成熟期睾丸大小,维持睾丸正常生精[7]。文献表明各种因素诱导下的大鼠睾丸内极度缺氧,造成与精子发生密切的支持细胞数量减少、功能和结构的损坏,导致生精障碍[24]。PCNA 是细胞增殖的阳性标记物,在哺乳动物DNA 复制与修复,细胞增殖分化周期进程中起重要作用[25]。大量研究表明,细胞增殖与氧气浓度密切相关,重度缺氧会造成细胞内线粒体和内质网结构紊乱,抑制细胞增殖[26],HIF-1α 可以通过扰乱细胞周期过程抑制细胞增殖[27]。本研究发现低氧诱导的SC 内出现大量的空泡,细胞结构被破坏,HIF-1α 在严重缺氧环境中大量移位至SC 胞核中,PCNA 蛋白在低氧支持细胞中表达显著降低。表明严重低氧可能通过激活HIF-1α 转录活性启动或促进细胞凋亡、自噬信号以及直接扰乱细胞周期,进而影响大鼠睾丸内SC 的增殖能力。
4 结论
本次实验观察到原代SC 培养至3-4 d 时,形态较为典型,适合各种形态学观察实验;培养至3-7 d 阶段,增殖能力强,生长速度快,纯度较高;而传代后的SC 生长状态欠佳。免疫荧光法鉴定支持细胞内Vimentin 蛋白表达、HE染色观察到支持细胞形态,油红O 染色呈现了支持细胞内脂滴,共同快速准确地鉴定出支持细胞及其纯度,是有效鉴定睾丸支持细胞的手段。在实验中利用第一代处于生长对数期的支持细胞,成功建立了体外低氧支持细胞模型,并且观察到低氧对SC 增殖的抑制,因此低氧诱导原代SC 作为研究低氧致男性不育机制的体外细胞模型可能较为合适。
