青枯病发生的土壤影响因素及防治措施研究进展
2023-06-04李海鹏曹启民黄月华孙晓东孙楚涵
李海鹏 曹启民 黄月华 孙晓东 孙楚涵
摘要:青枯雷尔氏菌(Ralstonia solanacearum)侵染植物所引起的青枯病是對全球农作生产活动危害最为严重的土传病害之一,青枯病对农作物危害极大,影响深远;青枯雷尔氏菌在土壤中存活时间长,可以在植物根系中定殖,通过阻断植物维管系统水分运输致使植株枯萎,其对世界农业造成的威胁无法忽视。国内外对青枯雷尔氏菌及青枯病的研究重点集中在土壤对青枯病发生的影响以及青枯病的防控措施,本文将青枯病发生受土壤影响的因素进行系统的梳理,土壤矿质营养物质、理化特性、根系分泌物、微生物多样性及酶活性是对青枯雷尔氏菌侵染植物(作物)有重大影响的关键因素;本文同时也结合土壤影响青枯病发生的因素阐述了国内外对青枯病的防控措施,主要包括农业防治、化学防治与生物防治;在可持续农业发展进程中,可再生的生物炭被广泛用于土壤改良材料,笔者对近年国内外生物炭防治青枯病的相关研究进行整理,大量研究表明,生物炭能够对青枯病起到较理想的防控效果。目前,土壤对青枯病的防御还需要营养元素、植物激素、微生物菌剂等外源干扰,但时至今日青枯病仍长期威胁着农业生产活动。笔者展望了未来土壤与青枯雷尔氏菌互作、青枯病的研究与发展方向,也为科学防控植物(作物)青枯病并建立相关理论体系与策略方针提供一定参考。
关键词:青枯雷尔氏菌;青枯病;影响因素;防控措施;生物炭
中图分类号:S182 文献标志码:A 文章编号:1002-1302(2023)09-0025-09
基金项目:海南省省属科研院所技术创新专项(编号:Jscx202005)。
作者简介:李海鹏(1996—),男,四川成都人,硕士研究生,主要从事土传病害防控研究。E-mail:2417289841@qq.com。
通信作者:曹启民,博士,研究员,主要从事农业土壤面源污染物迁移变化研究,E-mail: 271093491@qq.com;黄月华,博士,副教授,主要从事环境微生物与自然界物质元素循环研究,E-mail:sunflower-001@163.com。
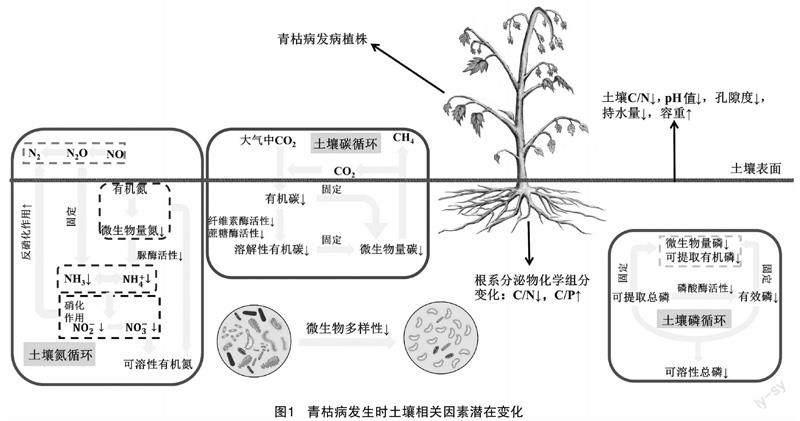
青枯雷尔氏菌(Ralstonia solanacearum)是一种革兰氏阴性的植物致病菌[1],因其侵染植株所引起的青枯病是目前为止对世界各地农作生产活动危害最为严重的土传病害之一。青枯病这类细菌性病害对农作物影响广泛、宿主众多,已有超过50科属下200多种植物遭受过青枯雷尔氏菌的侵染,而青枯病也是茄科作物(辣椒、番茄、茄子等)易发的主要病害之一[2-3]。青枯病在我国除澳门、西藏、内蒙古外的31个省级行政区均有报道,其中南方地区面临青枯病肆虐情况较其他地区更为严峻[4]。青枯雷尔氏菌在土壤中生存能力极强,有报道显示,在15、28 ℃ 环境温度下,青枯菌在土壤中存活时间至少可以达到5个月以上[5];青枯雷尔氏菌以土壤作为介质侵染植株根系,利用根系伤口、根尖、次生根等部位进行定殖,经过一定时间的渗透,到达植株维管系统,在植物木质部内侧大量繁殖,并分泌大量胞外多糖,使得植株内部水分运输受阻,最终导致植株枯萎死亡[6-7]。作为全球十大植物致病菌之一[8],青枯雷尔氏菌对我国乃至全世界的农业生产活动都构成了持续且无法忽视的困扰,制定降低和消除青枯雷尔氏菌对农作物的影响与危害的针对性方案迫在眉捷。大量研究表明,青枯病这类土传病害的发生与土壤的理化、生物特性关系十分紧密,包括土壤酶活性、酸碱度、营养元素、根系分泌物、土壤微生物多样性等影响因素[9-16],病原菌会由于这些关键性指标在一定环境条件下发生的骤变表现出致病特征从而对寄主植物进行侵染(图1)。前人已有对青枯雷尔氏菌在土壤存活影响因素及防治方法分别进行了较为系统的分析[17-18],却并未将二者结合再进行针对性分析,笔者从作物发生青枯病受土壤影响因素与对其防治策略2个方面来探讨总结,以期明晰青枯雷尔氏菌传播与土壤理化、生物特性之间的联系,并为防治青枯雷尔氏菌传播所导致的作物细菌枯萎病提供相关理论体系与技术支撑。
1 土壤相关因子对青枯病发生的影响
1.1 土壤矿质营养物质
土壤为植物生长提供大量的营养物质,植物体内的营养水平与青枯雷尔氏菌对其的侵染情况联系紧密。尤其是土壤养分元素对土壤中青枯雷尔氏菌的侵染以及植物对其的防御体系有着深远的影响。碳、氮是土壤必不可少的元素,大量研究表明,碳氮比(C/N)会显著影响土壤环境[19-20]。土壤中有机碳的比例决定着土壤肥力与植物抗病能力[21-22],相关研究表明,C/N(范围:C/N<22)与植株疾病指数呈负相关关系[23];而氮素既是植物生长所需的关键营养元素,也是病原菌的能量来源;青枯雷尔氏菌对氮素的利用率以及植物所处土壤环境氮素供给能力决定了植物的抗病水平[24]。高升升研究发现,氮素水平的升高反而会促进烟草青枯病的发生[14];Wang等通过对比施加一定量氮肥和未施加氮肥芝麻植株,发现未施加氮肥的植株发病率更高[25];植株吸收的土壤中磷、钾元素也在一定程度上巩固了作物应对病原菌入侵的防御机制,土壤氮磷比值(N/P)<5时,也与植株疾病指数呈负相关关系[23,26]。植物根系通过吸收土壤中硅、镁、锰、钙、铁元素均可以对青枯病起到预防和降低感染概率的作用[27],其中过氧化钙在铁多酚的催化下可以抑制土壤中青枯雷尔氏菌的增长,降低青枯病发生概率[28];铁元素可诱导青枯雷尔氏菌发生非致病表型转换(PC)[13]。郑世燕研究发现,钼元素对植物青枯病田间控病率最高可达到62.23%[29];高于400 mg/L的铝离子溶液对青枯雷尔氏菌的生长有较为显著的抑制作用,而酸性土壤环境下,100~300 mg/kg的铝离子溶液则会加速青枯病发生的进程[30]。
1.2 土壤理化特性
土壤理化特性变化对土壤中青枯雷尔氏菌存活、植株青枯病发生的影响不可忽视。土壤pH值、孔隙度、温度、湿度等非生物因子会随着环境气候及当地植物资源的变化发生剧烈或微弱的改变,对病原菌构成非生物胁迫,此时病原菌的自我保护机制的启动将会削弱其毒力[31]。如青枯菌在冬季温度较低时,会自动转化为存活但不可培养状态(VBNC)[32];在环境温度为21.1 ℃,土壤湿度达到58.5%,维持16 d以上,田间植株便会出现青枯病症状[33];酸性土壤(pH值范围:4.5~5.5)中营养成分流失严重,青枯雷尔氏菌在这种环境下生长更迅速,而有益菌群则难以生存[12,34]。土壤低孔隙度不利于土壤微生物菌落生长[35],Mi等研究发现,土壤孔隙度、持水量的提升以及容重的下降能够改善土壤微生物群落结构多样性,间接增强作物对病原菌的抗性,减轻作物受土传病害的影响[36]。作物青枯病的发生还与土壤电导率、颗粒粒径有潜在的联系,但其具体与青枯雷尔氏菌的互作机制与程度还需要进一步的探索与研究。
1.3 根系分泌物
自然界中植物根系向周围介质释放的不同化合物被称为根系分泌物。根系分泌物中有的是植物抵御青枯病防线的重要组成,而还有部分则是青枯雷尔氏菌侵染植株的“援兵”[37-38],这与根系分泌物的物质组成及特异成分有关。如嫁接辣椒根系分泌物中的邻苯二甲酸二异辛酯(DIOP)和二苯并呋喃(DBF)能够抑制青枯雷尔氏菌的生长从而降低青枯病的发病率[39];谷益安通过温室盆栽试验发现,番茄根系分泌物中咖啡酸对青枯雷尔氏菌有明显抑制作用,当咖啡酸浓度达到80 μmol/L时,对青枯雷尔氏菌的抑制率最高[40]。根系分泌物也可以通过诱导土壤有益菌群对青枯雷尔氏菌产生抑制作用。Tian等通过超高效液相串联质谱仪(UPLC-MS/MS)分析得出,根际分泌物赖氨酸含量升高、水杨酸含量降低后的土壤-根际微环境便不适宜青枯雷尔氏菌生存[41];烟草根系分泌物中较低浓度的酚酸物质苯甲酸(≤2 μg/L)与苯丙酸(≤3 μg/L)均能够促进青枯雷尔氏菌与拮抗菌短短芽孢杆菌(Brevibacillus brevis)的生长,但2种酚酸分泌量升高后,拮抗菌相比青枯雷尔氏菌受到酚酸的抑制作用更显著,所以青枯雷尔氏菌比拮抗菌适应高浓度酚酸类根系分泌物环境更快,这解释了烟草连作容易引起青枯病发生的现象[42];根系分泌物化学组分中碳氮比的增加有助于土壤固碳,促进土壤呼吸,提升植株对土传病害的抗病力[43]。而根系分泌物化学组分碳磷比(C/P)越高,青枯雷尔氏菌存活率也会升高[44]。此外,土壤微生物群落虽然对根系分泌物中氨基酸利用率很高,但土壤环境氨基酸浓度上调也会导致土壤pH值降低,土壤溶解性有机碳(DOC)释放[45],为青枯雷尔氏菌入侵植株制造了契机。
1.4 土壤微生物
土壤微生物多样性在植物-土壤生态系统中扮演着举足轻重的角色,土壤微生物群落组成与多样性是衡量土壤环境质量的重要指标。青枯雷尔氏菌侵入土壤后,土壤微生物多样性也将发生显著变化。健康土壤与烟草青枯病感病土壤间的生化差异为:健康土壤中有益微生物(Bradyrhizobium、Nocardioides、 Micromonospora)相对丰度也高于感病土壤[46];桑树青枯病根际土壤真菌(Mortierellomycota)、细菌(Acidobacteriota、Actinobacteriota、Verrucomicrobiota、Latescibacterota)相对丰度均低于健康土壤,尤其是Acidobacteriota、Actinobacteriota与抗病能力相关微生物在健康根际土壤中相对丰度比染病植株根际土壤分别高5.92%、3.71%[47];番茄青枯病发病高峰期,土壤中Gemmatimonas、Chujaibacter、norank_f_Chitinophagaceae和Ralstonia相对丰度明显升高,norank_o_Vicinamibacterales、norank_f_Vicinamibacteraceae、Bacillus和 Burkholderia-Caballeronia-Paraburkholderia明显降低[48]。土壤有益微生物能够直接或间接地改善土壤理化性质、维持土壤质量和肥力[23],相关研究证明,有益微生物群落如谷氨酸棒状杆菌(Corynebacterium glutamicum)降解同化芳香族化合物的功能,Microvirga的固氮作用以及多噬伯克霍尔德氏菌(Burkholderia multivorans)对磷酸盐的降解功能促进了土壤养分循环,提升土壤品质,间接降低了包含青枯病在内的土传病害发生的风险[49-51];而当土壤中青枯雷尔氏菌相对丰度升高时,Noviherbaspirillum、Reyranella和Thermus的相对丰度也随之上升,而这3种菌属在土壤氮循环中均起到反硝化作用,使土壤中氮素流失[52]。
1.5 土壤酶
土壤酶是土壤環境变化的关键指标,反映了土壤生化变化过程的方向和强度,影响着土壤的理化性质、肥力;土壤蔗糖酶、纤维素酶高度参与碳代谢进程,土壤脲酶与土壤生态系统氮循环相关,土壤磷酸酶除了促进磷循环外还能作为预测土传病害的指征,而土壤中可利用碳、氮的增加同时促进磷酸酶活性的提高[53-57]。健康土壤的土壤脲酶、过氧化氢酶、转化酶明显高于烟草青枯病感病土壤[46],桑树染病植株根际土壤中β-葡萄糖苷酶、磷酸二脂酶活性较健康土壤显著降低[47],李得铭向已施加微生物复合肥(含Bacillus、Trichoderma)的番茄植株土壤与未施肥番茄植株土壤接种青枯雷尔氏菌后发现,施肥土壤中脲酶、磷酸酶、过氧化氢酶活性远高于未施肥植株土壤,且已施肥植株发病率低于未施肥土壤[58];Chen等研究发现,脲酶及土壤营养物质的提升可以降低烟草青枯病的发病率,其中缘由是土壤肥力的增强促进了植物和根系的生长发育,保证了土壤自身生产力的可持续性[52]。
2 青枯病防治措施
长期以来,集约化农业迅速发展,在单一连作的栽培方式以及气候变暖的环境条件下,植物受青枯病威胁的风险逐步增高[4,59],土传病害的防控涉及植物病理学、土壤学、农学、微生物学等多学科领域,各领域学者对作用于青枯病的防控机制进行了深入研究。值得一提的是,“土壤免疫”被提出后,科研工作者揭示了土壤免疫机制的部分环节[60],可就青枯病而言,还没有系统完整的土壤免疫机制报道。据现有研究来看,仍需要强有力的特定外部干扰[61],前文提到的矿质元素,微生物以及部分根系分泌物(植物激素)等物质来创造激发土壤免疫应答响应的环境[2 46, 62]。目前,对于植物青枯病较为成熟的防治措施主要基于消灭病原菌、阻断传播、侵入及提升寄主抗病性3个方面实施,包括农业防治、化学防治、生物防治3类[15,63-65]。由于农业环境与经济的矛盾仍旧存在,当前全球生态承载能力接近阈值,人类对绿色发展的追求愈加强烈[66]。近年来,包括生物炭在内的环境友好型防治措施逐渐成为青枯病防治研究的热点。
2.1 常用防治措施
2.1.1 农业防治 轮作是农业生产中常见的种植方法[67]。如将茄科作物与非茄科作物进行3~4年的轮作,前作以韭菜、大葱为主,后作以禾本科、十字花科为主;这样的轮作方式可以有效改善土壤生态环境与非毛管孔隙[68],但由于作物轮作的供应有限,这种防治方法受到病原体宿主范围的限制[69]。嫁接同样能提高作物对青枯病的抗病力:砧木品种夏威夷7996是经典的抗性遗传研究的经典抗原[70]。将其用于嫁接培育,番茄青枯病发病率下降97.3%,增产超过100%[64];赵文宗接种青枯雷尔氏菌到砧穗嫁接植株与砧木自根嫁接植株中,青枯病发病率均低于15%[71]。在新农业发展背景下,通过生物技术工具开发稳定的抗青枯病的植物(作物)是当下主流农业防治措施,主要通过体细胞杂交、标记辅助育种、转录组学、遗传转化和基因沉默等技术实现[72]。而对夏威夷7996番茄品种就使用的全基因组转录组学技术,使根介导对茄科植物的抗性,从而导致防御基因的激活和生长素途径的转变[73]。
2.1.2 化学防治 化学防治在我国一直是对作物青枯病的重要防治技术。化学防治具有直接、快速、高效的特点。如质量浓度为1 g/L的3, 4, 5-三羟基苯甲酸甲酯(MG)溶液和当前农业生产活动普及的20%噻菌铜悬浮剂对番茄青枯病的防效都在60%以上[74],相关研究表明,青枯雷尔氏菌细胞壁会遭到MG的破坏,细胞糖酵解-三羧酸(TCA)循环被抑制[75],从而无法入侵植物(作物);土壤熏蒸也是一种防控效果较好的化学防治措施,早期普遍使用溴甲烷(MB)作为土壤熏蒸剂,MB对土壤熏蒸效果可以达到72%~100%[76],但在2018年,我国已禁止将MB用于农业生产。棉隆(DZ)是一种较为环保的土壤熏蒸剂,施加80 g/m2 DZ至生姜种植区后,青枯病发病率仅为3.1%(未施加熏蒸剂处理组为100%)[77],但其灭杀病原菌的具体机制还未有深入探究。值得一提的是,诸如二甲基二硫醚(DMDS)、1, 3-二氯丙烯(1, 3-D)等土壤熏蒸剂因为环境毒性等级过高被禁用,目前仅有三氯硝基甲烷(Pic)是我国唯一注册登记的生姜土壤熏蒸剂[78-79]。综上所述,化学药剂虽然对青枯病都有一定抑制效果,但是作用也是有限的,如MG诱导番茄产生的抑菌物质如香叶醇、豆甾醇等含量过低导致青枯病在施药后再次暴发[80];而DZ、Pic等土壤熏蒸剂除作用于病原菌外也会消杀掉大量非目标微生物,损害土壤生态系统[81]。
2.1.3 生物防治 青枯病生物防治具体分为功能微生物通过供给根际-土壤营养、分泌拮抗化学因子、诱导植株抗性及同病原菌竞争营养源等方式来抑制、消灭植物病原菌以防控青枯病大范围传播[82]。将掺加绿脓杆菌(Pseudomonas aeruginosa) NXHG29的生物有机肥与种植烟草的土壤混合,使土壤中含有1×108 CFU/g绿脓杆菌NXHG29,再接种青枯雷尔氏菌,最终发现经绿脓杆菌NXHG29处理的烟草植株发病率最高为34.37%(对照组发病率为43.05%)[83];另外土壤中的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)能产生抗菌物质直接作用于病原菌,阻滞青枯病的传播[84],Li等研究发现,菌株B. amyloliquefaciens SQRT3能够诱导番茄系统抗性(ISR)作为植株潜在的抑病机制之一,用该菌株菌悬液浸根后,番茄对青枯病生防效果达到84.1%[85];而B. amyloliquefaciens与枯草芽孢杆菌(B. subtilis)共同作用于青枯雷尔氏菌,相比于对照组(未施用微生物菌剂)将青枯雷尔氏菌数量降低近1 000倍[86];Zheng等利用无毒的青枯雷尔氏菌(aRS)与一种微生物修复基质(MRS,成分:33%咖啡粉、33%椰壳、34%秸秆)混合后加入到种植番茄土壤中,发现aRS+MRS处理的番茄植株比未处理植株的疾病指数约降低88.89%[87]。此外沃氏葡萄球菌(Staphylococcus warneri)、哈茨木霉(Trichoderma harzianum)、灰锈赤链霉菌(Streptomyces griseorubiginosus)也被证实对青枯雷尔氏菌有拮抗作用[88-90]。从环境友好角度来说,上述微生物菌剂是化学农药的第一替代品,其既具有专一性、低毒性,又能保障农业可持续发展、提高农业生产活动效率与质量[68],但许多微生物菌剂仅能起到预防作用,对已发生土传病害的植物(作物)效果甚微[91],而且实际农业生产过程中为使生防菌株快速定殖于土壤,一般是将其与肥料混合后再施入土壤。前文提到的B. subtilis与B. amyloliquefaciens需要与液体生物肥料一并施用于作物;Boonraeng等也是将MRS作为基质与aRS混合[86-87]。因此,生物防治方法目前仍无法做到即插即用,所以研究防效持久的青枯病微生物菌剂仍是一个待解的难题[3]。
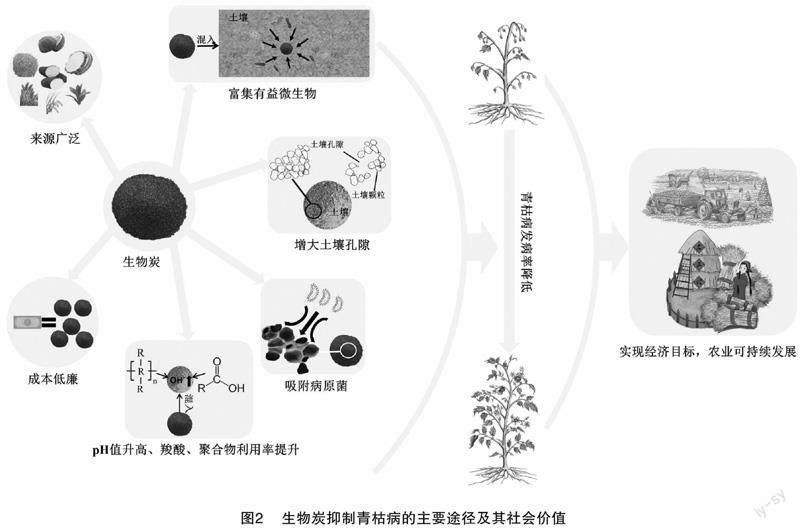
2.2 生物炭防治
为保证全球尺度下生产活动的品质、衍生品数量提高的同时,环境质量也得以改善;生物炭逐渐成为实现经济目标、满足生产力、可持续发展的辅助工具[92]。生物炭是生物质在完全或部分缺氧的条件下经热解、烘烤或气化得到的一种稳定、高度芳香化的固体木炭类材料[93-94]。在诸多报道中,生物炭兼具农业防治与化学防治的双重功效,其通过自身特性可以提高土壤有机质含量与养分利用率,同时能够使土壤比表面积扩大,吸附能力、保水保肥能力进一步增强[95-96],尤其是吸附能力,生物炭可以吸附植株根际的青枯雷尔氏菌从而减少其在根际的定殖数量[40];相关研究表明,生物炭可以改善土壤理化性質及微生物群落结构。Zhu等将秸秆生物炭添加到熏蒸后土壤中60 d后发现土壤细菌总数恢复到熏蒸前水平[97];Gao等将生物炭与土壤按1 ∶ 50(质量比)混合,再接种青枯雷尔氏菌1×108 CFU/mL 到土壤与植株根系,7 d后,发病程度远低于CK(土壤未混入生物炭),Flavisolibactor、Ohtaekwangia、Proteobacteria、Bacteroidetes、Nitrospirae、Gemmatimonadetes等微生物的相对丰度高于CK,这与Cao等的研究结果[10,52]类似;Medeiros分别用以木薯皮、豆秸秆、甘蔗秸秆、玉米秸秆为原材料的生物炭与沙土混合后,种植番茄后接种青枯病病菌,发现4种生物炭对青枯病均有抑制作用,其中豆秸秆与玉米秸秆生物碳处理土壤青枯病发病率最低,青枯雷尔氏菌的活性也显著下降[98]。相关研究表明,生物炭还可以改善土壤酸碱度与土壤中聚合物、羧酸的资源利用率促进土壤有益菌群的生长以防控青枯病[99-100]。综上所述,生物炭不仅具有成本低廉,来源广泛的优点[94],而且生物炭可以调节根际微生物群落结构,富集有益微生物,促进土壤微生态健康发展,同时减少青枯病的发病率(图2)[52,101-102]。
3 結论与展望
青枯病是全球集约化农业发展下的巨大隐患。明晰青枯病这类土传病害的防治措施(农业防治、化学防治、生物防治)与土壤相关因素(土壤矿质元素、理化特性、根系分泌物、酶活及微生物多样性)对青枯雷尔氏菌侵染的影响,对构建防控青枯病的理论体系与策略方针具有实际意义。在可持续农业发展进程中,可再生的生物炭也被广泛用于土壤改良,其对青枯病的防效也与土壤质地(类型)、原材料和植物(作物)紧密相关;土壤免疫则是近年来提出的新概念,响应机制由土壤-根际微生态环境发出的信号启动,然而关于青枯病的土壤免疫机制与途径还未有相关报道。在当前全球变暖的气候条件下,防治作物病害,保障作物健康是保证农业可持续发展的前提,未来需要不同学科交叉融合,
结合植物、土壤、微生物的相互作用去统筹规划科学防治青枯病的方案:(1)探明全球变化(气温、人口活动)下,青枯病对当前农业生产影响的变化,研究对于青枯病最适宜的防控措施;(2)探明青枯病的土壤免疫机制,并研究在没有外源干扰下,植株根际-土壤微生态环境受病原菌侵袭后的最大承载力;研究土壤多因素互作下增强土壤-根际免疫的途径;(3)探讨包括生物炭在内的土壤改良材料防控不同植物青枯病的适宜施用量的阈值,在理论研究的基础上,也需要综合考虑实际防控中环境条件的变化,明确土壤改良材料对植物(作物)施用量的“最优解”。
参考文献:
[1]Grey B E,Steck T R. The viable but nonculturable state of Ralstonia solanacearum may be involved in long-term survival and plant infection[J]. Applied and Environmental Microbiology,2001,67(9):3866-3872.
[2]Genin S,Denny T P. Pathogenomics of the Ralstonia solanacearum species complex[J]. Annual Review of Phytopathology,2012,50:67-89.
[3]Mamphogoro T P,Babalola O O,Aiyegoro O A. Sustainable management strategies for bacterial wilt of sweet peppers (Capsicum annuum) and other Solanaceous crops[J]. Journal of Applied Microbiology,2020,129(3):496-508.
[4]Jiang G, Wei Z, Xu J, et al. Bacterial wilt in China: history, current status, and future perspectives[J]. Frontiers in Plant Science,2017,8:1549.
[5]Messiha N A S,van Bruggen A H C,Franz E,et al. Effects of soil type,management type and soil amendments on the survival of the potato brown rot bacterium Ralstonia solanacearum[J]. Applied Soil Ecology,2009,43(2/3):206-215.
[6]Vasse J, Danoun S, Trigalet A. Microscopic studies of root infection in resistant tomato cultivar Hawaii7996[J]. Bacterial Wilt Disease and the Ralstonia solanacearum Species Complex,2005:285-291.
[7]Kwak M J,Kong H G,Choi K,et al. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology,2018,36:1100-1109.
[8]Mansfield J,Genin S,Magori S,et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular Plant Pathology,2012,13(6):614-629.
[9]Shen G H,Zhang S T,Liu X J,et al. Soil acidification amendments change the rhizosphere bacterial community of tobacco in a bacterial wilt affected field[J]. Applied Microbiology and Biotechnology,2018,102(22):9781-9791.
[10]Gao Y,Lu Y,Lin W P,et al. Biochar suppresses bacterial wilt of tomato by improving soil chemical properties and shifting soil microbial community[J]. Microorganisms,2019,7(12):676.
[11]刘业霞,付 玲,艾希珍,等. 嫁接辣椒根系特征及根际土壤酶活性与青枯病抗性的关系[J]. 西北植物学报,2012,32(5):963-968.
[12]樊 俊,谭 军,王 瑞,等. 烟草青枯病发病程度的影响因素分析[J]. 烟草科技,2021,54(10):20-28.
[13]Nakahara H,Mori K,Mori T,et al. Induction of spontaneous phenotype conversion in Ralstonia solanacearum by addition of iron compounds in liquid medium[J]. Journal of Microbiological Methods,2021,186:106233.
[14]高升升. 高氮投入促進烟草青枯病暴发机理研究[D]. 重庆:西南大学,2020:26-32.
[15]Wu K,Su L,Fang Z Y,et al. Competitive use of root exudates by Bacillus amyloliquefaciens with Ralstonia solanacearum decreases the pathogenic population density and effectively controls tomato bacterial wilt[J]. Scientia Horticulturae,2017,218:132-138.
[16]李石力. 有机酸类根系分泌物影响烟草青枯病发生的机制研究[D]. 重庆:西南大学,2017:7-18,21-65.
[17]马 超,杨欣润,江高飞,等. 病原青枯菌土壤存活的影响因素研究进展[J]. 土壤学报,2021,58(6):1359-1367.
[18]Chen X X,Zhang H K,Li J K,et al. Analysis of chemical compounds of pomegranate peel polyphenols and their antibacterial action against Ralstonia solanacearum[J]. South African Journal of Botany,2021,140:4-10.
[19]Yu M X,Wang Y P,Baldock J A,et al. Divergent responses of soil organic carbon accumulation to 14 years of nitrogen addition in two typical subtropical forests[J]. Science of the Total Environment,2020,707:136104.
[20]戴 辉,周嘉聪,曾泉鑫,等. 短期氮添加对黄山松林土壤碳组分的影响及其微生物机制[J]. 环境科学学报,2022,42(9):291-300.
[21]Schmidt H P,Kammann C,Niggli C,et al. Biochar and biochar-compost as soil amendments to a vineyard soil:influences on plant growth,nutrient uptake,plant health and grape quality[J]. Agriculture,Ecosystems & Environment,2014,191:117-123.
[22]丛 萍,李玉义,高志娟,等. 秸秆颗粒化高量还田快速提高土壤有机碳含量及小麦玉米产量[J]. 农业工程学报,2019,35(1):148-156.
[23]Cao Y F,Thomashow L S,Luo Y,et al. Resistance to bacterial wilt caused by Ralstonia solanacearum depends on the nutrient condition in soil and applied fertilizers:a meta-analysis[J]. Agriculture,Ecosystems & Environment,2022,329:107874.
[24]王 晴,张大琪,方文生,等. 土壤熏蒸对土壤氮循环及其功能微生物的影响研究进展[J]. 农药学学报,2021,23(6):1063-1072.
[25]Wang R Q,Xiao Y P,Lv F J,et al. Bacterial community structure and functional potential of rhizosphere soils as influenced by nitrogen addition and bacterial wilt disease under continuous sesame cropping[J]. Applied Soil Ecology,2018,125:117-127.
[26]Davey R S,McNeill A,Barnett S,et al. Potential for suppression of Rhizoctonia root rot is influenced by nutrient (N and P) and carbon inputs in a highly calcareous coarse-textured topsoil[J]. Soil Research,2021,59(4):329-345.
[27]孙 战, 李 明, 魏永成, 等. 木麻黄青枯病发生与土壤五种元素含量分析[J]. 分子植物育种,2023,21(4):1313-1321.
[28]Morikawa C K. Generation of hydroxyl radicals by Fe-polyphenol-activated CaO2 as a potential treatment for soil-borne diseases[J]. Scientific Reports,2018,8(1):9752.
[29]郑世燕. 矿质营养Mo对烟草抗青枯病的影响及生理生化机理[D]. 重庆:西南大学,2014:66-67.
[30]张淑婷. 铝离子影响烟草青枯病发生的机制研究[D]. 重庆:西南大学,2018:18-20.
[31]韦 中,王佳宁,江高飞,等. 土传病原细菌的生存与致病权衡[J]. 土壤学报,2022,59(2):324-333.
[32]Caruso P,Palomo J L,Bertolini E,et al. Seasonal variation of Ralstonia solanacearum biovar 2 populations in a Spanish river:recovery of stressed cells at low temperatures[J]. Applied and Environmental Microbiology,2005,71(1):140-148.
[33]劉宪臣. 温湿度对烟草青枯病发生的影响及调控技术研究[D]. 重庆:西南大学,2014:41-42.
[34]Li S L,Liu Y Q,Wang J,et al. Soil acidification aggravates the occurrence of bacterial wilt in South China[J]. Frontiers in Microbiology,2017,8:703.
[35]Qiu Y,Lv W C,Wang X P,et al. Long-term effects of gravel mulching and straw mulching on soil physicochemical properties and bacterial and fungal community composition in the Loess Plateau of China[J]. European Journal of Soil Biology,2020,98:103188.
[36]Mi Y Z,Zhao X L,Liu F F,et al. Changes in soil quality,bacterial community and anti-pepper Phytophthora disease ability after combined application of straw and multifunctional composite bacterial strains[J]. European Journal of Soil Biology,2021,105:103329.
[37]Nwokolo N L,Enebe M C,Chigor C B,et al. The contributions of biotic lines of defence to improving plant disease suppression in soils:a review[J]. Rhizosphere,2021,19:100372.
[38]Yang T J,Wei Z,Friman V P,et al. Resource availability modulates biodiversity-invasion relationships by altering competitive interactions[J]. Environmental Microbiology,2017,19(8):2984-2991.
[39]段 曦,孙晨晨,孙胜楠,等. 嫁接辣椒根系分泌物对根腐病和青枯病的影响[J]. 园艺学报,2017,44(2):297-306.
[40]谷益安. 土壤细菌群落和根系分泌物影响番茄青枯病发生的生物学机制[D]. 南京:南京农业大学,2017:62-65.
[41]Tian J H,Rao S,Gao Y,et al. Wheat straw biochar amendment suppresses tomato bacterial wilt caused by Ralstonia solanacearum:potential effects of rhizosphere organic acids and amino acids[J]. Journal of Integrative Agriculture,2021,20(9):2450-2462.
[42]Liu Y X,Li X,Cai K,et al. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms[J]. Applied Soil Ecology,2015,93:78-87.
[43]张海龙,武润琴,李佳佳,等. 根系分泌物C ∶ N对刺槐林地土壤理化特征和土壤呼吸的影响[J]. 应用生态学报,2022,33(4):949-956.
[44]Yang T J,Han G,Yang Q J,et al. Resource stoichiometry shapes community invasion resistance via productivity-mediated species identity effects[J]. Proceedings of the Royal Society(Biological Sciences),2018,285(1893):20182035.
[45]Wen T,Yu G H,Hong W D,et al. Root exudate chemistry affects soil carbon mobilization via microbial community reassembly[J]. Fundamental Research,2022,2(5):697-707.
[46]Wang R,Zhang H C,Sun L G,et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak[J]. Scientific Reports,2017,7:343.
[47]覃仁柳,林刚云,吴银秀,等. 桑树青枯病与根际土壤肥力及微生物群落结构特征的研究[J]. 中国生物防治学报,2021,37(6):1256-1264.
[48]侯金鳳,申民翀,孙菲菲,等. 番茄连作青枯病不同发病时期的非根际土壤细菌群落变化特征[J]. 微生物学报,2022,62(9):3464-3477.
[49]Shen X H,Zhou N Y,Liu S J.Degradation and assimilation of aromatic compounds by Corynebacterium glutamicum:another potential for applications for this bacterium?[J]. Applied Microbiology and Biotechnology,2012,95(1):77-89.
[50]Osei O,Abaidoo R C,Ahiabor B D K,et al. Bacteria related to Bradyrhizobium yuanmingense from Ghana are effective groundnut micro-symbionts[J]. Applied Soil Ecology,2018,127:41-50.
[51]Liu Y Q,Wang Y H,Kong W L,et al. Identification,cloning and expression patterns of the genes related to phosphate solubilization in Burkholderia multivorans WS-FJ9 under different soluble phosphate levels[J]. AMB Express,2020,10(1):108.
[52]Chen S,Qi G F,Ma G Q,et al. Biochar amendment controlled bacterial wilt through changing soil chemical properties and microbial community[J]. Microbiological Research,2020,231:126373.
[53]Cheng J N,Jin H,Zhang J L,et al. Effects of allelochemicals,soil enzyme activities,and environmental factors on rhizosphere soil microbial community of Stellera chamaejasme L. along a growth-coverage gradient[J]. Microorganisms,2022,10(1):158.
[54]Gao D C,Bai E,Yang Y,et al. A global meta-analysis on freeze-thaw effects on soil carbon and phosphorus cycling[J]. Soil Biology and Biochemistry,2021,159:108283.
[55]Gao D C,Bai E,Li M H,et al. Responses of soil nitrogen and phosphorus cycling to drying and rewetting cycles:a meta-analysis[J]. Soil Biology and Biochemistry,2020,148:107896.
[56]孙 战,王圣洁,杨锦昌,等. 木麻黄根区土壤理化特性及酶活性与青枯病发生关联分析[J]. 生态环境学报,2022,31(1):70-78.
[57]Mndzebele B,Ncube B,Fessehazion M,et al. Effects of cowpea-amaranth intercropping and fertiliser application on soil phosphatase activities,available soil phosphorus,and crop growth response[J]. Agronomy,2020,10(1):79.
[58]李得銘. 绿农林41号微生物复合菌肥对番茄青枯病防控效果的研究[D]. 海口:海南大学,2020:31-33.
[59]Delgado-Baquerizo M,Guerra C A,Cano-Díaz C,et al. The proportion of soil-borne pathogens increases with warming at the global scale[J]. Nature Climate Change,2020,10(6):550-554.
[60]Raaijmakers J,Mazzola M. Soil immune responses[J]. Science,2016,352:1392-1393.
[61]Deng X H,Zhang N,Shen Z Z,et al. Soil microbiome manipulation triggers direct and possible indirect suppression against Ralstonia solanacearum and Fusarium oxysporum[J]. Biofilms and Microbiomes,2021,7:33.
[62]Narasimhamurthy K,Soumya K,Udayashankar A C,et al. Elicitation of innate immunity in tomato by salicylic acid and Amomum nilgiricum against Ralstonia solanacearum[J]. Biocatalysis and Agricultural Biotechnology,2019,22:101414.
[63]赵世元. 黄腐酸诱导烟草抗青枯病的活性及初步机理研究[D]. 重庆:西南大学,2020:4-6.
[64]熊书萍,田时炳,蔡贵华,等. 番茄嫁接栽培技术研究[J]. 西南园艺,2004(3):1-3.
[65]韩松庭,丁 伟. 烟草青枯病的化学防治研究进展[J]. 植物医生,2019,32(5):20-25.
[66]Yang F, Yuan H, Yi N. Natural resources, environment and the sustainable development[J]. Urban Climate, 2022, 42: 101-111.
[67]Celine J, Francois V, Claude A, et al. Soil health through soil disease suppression: which strategy from descriptors to indicators?[J]. Soil Biology and Biochemistry,2007,39(1):1-23.
[68]徐 暄,侯旭东,蒋世昌.保护地辣椒土传病害绿色防控技术研究进展[J]. 安徽农学通报,2021,27(23):116-118.
[69]Nguyen M,Ranamukhaarachchi S.Soil-borne antagonists for biological control of bacterial wilt disease caused by Ralstonia solanacearum in tomato and pepper[J]. Journal of Plant Pathology,2010,92:395-406.
[70]汪国平,林明宝,吴定华. 番茄青枯病抗性遗传研究进展[J]. 园艺学报,2004,31(3):403-407.
[71]赵文宗. 嫁接番茄抗青枯病特性及根系分泌物化感作用的研究[D]. 南宁:广西大学,2019:14-17.
[72]Sharma S,Katoch V,Banyal D K.Review on harnessing biotechnological tools for the development of stable bacterial wilt resistant solanaceous vegetable crops[J]. Scientia Horticulturae,2021,285:110158.
[73]French E,Kim B S,Rivera-Zuluaga K,et al. Whole root transcriptomic analysis suggests a role for auxin pathways in resistance to Ralstonia solanacearum in tomato[J]. Molecular Plant-Microbe Interactions,2018,31(4):432-444.
[74]李 悦,范腕腕,袁高庆,等. 3,4,5-三羟基苯甲酸甲酯的抑菌特性及其对番茄青枯病的田间防治作用[J]. 农药,2014,53(11):845-848.
[75]Fan W W,Yuan G Q,Li Q Q,et al. Antibacterial mechanisms of methyl gallate against Ralstonia solanacearum[J]. Australasian Plant Pathology,2014,43(1):1-7.
[76]Santos B M,Gilreath J P,Motis T N,et al. Comparing methyl bromide alternatives for soilborne disease,nematode and weed management in fresh market tomato[J]. Crop Protection,2006,25(7):690-695.
[77]Mao L G,Jiang H Y,Wang Q X,et al. Efficacy of soil fumigation with dazomet for controlling ginger bacterial wilt (Ralstonia solanacearum) in China[J]. Crop Protection,2017,100:111-116.
[78]Zanón M J,Gutierrez L A,Myrta A. Spanish experiences with dimethyl disulfide (DMDS) on the control of root-knot Nematodes,Meloidogyne spp.,in fruiting vegetables in protected crops[J]. Acta Horticulturae,2014,1044:421-425.
[79]Yan D D,Wang Q X,Li Y,et al. Efficacy and economics evaluation of seed rhizome treatment combined with preplant soil fumigation on ginger soilborne disease,plant growth,and yield promotion[J]. Journal of the Science of Food and Agriculture,2022,102(5):1894-1902.
[80]袁高庆,陈媛媛,范腕腕,等. 3,4,5-三羟基苯甲酸甲酯防治番茄青枯病的物理作用方式及其对番茄根系次生代谢物质的影响[J]. 植物保护,2016,42(6):80-85.
[81]Ibekwe A M. Effects of fumigants on non-target organisms in soils[J]. Advances in Agronomy, 2004, 83: 1-35.
[82]李美芸. 拮抗放线菌的筛选及其生物有机肥对番茄青枯病的防控效果[D]. 南京:南京农业大学,2017:5-7.
[83]Ma L,Zhang H Y,Zhou X K,et al. Biological control tobacco bacterial wilt and black shank and root colonization by bio-organic fertilizer containing bacterium Pseudomonas aeruginosa NXHG29[J]. Applied Soil Ecology,2018,129:136-144.
[84]Wang X B,Liang G B.Control efficacy of an endophytic Bacillus amyloliquefaciens strain BZ6-1 against peanut bacterial wilt,Ralstonia solanacearum[J]. BioMed Research International,2014,2014:465435.
[85]Li C Y,Hu W C,Pan B,et al. Rhizobacterium Bacillus amyloliquefaciens strain SQRT3-mediated induced systemic resistance controls bacterial wilt of tomato[J]. Pedosphere,2017,27(6):1135-1146.
[86]Boonraeng S,Punyoyai N. The utilization of agro-industrial waste for soil amendment and liquid biofertilizer mixed bacterial antagonist in eggplant production[J]. IOP Conference Series(Earth and Environmental Science),2021,883(1):012087.
[87]Zheng X F,Zhu Y J,Wang J P,et al. Combined use of a microbial restoration substrate and avirulent Ralstonia solanacearum for the control of tomato bacterial wilt[J]. Scientific Reports,2019,9:20091.
[88]Agarwal H,Dowarah B,Baruah P M,et al. Endophytes from Gnetum gnemon L. can protect seedlings against the infection of phytopathogenic bacterium Ralstonia solanacearum as well as promote plant growth in tomato[J]. Microbiological Research,2020,238:126503.
[89]唐 琳,張焕丽. 源自3种茄科蔬菜土壤木霉菌的分离与鉴定[J]. 东北农业科学,2020,45(5):52-56.
[90]赖宝春,姚锦爱,戴瑞卿,等. 2株拮抗放线菌复合防治番茄青枯病的研究[J]. 中国生物防治学报,2021,37(5):1035-1040.
[91]王 杰,龙世芳,王正文,等. 番茄青枯病防治研究进展[J]. 中国蔬菜,2020(1):22-30.
[92]Kochanek J,Soo R M,Martinez C,et al. Biochar for intensification of plant-related industries to meet productivity,sustainability and economic goals:a review[J]. Resources,Conservation and Recycling,2022,179:106109.
[93]Wang D,Jiang P K,Zhang H B,et al. Biochar production and applications in agro and forestry systems:a review[J]. Science of the Total Environment,2020,723:137775.
[94]Fan Y, Klemes J, Lee C T. Environmental performance and techno-economic feasibility of different biochar applications: an overview[J]. Chemical Engineering Transactions, 202 83: 469-474.
[95]李文静. 玉米秸秆生物炭对石灰性农田土壤微生物数量和功能的影响[D]. 太原:太原理工大学,2019:23-24.
[96]于玲玲,赵贵元,崔婧婧,等. 施用生物炭对玉米田土壤呼吸及水分利用效率的影响[J]. 江苏农业科学,2022,50(3):209-213.
[97]Zhu J H,Cao A C,Wu J J,et al. Effects of chloropicrin fumigation combined with biochar on soil bacterial and fungal communities and Fusarium oxysporum[J]. Ecotoxicology and Environmental Safety,2021,220:112414.
[98]Medeiros E V,Lima N T,Sousa L J R,et al. Biochar from different sources against tomato bacterial wilt disease caused by Ralstonia solanacearum[J]. Journal of Soil Science and Plant Nutrition,2022,22(1):540-548.
[99]胡瑞文,劉勇军,周清明,等. 生物炭对烤烟根际土壤微生物群落碳代谢的影响[J]. 中国农业科技导报,2018,20(9):49-56.
[100]张广雨,褚德朋,刘元德,等. 生物炭及海藻肥对烟草生长、土壤性状及青枯病发生的影响[J]. 中国烟草科学,2019,40(5):15-22.
[101]冯慧琳,付 兵,任天宝,等. 生物炭对青枯病烟株的根际土壤微生物群落结构调控机制分析[J]. 农业资源与环境学报,2022,39(1):173-181.
[102]Li C J,Ahmed W,Li D F,et al. Biochar suppresses bacterial wilt disease of flue-cured tobacco by improving soil health and functional diversity of rhizosphere microorganisms[J]. Applied Soil Ecology,2022,171:104314.
