电针对骶上脊髓损伤大鼠急性期肾及下尿路功能的影响
2023-05-30张雨辰许明刘琼胡碧浓唐丽亚艾坤张泓
张雨辰 许明 刘琼 胡碧浓 唐丽亚 艾坤 张泓
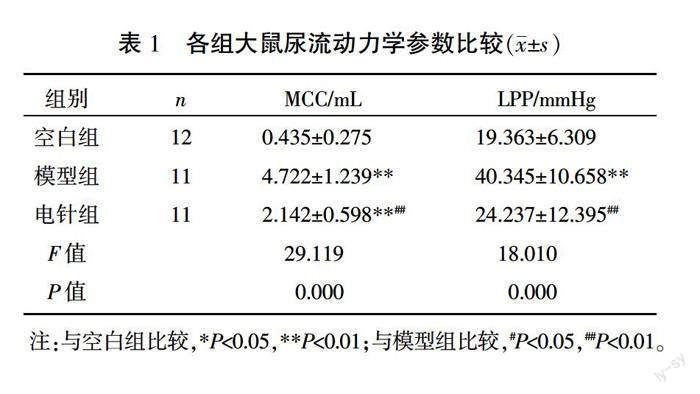
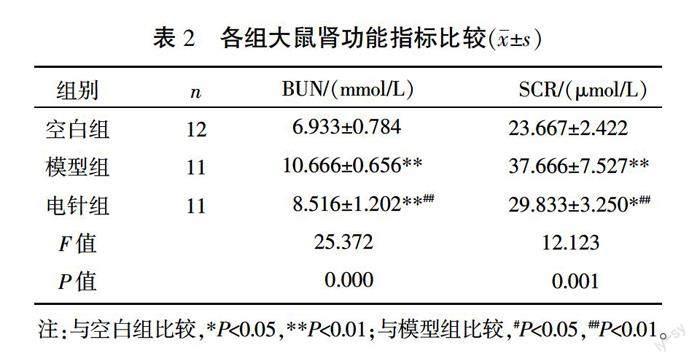
〔摘要〕 目的 通過观察电针对急性期骶上脊髓损伤(suprasacral cord injury, SSCI)后逼尿肌-括约肌协同失调(detrusor sphincter dyscoordination, DSD)大鼠膀胱最大容量(maximum cystometric capacity, MCC)、漏尿点压力(leakage point pressure, LPP)、血清尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, SCR)和肾组织形态学的改变,探讨电针治疗在SSCI急性期对上、下尿路功能(膀胱功能和肾功能)的影响。方法 36只SD雌性大鼠,随机抽取12只作为空白组,剩余24只采用改良Hassan Shaker脊髓横断法在T10脊髓节段全横断制作SSCI大鼠模型,成模后随机分为模型组和电针组,每组12只。电针组取“次髎”“中极”“三阴交”穴予持续电针刺激40 min,1次/d,连续治疗7 d;空白组与模型组只捆绑不治疗。采用膀胱造瘘法进行尿流动力学检测;随后腹主动脉采血,通过SCR、BUN检测评估肾功能;处死大鼠后取肾行HE染色,观察其组织形态结构的变化。结果 与空白组比,模型组大鼠MCC、LPP、BUN和SCR均显著升高(P<0.01);电针组大鼠MCC、BUN和SCR显著低于模型组(P<0.01),高于空白组(P<0.05或P<0.01);电针组大鼠LPP显著低于模型组(P<0.01),较空白组差异无统计学意义(P>0.05)。与模型组相比,电针组大鼠肾皮质炎性细胞浸润减轻、胞质空泡化减少,皮质部集合小管和肾小管上皮细胞核固缩减轻,肾小管坏死减少。结论 电针治疗可能通过降低SSCI后DSD大鼠MCC和LPP以改善肾脏微血管血流,发挥对肾功能和肾脏结构的保护作用。电针穴位可能刺激骶神经、胫神经的神经传入,促进尿道外括约肌爆发恢复,并且通过调节交感、副交感神经传出而影响排尿效率。
〔关键词〕 骶上脊髓损伤;逼尿肌-括约肌协同失调;尿道外括约肌爆发模式;膀胱顺应性;上尿路损伤;肾脏微血管血流;肾功能
〔中图分类号〕R245;R694 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.020
Effects of electroacupuncture on renal and lower urinary tract function of rats in the
acute stage of suprasacral spinal cord injury
ZHANG Yuchen, XU Ming, LIU Qiong, HU Binong, TANG Liya, AI Kun*, ZHANG Hong*
College of Acupuncture & Tuina and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the effects of electroacupuncture on upper and lower urinary tract function (bladder function and renal function) in the acute stage of suprasacral cord injury (SSCI), by observing the changes of maximum cystometric capacity (MCC), leakage point pressure (LPP), blood urea nitrogen (BUN), serum creatinine (SCR) and renal histopathology in rats with detrusor sphincter dyscoordination (DSD) after SSCI. Methods There were 36 SD female rats, 12 of which were randomly selected as control group. The remaining 24 rats were made into SSCI models by modified Hassan Shaker spinal cord transection at T10 segment, which were randomized into model group and electroacupuncture group, with 12 rats in each. In electroacupuncture group, points of Ciliao (BL32), Zhongji (CV3) and Sanyinjiao (SP6) were subjected to continuous electroacupuncture stimulation for 40 min, once per day, for consecutive 7 d; control group and model group were only bound without any treatment. The urodynamic test was performed by cystostomy. Then, blood samples were collected from the abdominal aortas, and SCR and BUN were detected to evaluate the renal function. After the rats were sacrificed, the kidneys were stained with HE to observe the changes of histomorphology and structural injury. Results Compared with control group, MCC, LPP, BUN and SCR in model group significantly increased (P<0.01). MCC, BUN and SCR in the electroacupuncture group were significantly lower than those in the model group (P<0.01), but higher than those in the control group (P<0.05 or P<0.01). LPP of the electroacupuncture group was significantly lower than that of the model group (P<0.01), but there was no statistical significance compared with the control group (P>0.05). Compared with the model group, the inflammatory cell infiltration and cytoplasmic vacuolation of the renal cortex were reduced, karyopyknosis of the epithelia of the collecting tubules and renal tubules were improved and the renal tubule necrosis decreased in electroacupuncture group. Conclusion Electroacupuncture may reduce MCC and LPP of DSD rats after SSCI to improve renal microvascular blood flow and play a protective role in renal function and renal structure. It may promote the recovery of external urethral sphincter bursting activity by stimulating the afference of the sacral and tibial nerves through the selected points, and affect the efficiency of urination by regulating the efference of the sympathetic and parasympathetic nerves.
〔Keywords〕 suprasacral cord injury; detrusor sphincter dyscoordination; external urethral sphincter bursting activity; bladder compliance; upper urinary tract injury; renal microvascular blood flow; renal function
脊髓損伤(spinal cord injure, SCI)可影响感觉、运动和自主神经系统功能,而神经源性膀胱(neurogenic bladder, NB)是SCI常见的继发性并发症,发病率高并极大地影响患者的生活质量[1]。SCI患者NB的表现取决于损伤的位置。鉴于脊髓对排尿的控制发生在S2~S4骶丛节段,当病变位于S2~S4(脊髓圆锥、马尾或周围神经)以上的节段,则为骶上脊髓损伤(suprasacral cord injury, SSCI)[2]。
SSCI造成上运动神经元病变,导致逼尿肌和外括约肌同时过度活跃。由此产生的排尿障碍会导致尿液回流到输尿管和肾脏,最终增加患者尿路感染及肾脏疾病的患病风险[3]。有研究称,70%~84%的SCI患者在一生中的某个阶段会出现NB[4],如果不治疗可能会随着时间的推移导致肾功能恶化、肾结石、难治性尿失禁和恶性肿瘤等[5]。
慢性SCI患者会出现肾功能障碍,且损伤早期影响肾功能的因素也很多。严重SCI早期已出现肾功能损害,且高位损伤造成的肾功能不全比低位损伤更明显,这证明SSCI患者急性期的肾功能保护的重要性。针灸作为该病的有效治疗手段[6],能否通过改善下尿路功能阻止SSCI早期的肾功能损害,值得进一步探究。
1 材料与方法
1.1 实验动物
雌性SD成年大鼠36只,SPF级,体质量230~250 g。湖南中医药大学动物实验中心提供,许可证号:SCXK(湘)2019-0004,合格证号:1107271911006889。分笼饲养于湖南中医药大学动物中心实验室,饲养温度24~26 ℃,湿度 50%~70%。实验单位使用许可证号:SYXK(湘)2019-0009,伦理证明号:LL2019092303。
1.2 主要试剂、药物和仪器
10%水合氯醛溶液(国药集团化学试剂有限公司,10 mL,批号:20181120);青霉素钠(华北制药集团有限责任公司,80万U,批号:H13020657);伊红染液、苏木素染液(武汉塞维尔生物科技有限公司,批号:CR1901064);象皮生肌膏(湖南中医药大学第一附属医院药剂科自制);苦苹果防舔防咬喷剂(美国Grannick公司,236 mL)。
导尿管(上海上医康鸽医用器材有限责任公司,型号:F3);针灸针(苏州天一针灸器械有限公司,型号:0.25 mm×25 mm、0.25 mm×13 mm);电针治疗仪(苏州医疗用品厂有限公司,型号:SDZ-V);MP-150多通道生理记录仪(美国BIOPAC公司,型号:MP150-WSW);双通道微量注射泵(浙江史密斯医学仪器有限公司,型号:WZ-50C6);生物显微镜、数码医学图像分析系统(麦克奥迪实业集团有限公司,型号:BA410、Med 6.0);低温离心机(美国SCILOGEX公司,型号:D3024R);全自动生化分析仪(日本东芝,型号:TBA-120FR)等。
1.3 动物分组与造模
1.3.1 分组 36只大鼠随机编号后,采用随机数字表法分组。首先选取12只作为空白组,其余24只大鼠在T10脊髓节段采用改良Hassan Shaker脊髓横断法[7]制作完全性SSCI模型,成模后再分为模型组和电针组,每组12只。
1.3.2 造模方法 大鼠术前24 h禁食不禁水,术前2 h腹腔注射20万U青霉素钠预防感染。称重后,用10%水合氯醛300 mg/kg行腹腔麻醉,随后将大鼠俯卧固定于鼠板上备皮。采用改良Hassan Shaker脊髓横断法制作完全性SSCI模型。脊髓横断部位选取T10脊髓节段(相当于T8椎骨的位置),通过浮肋连接的T13作为骨性标志向上进行具体定位。确定手术部位后做标记并消毒皮肤,以标记点为中心沿背部正中线作长约3 cm的纵向切口,依次切开表皮和皮下筋膜,使用玻璃分针钝性分离两侧竖脊肌,充分暴露棘突和椎板。用显微咬骨器从尾侧向头侧咬除T8椎板直至两侧椎弓根,使脊髓充分暴露,用牙科钩沿横断椎间隙横向小幅度钩出脊髓,手术刀切断脊髓后反复刮扫以确定脊髓完全横断,确定无神经纤维残留,则表明脊髓完全横断[8]。最后由内向外逐层缝合完成手术。手术全程要求严格消毒及无菌操作,术后观察大鼠的生命体征是否平稳。
1.4 术后护理
(1)体温管理:术后立即置于电热毯上防止体温过低,以肛温计上升到 37 ℃以上为佳,大鼠均单笼饲养。(2)抗感染护理:术后48 h内,腹腔注射青霉素钠20万U/12 h;48 h后至术后7 d,20万U/24 h;从术后第8天开始,如大鼠出现脓尿、血尿,则注射20万U/24 h以抗感染,直至尿液澄清。术后每24 h在伤口周围使用碘酊进行皮肤消毒3次。(3)Crede手法排尿:每8 h(早、中、晚)用Crede法对大鼠进行人工辅助排尿,注意手法和力度,防止损伤膀胱。密切观察大鼠的生命体征,每日总饮水量小于30 mL,防止因膀胱大量尿潴留导致肾脏及膀胱壁损伤。(4)压疮防护:用50%乙醇溶液擦拭大鼠的身体(腹部及双下肢)以防止压疮;有压疮形成时用象皮生肌膏涂抹以促进伤口愈合。(5)自残防护:因术后大鼠下肢感觉缺失,部分老鼠会出现撕咬手术部位和下肢的自残行为,可涂上苦苹果防舔防咬喷剂以防止自残。
1.5 纳入及剔除标准
1.5.1 纳入标准 (1)运动功能评估:采用BBB评分法[9],评估大鼠后肢运动功能恢复情况。0分为双后肢拖行。(2)排尿功能评估:脊髓休克后,虽能不自主间断的少许排尿,但膀胱内仍潴留大量尿液,Crede手法辅助排尿时触及胀大的膀胱在两手拇指指腹间滚动并感觉排尿有阻力。
同时满足以上两项条件“(1)BBB评分为0分”和“(2)采用Crede手法辅助排尿时感到阻力”,则认为模型成功,纳入实验。
1.5.2 剔除标准 造模后大鼠出现双后肢自主运动,脊髓休克期后完全尿潴留或自主排尿,大鼠自残或死亡的情况,均予以剔除。
1.6 治疗方案
1.6.1 处理方法 术后第14天开始实施干预,电针组大鼠取“次髎”“中极”“三阴交”穴予持续电针刺激,空白组与模型组大鼠只捆绑固定,共40 min,1次/d,连续7 d。
1.6.2 取穴方法 参照“十三五”国家规划统编教材《实验针灸学》[10]大鼠标准穴位图谱定位,并模拟人体腧穴骨度分寸法量取“次髎”“中极”“三阴交”穴。
1.6.3 电针方法 (1)针刺方法:各穴均用30号1寸针直刺,深度分别为次髎15 mm、中极5 mm、三阴交5 mm。(2)穴位对接:大鼠仰卧位固定,中极与三阴交一组(三阴交左右两穴隔日交替进行);俯卧位固定,次髎与大鼠尾根部一组(次髎左右两穴隔日交替进行)。(3)电针刺激参数:SDZ-V型华佗牌电针治疗仪,疏密波10/50 Hz,强度以肢体轻颤并耐受为度,刺激时间20 min。
1.7 指标检测
1.7.1 尿流动力学检测 治疗7 d后,所有大鼠采用膀胱造瘘法行尿流动力学检测。大鼠麻醉后,用Crede手法排空膀胱后进行膀胱造瘘,用眼科剪在膀胱顶部造一小口插入F3导尿管,深度1~2 cm,用4-0丝线将切口部位膀胱与导管捆绑固定防止渗漏。将导尿管、MP150-WSW型16通道生理记录仪与WZ-50C6微量注射泵通过三通管相连接。始终保持导尿管水平放置,与尿道平行,设置MP150主机压力基线为零。打开微量注射泵,灌注速度为6 mL/h,灌注的生理盐水温度为25~35 ℃。观察并记录大鼠首次尿液溢出时的膀胱压力即为漏尿点压力(leakage point pressure, LPP),最大膀胱容量(maximum cystometric capacity, MCC)则为从开始灌注到尿液首次溢出期间所灌注的液体总量。
1.7.2 肾功能检测 尿流动力学检测完毕后,每组随机抽取6只(共18只)进行腹主动脉采血,取满5 mL动脉血后将真空采血管静置于低温离心机,最大离心半径8.5 cm,3000 r/min,离心10 min,分离上层血清,全自动生化分析仪检测血清尿素氮(blood urea nitrogen, BUN)和血肌酐(serum creatinine, SCR)的含量以评估各组大鼠肾功能。
1.7.3 肾组织形态学观察 大鼠采血后处死,取肾组织,将其浸泡于4%多聚甲醛溶液固定24 h,经脱水、透明后制成蜡块,再制成石蜡切片,采用苏木精-伊红(HE)染色后封片,分别置于40倍和200倍生物显微镜下观察肾的组织形态学改变。所有图片采用Motic Med 6.0数码医学图像分析系统处理。
1.8 统计学方法
使用SPSS 22.0进行数据处理。计量资料以“x±s”表示,所有资料均进行正态性和方差齐性检验,符合正态分布者采用单因素方差分析;不符合正态分布者采用非参数检验。均以P<0.05为差异有统计学意义。
2 结果
2.1 尿流动力学检测结果
模型組、电针组各1只大鼠因死亡剔除实验,最后纳入34只大鼠进行尿流动力学检测。与空白组相比,模型组大鼠MCC和LPP显著增大(P<0.01)。电针组大鼠MCC和LPP较模型组均显著降低(P<0.01),且LPP较空白组差异无统计学意义(P>0.05),但MCC仍显著高于空白组(P<0.01)。详见表1。
2.2 肾功能检测结果
与空白组相比,模型组大鼠BUN和SCR均显著升高(P<0.01)。而电针组大鼠BUN和SCR显著低于模型组(P<0.01),但高于空白组(P<0.05或P<0.01)。详见表2。
2.3 肾组织形态学观察结果
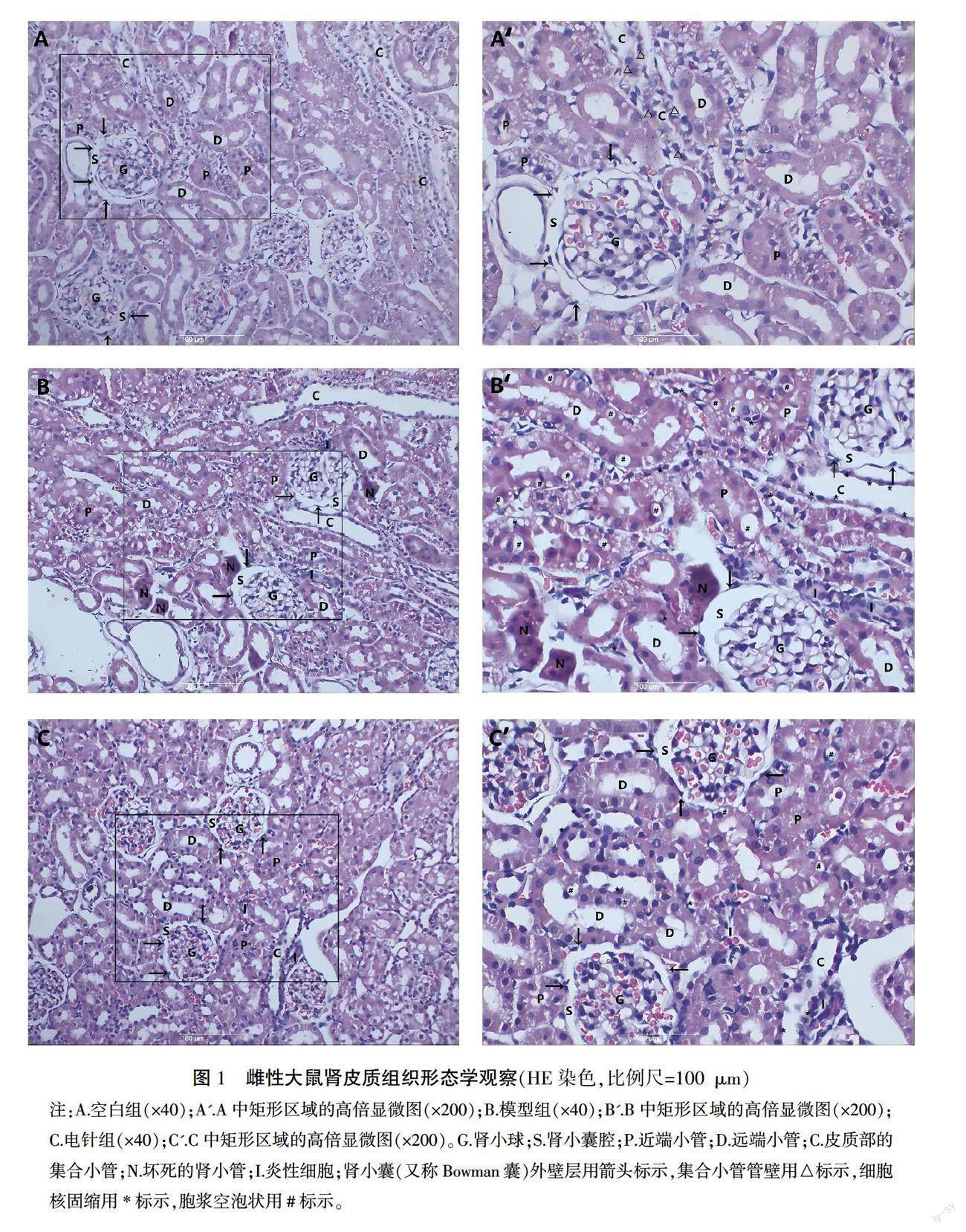
正常雌性大鼠肾皮质层切片HE染色(见图1A和A')显示:肾皮质由肾小体和肾小管组成。而肾小体是由毛细血管肾小球簇以及包绕在其外的Bowman囊构成。囊的外壁层由单层扁平上皮构成,与近球小管上皮细胞相连续;内层紧包在毛细血管袢的外面;两层之间为肾小囊腔。肾小管分为近端小管和远端小管,近端小管管腔狭窄且不规则,而远端小管管腔清晰。偶见皮质部集合小管,管壁由立方形上皮细胞构成,胞质色淡而明亮,细胞分界清楚,结构简单。
SSCI大鼠(见图1B和B')切片中可见:肾小球缩小,Bowman囊增厚,肾小囊腔间隙扩大;肾小体间可见炎性细胞浸润。大量肾小管上皮细胞出现细胞核深染固缩、胞浆呈空泡状,部分肾小管坏死。集合小管管腔扩张,管壁上皮细胞出现深染的核固缩。
电针治疗大鼠(图1C和C')切片显示:肾小体、近端小管和远端小管结构基本保留,少量细胞出现固缩核或细胞质空泡化,轻微炎性细胞浸润。
3 讨论
尿路包括两个相互依赖的组成部分:上尿路(肾脏、输尿管)和下尿路(膀胱、尿道)。其作为一个功能单元,先将尿液从肾脏推进到膀胱,再以低压储存在膀胱内,最终间歇性地将尿液经尿道完全排出体外[11]。
理论上,SSCI后膀胱功能异常包括充盈期逼尿肌过度活动(detrusor overactivity, DO),排尿期逼尿肌-括约肌协同失调(detrusor sphincter dyscoordination, DSD)。下尿路功能特征为:(1)膀胱充盈过程中出现非排尿收缩;(2)排尿效率降低;(3)残余尿量增加;(4)膀胱容量增加[12]。实际上,不同程度的损伤可能导致不可预测的混合排尿功能障碍。尿动力学检测有助于早期辨别膀胱储存能力和顺应性[13]。本研究T8椎体水平脊髓横断后,模型组大鼠膀胱MCC和LPP均显著增大(P<0.01),说明膀胱压力高、排空效率低、膀胱容量被动增大,符合SSCI后DSD的表现。由于SSCI后脊髓休克期,膀胱反射消失及尿潴留致使膀胱过度膨胀(bladder overdistension, BOD)[14]。损伤后急性期BOD使SSCI患者下尿路储存功能恶化,并表现为最大膀胱压力升高、膀胱顺应性降低[15-16]。有研究表明,LPP与膀胱顺应性呈负相关[17]。脊髓休克期后立即介入治疗,电针组大鼠MCC、LPP明显低于模型组(P<0.01),说明电针治疗对膀胱容量和压力降低,减轻了损伤后急性期BOD,使膀胱保留了更多的顺应性,保护了SSCI后DSD大鼠的下尿路功能。
肾功能既受交感神经的控制,又与肾脏微血管系统关系密切[18]。有研究认为,脊髓横断后肾功能的改变可能由肾血流量和肾交感神经活动(renal sympathetic nerve activity, RSNA)的变化引起[19]。也有研究发现,颈脊髓横断后有肾神经和无肾神经的大鼠肾功能没有差异[20]。而肾血流量的减少将导致肾功能恶化[21]。SCI后肾脏微血管血流(microvascular blood flow, MVBF)逐渐下降,可能与尿潴留引起的肾血流阻力增加有关[22]。既往研究认为,下尿路功能障碍与上尿路各种并发症的发生关系密切,LPP和MCC值对发现上尿路损伤风险具有重要意义[23]。由此可见,电针治疗可能通过降低SSCI后DSD大鼠膀胱容量和压力,改善肾脏MVBF,发挥肾功能保护作用。
储尿期的低顺应性膀胱和/或DO伴DSD引起的逼尿肌压力过高,可能导致下、上尿路结构的不可逆改变[24]。大鼠L6和S1的腹根和背根被横切,4个月后大鼠膀胱内压、MCC、残余尿量、膀胱顺应性、SCR及BUN均大于正常大鼠,并伴肾积水、膀胱和肾脏的纤维化,说明大鼠神经源性膀胱功能障碍与上尿路损伤之间的关系[25]。结合本研究结果可知:电针治疗可减少肾小管坏死和细胞胞质空泡化,减轻炎性细胞浸润,减少肾组织结构损伤;电针组大鼠BUN和SCR的表达低于模型组而高于空白组。进一步证实,电针刺激SSCI后DSD大鼠“中极”“次髎”“三阴交”穴通过降低膀胱MCC和LPP,而减少肾组织结构损伤、保护肾功能的可能性。
脊髓完整的大鼠在膀胱充盈到出现收缩峰值时尿道外括约肌(external urethral sphincter, EUS)同时舒张,SSCI诱导的DSD即逼尿肌和EUS的不协调。与人类在排尿过程中EUS全程舒张不同,大鼠EUS呈现节律性收缩和舒张,这种EUS爆发性松弛模式依靠反射调控。T10全横断大鼠面临的是逼尿肌-EUS协调永久丧失。SSCI后,大鼠仍可通过EUS阶段性爆发活动排出尿液[26]。由此可见,反射性EUS爆发模式,是大鼠在SSCI导致失去脊髓上控制后也能部分实现有效排尿的重要原因。
正常情况下肾血流是自动调节的,肾神经作为中枢神经系统和肾脏之间的联系,只在异常情况下参与肾循环的控制[27]。SCI导致脊髓来源的交感神经活动抑制不足,使大鼠RSNA升高[28]。RSNA过度活跃和去甲肾上腺素水平升高,是肾脏疾病进展的关键因素[29]。关于下胸椎和上腰椎交感神经节前神经元的研究表明,这些神经元调节盆腔脏器并没受到脊髓损伤的严重影响,脊髓中间神经元似乎为这些神经元提供了大部分的突触输入,并不依赖于大脑中枢控制的直接输入,针对这些神经元的治疗应该有助于交感神经介导的盆腔内脏反射的正常化[30]。SCI后立即启动骶神经调节(sacral neuromodulation, SNM),可以防止神經源性逼尿肌过度活动并保持膀胱容量和顺应性[31]。“次髎”位于骶尾部第2骶后孔处,八髎穴之一,属膀胱经,临近骶部脊髓排尿中枢,其下有支配膀胱等盆腔脏器的骶神经S2~S4走行[32]。故电针“次髎”穴可能通过传入刺激,调节交感、副交感传出而影响排尿。“三阴交”为足太阴脾经、足少阴肾经和足厥阴肝经交会穴,其下胫神经通过。胫神经传入投射到L5~S1脊柱节段,可抑制膀胱过度活动。与SNM对骶髓调节不同,胫神经调节取决于对腰椎的传入投射。电针刺激“三阴交”穴改善SSCI后DSD大鼠排尿功能,其治疗机制可能除了与抑制排尿反射相关[33],还可能与胫神经传入促进EUS爆发活动恢复相关[34]。此外,“中极”位于下腹部正中线上,是膀胱的募穴,属任脉。电刺激“中极”穴引起的腹壁收缩,导致腹内压力增加,有助于有效排空膀胱[35]。
电针刺激SSCI后DSD大鼠“次髎”“三阴交”“中极”穴,可能通过骶神经、胫神经传入促进EUS阶段性爆发恢复,调节交感、副交感传出,提高排尿效率、降低膀胱MCC和LPP,进而改善肾脏MVBF,发挥肾功能保护效应。BUN和SCR的降低,肾组织结构损伤的减少,均说明电针治疗可以通过改善下尿路功能阻止SSCI早期的肾功能损害。
参考文献
[1] HOU S P, RABCHEVSKY A G. Autonomic consequences of spinal cord injury[J]. Comprehensive Physiology, 2014, 4(4): 1419-1453.
[2] HAMID R, AVERBECK M A, CHIANG H, et al. Epidemiology and pathophysiology of neurogenic bladder after spinal cord injury[J]. World Journal of Urology, 2018, 36(10): 1517-1527.
[3] STOFFEL J T. Detrusor sphincter dyssynergia: A review of physiology, diagnosis, and treatment strategies[J]. Translational Andrology and Urology, 2016, 5(1): 127-135.
[4] MANACK A, MOTSKO S P, HAAG-MOLKENTELLER C, et al. Epidemiology and healthcare utilization of neurogenic bladder patients in a US claims database[J]. Neurourology and Urodynamics, 2011, 30(3): 395-401.
[5] NSEYO U, SANTIAGO-LASTRA Y. Long-term complications of the neurogenic bladder[J]. The Urologic Clinics of North America, 2017, 44(3): 355-366.
[6] FAN Q, CAVUS O, XIONG L, et al. Spinal cord injury: How could acupuncture help?[J]. Journal of Acupuncture and Meridian Studies, 2018, 11(4): 124-132.
[7] 許 明,张 泓,刘继生,等.完全性骶上脊髓损伤后神经源性膀胱大鼠模型的建立及尿流动力学分析[J].中国康复理论与实践,2016,
22(8):869-875.
[8] 张雨辰,张 泓,艾 坤,等.大鼠脊髓损伤后神经源性膀胱模型的制备[J].中国康复医学杂志,2014,29(6):542-546.
[9] 陈向荣,游思维,金大地.BBB评分评估脊髓损伤大鼠后肢运动功能的探讨[J].中国脊柱脊髓杂志,2004,14(9):547-549.
[10] 余曙光,徐 斌.实验针灸学[M].2版.北京:人民卫生出版社, 2016.
[11] WOOLF A S, LOPES F M, RANJZAD P, et al. Congenital disorders of the human urinary tract: Recent insights from genetic and molecular studies[J]. Frontiers in Pediatrics, 2019, 7: 136.
[12] ISHIDA H, YAMAUCHI H, ITO H, et al. α1D-Adrenoceptor blockade increases voiding efficiency by improving external urethral sphincter activity in rats with spinal cord injury[J]. Regulatory, Integrative and Comparative Physiology, 2016, 311(5): R971-R978.
[13] HU H Z, GRANGER N, JEFFERY N D. Pathophysiology, clinical importance, and management of neurogenic lower urinary tract dysfunction caused by suprasacral spinal cord injury[J]. Journal of Veterinary Internal Medicine, 2016, 30(5): 1575-1588.
[14] JOELSSON-ALM E, NYMAN C R, SVENS?魪N C, et al. Micturition problems after bladder distension during hospitalization in Sweden: I'm not ill, just damaged for the rest of my life[J]. Nursing Research, 2014, 63(6): 418-425.
[15] WADA N, SHIMIZU T, SHUN T K, et al. Post-injury bladder management strategy influences lower urinary tract dysfunction in the mouse model of spinal cord injury[J]. Neurourology and Urodynamics, 2017, 36(5): 1301-1305.
[16] TAKAHASHI R, KIMOTO Y, MAKI T, et al. Postinjury bladder overdistension deteriorates the lower urinary tract's storage function in patients with spinal cord injury[J]. Urologia Internationalis, 2020, 104(7/8): 604-609.
[17] GHONIEM G M, ROACH M B, LEWIS V H, et al. The value of leak pressure and bladder compliance in the urodynamic evaluation of meningomyelocele patients[J]. The Journal of Urology, 1990, 144(6): 1440-1442.
[18] KRISHNAN S, SUAREZ-MARTINEZ A D, BAGHER P, et al. Microvascular dysfunction and kidney disease: Challenges and opportunities?[J]. Microcirculation, 2021, 28(3): e12661.
[19] OSBORN J W J, LIVINGSTONE R H, SCHRAMM L P. Elevated renal nerve activity after spinal transection: Effects on renal function[J]. The American Journal of Physiology, 1987, 253(4 Pt 2): R619-R625.
[20] TROSTEL K A, OSBORN J W. Do renal nerves chronically influence renal function and arterial pressure in spinal rats?[J]. The American Journal of Physiology, 1992, 263(6 Pt 2): R1265-R1270.
[21] CZARKOWSKA-PCZEK B, MUCHA K, PCZEK L. Age-related decline in renal blood flow could be a beneficial and compensatory mechanism[J]. Medical Science Monitor, 2020, 26: e918643.
[22] YUAN X, WU Q, TANG Y, et al. Systemic microcirculation dysfunction after low thoracic spinal cord injury in mice[J]. Life Sciences, 2019, 221: 47-55.
[23] MOSLAVAC S, DZIDIC I, KEJLA Z. Neurogenic detrusor overactivity: Comparison between complete and incomplete spinal cord injury patients[J]. Neurourology and Urodynamics, 2008, 27(6): 504-506.
[24] BYWATER M, TORNIC J, MEHNERT U, et al. Detrusor acontractility after acute spinal cord injury—Myth or reality?[J]. The Journal of Urology, 2018, 199(6): 1565-1570.
[25] LI Y L, WEN J J, WEN Y B, et al. Reconstruction of bladder function and prevention of renal deterioration by means of end-to-side neurorrhaphy in rats with neurogenic bladder[J]. Neurourology and Urodynamics, 2018, 37(4): 1272-1280.
[26] KADEKAWA K, YOSHIMURA N, MAJIMA T, et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury: A comparison study with rats[J]. Regulatory, Integrative and Comparative Physiology, 2016, 310(8): R752-R758.
[27] ZANCHETTI A, STELLA A. Sympatho-renal interactions[J]. The Italian Journal of Neurological Sciences, 1987, 8(5): 477-485.
[28] ZAHNER M R, KULIKOWICZ E, SCHRAMM L P. Recovery of baroreflex control of renal sympathetic nerve activity after spinal lesions in the rat[J]. Regulatory, Integrative and Comparative Physiology, 2011, 301(5): R1584-R1590.
[29] NOH M R, JANG H S, KIM J, et al. Renal sympathetic nerve-derived signaling in acute and chronic kidney diseases[J]. International Journal of Molecular Sciences, 2020, 21(5): 1647.
[30] LLEWELLYN-SMITH I J, WEAVER L C, KEAST J R. Effects of spinal cord injury on synaptic inputs to sympathetic preganglionic neurons[J]. Progress in Brain Research, 2006, 152: 11-26.
[31] REDSHAW J D, LENHERR S M, ELLIOTT S P, et al. Protocol for a randomized clinical trial investigating early sacral nerve stimulation as an adjunct to standard neurogenic bladder management following acute spinal cord injury[J]. BMC Urology, 2018, 18(1): 72.
[32] LEE C L, LEE J, PARK J M, et al. Sophisticated regulation of micturition: Review of basic neurourology[J]. Journal of Exercise Rehabilitation, 2021, 17(5): 295-307.
[33] MATSUTA Y, ROPPOLO J R, DE GROAT W C, et al. Poststimulation inhibition of the micturition reflex induced by tibial nerve stimulation in rats[J]. Physiological Reports, 2014, 2(1): e00205.
[34] 劉黎黎,董熙远,陈 彪.电针刺激三阴交穴对压力性尿失禁大鼠脊髓NMDA受体及α 2受体表达的影响[J].中华物理医学与康复杂志,2021,43(3):206-210.
[35] CRUZ Y, DOWNIE J W. Abdominal muscle activity during voiding in female rats with normal or irritated bladder[J]. Regulatory, Integrative and Comparative Physiology, 2006, 290(5): R1436-R1445.
〔收稿日期〕2022-07-04
〔基金项目〕国家自然科学基金面上项目(81874510);国家自然科学基金青年项目(82205255);湖南省自然科学基金青年项目(82019JJ50437,
2022JJ40312);湖南省大学生创新创业训练计划项目(S202110541019);湖南省教育厅科研项目(20C1432)。
〔第一作者〕张雨辰,女,博士研究生,研究方向:常见疾病针灸康复机制的研究。
〔通信作者〕*张 泓,男,教授,博士研究生导师,E-mail:zh5381271@sina.com;艾 坤,男,副教授,硕士研究生导师,E-mail:aikun650@qq.com。
