水稻根际土壤解磷细菌筛选及其解磷机制研究
2023-05-29潘林弥春霞徐青山魏倩倩孔亚丽朱练峰田文昊金千瑜张均华朱春权
潘林 弥春霞 徐青山 魏倩倩,3 孔亚丽朱练峰 田文昊 金千瑜 张均华* 朱春权*
(1 牡丹江师范学院,黑龙江 牡丹江 157011;2 中国水稻研究所/水稻生物育种全国重点实验室,杭州 310006;3 安徽大学,合肥 230601;#共同第一作者;*通迅作者:zhangjunhua@caas.cn;zhuchunquan@caas.cn)
磷是植物生长发育必需的营养元素,不仅是细胞膜和三磷酸腺苷(ATP)的主要组成成分,也参与植物光合作用等生理生化反应[1]。磷在土壤中易通过化学固定、吸附和生物固定等作用形成不能被植物直接吸收利用的难溶态磷,从而对作物造成缺磷胁迫。据统计,我国约2/3 面积的耕地处于缺磷状态[2]。农业生产通过施加磷肥保障作物对磷的吸收。然而,作物对磷的当季利用率很少超过25%[3]。目前,我国耕地土壤中的总磷含量为0.2~1.1 g/kg,将土壤中这部分固定态磷释放出来供作物利用,是提高磷利用效率和促进农业生产绿色可持续发展的重要研究方向。
土壤中存在具有解磷能力的细菌,统称为解磷细菌,其可通过自身代谢产物或其他作用将土壤中固定的磷转化成可被植物直接吸收的有效磷,从而提高植物对磷的利用率,促进植物生长发育[4]。目前,解磷细菌的解磷机制主要包括:降低土壤pH 值促进土壤中难溶态磷的释放,比如通过呼吸作用产生CO2,对生物残渣分解产生酸性物质,与NH4+发生同化反应产生质子,合成和释放硫化氢及释放有机酸等途径降低土壤pH值[5-9];通过分泌磷酸酶、植酸酶、核酸酶和脱氢酶等胞外酶类物质降解土壤中的有机磷[10]。
作者从水稻根际土壤中筛选得到2 株解磷细菌,鉴定为阿氏芽孢杆菌(Priestia aryabhattai)和甲壳虫WSH-0021 细菌(Bacillus megaterium WSH-0021)。我们将筛选得到的解磷细菌分别接种至2 种不同磷含量的土壤进行培养,30 d 后通过测定土壤微生物量磷、细菌丰度、有效磷含量、磷酸酶活性和pH 值等,分析其解磷能力和解磷机制,为后期解磷细菌的开发和应用提供理论依据。
1 材料与方法
1.1 目的菌株的筛选与鉴定
提取中国水稻研究所富阳基地大田中水稻根际土,用灭菌超纯水对水稻根际土以土水比1∶10(质量比)进行重悬,然后进行10 倍的梯度稀释,将稀释液分别涂布于解无机磷细菌和解有机磷固体筛选培养基。筛选获得的细菌用LB 液体培养基进行扩繁,连续传代3 次后,运用16s rRNA(27f 和1492r)进行菌液PCR,获得的产物送至杭州有康生物科技有限公司进行测序,然后在NCBI 上进行比对,最终得到2 种细菌,分别为阿氏芽孢杆菌(从解有机磷细菌鉴定培养基上获得)和甲壳虫WSH-0021 细菌(从解无机磷细菌鉴定培养基上获得)。
将鉴定得到的2 种解磷细菌分别加入解无机磷细菌和解有机磷液体培养基中培养,以灭菌的解无机磷细菌和解有机磷液体培养基作为对照,培养条件为30 ℃和180 rpm,当菌液OD600 为0.5 时测定液体培养基中的有效磷含量,以不接菌的培养基作为对照。
解无机磷细菌筛选和鉴定培养基配方:葡萄糖10 g/L,硫酸铵0.5 g/L,酵母浸粉0.5 g/L,氯化钾0.3 g/L,氯化钠0.3 g/L,硫酸镁0.3 g/L,硫酸锰0.03 g/L,硫酸钾0.3 g/L,硫酸亚铁0.03 g/L,磷酸钙5.0 g/L,pH 值7.0~7.5。根据需要添加15 g/L 琼脂。解有机磷细菌筛选和鉴定培养基配方:葡萄糖10 g/L,硫酸铵0.5 g/L,氯化钠0.3 g/L,硫酸镁0.3 g/L,硫酸锰0.03 g/L,硫酸钾0.3 g/L,硫酸亚铁0.03 g/L,卵磷脂0.2 g/L,碳酸钙1.0 g/L,pH值7.0~7.5。根据需要添加15 g/L 琼脂。肉汤培养基(LB)配方:胰蛋白胨10 g/L,酵母浸出粉5 g/L,氯化钠10 g/L,pH 值7.0~7.2。
1.2 土壤培养实验
分别采集浙江省杭州市富阳区学院路茶园和中国水稻研究所水稻田0~20 cm 表层土壤(分别命名为土样1 和土样2),将土壤放入采集袋中,风干过筛后备用。土样1 和土样2 的全磷含量分别为0.24 g/kg 和0.75 g/kg,有效磷含量分别为4.93 mg/kg 和14.92 mg/kg,pH 值分别为5.84 和6.27。
将筛选得到的2 种细菌分别在LB 液体培养基中进行扩大培养,在30 ℃、180 rpm 条件下振荡培养,待菌液OD600 为0.5 时取出菌液,以菌液∶土壤=12 mL∶100 g 的比例添加菌液,调节土壤绝对含水量为20%。对照土壤添加不接细菌的灭菌培养基。培养7 d 后,取土样备用。每个样品3 次重复。
1.3 菌株生长曲线绘制
将菌株接入LB 液体培养基中,在30 ℃、180 rpm条件下进行震荡培养,每隔1 h 取样1 次,并测定菌液OD 值和pH 值,绘制生长曲线[11]。每个样品3 次重复。
1.4 磷含量测定
土壤和液体培养基中的磷含量采用钼锑抗比色法[12]测定。每个样品重复3 次。
1.5 土壤细菌丰度测定
用土壤DNA 快速提取试剂盒(Fast DNA SPIN Kit for Soil)提取土壤微生物总DNA。用不同含有16s rRNA 片段的质粒制作标曲。根据Ct 值和土壤干质量计算土壤样品中细菌的总拷贝数。采用16s rRNA-F(5′-ACTCCTACGGGAGGCAGCAG-3′)和16s rRNA-R(5′-ATTACCGCGGCTGCTGG-3′)进行实时荧光定量PCR。其中PCR 反应体系为:DNA 模板2.5 μL,引物(10 μmol/L)各1.5 μL,Sybgreen 25 μL,dd H2O 19.5 μL。反应条件为:94 ℃3 min;94 ℃1 min,52 ℃1 min,72 ℃1.0 min,32 个循环;72 ℃10 min。
1.6 酸性磷酸酶活性测定
称取5 g 土壤置于200 mL 三角瓶中,加入2.5 mL甲苯,轻摇15 min,加入20 mL 0.5%的磷酸二甲苯,摇床中37 ℃过夜培养,随后加入100 mL 0.3%的硫酸铝溶液并过滤。吸取3 mL 滤液,采用磷酸苯二那比色法测定酸性磷酸酶活性[13]。
1.7 土壤pH 测定
将风干土壤按照水土比2.5:1 的比例混合,在25 ℃、180 rpm 条件下振荡30 min,静置后用pH 计测定pH[14]。
1.8 土壤微生物量磷含量测定
每个样品称取2 组土壤,1 组采用熏蒸法处理,1 组不熏蒸。将2 组样品分别吸取25 mL 于150 mL 三角瓶中,加入1 mL 33%硫酸溶液,加入4 mL 15%过硫酸钾溶液。放入高压灭菌锅,20 min 取出。采用钼锑抗比色法测定土壤中磷含量[15]。
2 结果与分析
2.1 解磷细菌筛选和鉴定
在解有机磷和解无机磷固体培养基分别筛选得到的细菌,运用16s rRNA 扩增后进行测序,将测得序列在NCBI 网页中进行同源性比较,结果得出解有机磷细菌筛选得到的细菌与阿氏芽孢杆菌同源性为99%,解无机磷细菌培养基中筛选得到的细菌与甲壳虫WSH-0021 细菌同源性为99%。
观察2 种菌的菌落结构,发现阿氏芽孢杆菌的菌落小,呈黄色,形状不规则,菌落较透明,周围稍突起,有溶磷圈(图1 A)。甲壳虫WSH-0021 菌落小,呈黄色,圆型,菌落不透明,较湿润,周围无突起(图1 B)。

图1 筛选得到的两种解磷细菌的菌落形态
阿氏芽孢杆菌在LB 培养基中培养的前8 h 处于延缓期,8 h 后进入对数期,生长发育迅速,培养基的pH 值也迅速下降,从7.00 下降至6.45 左右;12 h 后细菌进入稳定期(图2 A)。甲壳虫WSH-0021 细菌延缓期较长,在前12 h 处于延缓期,12 h 后进入对数期,培养基的pH 值也迅速下降,从7.00 下降至6.47;17 h 后细菌进入稳定期(图2 B)。

图2 阿氏芽孢杆菌(A)和甲壳虫WSH-0021 细菌(B)的生长曲线和pH 变化
2.2 解磷能力鉴定
将筛选得到的2 株细菌分别培养在有机磷和无机磷鉴定培养基中,24 h 后测定上清液中的有效磷含量。结果显示,接种阿氏芽孢杆菌后,解有机磷鉴定培养基中的有效磷含量从3.05 mg/L 增加到了57.920 mg/L,增幅1 799.02%;接种甲壳虫WSH-0021 细菌后,解无机磷鉴定培养基中的有效磷含量从204.28 mg/L 增加到了1 004.60 mg/L,增幅391.78%(表1)。
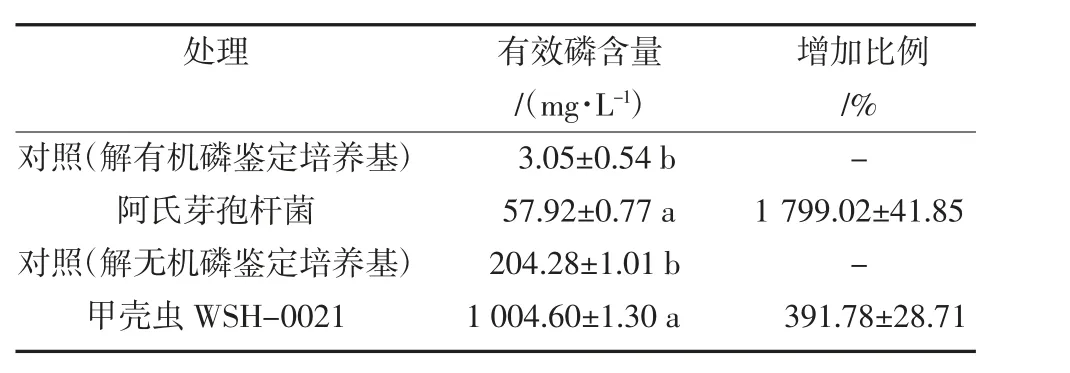
表1 2 种解磷细菌解磷能力鉴定
2.3 土壤中解磷能力鉴定
2 株细菌接种至不同磷含量的土样后培养7 d,分别测定土壤细菌丰度。从表2 可见,接种阿氏芽孢杆菌和甲壳虫WSH-0021 细菌后均显著增加土壤的细菌丰度。土样1 的细菌丰度从1.33 ×109copies/g DW 分别增加至7.61 ×109copies/g DW 和53.20 ×109copies/g DW,增幅分别为3 900.00%和148.99%;土样2 的细菌丰度活性从38.99 ×109copies/g DW 分别增加至92.35×109copies/g DW 和97.08 ×109copies/g DW,增幅分别为136.86%和148.99%。
从表3 可见,接种阿氏芽孢杆菌和甲壳虫WSH-0021 细菌后均显著增加土壤的微生物量磷含量。土样1的微生物量磷含量从1.89 mg/kg 分别增加至6.35 mg/kg和39.58 mg/kg,增幅分别为235.98%和1 994.18%;土样2 的微生物量磷含量从2.70 mg/kg 分别增加至48.25 mg/kg 和3.17 mg/kg,增幅分别为1 687.03%和17.41%。

表3 土壤中微生物量磷测定结果
从表4 可见,接种阿氏芽孢杆菌显著增加土样1中的有效磷含量从4.68 mg/kg 增加至5.32 mg/kg,增幅13.68%。阿氏芽孢杆菌虽然增加了土样2 中的有效磷含量,增幅为12.07%,但差异不显著。接种甲壳虫WSH-0021 细菌显著增加土样1 和土样2 中的有效磷含量,分别从4.68 mg/kg 增加到5.67 mg/kg 和从12.92 mg/kg 增加到19.47 mg/kg,增幅分别为21.15%和11.66%。
2.4 土壤的pH 变化
从表5 可见,接种阿氏芽孢杆菌和甲壳虫WSH-0021 细菌后均显著降低土壤的pH 值,其中土样1 的pH 值从5.84 分别降低至5.57 和5.67,土样2 的pH 值从6.27 分别降低至5.86 和5.87。

表5 土壤pH 值变化
2.5 土壤中的酸性磷酸酶活性
从表6 可见,接种阿氏芽孢杆菌和甲壳虫WSH-0021 细菌后均显著增加土壤的酸性磷酸酶活性。土样1 的酸性磷酸酶活性从0.26 mg/(kg·h)分别增加至0.62 mg/(kg·h)和0.45 mg/(kg·h),增幅分别为138.46%和73.07%;土样2 的酸性磷酸酶活性从0.05 mg/(kg·h)分别增加至0.92 mg/(kg·h)和0.22 mg/(kg·h),增幅分别为1 760.00%和3 400.00%。
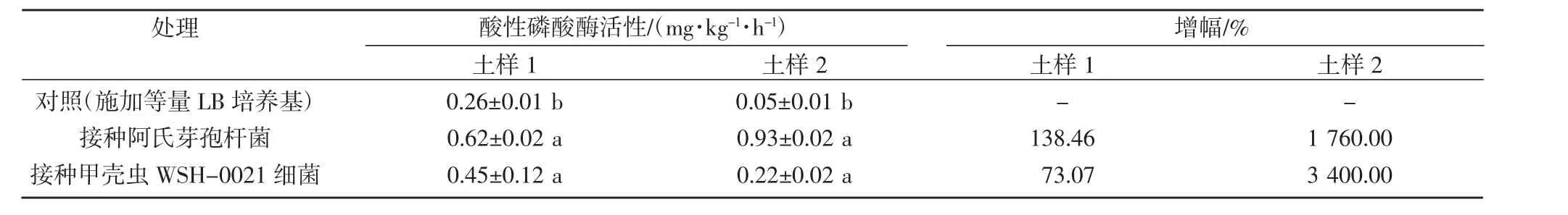
表6 土壤中酸性磷酸酶活性变化
3 结论与讨论
解磷微生物包括解磷细菌、解磷真菌和解磷放线菌,其中以解磷细菌效果最好。朱德旋等[16]筛选出的伯克霍尔德菌属高效解磷菌,在含磷酸三钙的无有效磷培养基中培养4 d 后,其发酵液中可溶性磷含量高达832.74 mg/L,将菌接种至土壤后,不仅显著提高水稻根际土中的有效磷含量,还显著提高水稻的分蘖数、株高、根长和千粒重。接种菌株BS06 高效解磷菌显著提高甘蔗茎、叶、根等器官中的总磷含量,同时提高甘蔗的株高和干质量[17]。本实验中筛选得到的阿氏芽孢杆菌和甲壳虫WSH-0021 细菌,在不含有效磷的液体培养基中培养24 h 后,其液体培养基中的可溶性磷含量分别比对照增加了1 799.02%和391.78%(表1),说明我们筛选得到的菌株同样为高效解磷细菌;将菌株分别接种至2 种土样后培养30 d,土壤中的有效磷含量均显著增加,其中,接种阿氏芽孢杆菌后,土样1(低磷土壤)中有效磷增加了13.68%,土样2(正常磷土壤)中的有效磷增加了12.07%,接种甲壳虫WSH-0021 细菌后,土样1 中有效磷增加了21.15%,土样2 中有效磷含量增加了11.66%(表4),进一步证明了我们筛选得到的2 种解磷细菌的高效解磷能力。
降低周围环境pH 值是解磷细菌的解磷机制之一[21]。降低pH 的过程中,环境中H+数量增多,H+与土壤中与磷酸根离子结合的铁、铝、钙、镁等金属离子发生螯合反应,减少金属离子对磷结合位点的竞争,从而释放磷酸根离子,增加有效磷含量[22]。比如解磷细菌肠杆菌(Enterobacter)通过分泌乙酸和葡萄糖酸降低环境pH 值,从而提高环境中有效磷含量和提高小麦生长[23]。假单胞菌属解磷细菌通过呼吸作用或同化NH4+释放H+,从而通过降低培养液pH 值进行解磷作用[24]。本次实验结果显示,2 种细菌生长曲线测定过程中,其培养基的pH 值均显著下降,在土壤中接种细菌培养30 d后,2 种细菌同样降低土样1 和土样2 的pH 值,证明我们筛选的解磷细菌亦是通过制造酸性环境进行解磷作用。
分泌磷酸酶是解磷微生物的另一种解磷机制[5]。磷酸酶是生物磷代谢的重要酶类,可通过水解土壤中含有机磷化合物释放无机磷。磷酸酶的活性直接影响土壤有机磷的分解、转化和生物有效性[25]。缺磷环境下,解磷细菌可通过分泌磷酸酶矿化有机磷酸盐,促进有机磷转化为无机磷,提高植物的磷素吸收率[26]。磷酸酶活性与环境pH 和有效磷含量直接相关[27]。庄馥露等[28]研究显示,其筛选出的10 株解磷菌均能向外分泌酸性磷酸酶,通过定量测定后发现,PsbM4 解磷细菌的酸性磷酸酶活性最高。毕银丽等[29]发现,在土壤中接种解磷菌后,能显著提高玉米根际土壤中酸性磷酸酶活性。王法威等[30]在土壤中接种A9 解磷菌,发现其显著提高土壤中的酸性磷酸酶活性和有效磷含量,最终促进大豆的生长。本实验研究发现,在土壤中接种2 种解磷菌后,显著提高土壤中的酸性磷酸酶活性。其中,接种阿氏芽孢杆菌和甲壳虫WSH-0021 细菌后,土样1 中的酸性磷酸酶活性分别增加138.46%和73.07%,土样2 中的酸性磷酸酶活性分别增加1 760.00%和3 400.00%,说明本实验筛选得到的2 种解磷菌也通过向外分泌磷酸酶进行解磷。
