遗传性结直肠癌及其基因阻断的研究现状与患者的临床管理
2023-05-29陈园园颜宏利
陈园园,颜宏利
海军军医大学第一附属医院生殖医学中心 上海 200433
结直肠癌是目前人类第三大常见癌症,占全球每年总死亡人数的8%以上[1]。随着环境暴露、职业暴露、生活方式、筛查手段等的变化,结直肠癌发病率和死亡率均呈逐年上升趋势。遗传性结直肠癌是结直肠癌中存在遗传背景(相关基因胚系突变)的类型,占结直肠癌总病例数的10%,且这一比例在年龄小于50岁的早发性结直肠癌患者中高达16%~18%[1-6]。随着临床诊疗、检测技术水平的提高,越来越多的结直肠癌相关基因突变被发现,遗传性结直肠癌的检出率将进一步提高。目前,遗传性结直肠癌的诊断主要依赖临床表现、家族史和基因检测技术。充分的家族史问诊是临床诊疗的重要环节,有助于发现遗传性结直肠癌。对于结直肠癌患者,若有2名及以上的一级或二级亲属患有结直肠癌即可诊断为家族性结直肠癌,占结直肠癌总病例数的20%左右。对于家族性结直肠癌患者,更应警惕、判断其是否为遗传性,这有助于分析患者病因,亦有助于发现家族中未发病成员,以实现早期干预[5]。
遗传性结直肠癌相关基因的胚系突变特点,意味着其可遗传至下一代。此外,该类患者发病早,常处于育龄期或育龄前期,如何避免其致病基因遗传是患者经常提出的问题。基于这一问题,本文概述遗传性结直肠癌不同亚型的基因突变类型和基因突变的检测方法,并重点论述如何利用基因阻断技术为该类患者的优生优育策略提供参考。
1 基因突变在遗传性结直肠癌中的特征、检测方法及患者的随访管理
遗传性结直肠癌根据有无息肉大致可分为二类:一类为非息肉病性结直肠癌,其中以Lynch综合征为主要代表。另一类以息肉病为特征,包括家族性腺瘤性息肉病(familial adenomatous polyposis,FAP);遗传性色素沉着消化道息肉病综合征(Peu⁃tz-Jeghers syndrome,PJS);幼年性息肉综合征(ju⁃venile polyposis syndrome,JPS)和锯齿状息肉病综合征(serrated polyposis syndrome,SPS)等[2,7]。
Lynch综合征是一种常染色体显性遗传肿瘤综合征,占所有结直肠癌患者的2%~4%,是最常见的遗传性结直肠癌综合征[2,5,8]。该病发病年龄较早,中位发病年龄约为42.8岁,既往诊断主要依赖家族史[9]。目前已证实的Lynch综合征相关致病基因包括MMR家族中的MLH1、MSH2、MSH6、PMS2基因。MLH1和MSH2是最主要的相关致病基因,其胚系突变占Lynch综合征基因突变的80%~90%;此外,EPCAM基因缺失导致MSH2启动子高度甲基化,引起MSH2沉默,亦可导致Lynch综合征[2,10-11]。对于相关致病基因携带者,目前建议从20~25岁即开始行结肠镜检查,其后每1~2年复查一次;若家族中曾有结直肠癌初发年龄<30岁的成员,则建议初始筛查年龄再提前2~5年[2,12]。
FAP 依据遗传病因和临床表型的不同,可分为经典型家族性腺瘤性息肉病(classical FAP,CFAP),衰减型家族性腺瘤性息肉病(attenuated FAP,AFAP),MUTYH基因相关的家族性腺瘤性息肉病(MUTYH-associated polyposis,MAP),Gard⁃ner 综合征,Turcot 综合征等亚型[2,13]。APC基因突变是FAP 最常见的致病原因,呈常染色体显性遗传;此外,还有呈常染色体隐性遗传的MUTYH基因突变,呈常染色体显性遗传的POLE、POLD1基因突变,以及呈常染色体隐性遗传的NTHL1基因突变[12]。FAP 患者的最早发病年龄为6 岁[14],有家族史的FAP 患者常于青春期发病。对于该类患者及相关致病基因携带者,目前建议从10~15岁开始,每年进行一次乙状结肠镜或结肠镜检查,从25~30岁开始随访相关肠外肿瘤,如甲状腺癌、肝癌、胆管癌、中枢神经系统恶性肿瘤[2,15-16]。
PJS简称黑斑息肉病,是一种由LKB1/STK11基因胚系突变引起的常染色体显性遗传病,以特定部位皮肤黏膜色素斑和胃肠道多发错构瘤息肉为特征[2,12,17]。PJS患者应定期进行内镜检查,尤其是小肠镜随访检查;应对确诊患者及其家系成员进行LKB1/STK11基因胚系突变的检测[2]。JPS 是一种由BMPR1A或SMAD4基因突变引起的常染色体显性遗传病,以胃肠道(主要是结直肠)多发幼年性息肉为特征[2,12,18]。SPS即既往所指的增生性息肉综合征,以结肠内多发和(或)较大的锯齿状息肉为主要临床特征,此类病变中存在KRAS和(或)BRAF基因体细胞突变。病变部位、类型不同,其所伴有的基因突变情况也存在一定差异[2,12,19]。
为更好地实现对遗传性结直肠癌的预防、早诊、早治,建议基于目前已证实的相关致病基因,诸如MLH1、MSH2、MSH6、PMS2、EPCAM、APC、MUTYH、POLE、POLD1、NTHL1、LKB1/STK11、BMPR1A、SMAD4,对先证者及其家系成员进行基因诊断,继而找到致病基因携带者,并对这些高危人群进行风险管理[2,5]。对于遗传性结直肠癌患者及其家系成员的遗传学检查,建议使用多基因组合的二代测序技术(next-generation sequencing,NGS)进行基因突变检测。该法的优势在于,除对已知特定基因的检测外,可同时评估涉及多种遗传性癌症综合征的多个基因,有助于识别可能遗漏的遗传性癌症综合征。但该技术目前仅在部分医疗机构开展,大部分基层医疗机构往往需将患者样本送至第三方检测机构进行检测,检测周期相对较长(平均1个月左右)、检测费用较高(1万元左右),且所得检测结果需由从事遗传学诊疗的专业人士加以解读。对于NGS 未能检出,但又高度怀疑存在基因突变的,可行多重连接探针扩增(multiplex ligation-de⁃pendent probe amplification,MLPA)、全外显子测序、全基因组测序等方法进行突变基因的确认[12,20-21]。
2 遗传性结直肠癌的基因阻断技术
对于明确携带胚系突变致病基因的患者,其致病基因有可能通过遗传向下一代传递。大部分遗传性结直肠癌患者发病年龄早、确诊年龄轻,在考虑生育时,可借助基因阻断技术阻止致病基因遗传。
第三代试管婴儿辅助生殖技术是目前阻断致病基因遗传的主要方法。通过体外受精获得的胚胎,在植入母体前进行胚胎植入前遗传学检测,挑选出不携带致病基因的胚胎进行移植,从生命的“源头”阻断遗传性肿瘤的家族遗传,有助于避免不必要的人工终止妊娠对母体身心造成的伤害。
遗传性结直肠癌基因阻断技术的具体实施流程如下:
(1)对结直肠癌患者进行遗传咨询和基因检测,明确其携带的肿瘤遗传致病基因。
(2)女方通过控制性促排卵技术获得卵母细胞,男方取精,通过卵胞质内单精子显微注射技术,将优质精子注射进卵母细胞,体外培养获得受精卵。
(3)待受精卵在体外培养至第5~6 天,进行胚胎滋养层细胞活检。
(4)对活检细胞进行胚胎植入前单基因遗传学检测(preimplantation genetic testing for monogen⁃ic,PGT-M)。对于家系齐全的患者,可以通过遗传型家系构建单体型行PGT-M,对于家系不全或存在新发基因突变的患者,可以通过胚胎互推、三代测序等方式行PGT-M,从而判断胚胎是否携带致病基因。
(5)根据患者的实际情况,女性患者需待肿瘤缓解后,经会诊确定其可考虑生育时,挑选经过PGT-M 检测的已排除致病基因携带的胚胎进行胚胎移植术。
(6)女方妊娠后,可以进一步结合产前诊断技术,验证胎儿未携带致病基因,确保肿瘤遗传致病基因未向下一代传递。
该技术可在有第三代试管婴儿辅助生殖技术资质的生殖医学中心进行。基因阻断技术不仅适用于遗传性结直肠癌患者,对于其他遗传性疾病患者,在有生育计划、为阻断家系疾病遗传时,也可以考虑采用。
3 遗传性结直肠癌患者和肿瘤遗传致病基因携带者的生育力管理
除对遗传性结直肠癌患者通过第三代试管婴儿辅助生殖技术进行肿瘤遗传致病基因阻断外,对于育龄前期或暂无生育计划的患者,更需要考虑到肿瘤本身和抗肿瘤治疗将对患者的生育力造成的损伤,应积极保护其生育力[22]。
对于携带肿瘤遗传致病基因的人群,即使未发生肿瘤,基因突变常会导致患者生育窗口期缩短,在证实其携带肿瘤遗传致病基因时,即应对其开展进一步的遗传咨询,建议其行生育力保护,对已婚并有生育计划的人群,更应积极鼓励其尽早接受PGT-M辅助生殖技术[22]。
无论是已确诊的遗传性肿瘤患者,还是已证实的肿瘤遗传致病基因携带者,若其有生育意愿,均应积极地给予及时的遗传咨询和生育力保护咨询,充分评估肿瘤及抗肿瘤治疗对其生育力的影响,告知患者其所面临的生育风险,争取在肿瘤发生前或治疗前进行生育力保护,从而为后期阻断致病基因遗传、生育健康后代提供机会。
对于已婚的遗传性结直肠癌患者或已证实的肿瘤遗传致病基因携带者,无论性别,均建议首选第三代试管婴儿辅助生殖技术。对于新确诊的患者,应积极争取在抗肿瘤治疗前取卵或取精;若已行抗肿瘤治疗,可根据具体的治疗方案进行多学科会诊以确定是否可行辅助生殖技术干预,以最大程度减少抗肿瘤治疗对生殖细胞造成的损伤。
对于未婚的女性患者,如已性成熟,可行卵巢刺激控制性促排卵、B超引导下经阴道取卵,将获得的成熟卵母细胞进行冷冻保存;如获得未成熟卵母细胞,可行体外成熟培养(in vitro maturation,IVM)后加以冷冻保存。青春期前确诊的女性患者,可考虑行卵巢组织冷冻,同时应对卵巢组织多点取样行病理检查,以排除肿瘤细胞的卵巢组织种植。对于女性携带者,可待其性成熟后尽早进行卵母细胞冷冻,以保护其生育力。
对于未婚的男性患者,如已性成熟,可行精子冷冻保存,该法简便、易行,建议至少保存3份精液样本,采集时间至少间隔2天,以更好保证后期辅助生殖所需用量。青春期前确诊的男性患者,可考虑行睾丸组织冷冻,同时亦应多点取样行病理检查,以排除肿瘤细胞的睾丸组织种植。对于男性携带者,可待其性成熟后尽早进行精液冷冻,以保护其生育力。
4 遗传性结直肠癌基因阻断的全流程解决方案及相关问题
对于遗传性结直肠癌患者和肿瘤遗传致病基因携带者,均建议其尽早接受遗传咨询,在肿瘤治疗前甚至在肿瘤发生前,尽早启动生育力保护干预,根据患者的年龄和婚姻状况选择采用配子、性腺组织或胚胎冷冻保存技术,采用PGT-M 技术对胚胎进行检测以排除胚胎携带致病基因,在合适的时机将健康胚胎植入母体,为患者生育健康后代提供机会(图1)。基因阻断干预的整个流程涉及到肿瘤科、生殖医学中心、妇产科等相关学科共同提供的临床诊疗、遗传咨询、检测技术,从肿瘤患者的管理到健康后代出生,需要多学科通力合作(图2)。此外,其他遗传性肿瘤的基因阻断干预均可借鉴该多学科联合诊疗模式。
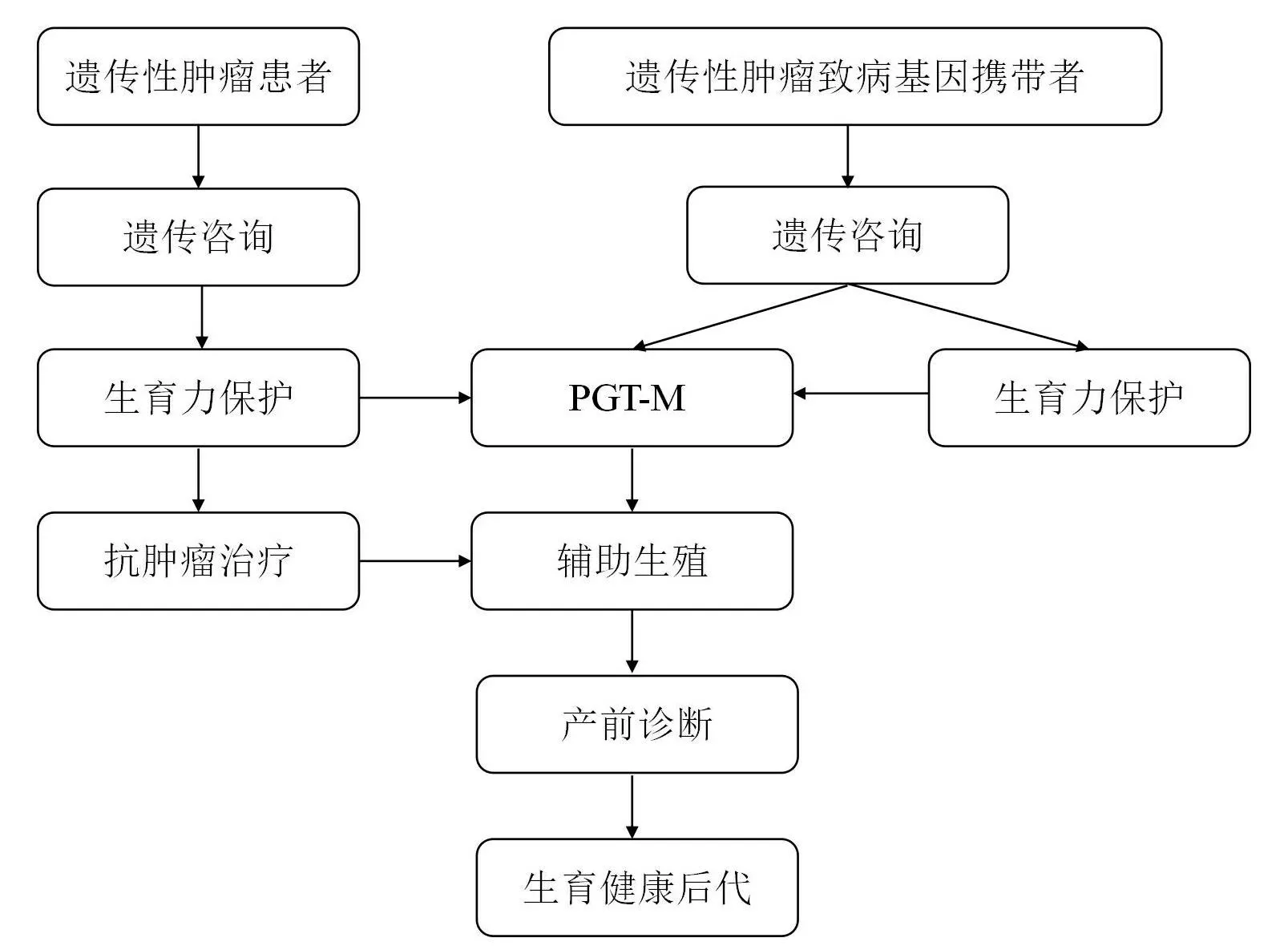
图1 遗传性肿瘤的基因阻断干预流程

图2 遗传性肿瘤基因阻断的多学科会诊方案
在遗传性结直肠癌基因阻断的全流程方案中,还有部分技术仍待完善。一方面,配子的冷冻保存技术尚未完全成熟。对于女性患者,卵母细胞冷冻保存的复苏存活率仅为70%~80%,其操作流程及条件有待进一步改进;未成熟卵母细胞的IVM 技术尚未达成共识且未形成标准操作流程,各家生殖医学中心方案不一、效果不一,技术也有待进一步提高;卵巢组织的冷冻和植回效果依赖于妇产科的技术水平,国内目前仅有少数单位可以开展相关技术[23-24]。对于青春期前的男性患者,在不能通过体外排精获得精子的情况下,需采用睾丸组织冷冻保存技术,但该技术的复苏存活率较低,尚停留在实验室研究阶段,未达成技术共识,亦未得到推广应用,该技术水平亟需进一步提高[25]。另一方面,遗传性肿瘤的基因阻断技术尚未在各级医疗机构中得以开展。即使在没有完整资质的医疗机构,也应及时向遗传性肿瘤患者告知生育力保护和基因阻断的必要性和可行性,建议联合生殖医学中心、产前诊断(遗传咨询)中心等开展多学科会诊,确保遗传性肿瘤患者和肿瘤遗传致病基因携带者尽早得到有效的生育咨询和相关干预。对于女性肿瘤患者肿瘤缓解后生育时机的选择,建议由生殖医学中心、妇产科联合评估(风险),并对妊娠患者进行随访管理,以期为患者孕育健康后代提供机会。
5 小结与展望
随着临床诊疗技术的进步,越来越多的遗传性结直肠癌患者得以早期诊断,这为改善患者预后提供了更多的有利条件,提高患者的生育质量是其中一个重要方面。随着检测技术的进步,必将有更多致病突变位点得以发现,检测的便捷性将大幅提高,检测费用也会随之降低,为随之带来的遗传学诊疗提供更广阔的空间。结合辅助生殖技术,可以对有生育意愿的遗传性结直肠癌患者及肿瘤遗传致病基因携带者进行生育力保护和基因阻断,避免致病基因向下一代传递,实现优生优育。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。
