纳米塑料-脲酶蛋白冠的形成及特征
2023-05-29张秋歌喻燕妮戴伟栾亚宁
张秋歌,喻燕妮,戴伟,栾亚宁
(北京林业大学林学院/森林培育与保护教育部重点实验室,北京 100083)
自然环境中大量被遗弃的塑料在长时间物理(机械磨损)、化学(紫外光降解)和生物(生物降解)作用下发生破碎所形成的尺寸较小、形状各异的微塑料[1-2]和纳米塑料(nanoplastics,NPs)[3],成为全球性环境污染的重要原因[4-6]。纳米塑料主要指粒径低于1 000 nm的塑料颗粒[7-10],在环境和生物体内的累积效应不仅会导致环境污染,且极可能引发生物毒性[5]。目前已经发现纳米塑料广泛分布于土壤[11]、水体[6]和大气[2],其中,农林业地膜的使用、污水污泥的灌溉、有机肥的施用、大气沉降以及垃圾填埋场渗滤液下渗等多途径的影响使土壤具有最高的纳米塑料分布丰度[12]。
已有研究表明,纳米材料因具有比表面积大、吸附力强和易官能化等独特性质[13]使其与生物大分子相互作用形成冠状物,即蛋白冠[14],从而改变纳米材料原有的界面性质和生物大分子的构象和活性,并可能引发一系列的生物学效应[15]。纳米塑料与纳米材料相似,同样具有比表面积大、吸附力强和易官能化等特征。脲酶不仅可以催化尿素迅速水解为二氧化碳和氨,利于氮的转化以及植物的氮素营养吸收,还可以通过参与蛋白氮的转运通路增强植物的防御抗逆性,对植物和土壤有着必不可少的重要意义[16],因此脲酶的研究受到更多的关注。但纳米塑料和土壤酶是否可以形成蛋白冠、形成后对纳米塑料和土壤酶原有性质是否产生影响、影响强度如何等一系列相关科学问题的研究至今尚未展开,限制了人们对纳米塑料在环境中影响作用的认识。为此,本研究以不同电性的纳米塑料和不同浓度的脲酶为研究对象,研究不同电性纳米塑料在不同浓度脲酶条件下蛋白冠的形成,探究蛋白冠对纳米塑料形貌特征以及脲酶构象和活性的影响。研究结果可为今后深入探究真实土壤环境中纳米塑料对植物生长的影响提供理论参考依据。
1 材料与方法
1.1 试验材料
不带电、带正电和带负电的3种平均粒径为200 nm的纳米塑料均购自天津大鹅科技有限公司。刀豆脲酶(CAS号:9002-13-5,易溶于水,4~8 ℃储存),购自西亚化学科技(山东)有限公司。
1.2 试验方法
1.2.1 纳米塑料-脲酶混悬液的制备将1 mg·mL-1的纳米塑料混悬液分别与0.05、0.20和0.50 mg·mL-1脲酶溶液进行等体积混匀,置于37 ℃、150 r·min-1恒温振荡器孵育4 h,制备得到不同处理条件的混悬液。混悬液于4 ℃条件下保存备用。
1.2.2 纳米塑料-脲酶蛋白冠的分离和纯化吸取2 mL混悬液置于离心管,超高速冷冻离心机4 ℃离心20 min(离心力17 000g),收集上清液,再次向离心管中加超纯水至刻度线处,离心并收集上清液,重复3次。收集后的上清液在4 ℃条件下保存备用。
1.2.3 纳米塑料-脲酶蛋白冠形貌特征分析利用真空冷冻干燥机对1.2.1节提取的沉淀物进行干燥。将样品置于制样片上,用离子溅射镀膜仪进行表面镀膜,最后用场发射扫描电子显微镜观察颗粒形貌特征。另外,在制样片上滴1滴不同处理的混悬液,干燥后通过原子力显微镜扫描分析颗粒表面粗糙度。
1.2.4 纳米塑料-脲酶蛋白冠水合粒径和Zeta电位测定分别将1 mL不同处理的混悬液置于粒径和电位的专用测量皿中,进行DLS水合粒径分析和Zeta电位检测。
1.2.5 纳米塑料对脲酶吸附量的测定考马斯亮蓝法分别测定混悬液和1.2.2节获取的上清液中脲酶含量,利用差减法计算纳米塑料对脲酶的吸附量(q),计算公式:q=(C1-C2)/C1×100%。式中:C1和C2分别为混悬液中脲酶总量和上清液中脲酶量(%)。
1.2.6 纳米塑料-脲酶蛋白冠构象的测定用不同电性纳米塑料与0.05 mg·mL-1脲酶制备获得的混悬液进行稳态荧光及圆二色性光谱分别测定脲酶的三级结构和二级结构,空白对照为纯水与0.05 mg·mL-1脲酶溶液等体积混合的溶液。荧光测定条件:激发波长为280 nm,发射光谱扫描范围300~500 nm;圆二色性光谱测定条件:N2条件下狭缝宽度为1 nm,检测波长为190~240 nm。使用Spectra Manager软件对CD光谱数据进行平滑预处理,保存后用Peakit 2.0进行基线校正与分峰拟合,波数范围选择190~240 nm,进行拟合计算得到二级结构相对含量。荧光光谱由Origin绘制。
1.2.7 脲酶活性的测定利用试剂盒(G20210714S,江苏艾迪生生物科技有限公司)通过靛酚蓝比色法测定吸光度A(紫外分光光度计测定波长578 nm,蒸馏水调零)。每毫升液体每分钟产生1 μg的NH3-N定义为1个酶活力的单位。
1.3 数据处理与分析
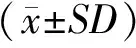
2 结果与讨论
2.1 不同电性纳米塑料对脲酶吸附量的影响
3种不同电性纳米塑料均能吸附脲酶,吸附量随脲酶质量浓度的增加而增加(表1)。其中,带正电纳米塑料对脲酶的吸附量显著高于其他处理,当脲酶质量浓度为0.50 mg·mL-1时,吸附量可达48.68%±6.86%。不带电和带负电纳米塑料对脲酶吸附量差异不显著。有研究表明,纳米颗粒和蛋白质之间的相互作用受纳米颗粒自身电荷和蛋白质浓度的影响[16-17],本研究也进一步证实纳米塑料对脲酶吸附量存在电荷差异和浓度效应,推测带正电的纳米塑料通过吸附脲酶形成蛋白冠的可能性最大[18]。
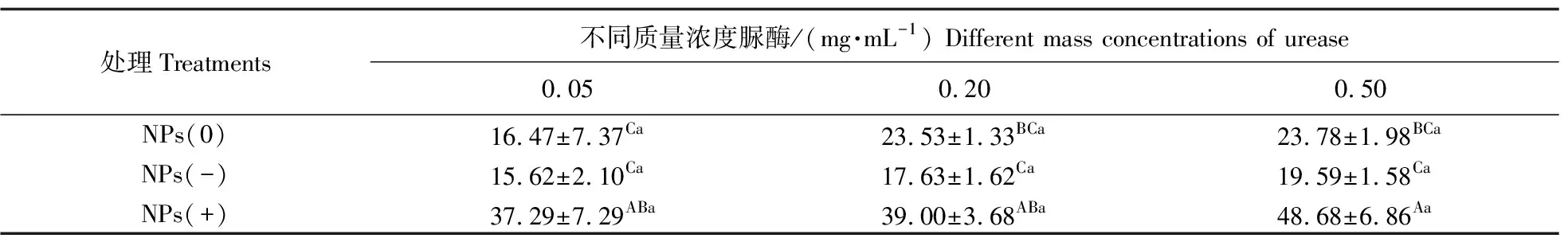
表1 不同质量浓度脲酶条件下3种纳米塑料对脲酶的吸附量Table 1 Effects of three nanoplastics with different charges and mass concentrations of urease on the adsorption capacity %

图1 不同质量浓度脲酶处理后纳米塑料蛋白冠电子显微镜(SEM)扫描图Fig.1 SEM image of nanoplastics protein corona treated by different mass concentrations of urease
2.2 不同电性纳米塑料-脲酶蛋白冠的形成
原纳米塑料颗粒具有表面光滑、形状规则和颗粒边界清晰等特征。但与脲酶发生吸附反应后,3种纳米塑料颗粒间均出现不同程度的粘连现象。具体表现为:1)相同脲酶质量浓度下正电纳米塑料粘连现象最明显;2)随脲酶质量浓度增加,相同电性纳米塑料粘连现象愈加严重(图1)。这些现象明确反映出3种电性纳米塑料都能和脲酶形成蛋白冠,但蛋白冠的形成强度随条件的不同表现出明显的差异性。
脲酶是含Ni+的金属酶,等电点为4.6~4.8[19],但在纯水环境下,其等电点大于4.8,带负电。这一特征更利于其与正电纳米塑料相互吸引形成蛋白冠,改变纳米塑料颗粒原有形貌。脲酶质量浓度越高,带正电纳米塑料对脲酶的吸附量越大(表1),因此降低了同种电荷的排斥力,提高了纳米颗粒间相互交联的桥梁作用[20-21],进一步促进了纳米颗粒的聚集和蛋白冠的形成。带负电纳米塑料和不带电的纳米塑料以及脲酶的电性特征不利于脲酶的吸附,导致相同脲酶质量浓度下脲酶的吸附量和颗粒间粘连现象都明显低于正电纳米塑料,2种纳米塑料可能通过其他途径吸附脲酶。因此,纳米塑料的带电性以及脲酶的带电性和浓度是影响蛋白冠的形成及改变颗粒形貌的关键因素。
2.3 蛋白冠对纳米塑料性质的影响
2.3.1 对表面粗糙度的影响从图2-A可知:不同脲酶质量浓度处理下形成的蛋白冠使纳米塑料表面失去其原有的平滑性,粗糙度均显著高于原纳米塑料(P<0.05)。结合扫描电子显微镜可以看出,随脲酶质量浓度的增加,纳米塑料颗粒表面粗糙度增加。这与邢畅[17]的研究结果一致。
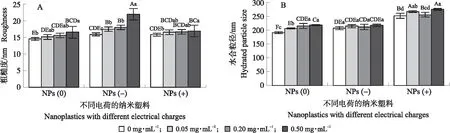
图2 不同电荷的纳米塑料与不同质量浓度脲酶作用对其颗粒表面粗糙度(A)和水合粒径(B)的影响Fig.2 Effect of different charges nanoplastics combined with different mass concentrations of urease on their particlesurface roughness(A)and hydrated particle size(B)不同大写字母表示不同电荷处理间的粗糙度和水合粒径的显著性(P<0.05);不同小写字母表示同种电荷不同质量浓度脲酶处理间粗糙度和水合粒径的显著性(P<0.05)。Different capital letters indicate roughness and hydration particle size significance between different charge treatments(P<0.05);Different lowercase letters indicate the significance of the same charge,different mass concentration,roughness between urease treatments and hydration particle size(P<0.05).
2.3.2 对水合粒径的影响脲酶吸附在纳米塑料表面造成颗粒水合粒径的改变,随着脲酶质量浓度的增加而显著增加(P<0.05)(图2-B)。3种电荷处理相比,带正电的纳米塑料与带负电的脲酶结合形成的蛋白冠使纳米塑料颗粒水合粒径更大。这与大多数的研究结果相符,如魏慧芳[22]研究表示,氧化铁纳米颗粒与4种蛋白质反应形成蛋白冠后,其水合粒径均大于原氧化铁纳米颗粒;夏凯[23]研究发现,纳米颗粒表面与4种不同的蛋白相互作用后形成的蛋白冠厚度不同,但是水合粒径均增大。
也有人认为,纳米塑料的尺寸大小与其表面曲率密切相关,是影响蛋白冠形成的重要因素[24]。Piella等[25]研究了不同尺寸纳米金颗粒表面蛋白冠的形成过程,发现蛋白冠的厚度取决于纳米金的尺寸,研究发现越小的颗粒,蛋白冠层越薄。结合动态光散射法测得的纳米塑料水合粒径不难发现,带正电的原纳米塑料颗粒大于不带电和带负电的纳米塑料颗粒,这表明纳米颗粒的粒径和表面修饰电荷是影响纳米塑料吸附脲酶的重要因素,与大部分的研究结果相符[22-25]。
2.3.3 对混悬液稳定性的影响在不同电荷及不同质量浓度的处理条件下,蛋白冠的形成均不同程度改变了原纳米塑料溶液的Zeta电位(图3)。一方面,不带电和带负电的纳米塑料与自身带负电的脲酶反应,负电荷增多,Zeta电位绝对值显著增加(P<0.05),溶液稳定性提升;与之相反的是,带正电的纳米塑料溶液则表现出随脲酶质量浓度增加,所带正电荷减少,Zeta电位减小,稳定性降低[17]。另一方面,在纳米塑料与脲酶结合过程中,溶液中结合和未结合蛋白处于动态平衡的状态,蛋白质吸附在纳米颗粒表面,相互作用较弱,形成“软蛋白冠”[14],结构松散,因此蛋白冠溶液分散性差,不稳定。因同电相斥,所以带负电微塑料溶液稳定性最好;因异电相吸,所以正电微塑料溶液稳定性最差;不带电的介于两者之间。
Dominguez-Melina等[26]认为蛋白冠能提升纳米颗粒胶体的稳定性;Gebauer等[27]则表明蛋白冠的形成会造成纳米颗粒的聚集。其中第1种结论认为,蛋白冠层无法有效克服范德华引力,其中蛋白质的性质和亲和力都会影响其聚集或沉淀的程度。第2种结论认为,吸附的蛋白质在纳米颗粒之间起着物理桥梁的作用。Cukalevski等[20]提出了关于蛋白冠与纳米颗粒稳定性的机制,即在蛋白含量较低时,通常会作为能够克服纳米颗粒之间电荷排斥力的“保护壳”使其彼此靠近,从而导致纳米颗粒的聚集。
2.4 蛋白冠对脲酶构象和活性的影响
2.4.1 对脲酶构象的影响蛋白质的内源荧光主要来源于芳香族氨基酸残基上的色氨酸(Trp)和酪氨酸(Tyr),内源荧光的变化直接反映了蛋白质中氨基酸残基本身及其周围环境的变化情况[22-23]。如图4所示,脲酶在激发波长为280 nm时,在327 nm左右处有1个荧光发射峰,该荧光峰主要由脲酶肽链色氨酸残基提供,酪氨酸次之。脲酶与3种电荷的纳米塑料结合,芳香族氨基酸残基的荧光发射峰强度逐渐下降,并发生了明显的蓝移,说明3种纳米塑料与脲酶肽链氨基酸残基都发生了较强的相互作用,脲酶表面Trp微环境疏水性增强。
在荧光峰移动过程中,295和312 nm处出现的2个明显荧光峰可以说明酪氨酸和色氨酸都是纳米塑料与脲酶相互结合反应的作用位点,表明蛋白冠的形成使脲酶结构发生了明显的重排,Tyr和Trp的相互作用可能明显减弱。此外,3种电荷纳米塑料的修饰位点相同,但荧光强度差异明显,其中带正电的纳米塑料使脲酶分子表面的芳香族氨基酸在表面转移至疏水核心,从而导致荧光强度增大,导致脲酶可能具有更高的疏水性,对脲酶的影响最强烈。
由荧光光谱可知,纳米塑料颗粒吸附脲酶,使脲酶分子构象发生了明显的重排,但是脲酶质量浓度对其影响不显著。为了进一步研究脲酶构象的变化,利用圆二色性光谱分析了蛋白质二级结构变化情况。从图5中可以看出,脲酶的圆二色性光谱在195 nm附近具有明显的正吸收峰,在220 nm附近具有1个连续的负吸收峰。随着脲酶与3种电荷的纳米塑料的结合,其吸收峰位置发生较大改变,表明脲酶分子表面发生构象重排,脲酶样本的二级结构相对含量如表2所示。
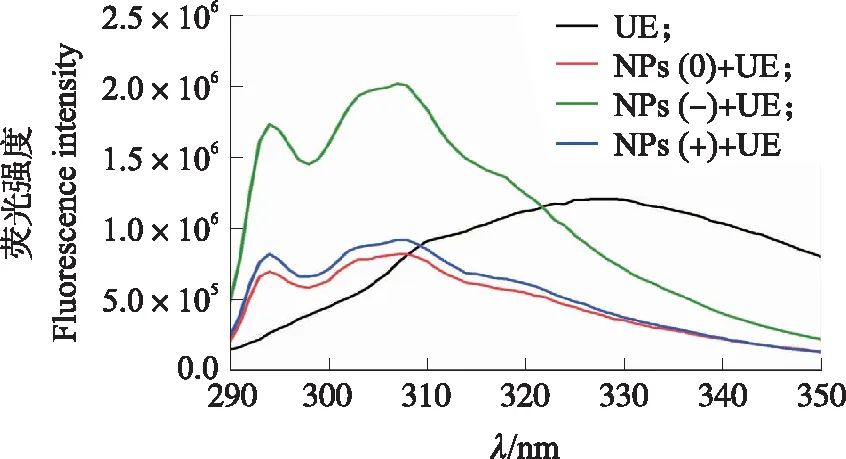
图4 不同电荷纳米塑料蛋白冠对脲酶(UE)荧光光谱的影响Fig.4 Effect of nanoplastics protein corona withdifferent charges on the fluorescencespectrum of urease(UE)
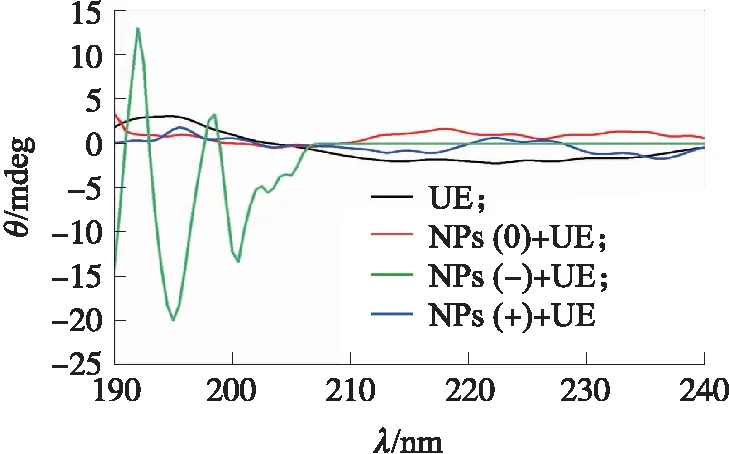
图5 不同电荷纳米塑料蛋白冠对脲酶圆二色性光谱的影响Fig.5 Effect of nanoplastics protein corona withdifferent charges on circular dichroismof urease
α-螺旋结构和β-折叠结构是蛋白质二级结构的重要组成部分。一般而言,α-螺旋和β-折叠都是依靠氢键维持[28],氢键的断裂或新的氢键形成均会改变蛋白质二级结构的相对含量[29],脲酶中α-螺旋和β-折叠结构含量分别为39.25%和38.64%,合计占比超过70%,而β-转角和无规则卷曲结构含量较低,仅为13.47%和8.64%,说明氢键对脲酶执行其功能起主要作用。但纳米塑料-脲酶蛋白冠形成后,3种蛋白冠表现出相同的变化特征,即β-折叠结构含量的降低和无规则卷曲结构含量的增加,但3者变化强度不同。其中,带正电的纳米塑料-脲酶蛋白冠变化最为强烈;α-螺旋结构和β-折叠结构合计占比降至49%左右,氢键作用降低,且主要表现为β-折叠结构的破坏,其含量显著降低,降幅达27.61%;与此相对应的是无规则卷曲结构含量出现明显的增加(增幅33.73%)。由此表明:3种纳米塑料主要通过改变氢键作用强度影响脲酶的β-折叠结构以及通过增加无规则卷曲结构含量对脲酶的构象产生不同程度的影响。而三者间的强度差异主要是电性差异所致,这也进一步证实纳米塑料的带电性是影响蛋白冠形成的重要因素。
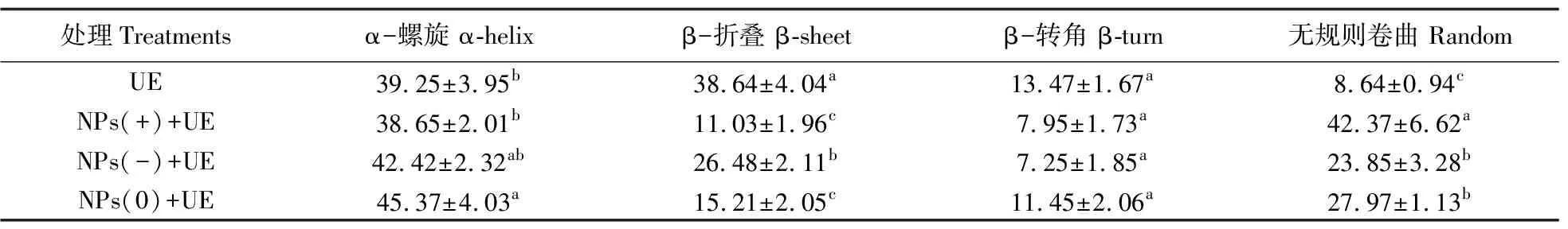
表2 蛋白质二级结构相对含量(波段范围190~240 nm)Table 2 Relative content of protein secondary structure(band range 190-240 nm) %
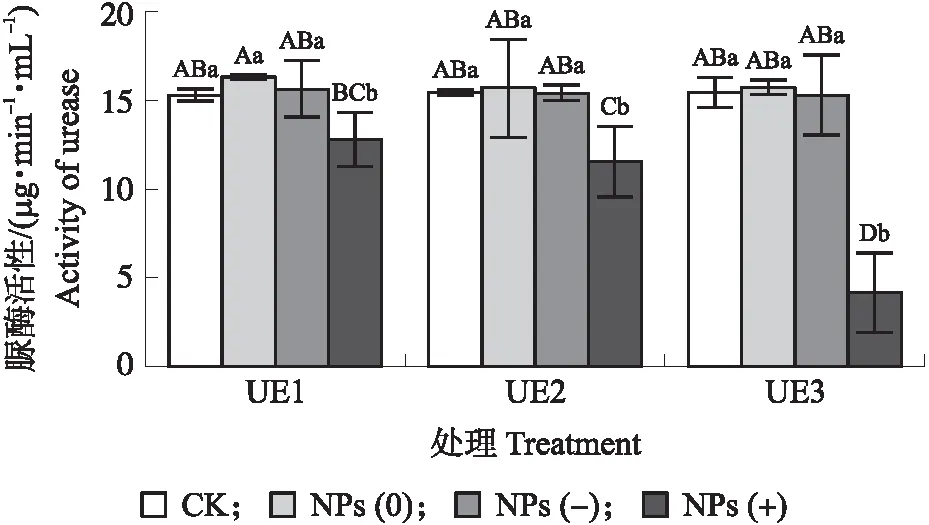
图6 不同电荷纳米塑料与不同浓度脲酶作用对脲酶活性的影响Fig.6 Effect of nanoplastics with different charges and different concentrations of urease on activity of ureaseCK:对应质量浓度条件下的纯脲酶处理。UE1、UE2、UE3分别代表0.05、0.20和0.50 mg·mL-1的脲酶处理。CK:Urease treatment under the condition of corresponding mass concentra-tion. UE1,UE2 and UE3 represent treatments of 0.05,0.20 and 0.50 mg·mL-1 urease.
2.4.2 对脲酶活性的影响图6显示,不带电和带负电的纳米塑料与脲酶形成蛋白冠前后,脲酶活性差异不显著。带正电的纳米塑料与脲酶形成蛋白冠后,脲酶活性逐渐降低,在中等浓度(0.20 mg·mL-1)和高等浓度(0.50 mg·mL-1)处理条件下,显著抑制了脲酶(P<0.05)。
纳米颗粒的表面电性、疏水性是引发蛋白质构象和活性变化的重要因素。例如,带电或疏水性的纳米颗粒比亲水性纳米颗粒表面更容易引起蛋白质构象的变化[30]。溶菌酶在带有负电荷的硅纳米颗粒上吸附,损失70%的α-螺旋结构和40%的酶活性[31]。单壁碳纳米管吸附的胰凝乳蛋白酶的二级结构被损坏,酶活性丧失[32]。蛋白酶与SiO2纳米颗粒的结合,可以导致肠道酶活性降低[17]。不同处理对脲酶活性的影响与脲酶结构以及纳米塑料的表面电荷有关[18]。本研究不仅印证了纳米塑料表面电性和疏水性对蛋白质的重要影响,同时还进一步发现纳米塑料主要是通过改变氢键作用强度降低脲酶的β-折叠结构以及通过增加无规则卷曲结构含量对脲酶的构象产生不同程度的影响,进而导致活性的变化。
3 结论
不同电荷的纳米塑料均能与脲酶结合形成蛋白冠,蛋白冠的形成使纳米塑料表面粗糙度增加,颗粒之间出现聚集和粘连,混悬液分散性变差。纳米塑料-脲酶蛋白冠的形成使脲酶分子结构发生了更明显的重排,改变了脲酶的二级结构。脲酶受构象变化的影响,活性受到影响。与其他电性纳米塑料相比,带正电的纳米塑料与脲酶形成的蛋白冠对纳米塑料的形态特征及脲酶构象与活性的影响更为显著。
