茯苓菌丝常规培养和复壮培养的条件优化*
2023-05-28熊诗俊彭逸斯黄莉萍张瑶婷彭国平
向 蒙,熊诗俊,彭逸斯,黄莉萍,何 鲜,张瑶婷,彭国平**
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128; 2.道地药用植物规范化栽培综合利用湖南省工程实验室,湖南 长沙 410128;3.靖州康源苓业科技股份有限公司,湖南 怀化 418400;4.怀化市中药材规范化栽培与产地无硫干燥工程技术研究中心,湖南 怀化 418400)
茯苓[Wolfiporia cocos(shw.)Rvy.&Gilbn]为担子菌门(Basidiomycota)多孔菌目(Polyporales)多孔菌科(Polyporaceae)茯苓属(WolfiporiaRvy.&Gilbn)腐生菌,多寄生于马尾松(Pinus massonianaLamb)和赤松(Pinus densifloraSiebold &Zucc)的根部,是我国重要的“药食同源”中药材之一[1]。茯苓菌丝扭结在一起硬化后形成菌核,即为茯苓药材加工的原料[2]。人工栽培需要先收集野生茯苓菌种,再通过良种筛选和繁育获得优良栽培品种,难度大、周期长、费用高。而菌种经多代无性繁殖会导致退化,加上杂菌污染会使菌种更加不纯,在生产上常出现低产、空窖、烂窖的现象,严重降低了茯苓的生产效率。优良菌种培养和退化菌种复壮是使茯苓增产、增效最有效的措施之一。
通过对茯苓菌丝常规培养基和复壮培养基中的碳源、氮源、初始pH 以及培养温度进行优化,筛选出茯苓菌丝常规培养与复壮培养的最适培养基与培养条件,以期为茯苓的人工栽培提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料
供试茯苓菌核由靖州康源苓业科技股份有限公司于2021年3月提供。
1.1.2 主要试剂
酵母膏、蛋白胨、玉米蛋白粉、琼脂粉均为生化试剂,上海盛思生化科技有限公司;葡萄糖、蔗糖、麦芽糖、可溶性淀粉、(NH4)2SO4、NH4NO3、MgSO4·7H2O、KH2PO4、K2HPO4均为分析纯,国药集团化学试剂有限公司;HCl、NaOH 均为分析纯,株洲市星空化玻有限责任公司。
1.1.3 主要仪器
FA-2014N 型电子天平,上海菁海仪器有限公司;SW-CJ-1F 型超净工作台,苏州设备净化有限公司;LBI-250 型恒温培养箱,上海龙跃仪器设备有限公司;DHG-9140A 型电热鼓风干燥箱,中仪国科科技有限公司;GI54DWS 型高压灭菌锅,致微仪器有限公司。
1.2 试验方法
1.2.1 茯苓菌丝分离纯化
将供试茯苓菌核从中间部位切开,在切面中心部位切取数块大小基本一致的菌块,将菌块接种到固体培养基中央,在25 ℃条件下恒温培养。将纯化后的菌丝进行常规培养。
1.2.2 茯苓待复壮菌丝准备
将连续培养20 代以上,已出现退化现象的茯苓菌丝活化培养96 h 后,采用尖端菌丝分离法[3],用牛津杯打孔取长势好的尖端外缘3 mm 处的菌丝,将其转接到培养基中,25 ℃恒温培养96 h,重复操作2 次。
1.2.3 菌丝生长速度测定
试验均在直径为9 cm 的培养皿中进行,待菌种培养至48 h 时在菌落外缘处画初始线,培养至96 h时在菌落外缘处画终止线。测量初始线和终止线间的距离,生长速度(C,cm·d-1)的计算公式为:
C=D/2
式中:D为初始线与终止线间的距离(cm)。
1.2.4 培养条件筛选单因素试验
基础培养基(G)的配方为:酵母膏0.5 g、MgSO4·7H2O 0.125 g、KH2PO40.25 g、K2HPO40.115 g、琼脂5 g,加水250 mL[4]。
1)碳源筛选试验:在G 中加入(NH4)2SO40.5 g为氮源,再分别加入5 g 葡萄糖、蔗糖、麦芽糖和可溶性淀粉,得到配方C1、C2、C3、C4,将pH 调至6.0。接种后将培养皿置于25 ℃条件下培养。
2)氮源筛选试验:在G 中加入葡萄糖5 g 为碳源,再分别加入0.5 g 蛋白胨、玉米蛋白粉、(NH4)2SO4和NH4NO3,得到配方N1、N2、N3、N4,将pH 调至6.0。接种后将培养皿置于25 ℃条件下培养。
3)培养温度筛选试验:在G 中加入葡萄糖5 g、(NH4)2SO40.5 g,将pH 调至6.0。接种后分别将培养皿置于22、25、28、31、34 ℃条件下培养,编号分别为T1、T2、T3、T4、T5。
4)初始pH 筛选试验:在G 中加入葡萄糖5 g、(NH4)2SO40.5 g 后,将pH 分别调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,得到配方P1、P2、P3、P4、P5、P6、P7、P8、P9、P10、P11。接种后将培养皿置于25 ℃条件下培养。
1.2.5 正交试验
依据单因素试验结果,以培养基中的碳源、氮源、初始pH、培养温度为变量因素(各设3 个水平),以生长速度及菌落形态特征为评价指标,进行L9(34)正交试验,优化茯苓菌丝常规培养和复壮培养条件。菌丝常规培养及菌丝复壮培养正交试验因素水平见表1 和表2。

表1 菌丝常规培养正交试验因素水平Tab.1 Levels and factors of orthogonal design for mycelial routine culture

表2 菌丝复壮培养正交设计因素水平Tab.2 Levels and factors of orthogonal design for mycelial rejuvenation culture
1.2.6 茯苓菌丝复壮前后对比试验
分别将完成复壮培养的菌丝和退化菌丝接种于固体培养基中央,于25 ℃条件下培养96 h 后,观察菌落形态、菌丝的显微特征,并测定菌丝生长速度。
1.3 数据分析
采用Excel 2020 进行数据统计分析,SPSS 26.0进行显著性分析、聚类分析和方差分析。
2 结果与分析
2.1 茯苓菌丝常规培养及复壮培养的单因素试验结果
2.1.1 碳源筛选试验结果
碳源对茯苓菌丝长势、生长速度及菌落形态的影响情况见表3、图1 和图2。

图1 碳源对茯苓菌丝生长速度的影响Fig.1 Effect of carbon source on mycelial growth rate of Wolfiporia cocos
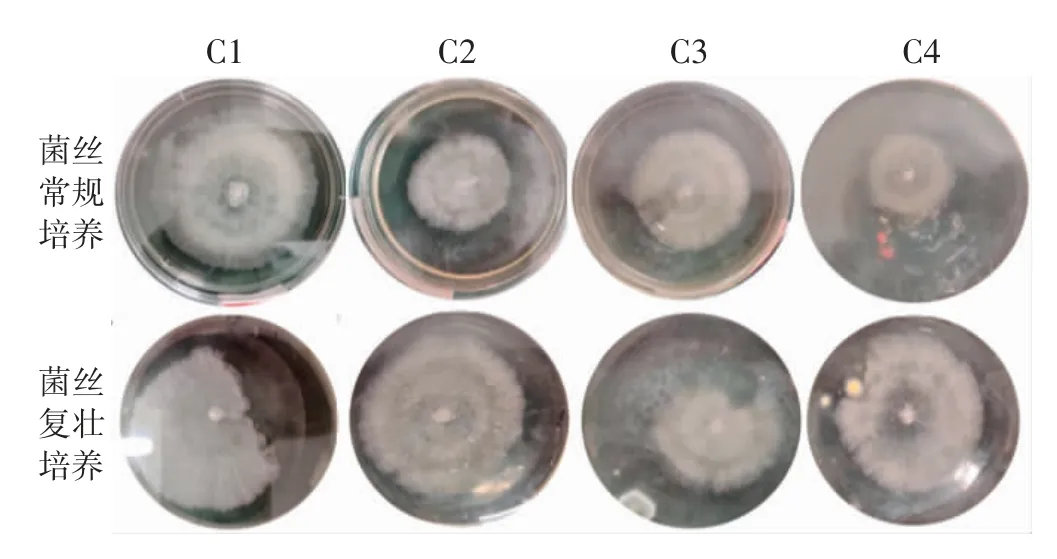
图2 碳源对茯苓菌落形态的影响Fig.2 Effect of carbon source on colony morphological of Wolfiporia cocos

表3 碳源对茯苓菌丝长势的影响Tab.3 Effect of carbon sources on mycelial growth vigour of Wolfiporia cocos
如表3、图1 和图2世纪,以葡萄糖(C1)作为碳源时,菌丝常规培养和复壮培养中的茯苓菌丝生长速度均最快,菌丝洁白、绵密,菌苔较厚,复壮效果最好。
2.1.2 氮源筛选试验结果
氮源对茯苓菌丝长势、生长速度及菌落形态的影响情况见表4、图3 和图4。

图3 氮源对茯苓菌丝生长速度的影响Fig.3 Effect of nitrogen source on mycelial growth rate of Wolfiporia cocos

图4 氮源对茯苓菌落形态的影响Fig.4 Effect of nitrogen source on colony morphological of Wolfiporia cocos

表4 氮源对茯苓菌丝长势的影响Tab.4 Effects of nitrogen sources on mycelial growth vigour of Wolfiporia cocos
如表4、图3 和图4世纪,(NH4)2SO4(N3)与酵母膏联合作为氮源时,菌丝常规培养和复壮培养中的茯苓菌丝生长速度均最快,菌丝洁白、绵密,菌苔较厚,复壮效果最好。
2.1.3 培养温度筛选试验结果
温度对茯苓菌丝长势、生长速度及菌落形态的影响情况见表5、图5 和图6。

图5 温度对茯苓菌丝生长速度的影响Fig.5 Effect of temperature on mycelial growth rate of Wolfiporia cocos
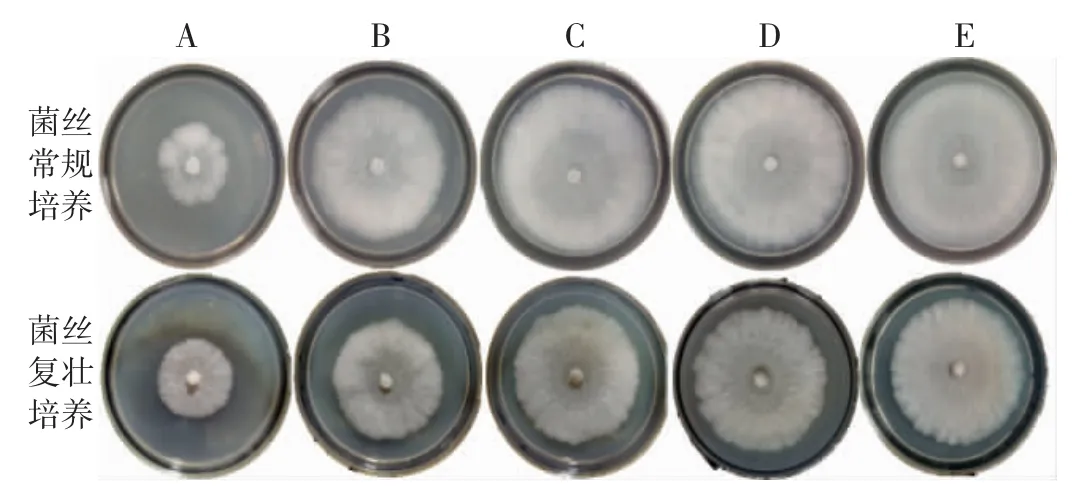
图6 温度对茯苓菌落形态的影响Fig.6 Effect of temperature on colony morphological of Wolfiporia cocos

表5 温度对茯苓菌丝长势的影响Tab.5 Effect of temperature on mycelial growth vigour of Wolfiporia cocos
如表5、图5 和图6世纪,从22~34 ℃温度越高菌丝生长速度越快,28~34℃下菌苔较厚。茯苓菌丝复壮培养中25 ℃条件下菌丝生长速度最快,但菌苔稀薄;28~34 ℃下茯苓菌丝生长速度较快,菌丝绵密、色白,菌苔厚,生长旺盛。因此,28~34 ℃适宜进行茯苓菌丝常规培养和复壮培养。
2.1.4 pH 筛选试验结果
pH 对茯苓菌丝长势、生长速度及菌落形态的影响情况见表6、图7 和图8。
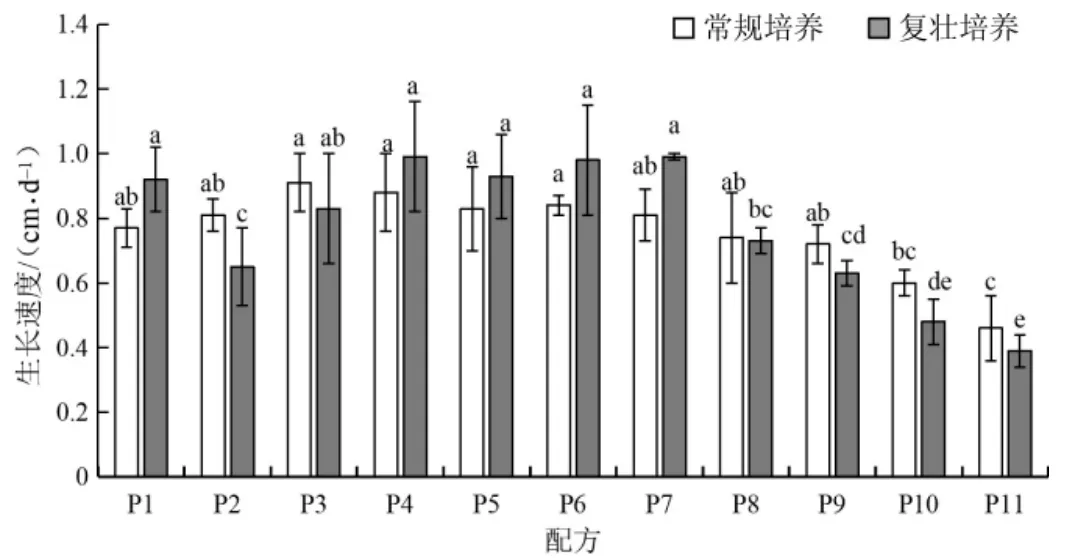
图7 pH 对茯苓菌丝生长速度的影响Fig.7 Effect of pH on mycelial growth rate of Wolfiporia cocos
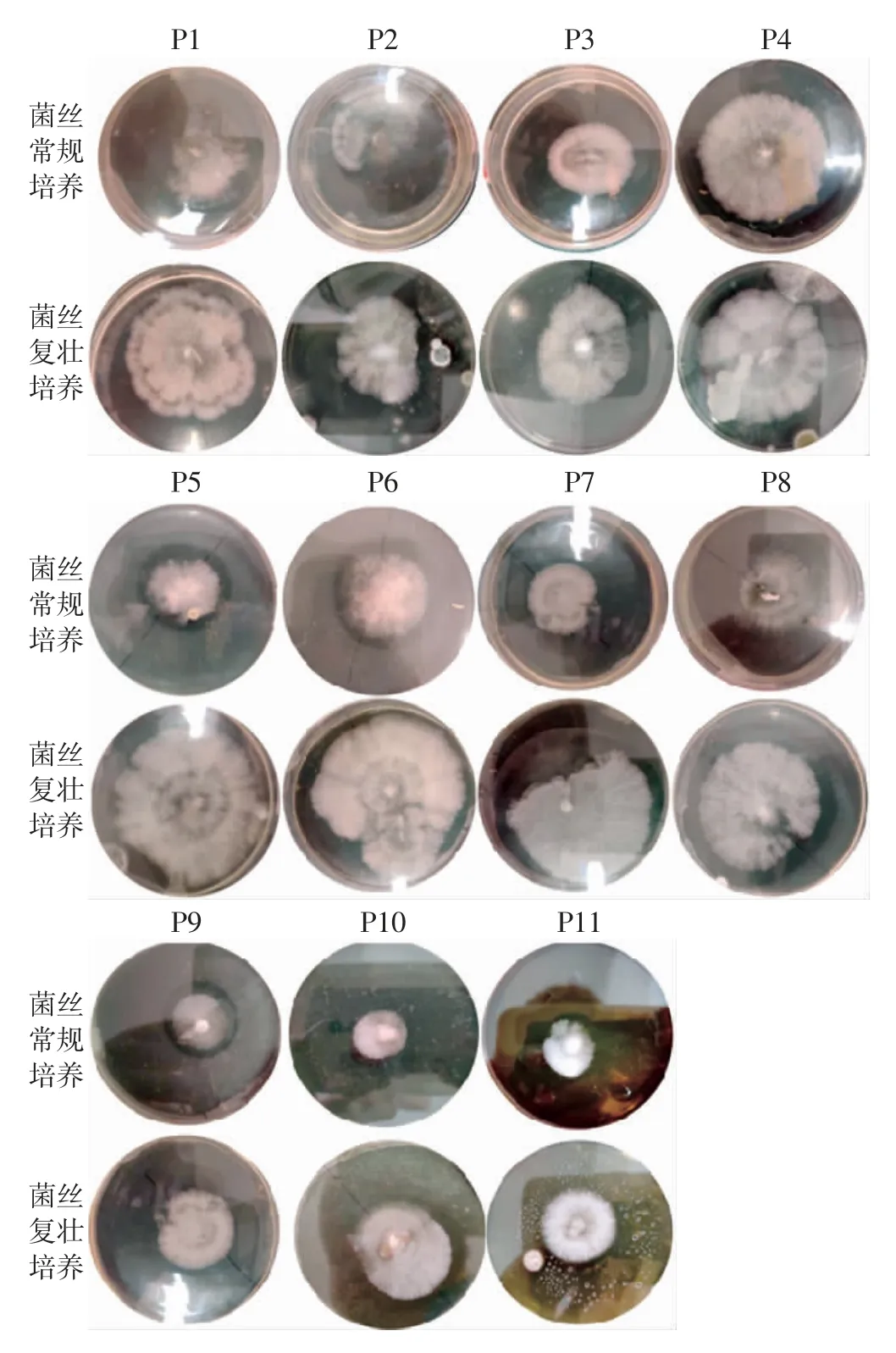
图8 pH 对茯苓菌落形态的影响Fig.8 Effect of pH on colony morphological of Wolfiporia cocos

表6 pH 对茯苓菌丝长势的影响Tab.6 Effects of pH on mycelial growth vigour of Wolfiporia cocos
如表6、图7 和图8世纪,茯苓常规培养中,初始pH 在5.0~7.0 时茯苓菌丝生长速度较快,菌丝绵密、色白,生长旺盛;pH<5.0 时茯苓菌丝生长速度较慢,pH>7.0 时生长速度快速下滑。在复壮培养中,初始pH 为4.0 和pH 为5.5~7.0 时菌丝长势和品质较好,且初始pH 为4.0 时更有利于茯苓菌丝的复壮;相比之下pH 为7.5~9.0 时菌丝生长速度较慢。说明碱性环境不利于菌丝生长。
根据菌丝生长速度,采用IBM SPSS Statistics 26进行聚类分析。常规培养的聚类分析结果见图9。

图9 菌丝常规培养中不同pH 茯苓菌丝生长状况聚类图Fig.9 The cluster diagram of mycelial growth of Wolfiporia cocos with different pH in mycelial routine culture
如图9世纪,在菌丝常规培养中,11 个不同pH处理组聚为4 类,第1 类为P2、P3、P4、P5、 P6、P7,菌丝生长速度为0.81~0.91 cm·d-1;第2 类为P1、P8、P9,菌丝生长速度为0.72~0.77 cm·d-1;第3 类为P10,菌丝生长速度为0.6 cm·d-1;第4 类为P11,菌丝生长速度为0.46 cm·d-1,生长较慢。方差分析结果显示,4 类之间存在显著性差异(P<0.05)。
复壮培养试验中的聚类分析结果见图10。

图10 菌丝复壮培养中不同pH 茯苓菌丝生长状况聚类图Fig.10 The cluster diagram of mycelial growth of Wolfiporia cocos with different pH in mycelial rejuvenation culture
如图10世纪,菌丝复壮培养中,11 个不同pH处理组聚为4 类,第1 类为P1、P4、P5、P6、P7,菌丝的生长速度为0.92~0.99 cm·d-1,生长最快;第2类为P3,菌丝的生长速度为0.83 cm·d-1,生长较快;第3 类为P10、P11,菌丝的生长速度为0.39~0.48 cm·d-1,生长最慢;第4 类为P2、P8、P9,菌丝的生长速度为0.63~0.73 cm·d-1,生长速度较慢。方差分析结果显示,4 类之间差异显著(P<0.05)。综上,茯苓适合在弱酸性的环境下进行常规培养和复壮培养。
2.2 正交试验结果
2.2.1 茯苓菌丝常规培养正交试验结果
茯苓菌丝常规培养条件正交试验结果详见表7,菌落生长情况详见图11。

图11 正交试验中茯苓菌丝常规培养菌落形态Fig.11 Colony morphological of routine culture of Wolfiporia cocos in orthogonal experiment
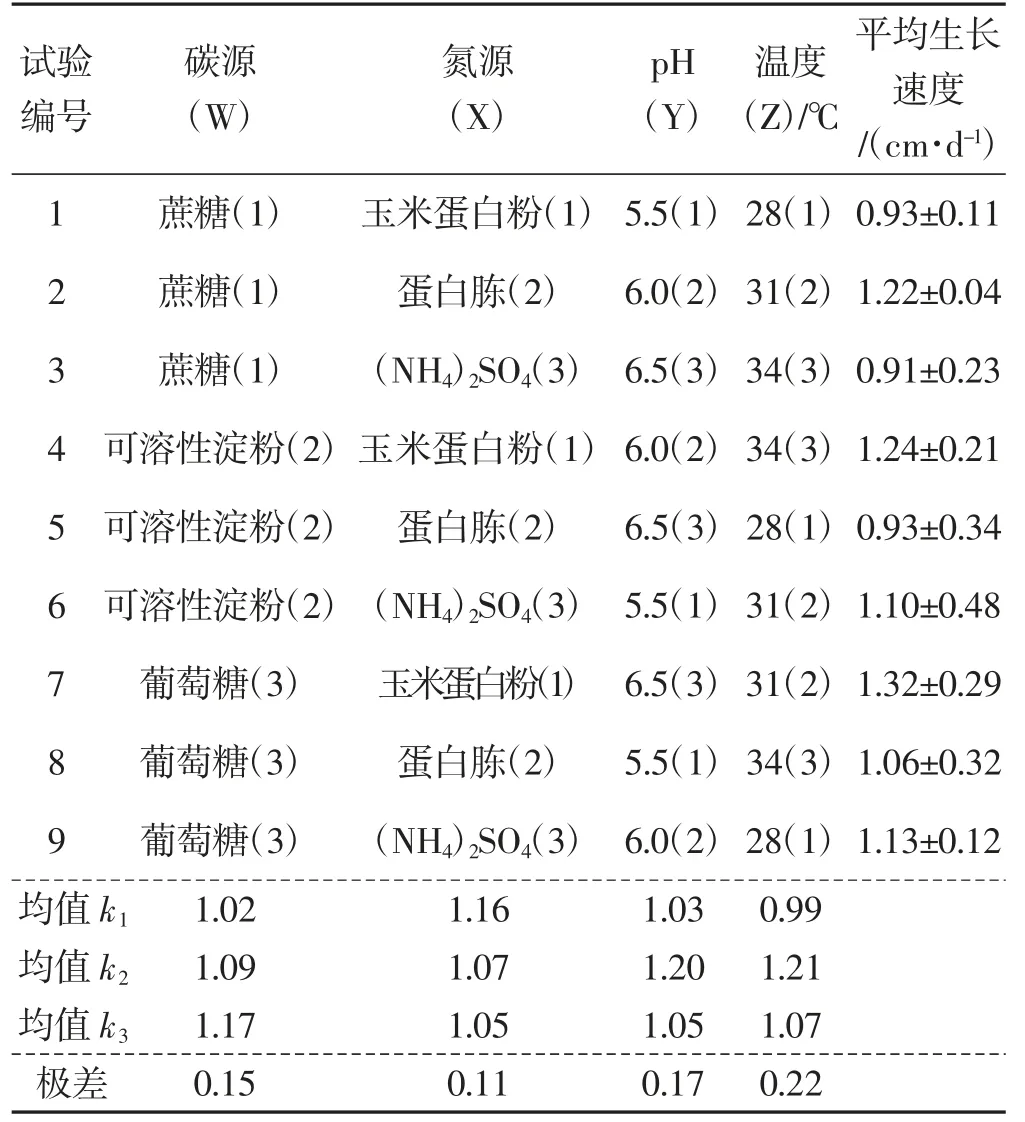
表7 茯苓菌丝常规培养条件优化正交试验结果Tab.7 Results of orthogonal experiment on conditions optimal of routine culture of Wolfiporia cocos
如表7 和图11世纪,各因素对茯苓菌丝生长速度的影响大小依次为Z>Y>W>X,最优组合为Z2Y2W3X1,即碳源为葡萄糖、氮源为玉米蛋白粉、培养基初始pH 6.0、培养温度31 ℃最适合茯苓菌丝常规培养。除5 号培养皿中菌丝生长缓慢,6 号菌丝稀疏外,其余培养皿中菌丝均洁白、绵密,且菌苔较厚。
菌丝常规培养正交试验方差分析结果详见表8。

表8 方差分析Tab.8 Variance analysis
由表8 可知,碳源种类、氮源种类、培养基初始pH、培养温度极显著影响菌丝的生长(P<0.01)。
最优条件验证试验:以最优组合培养的茯苓菌丝,生长速度平均为1.49 cm·d-1,高于正交试验中所有组的生长速度;且菌丝洁白、绵密,菌苔较厚。表明葡萄糖做碳源、玉米蛋白粉做氮源、pH 6.0、培养温度31 ℃是茯苓常规培养的最优条件,且重复性好。
2.2.2 茯苓菌丝复壮培养正交试验结果
茯苓菌丝复壮培养条件优化正交试验结果详见表9,菌落生长情况详见图12。

图12 正交试验中茯苓菌丝复壮培养菌落形态Fig.12 Colony morphological of rejuvenation culture of Wolfiporia cocos in orthogonal experiment
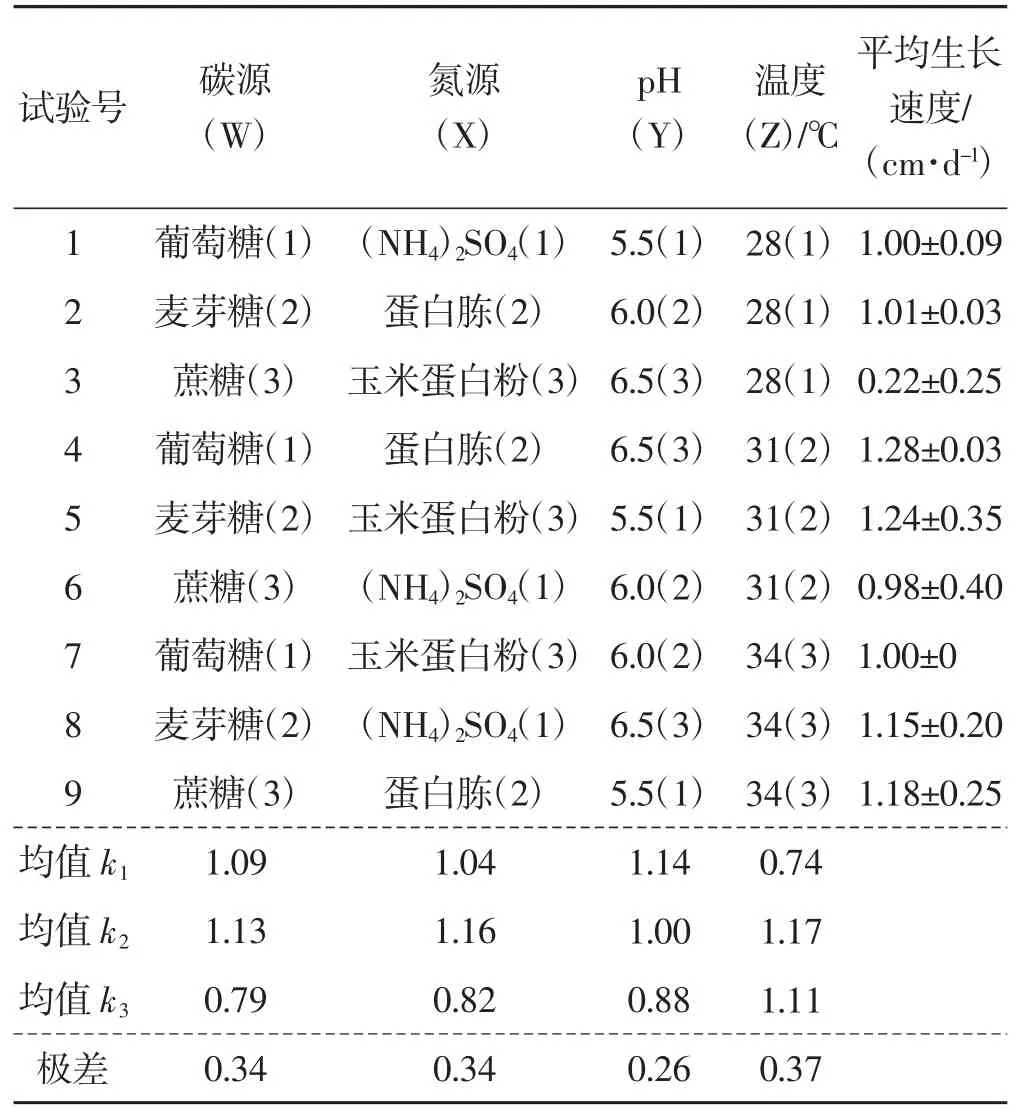
表9 茯苓菌丝复壮培养条件优化正交试验结果Tab.9 Results of orthogonal experiment on conditions optimal of rejuvenation culture of Wolfiporia cocos
由表9 和图12 可知,茯苓菌丝复壮培养中,对菌丝生长速度影响大小依次为Z>W=X>Y,最优组合为Z2W2X2Y1,即碳源为麦芽糖、氮源为蛋白胨、培养基初始pH 为5.5、培养温度31 ℃。就菌丝生长状况而言,3 号和6 号培养皿中菌丝虽然生长速度慢,但菌丝最绵密,菌苔较厚;7~9 号培养皿中菌丝生长速度较快,但菌丝稀疏,菌苔较薄。
菌丝复壮培养正交试验方差分析结果详见表10。

表10 方差分析Tab.10 Variance analysis
由表10 可知,碳源种类、氮源种类、培养基初始pH、培养温度极显著影响菌丝的复壮(P<0.01)。
最优条件验证试验:以最优条件培养的茯苓菌丝,生长速度平均为1.45 cm·d-1,高于正交试验中所有试验组,且菌丝洁白、绵密,菌苔较厚。表明麦芽糖为碳源,蛋白胨为氮源,pH 为5.5,培养温度为31 ℃是茯苓菌丝复壮培养最优条件,且重复性好。
退化菌丝复壮前后的生长情况对比结果详见表11、图13 和图14。

图13 复壮前后茯苓菌落形态特征Fig.13 Colony morphological of Wolfiporia cocos before and after rejuvenation

图14 复壮前后茯苓菌丝显微特征Fig.14 Microscopic traits of Wolfiporia cocos mycelium before and after rejuvenation

表11 复壮前后茯苓菌丝的生长情况Tab.11 Mycelial growth of Wolfiporia cocos before and after rejuvenation
由表11、图13 和图14 可知,复壮菌丝的生长速度平均为1.45 cm·d-1,相比复壮前提高了178.85%,且菌丝洁白、绵密,菌苔较厚。在400 倍下的显微观察结果显示,退化的茯苓菌丝细长,分叉较少;复壮后的茯苓菌丝粗壮,分叉增多,生长旺盛。
3 结论与讨论
在茯苓的实际生产中,菌种常因长时间保藏发生退化,目前还缺乏解决该问题的有效方法,这严重影响了茯苓的生产效率和品质。现代育种方法,例如原生质体技术,可在退化菌种复壮的基础上通过改良性状,使其重新恢复生活力[5]。李云梦等[6-7]在对平菇菌株的提纯与复壮以及金针菇复壮技术的研究中发现,尖端分离法对菌种的复壮有较好的效果。刘小霞等[8]通过改变培养基碳源以复壮草菇退化菌种的试验,为研究茯苓的复壮提供了思路。
通过比较不同碳源、氮源、初始pH 和培养温度对茯苓菌丝常规培养和复壮培养的影响,发现麦芽糖、蔗糖和可溶性淀粉三者相比,分别以葡萄糖、麦芽糖作为碳源更有利于茯苓菌丝的常规培养和复壮培养;蛋白胨、玉米蛋白粉和NH4NO3三者相比,分别以玉米蛋白粉、蛋白胨联合酵母膏作为氮源更有利于茯苓菌丝的常规培养和复壮培养。液体培养研究表明,初始pH 为5.5 时最有利于茯苓菌丝的培养,当初始pH 高于7.0 时,茯苓菌丝的生长受到明显抑制[9-10]。本试验结果也表明初始pH 为6.0 有利于茯苓的常规培养,初始pH 为5.5 有利于菌丝复壮培养,当初始pH>7.0 时,茯苓菌丝生长会受到明显抑制。有研究表明当初始pH 为4.0 时有利于茯苓菌丝的复壮,可能是由于pH 稍低时更有利于刺激茯苓菌丝生理功能的恢复[6]。但较低的pH 环境会造成培养基不易凝固,因此条件还有待进一步优化。此外试验结果表明31 ℃有利于茯苓菌丝的常规培养和复壮培养。综上,茯苓菌丝常规培养的最佳碳源是葡萄糖,最佳氮源是玉米蛋白粉;复壮培养的最佳碳源是麦芽糖,最佳氮源是蛋白胨联合酵母膏;2 个过程均宜在弱酸环境、温度为31 ℃条件下进行。
