连作年限影响芹菜根际土壤微生物群落结构及功能类群*
2023-05-26吴宏亮冯海萍张海宇康建宏
刘 素, 吴宏亮**,陈 倬,冯海萍,张海宇,康建宏
连作年限影响芹菜根际土壤微生物群落结构及功能类群*
刘 素1, 吴宏亮1**,陈 倬1,冯海萍2,张海宇1,康建宏1
(1.宁夏大学农学院,银川 750021;2.宁夏农林科学院园艺研究所,银川 750000)
芹菜是宁夏冷凉区特色蔬菜,大规模种植不可避免地导致连作障碍。为了揭示芹菜根际土壤微生物的多样性特征和群落结构随种植年限变化的差异,本研究采用Illumina Novaseq−PE250测序平台对芹菜种植一年(CA)、连作两年(CB)和连作三年(CC)时根际土样的16S V3V4区和ITS1区进行双末端Paired-end测序,并进行生物信息学分析。结果表明,土壤细菌多样性随连作年限延长呈逐渐降低趋势,Chao 1指数第一年8509.41,第三年降低至6314.09。CA香农指数最高,为11.48,CC最低,仅11.08。随着连作年限的增加,土壤细菌中的δ-变形菌纲(Deltaproteobacteria)和芽单胞菌纲(Gemmatimonadetes)等优势菌纲及其中的罗库菌属()、芽球菌属()、红杆菌属()等有益菌丰度减少。土壤真菌的多样性指数、丰富度指数等均随连作年限增加呈先下降后上升趋势,表现为CA、CB的Chao 1指数分别为505.44和264.66,而CC为443.92,CA、CB的香农指数分别为5.98和4.93,而CC为5.61,且连作年限间均存在显著差异。同时,土壤真菌中的粪壳菌纲(Sordariomycetes)和瓶毛壳属()、黑孢壳属()等优势菌纲属具有显著变化差异。微生物主坐标成分分析结果表明,CC与其他处理间存在强异质性。PICRUSt2功能预测分析表明,芹菜根际土壤细菌主要有7大类一级功能层,氨基酸生物合成相对丰度占比最高,真菌有5大类一级功能层,核苷和核苷酸生物合成相对丰度占比最高,同时芹菜连作不同年限时多条代谢通路间具有极显著差异。综上研究结果,芹菜连作会降低根际土壤菌群的丰富度及多样性,改变菌群结构,导致根际微生态环境失衡,从而引发相关连作障碍病害。其中,以芹菜连作三年时微生物各项指数变幅最大,故建议宁夏南部山区芹菜产业将连作不超过两年作为田间种植模式。
芹菜;连作年限;根际土壤微生物;高通量测序;PICRUSt2功能预测
芹菜(L.)为伞形科植物[1−2],富含大量芹菜素[3],是一种优质、高产、高营养的蔬菜,但芹菜不耐连作。宁夏西吉县地处海拔1688-2633m,为典型的温带大陆性季风气候,海拔高、昼夜温差大、气候冷凉、光热资源丰富,为当地芹菜产业的发展创造了有利条件[4],素来具有“中国西芹之乡”美称。但由于当地耕地面积的有限,加之种植条件的制约及经济利益驱动等因素,致使芹菜连作成为农户在农业生产中常采用的种植方式。而长期连作会引发作物严重的病害问题,如根茎腐病、放线虫害等,使其品质及产量显著下降,严重影响宁夏南部山区芹菜产业的健康可持续发展。
根际土壤微生物作为土壤生态系统的重要组成部分[5],与土壤环境中的能量流动及物质转化息息相关,并参与到许多重要的生化反应中[6]。而连作会对根际土壤微生物群落结构造成破坏,抑制有益生物的存活,同时促进病原菌的生长,加剧土传病害的发生,进而对作物的生长造成影响,导致减产[7]。高苇等[8]研究表明,芹菜连作后形成的根腐病会严重影响土壤真菌、细菌的种类和数量。郑立伟等[9]认为,甜瓜连作年限的增加致使土壤细菌多样性降低,细菌中多数优势菌门的有益菌丰度减少,土壤真菌的丰度增加。岳思君等[9]通过冗余分析表明,引起硒砂瓜连作障碍发生的主要原因是随着连作时间的增加,放线菌门、变形菌门等有益微生物丰度下降,而与土壤理化性质变化呈不显著关系。总之,连作种植在一定程度上会引起土壤微生物多样性的改变,但有关芹菜连作对微生物多样性影响尚缺乏系统研究,特别是对不同连作年限的芹菜种植土壤的微生物群落结构分析未见报道。因此,从土壤根际微生物菌群的群落结构稳定性与功能多样性的微生态系统角度研究连作障碍,对作物生产具有重要的理论和实践意义[10]。本研究通过Illumina Novaseq-PE250高通量测序技术对芹菜连作不同年限时的根际土壤菌群结构与多样性进行分析,旨在探明芹菜连作时根际土壤微生物群落变化情况,以期为探究造成芹菜连作障碍的核心病菌提供土壤环境微生物生态层次的理论依据。
1 材料与方法
1.1 土样收集
样品于2020年8月中旬,在宁夏回族自治区固原市西吉县隆堡村(N 35°81′E106°11′)不同种植年限芹菜地芹菜收获期采集,分别命名为芹菜一年根际土壤(用CA表示);芹菜连作两年根际土壤(用CB表示);芹菜连作三年根际土壤(用CC表示)。选择采样单元相对中心位置的典型地块用五点取样法收集样品,用铲子去除地表植被和其他杂质,在地面距根部5cm处挖出植株,再使用抖落法去除未富集根系土壤,将主根与毛根附着发达区域300~500g土壤作为根际土壤。五处根际土壤充分混匀后,挑出根系、秸秆、石块和虫体等杂物,在田间用四分法弃去多余部分,最后每个处理保留1kg左右,装入17cm×25cm自封袋,挂好内外标签,置入简易冷藏箱进行冷藏,随后将样品冻存于-80℃备用,准备送样检测,每组样品设4个重复,样品测序与分析委托上海某公司完成。
1.2 观测项目及分析
1.2.1 基因组DNA的提取和PCR扩增
使用OMEGA Soil DNA Kit试剂盒通过间接法提取样品根际土壤中的宏基因组DNA,再将土壤样品中的DNA进行0.8%琼脂糖凝胶电泳,进行分子大小判断,利用紫外分光光度计对DNA进行定量。选择用于细菌鉴定的16S rRNA V3V4区引物,真菌鉴定的ITS 1区引物进行 PCR 扩增,以通过琼脂糖凝胶电泳检测且检测合格的PCR扩增产物为模板进行测序文库的制备,最后将合格文库在Novaseq-PE250测序平台上机测序。
1.2.2 分析流程
(1)对高通量测序的原始下机数据根据序列质量进行初步筛查,对问题样本进行重测、补测。
(2)通过质量初筛的原始序列按照index和Barcode信息,进行文库和样本划分,并去除barcode序列。
(3)按照QIIME2 dada2[11−12]分析流程进行OTU聚类。
(4)对各样本(组)在不同物种分类学水平的具体组成进行展示,了解整体概况。
(5)在ASV/OTU层面,计算各样本的距离矩阵,并通过多种非监督的排序、聚类手段,结合相应统计学检验方法,衡量不同样本(组)间的Beta多样性差异及差异显著性。
(6)在物种分类学组成层面,通过各种非监督、监督的排序、聚类和建模手段,结合相应统计学检验方法,进一步衡量不同样本(组)间的物种丰度组成差异,并尝试寻找标志物种。
(7)根据16S rRNA和ITS基因测序结果,做预测样本的PICRUSt2功能预测分析[13]菌群代谢功能。
1.3 统计分析
用SPSS 22.0统计分析软件对数据进行单因素方差分析,处理间差异显著性检验使用邓肯法(Duncan,P<0.05)。微生物群落结构变化分析图和功能预测图形使用QIIME2 软件和R语言绘制。
2 结果与分析
2.1 连作年限对芹菜根区土壤微生物群落多样性指数的影响
不同连作年限田间芹菜根区土壤样品的细菌群落α多样性指数观测结果见表1。由表可见,Good’s coverage覆盖率为95%以上,即该土壤深度已经基本覆盖样品中所有的物种。对3个不同连作年限土壤的细菌α多样性进行统计分析可见,随着连作时间延长,土壤的Chao1指数、Shannon指数和Pielou’s evenness指数均有一定程度的降低。同时,CC处理与CA和CB处理的土壤中均呈现指标间显著差异,说明土壤进行芹菜的多年连续种植会降低其作物根际土壤细菌群落的丰富度及多样性。
真菌群落α多样性指数结果表明(表1),各样品文库的覆盖率为100%,观测到样品中序列没有被测出的概率很低。各处理多样性指数(Shannon指数)、丰富度指数(Chao1指数)和均匀度指数(Pielou’s evenness指数)变化趋势一致,均随连作年限增加呈下降后再回升的趋势,组间呈现显著性差异。其中CA数值最高,分别为505.44、5.98和0.6671,CB数值最低,分别为264.66、4.93和0.6131,说明芹菜的种植年限也会影响其根部土壤真菌菌群群落,连作年限不同,多样性、丰富度和均匀度不同。
2.2 连作年限对芹菜根区土壤细菌群落的影响
2.2.1 群落组成及丰度分析
选取丰度排名前8的物种,生成柱形图。由图1可见,主要细菌优势菌纲γ-变形菌纲(Gammaproteo- bacteria)、α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)和拟杆菌纲(Bacteroidia)的相对丰度变化趋势一致,由高到低排序为CC>CB>CA。其中,CC土壤中的上述4个菌纲丰度较CA的增幅分别为71.07%、44.40%、67.52%和182.52%。δ-变形菌纲(Deltaproteobacteria)、Subgroup_6菌纲、芽单胞菌纲(Gemmatimonadetes)和嗜热性菌纲(Thermoleophilia)的相对丰度随连作年限增加而呈现下降趋势。

表1 三种连作处理芹菜根际土壤样品中微生物多样性指数比较(平均值±均方差)
注:CA为芹菜种植一年根际土壤,前茬是休闲土壤,CB为芹菜连作两年根际土壤,CC为芹菜连作三年根际土壤。小写字母表示处理间在0.05水平上的差异显著性。下同。
Note: CA is the rhizosphere soil for celery planting for one year, which previous crop is the fallow soil, CB is the rhizosphere soil for celery continuous cropping for two years, and CC is the rhizosphere soil for celery continuous cropping for three years. The lower case letters indicate the significant difference between treatments at 0.05 level. The same as below.
选取属水平排名前 35 的属进行聚类分析,绘制热图。由图2可见,在CA处理中,细菌相对丰度占主要优势的(相对丰度>1%)有罗库菌属()、菌属、芽球菌属()、菌属和红杆菌属()共5个属。在CB处理中,纤维弧菌属()和溶杆菌属()两种菌属的相对丰度相较CA的土壤有明显升高。而CC处理中,以上各属的相对丰度明显降低,而黄杆菌属()、菌属、假单胞菌属()、异根瘤菌属-新根瘤菌属-副根瘤菌属-根瘤菌属()、砂单胞菌属()、气微菌属()和类诺卡氏菌属()的丰度较高。以上结果说明,芹菜连作不同年限时土壤根际菌群在属分类水平上存在显著差异。
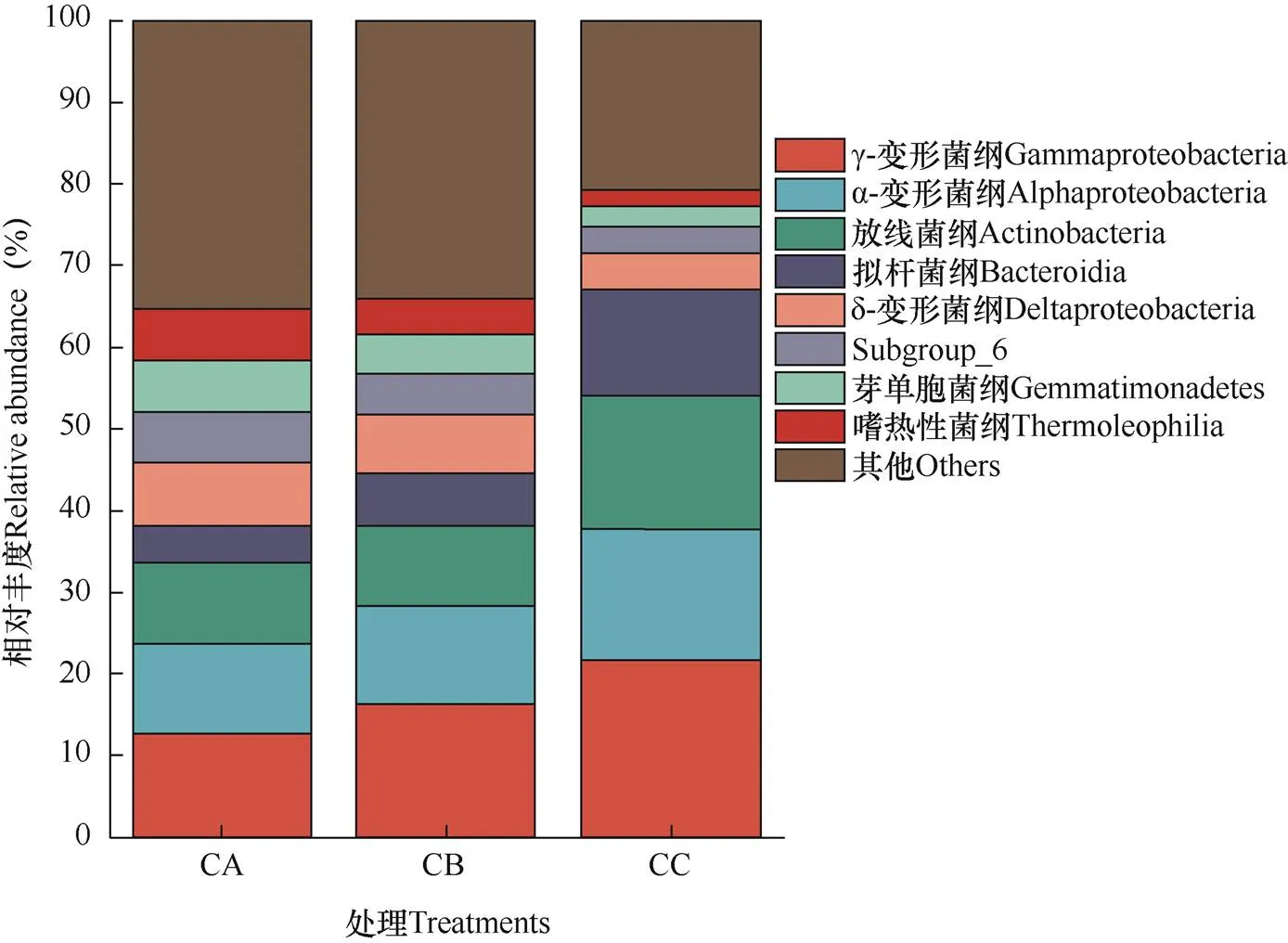
图1 三种连作处理中芹菜根际土壤样品在细菌纲水平上的组成和相对丰度

图2 三种连作处理中芹菜根际土壤样品在细菌属水平上的物种丰度聚类热图
图3表明,PCo1和PCo2能解释3组样品中64.5%的样品信息。其中,CA和CB分布在PCo1负值区域,说明细菌群落结构相似性较高,CC分布在正值区域,距离较远,说明相似性较低且组间差异大于组内差异,进一步表明芹菜连作不同年限时其根际土壤细菌菌群结构存在显著差异。
2.2.2 PICRUSt2细菌菌群功能预测分析
2.2.2.1 代谢通路统计
基于MetaCyc数据库对芹菜连作土壤进行细菌菌群功能预测分析(图4),结果表明,第一层次代谢通路共有7大类,每一类代谢通路又被进一步划分为多个等级。在芹菜根际土壤细菌的一级功能层中,生物合成为其主要组成。同时预测基因的第二层次代谢通路分析结果表明细菌菌群在多方面具有功能潜能,但只有在9种生物合成方面其相对丰度大于18000,占比最高的为氨基酸生物合成。

图3 三种连作处理中芹菜根际土壤样品细菌群落组成主坐标分析

图4 基于MetaCyc数据库对芹菜根际土壤不同细菌菌群PICRUSt2功能预测结果
2.2.2.2 代谢通路差异分析
在获得代谢通路的丰度数据后,对CA与CB、CB与CC、CA与CC分别进行组间代谢通路差异分析。在CA和CB中,以CA为对照组,CB为上调组,图5a显示,CB相对CA有34条代谢通路上调,其中25条通路之间具有极显著差异(P<0.001),分别是PWY-6565通路superpathway of polyamine biosynthesis III和ECASYN-PWY通路enterobacterial common antigen biosynthesis等。在CB和CC中(图5b),以CB为对照组、CC为上调组进行代谢通路的差异性分析,结果表明,CC相对CB有24条通路上调,26条通路下调,其中38条通路之间呈现极显著差异(P<0.001),分别是PWY-7385通路1,3-propanediol biosynthesis(engineered)和PWY- 7198通路pyrimidine deoxyribonucleotides de novo biosynthesis IV等。在CA和CC中(图5c),CA为对照组,CC为上调组,结果表明,CC相对CA有27条通路上调,23条通路下调,其中37条通路之间呈现极显著差异(P<0.001),分别是PWY-5499通路Pvitamin B6 degradation和PWY-7209通路superpathway of pyrimidine ribonucleosides degradation等。结果说明芹菜的连作年限对土壤微生物代谢有十分重要的影响,连作年限越长通路上下调变化越明显,通路之间差异越显著。
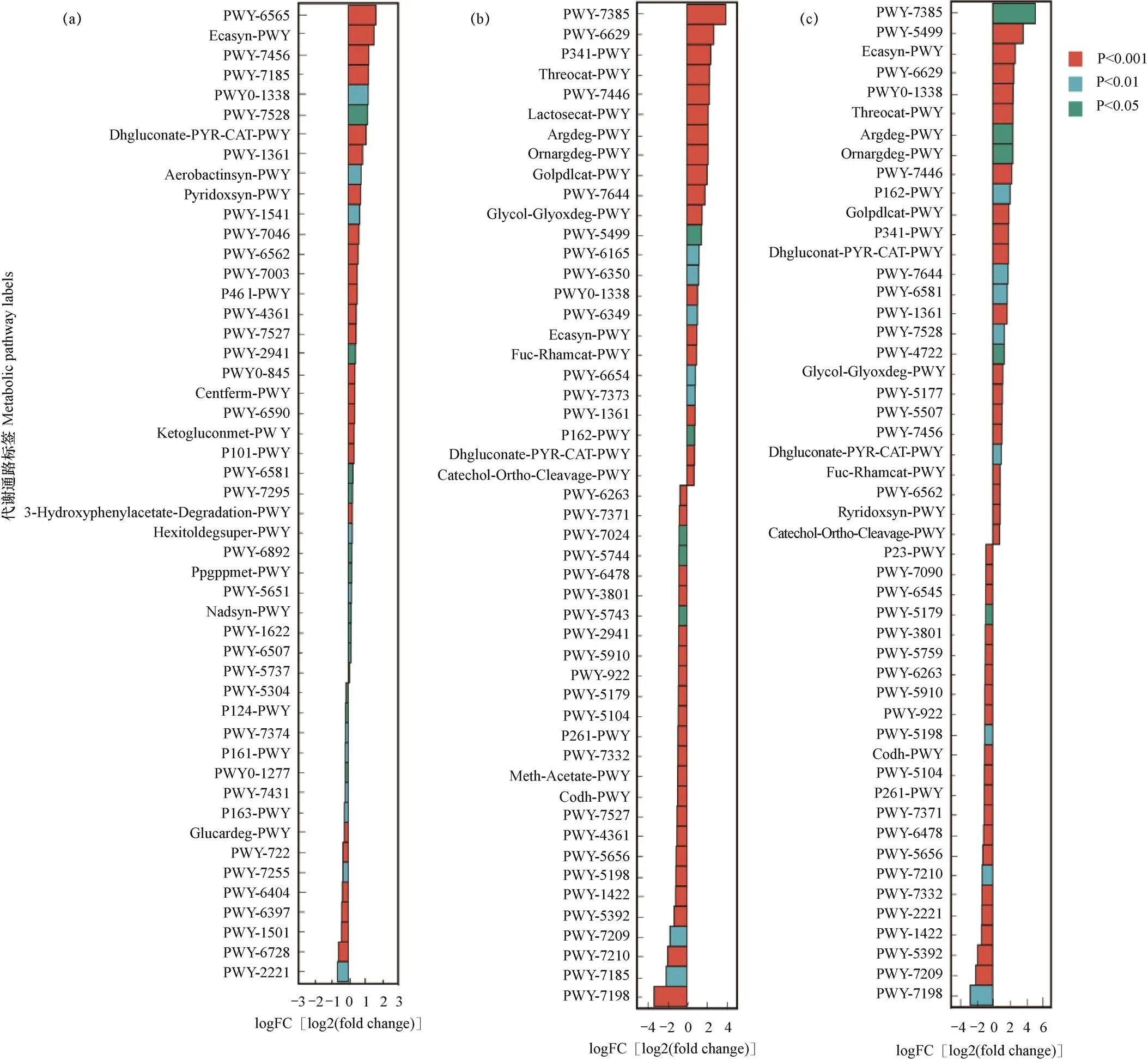
图5 CA与CB(a)、CB与CC(b)以及CA与CC(c)处理中土壤细菌菌群代谢通路的差异分析
注:logFC[log2(fold change)]为正值代表上调组相对对照组上调,负值为下调。下同。
Note: A positive value of logFC[log2(fold change)] represents upregulation in the upregulation group relative to the control group, and a negative value is downregulation. The same as below.
2.3 连作年限对芹菜根区土壤真菌群落的影响
2.3.1 群落组成及丰度分析
选取丰度排名前8的物种,生成柱形图。由图6可见,主要真菌优势菌纲粪壳菌纲(Sordariomycetes)、银耳纲(Tremellomycetes)、盘菌纲(Pezizomycetes)、锤舌菌纲(Leotiomycetes)和伞菌纲(Agaricomycetes)的相对丰度在三组样本中均呈先下降后上升趋势,由大到小排序为CC>CA>CB。其中,粪壳菌纲(Sordariomycetes)具有显著变化差异,相对丰度分别为55.56%、51.98%和44.52%。座囊菌纲(Dothideomycetes)和被孢霉纲(Mortierellomycetes)的变化趋势一致,由高到低分别为CA>CB>CC。其中,座囊菌纲(Dothideom- ycetes)的相对丰度百分比依次为15.56%、13.31%和10.72%。
选取属水平排名前20的属进行聚类,绘制热图。由图7可见,CA土壤中,前20中相对丰度大于1% 的有7个属,分别为菌属、刺毛四枝孢菌属()、弯孢菌属()、炭疽菌属()、被孢霉菌属()、赤霉菌属()和zyma菌属。CB中以上菌属的相对丰度呈下降趋势,而链格孢菌属()的相对丰度大于1%。CC中6个属的相对丰度与CA和CB差异显著,分别为瓶毛壳属()、黑孢壳属()、木拉克酵母属()、丝壳属()、假裸囊菌属()和土赤壳属()。
图8表明,PCo1和PCo2能解释3组样品82.3%的菌群多样性。其中,CA主要分布于PCo1的负端区域,CB分布于PCo1的0值附近,CC位于PCo1的正端区域,3个样品组间相似性较小,差异显著,说明芹菜连作后根际土壤真菌群落谱系间发生了改变。
2.3.2 PICRUSt2真菌菌群功能预测分析
2.3.2.1 代谢通路统计
基于MetaCyc数据库的预测分析见图9。由图可见,芹菜根际土壤真菌菌群的一级功能层包括5大类,其中生物合成、前体代谢和能量生成功能层的真菌菌群相对丰度较高。在第二层次代谢通路中,9种生物合成方面和2种前体代谢和能量生成方面真菌菌群的相对丰度大于3000,其中,占比最高的为核苷和核苷酸生物合成。

图6 三种连作处理中芹菜根际土壤样品在真菌纲水平上的组成和相对丰度
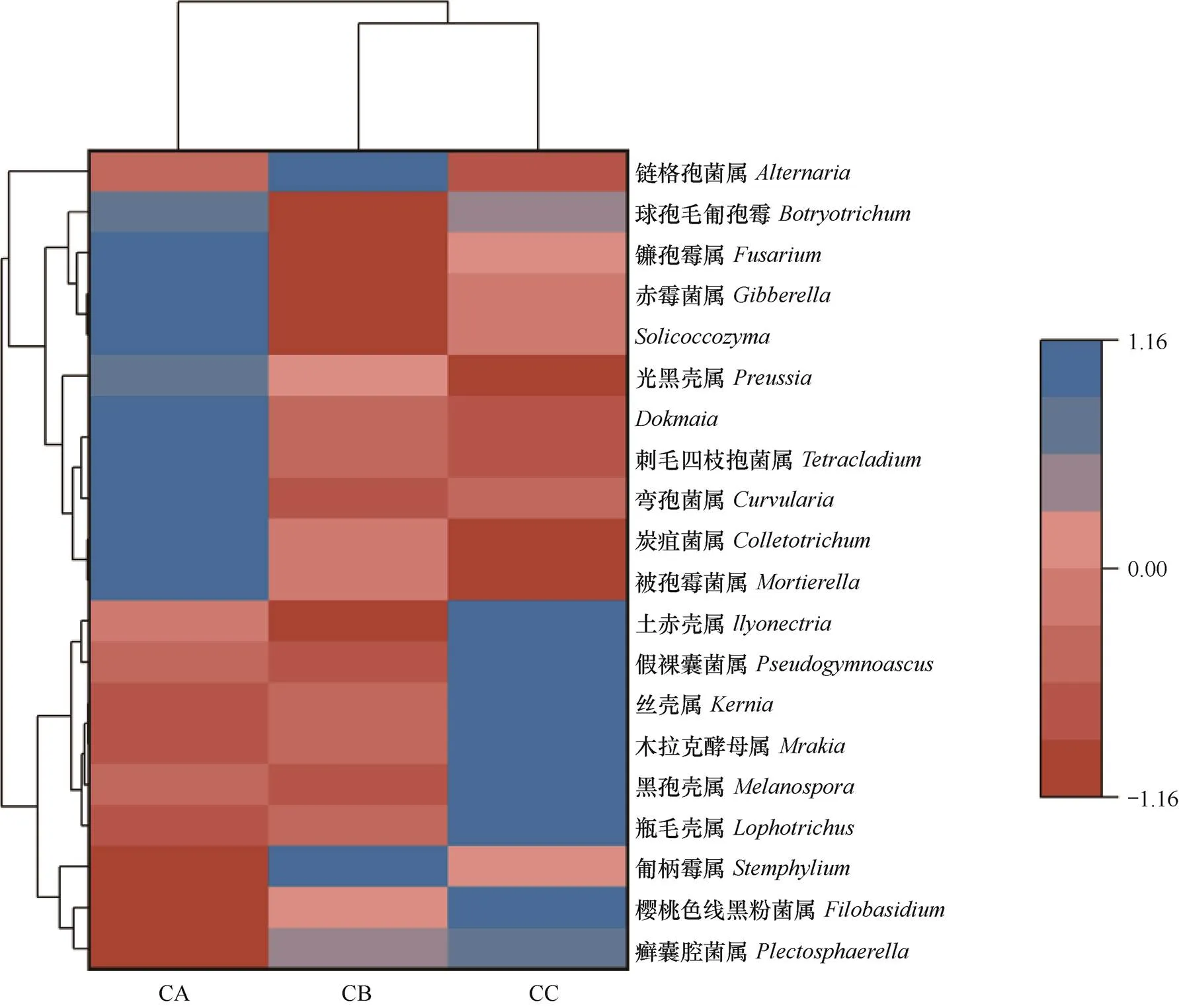
图7 三种连作处理芹菜根际土壤样品在真菌属水平的物种丰度聚类热图
2.3.2.2 代谢通路差异分析
代谢通路差异分析可以找出组间具有显著差异的代谢通路(图10)。在CA和CB的土壤样品中(图10a),以CA为对照组,CB为上调组,结果显示,CB相对CA有6条代谢通路上调,10条通路下调,其中4条通路之间具有极显著差异(P<0.001),下调通路中PWY-7409通路phospholipid remodeling和P221-PWY通路octane oxidation等变化幅度较大。CB和CC中(图10b)以CB为对照组、CC为上调组进行代谢通路的差异性分析,结果表明,CC相对CB有4条通路上调,14条通路下调,其中9条通路之间呈现极显著差异(P<0.001),上调通路中P221-PWY通路octane oxidation和SO4ASSIM- PWY通路sulfate reduction I (assimilatory)等具较大变幅。在CA和CC的土壤样品中(图10c),CA为对照组,CC为上调组,结果表明,CC相对CA有14条通路均下调,其中3条通路之间呈现极显著差异(P<0.001),分别是PWY4FS-8通路phosphatidylglycerol biosynthesis II (non-plastidic)和PWY4FS-7通路phosphatidylglycerol biosynthesis I (plastidic)等。结果进一步说明芹菜的连作年限对其微生物代谢有十分重要的影响,连作年限越长通路上下调变化越明显,通路之间差异越显著。

图10 CA与CB(a)、CB与CC(b)以及CA与CC(c)处理中土壤真菌菌群代谢通路的差异分析
3 讨论与结论
3.1 讨论
本研究采用Illumina平台对群落DNA片段进行双端(Paired-end)测序,通过将16S rRNA的V3−V4区和ITS V1区测序,结果表明,序列覆盖率在95%及以上的测序结果可以确切反映土壤环境中的细菌群落结构。
根际土壤是植物能量和物质代谢最活跃的部位之一[14],该微环境代表了植物-微生物和微生物-微生物相互作用的主要生态位,其中细菌在根际土壤生态系统中扮演着重要角色,对于植物生长发育和环境适应至关重要[15−16]。例如能直接参与土壤微生态物质循环和能量交换过程的固氮菌和纤维素分解菌,其分别在土壤氮元素循环和碳元素循环中起到重大作用[17−18],能将亚硝酸根氧化成硝酸根离子的硝化细菌,是帮助作物特别是旱作物顺利吸收利用所需氮素的主要细菌类群[19],能作为生防菌的芽孢杆菌[20]、假单胞杆菌[21]和巴氏杆菌[22],可通过竞争作用和拮抗作用诱导作物抗性并促进作物生长,间接提高作物抗性等一种或多种联合机制来抑制引起植物病害的某些病原菌的存活和活动[23−24]。因此,土壤菌群的结构和多样性对改善土壤质量和作物健康起着决定性的作用。
本研究通过对不同年限连作的芹菜根际土壤细菌进行比较分析,探究作物不同种植年限与其根际土壤菌群结构及多样性之间的关系。结果表明,芹菜连作两年时,纤维素分解性细菌的纤维弧菌属()相对丰度有所增加,它是具有解磷、固氮等促生功能的有益内生菌属[25]。同时黄单胞科的溶杆菌属()也比一年生芹菜的溶杆菌属相对丰度较高,该菌是一种重要的生防革兰氏阴性细菌,能产生多种胞外水解酶,包括几丁质酶、纤维素酶和蛋白酶,以及小分子次生抗菌代谢产物,对植物病原真菌、卵菌和阳性细菌均有较好的抗菌活性[26]。而在芹菜连作三年的根际土壤中,以上两种有益细菌菌属丰度反而降低,且己科河菌门的病原菌属丰度急剧减少,黄杆菌门的属相对丰度增加。有研究报道,罗库细菌可以构成一种单物理、植物水平谱系,对广泛的化学刺激做出反应,同时编码多种碳传递蛋白,包括专门生产脂质、肽和糖的蛋白质[27],而黄杆菌属为条件致病菌,在高盐碱土壤中会明显增多,与作物连作模式中植物病害的发生率升高呈显著相关性[28−29]。这一结果说明,芹菜种植连作年限越长,其根际土壤中原有的(具有潜在的纤维素降解功能[30])(根际促生菌[31])等功能性细菌量都会持续下降,对土壤环境中的土壤营养元素循环、植物对营养元素的吸收利用产生一定负面作用,从而影响植物的生长发育,降低作物产量与抗病能力。
对土壤真菌群落结构变化分析发现,芹菜连作三年时,瓶毛壳菌属(s)、黑孢壳属()、木拉克酵母菌属() 、丝壳菌属()、假裸囊菌属()和土赤壳菌属()的相对丰度急剧增加。其中,Farag Mf[32]通过真菌的形态学特征、病症症状和致病性试验,将确定为番茄粉红色根腐病的致病因子。同时,张进强等[33]对天麻连作土壤研究表明,的丰富度与天麻土传真菌病害发生率呈显著正相关。当地芹菜连作障碍主要表现为易感染根腐病,有可能是因为以黑孢壳属和土赤壳属真菌为主,其他侵袭性真菌为辅过多积累导致,但本试验结果还需在田间进一步验证,以具体明确影响连作植物生长的微生物种群,为连作土壤微生物菌群的定向改造提供更加充分的理论依据。
PICRUSt2软件是基于PICRUSt软件升级后的细菌群落功能预测平台,在土壤微生物群落功能预测方面多见应用[34],它可以适配OTU序列或ASV序列和丰度数据,将微生物的变化情况和生物功能联系起来[35]。王峰等[36]通过对茶园土壤细菌群落进行PICRUSt2功能预测,得出其在代谢、遗传信息处理和环境信息方面功能活跃。吕锡斌等[37]运用PICRUSt2预测软件分析得出,赤水河流域微生物群落的功能主要涉及代谢等46个子功能。本研究通过将芹菜根际土壤的16S rRNA序列和ITS序列进行PICRUSt2功能预测分析,发现土壤细菌共涉及7个主代谢通路,真菌共涉及5个主代谢通路,其子通路均表现出功能上的丰富性,同时通路之间也表现出极显著差异。但鉴于PICRUSt2功能预测分析具有一定的局限性,所以后续研究需要结合宏基因组测序等技术进一步分析。
3.2 结论
芹菜连作时其根际土壤的微生物群落结构与多样性之间存在显著差异。连作年限增加,益生菌比例缓慢下降,致病病原菌比例呈先下降后急剧增长趋势,此微生物群落结构的变化不利于作物的生长发育,最终导致芹菜出现严重的连作问题。因此,本研究认为芹菜连作两年是宁夏南部山区较好的田间种植方式,其连作障碍问题可能是因为连作两年后,根际土壤部分致病真菌菌群如黑孢壳属、土赤壳属真菌丰度急剧增加、结构剧烈变化引起。
[1] 汪劲武.伞形科植物观(上)[J].植物杂志, 1989(6):22-24.
Wang J W.Apiaceae plant view(Part I)[J].Chinese Journal of Botany,1989(6):22-24.(in Chinese)
[2] 汪劲武.伞形科植物观(下)[J].植物杂志, 1990(1):30-32.
Wang J W.Apiaceae plant view (Part II)[J].Chinese Journal of Botany, 1990(1):30-32.(in Chinese)
[3] 李荣华,夏薇,吴坤.蔬菜中芹菜素高效液相色谱测定[J].中国公共卫生, 2007(7):894-895.
Li R H,Xia W,Wu K.Determination of apigenin in vegetables by high performance liquid chromatography[J]. Chinese Journal of Public Health,2007(7):894-895.(in Chinese)
[4] 陈丽生.西吉县特色冷凉蔬菜产业发展现状分析[J].新农业,2019(15):84-85.
Chen L S.Analysis of the current situation of the development of special cold vegetable industry in Xiji county[J].New Agriculture,2019(15):84-85.(in Chinese)
[5] Yang R P,Mo Y L,Liu C M,et al.The effects of cattle manure and garlic rotation on soil under continuous cropping of watermelon(L)[J].PloS One, 2016,11(6):e0156515.
[6] Li W,Liu Q,Chen P.Effect of long-term continuous cropping of strawberry on soil bacterial community structure and diversity[J].Journal of Integrative Agriculture, 2018,17(11):2570-2582.
[7] Dong L,Xu J,Feng G,et al.Soil bacterial and fungal community dynamics in relation todeath rate in a continuous cropping system[J].Scientific Reports,2016,6(1):31802.
[8] 高苇,吴峰,王勇,等.棉隆与生物有机肥协同防治芹菜根腐病及其对根际土壤微生物数量的影响[J].中国农学通报,2018,34(2):65-68.
Gao W,Wu F,Wang Y,et al.Synergetic effect of dazomet and biological fertilizer on celery root rot and soil rhizosphere microorganisms[J].Chinese Agricultural Science Bulletin, 2018,34(2):65-68.(in Chinese)
[9] 郑立伟,赵阳阳,王一冰,等.不同连作年限甜瓜种植土壤性质和微生物多样性[J].微生物学通报,2022,49(1):101- 114.
Zheng L W,Zhao Y Y,Wang Y B,et al.Soil properties and microbial diversity in the muskmelon fields after continuous cropping for different years[J].Microbiology China, 2022, 49(1):101-114.(in Chinese)
[10] 岳思君,冯翠娥,杨彦研,等.不同连作年限硒砂瓜土壤细菌群落结构特征[J].干旱地区农业研究,2020,38(1):230- 236.
Yue S J,Feng C E,Yang Y Y,et al.Analysis of microbial community structure and diversity in selenium-sand melon soil under different continuous cropping years[J].Agricultural Research in the Arid Areas, 2020,38(1):230-236.(in Chinese)
[11] Callahan B J,Mcmurdie P J,Rosen M J,et al.DADA2:High resolution sample inference from Illumina amplicon data[J]. Nature Methods,2016,13(7):581-583.
[12] Bokulich N A,Kaehler B D,Ram R J,et al.Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin[J]. Microbiome, 2018,6(1):90.
[13] Gavin M D,Vincent J M,Jesse R Z,et al.PICRUSt2 for prediction of metagenome functions[J].Nature Biotechnology: the Science and Business of Biotechnology,2020,38(6): 685-688.
[14] 李梦洁,李占彪,周思含,等.植物根际微生物调控根系构型研究[J].中国农业气象, 2021,42(11):895-904.
Li M J,Li Z B,Zhou S H,et al.Advances in the root system architecture regulated by plant rhizosphere microorganisms[J]. Chinese Journal of Agrometeorology,2021,42(11):895-904. (in Chinese)
[15] Wang X,Feng H,Wang Y,et al.Mycorrhizal symbiosis modulates the rhizosphere microbiota to promote rhizobia- legume symbiosis[J].Molecular Plant,2021,14(3):503-516.
[16] 岳衡,李闪闪,段雅欣,等.深松耕对宁南山区马铃薯田土壤细菌多样性的影响[J].中国农业气象,2021,42 (12):998- 1008.
Yue H,Li S S,Duan Y X,et al.Effect of subsoil plowing on soil bacterial diversity in potato fields in mountainous areas of southern Ningxia[J].Chinese Journal of Agrometeorology, 2021,42(12):998-1008.(in Chinese)
[17] 刘亚军,马琨,李越,等.马铃薯间作栽培对土壤微生物群落结构与功能的影响[J].核农学报, 2018,32(6):1186- 1194.
Liu Y J,Ma K,Li Y,et al.Effect of different Intercropping cultivation patterns of potato on the structure and function of soil microorganism community[J].Journal of Nuclear Agricultural Sciences,2018,32(6):1186-1194.(in Chinese)
[18] 殷继忠,李亮,接伟光,等.连作对大豆根际土壤细菌菌群结构的影响[J].生物技术通报, 2018,34(1):230-238.
Yin J Z,Li L,Jie W G,et al.Effects of continuous cropping on bacterial flora structure in soybean rhizosphere soil[J]. Biotechnology Bulletin, 2018,34(1):230-238.(in Chinese)
[19] 张星,林炜铁,朱雅楠.硝化细菌中亚硝酸盐氧化还原酶的研究进展[J].微生物学通报, 2008,35(11):1806-1810.
Zhang X,Lin W T,Zhu Y N.Research progress of nitrite oxidoreductase in nitrobacteria[J].Microbiology China,2008, 35(11):1806-1810.(in Chinese)
[20] 王蕊,王腾,李二峰.生防芽孢杆菌在植物病害领域的研究进展[J].天津农学院学报,2021,28(4):71-77.
Wang R,Wang T,Li E F.Research advances of biocontrol Bacillus in the field of plant disease[J].Journal of Tianjin Agricultural University,2021,28(4):71-77.
[21] 高芸.生防芽孢杆菌及假单胞菌拮抗植物微生物病害研究进展[J].北方园艺,2021(2):131-136.
Gao Y.Research progress in biocontrol of plant microbial diseases by Bacillus and Pseudomonas.[J].Northern Horticulture, 2021(02):131-136.(in Chinese)
[22] 董炜博,石延茂,迟玉成,等.穿刺巴氏杆菌防治植物根结线虫病的研究现状及其应用前景[J].中国生物防治, 1999(2):42-46.
Dong W B,Shi Y M,Chi Y C,et al.Status and prospect of biocontrol of plant root-knot nematode diseases by pasteuria penetrans[J].Chinese Journal of Biological Control,1999(2):42-46.(in Chinese)
[23] Li P,Ma L,Feng Y L,et al.Diversity and chemotaxis of soil bacteria with antifungal activity against Fusarium wilt of banana[J].Journal of Industrial Microbiology & Biotechnology, 2012,39(10):1495-1505.
[24] 李俊州,文才艺.植物病害生防细菌研究进展[J].河南农业科学,2015,44(10):1-7.
Li J Z,Wen C Y.Research progress on bacteria for biological control of plant disease[J].Journal of Henan Agricultural Sciences,2015,44(10):1-7.(in Chinese)
[25] 覃仁柳,庞师婵,唐小付,等.番茄嫁接植株根系内生细菌和真菌群落的组成特征[J].西南农业学报,2021,34: 1062-1072.
Qin R L,Pang S C,Tang X F,et al.Characteristics of endophytic microbial diversity and community structure in roots of grafted tomatoes[J].Southwest China Journal of Agricultural Sciences,2021,34:1062-1072.(in Chinese)
[26] 杭唯.产酶溶杆菌第二信使C-dI-GMP合成相关基因lys385的克隆及功能分析[D].南京:南京农业大学, 2015.
Hang W.Identification and functional characterization of LYS385,a second messenger C-dI-GMP metabolising protein in Lysobacter enzymogenes[D].Nanjing:Nanjing Agricultural University,2015.(in Chinese)
[27] Becraft E D,Woyke T,Jarett J,et al.Rokubacteria:genomic giants among the uncultured bacterial phyla[J].Frontiers in Microbiology,2017(8):2264.
[28] 王文团.耐盐碱细菌筛选与生物菌肥对盐碱地作物的影响[D].泰安:山东农业大学,2020.
Wang W T.Screening of saline-tolerant bacteria and effects of biological fertilizer on saline-alkali crops[D].Tai’an Shandong Agricultural University,2020.(in Chinese)
[29] 曹佳.蚯蚓和菌根真菌促进土霉素降解及其修复污染土壤的协同机制[D].北京:中国农业大学,2018.
Cao J.Cooperation between earthworm and AM fungi on the degradation and remediation of oxytetracycline in soil[D].Beijing:China Agricultural University,2018.(in Chinese)
[30] 于竺岑.分离自芦苇根系一株芽生球菌的新菌鉴定及全基因组分析[D].呼和浩特:内蒙古大学,2021.
Yu Z Z.Identification and genome analysis of a new strain ofisolated from the root of phragmites australis[D].Hohhot:Inner Mongolia University,2021.(in Chinese)
[31] 金桃,冯强,万景旺,等.五种根际促生菌在改善植物的农艺性状方面的应用[P].广东省:CN106472568B,2020-05- 12.
Jin T,Feng Q,Wan J W,et al.Application of five inter-root promoting bacteria in improving agronomic traits of plants[P].Guangdong Province:CN106472568B,2020-05-12. (in Chinese)
[32] Farag Mf. F.First record of Melanospora chionea as a possible cause of pink root rot disease on tomato plants in Egypt[J].Journal of Plant Pathology & Microbiology, 2020 (11):1-8.
[33] 张进强,唐鑫,郭兰萍,等.天麻连作障碍与土赤壳属真菌的关联分析及改善措施[J].中国中药杂志,2022,47(9): 2296-2303.
Zhang J Q,Tang X,Guo L P,et al.Correlation analysis between continuous cropping obstacle of Gastrodia elata and Ilyonectria fungi and relieving strategy[J].China Journal of Chinese Materia Medica,2022,47(9):2296-2303. (in Chinese)
[34] 宋腾蛟,杨蒋舜,周静,等.基于Miseq测序技术分析不同元胡产区土壤细菌功能基因组成与差异[J].浙江中医药大学学报,2018,42(3):178-186.
Song T J,Yang J S,Zhou J,et al.Analysis of composition and difference of soil bacteria functional genes of in different corydalis Yanhusuo producing areas based on Miseq sequencing technology[J].Journal of Zhejiang Chinese Medical University,2018,42(3):178-186.(in Chinese)
[35] 杨盼,翟亚萍,赵祥,等.丛枝菌根真菌和根瘤菌互作对苜蓿根际土壤细菌群落结构的影响及PICRUSt功能预测分析[J].微生物学通报,2020,47(11):3868-3879.
Yang P,Zhai Y P,Zhao X,et al.Effect of interaction between arbuscular mycorrhizal fungi and Rhizobium on Medicago sativa rhizosphere soil bacterial community structure and PICRUSt functional prediction[J].Microbiology China,2020, 47(11):3868-3879.(in Chinese)
[36] 王峰,陈玉真,吴志丹,等.种植模式和坡位对茶园土壤细菌群落结构及功能类群的影响[J].生态学报,2022(20): 1-18.
Wang F,Chen Y Z,Wu Z D,et al. Effects of planting patterns and slope positions on soil bacterial community structure and functional groups in tea gardens[J].Acta Ecologica Sinica,2022(20):1-18.(in Chinese)
[37] 吕锡斌,吴云成,陈良强,等.赤水河流域浮游细菌群落特征及其与水质的关系[J].环境科学学报,2021,41(11):4596-4605.
Lv X B,Wu Y C,Chen L Q,et al. Characteristics of the bacterioplankton community and their relationships with water quality in Chishui River basin[J].Acta Scientiae Circumstantiae,2021,41(11):4596-4605.(in Chinese)
Continuous Cropping Years Affect the Rhizosphere Soil Microbial Community Structure and Functional Taxa of Celery
LIU Su1, WU Hong-liang1, CHEN Zhuo1, FENG Hai-ping2, ZHANG Hai-yu1, KANG Jian-hong1
(1.School of Agriculture, Ningxia University, Yinchuan 750021, China;2.Institute of Horticulture, Ningxia Academy of Agricultural and Forestry Sciences, Yinchuan 750000)
Celery is a characteristic vegetable in Ningxia cold region, and its large-scale planting inevitably leads to the prominent obstacle of continuous cropping. In order to reveal the diversity characteristics of microbes in celery rhizosphere soil and the difference of community structure with planting years, author used Illumina Novaseq-PE250 sequencing platform to sequence 16S V3V4 region and ITS1 region of celery rhizosphere soil samples after planting for one year (CA), continuous cropping for two years (CB) and continuous cropping for three years (CC), and made bioinformatics analysis.The results showed that the soil bacterial diversity decreased gradually with the extension of continuous cropping years. The Chao 1 index decreased from 8509.41 in the first year to 6314.09 in the third year.The CA Shannon index was the highest at 11.48 and the CC was the lowest at 11.08.The abundance of beneficial bacteria such as Deltaproteobacteria and Gemmatimonadetes in soil bacteria and,andin them decreased. The diversity index and richness index of soil fungi first decreased and then increased with the increase of continuous cropping years, which showed that the Chao 1 index of CA and CB was 505.44 and 264.66, while CC was 443.92, the Shannon index of CA and CB was 5.98, 4.93, and CC was 5.61, and there were significant differences between continuous cropping years. At the same time, there are significant differences among soil fungi, such as,,and other dominant genera. The results of microbial principal coordinate component analysis showed that there was strong heterogeneity between CC and other treatments. The function prediction analysis of PICRUSt2 showed that bacteria in the rhizosphere soil of celery mainly had 7 major categories of primary functional layers, with the highest relative abundance of Amino Acid Biosynthesis, fungi had 5 major categories of primary functional layers, and the highest relative abundance of Nucleoside and Nucleotide Biosynthesis. At the same time, there were significant differences between multiple metabolic pathways in different years of continuous cultivation of celery. To sum up, celery continuous cropping will reduce the richness and diversity of rhizosphere soil flora, change the flora structure, and lead to the imbalance of rhizosphere micro-ecological environment, thus causing related continuous cropping obstacle diseases. Among them, the microbial indices changed the most when celery was continuously cropped for three years. Therefore, it is recommended that the celery industry in the southern mountainous areas of Ningxia should be continuously cropped for no more than two years as a field planting mode.
Celery; Continuous croping year; Rhizosphere soil microorganism; High-throughput sequencing; PICRUSt2 functional prediction
10.3969/j.issn.1000-6362.2023.05.003
收稿日期:2022−05−22
宁夏自然科学基金项目(2021AAC03079);宁夏农业高质量发展和生态保护科技创新示范项目(NGSB−2021−8−06);宁夏自治区重点研发计划(2020BBF03016);宁夏青年拔尖人才项目
通讯作者:吴宏亮,副教授,主要从事耕作制度、农业生态领域的应用基础理论和技术研究,E-mail: nxuwu@163.com
刘素,E-mail:nxuliu@163.com
刘素,吴宏亮,陈倬,等.连作年限影响芹菜根际土壤微生物群落结构及功能类群[J].中国农业气象,2023,44(5):372-385
