溶菌酶滴眼液兔眼药代动力学研究
2023-05-25白英汉刘博文
赵 欣,左 琳,白英汉,刘博文,杨 强
(沈阳兴齐眼药股份有限公司,辽宁 沈阳,110164)
溶菌酶,又称胞壁质酶,是由 Fleming 于 1922 年首次发现的一种能够有效地溶解细菌的成分,广泛分布于眼泪、唾液、乳汁、心脏、肾脏等多种体液及器官组织中[1-3]。外眼直接暴露在含有各种病原微生物的环境中,泪液作为最外层屏障发挥着重要的抗感染防御作用。泪液中含有多种抗微生物的物质,例如溶菌酶、乳铁蛋白、β-溶素、免疫球蛋白、补体等。其中,含量最丰富的是溶菌酶,占泪液中蛋白质成分的 20%~40%[4]。泪液中溶菌酶的来源主要是泪腺细胞,含量约为 1~3 mg·mL-1,是血清中的上千倍[5]。已有研究表明,各种眼病患者泪液中溶菌酶水平会发生显著变化,如干燥性角结膜炎及干燥综合征可导致患者泪液中溶菌酶含量显著降低[6-7];在烟雾、化学气体等污染环境中泪液中溶菌酶含量也有下降[8-9];佩戴角膜接触镜人群泪液中溶菌酶含量也会显著降低[10]。泪液中溶菌酶的改变不仅对眼部疾病的诊断和治疗具有重要意义,也为补充溶菌酶进行治疗提供依据。
溶菌酶滴眼液早在上世纪八十年代就已上市,具有抗菌抗炎作用,主要用于治疗慢性结膜炎。溶菌酶的作用机制:首先,通过水解β-1,4 糖苷键有效清除细菌细胞壁的肽聚糖,导致细胞壁不稳定;其次,通过其阳离子性质的机制,不依赖肽聚糖水解杀死细菌;同时,溶菌酶具有良好的生物相容性,不易产生耐药性[11-12]。不仅如此,近期研究表明,溶菌酶作为一种眼表宿主防御肽,除能保持眼部健康外,还可在疾病治疗中发挥巨大潜力[13]。如溶菌酶能减少角膜接触镜上白蛋白沉淀物,降低细菌感染的风险[14];溶菌酶滴眼液不仅能有效缓解和改善干眼症,同时,能促进眼表损伤修复和抑制炎性反应,且效果优于玻璃酸钠滴眼液[15]。以上研究为溶菌酶滴眼液开拓新型适应症提供了基础。然而,关于溶菌酶滴眼液在眼内的药代动力学研究鲜有报道,药品说明书也缺少药代动力学研究的相关数据。相对于化学药而言,溶菌酶有分子量大、结构复杂、内源性物质干扰强等特点,故药代动力学研究需要灵敏度更高且特异性更强的定量检测方法。目前,测定溶菌酶常用的方法包括比浊法和平板扩散法。然而,这两种定量方法干扰因素较多,且重复性和灵敏度较差[16-17]。史瑾等人[18]分别采用 SDS-聚丙烯酰胺凝胶电泳法、免疫印迹法和反相高效液相色谱法测定兔眼房水中溶菌酶的浓度。但受这些检测方法灵敏度的限制,18 个样品中仅有 2 个被检出。本次研究建立灵敏度高且专属性强的酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)法检测溶菌酶的浓度,并应用于研究溶菌酶滴眼液在单多次给药后兔眼组织和血清的药代动力学研究中,揭示溶菌酶滴眼液局部给药后眼内动力学特征,为临床用药提供基础数据支持。
1 仪器与材料
1.1 仪器
Multiskin Sky 全波长酶标仪(美国 Thermo 公司),XS105 型分析天平(瑞士 Metter-Toledo公司),AllegraTMX-22R 型高速冷冻离心机(美国 Beckman 公司),手持裂隙灯(日本 Kowa公司),泪液微量采集器(广州盛泽康华生物医药有限公司),组织匀浆机(法国 Bertin technologies公司),微量加样器(美国 Eppendorf 公司)。
1.2 试剂与药品
ELISA 试剂盒(鸡溶菌酶试剂盒,批号 NBP2-60088,美国 NOVUS 公司),溶菌酶对照品(上海中华药业有限公司),溶菌酶滴眼液(沈阳兴齐眼药股份有限公司),纯化水(自制)。
1.3 实验动物
新西兰兔,46 只,体重 2.0~2.5 kg,雌雄各半(青岛康大爱博生物科技有限公司,质量合格证明号:No.37082321100065548)。所有动物均在环境技术指标符合的条件下饲养,温度为 16~26 °C,湿度保持在 40%~70%,给予标准光照周期(12 h 小时照明/ 12 h 黑暗明暗交替)。可自由摄入食物和水,适应性饲养一周以适应环境。实验前,将所有兔左眼进行荧光素钠染色,在裂隙灯下观察,角膜没有损伤的兔可进行后续实验。
2 方法
2.1 给药和泪液采集
12 只新西兰兔,雌雄各半。精密吸取 50 µL 溶菌酶滴眼液,6 只左眼单次给予溶菌酶滴眼液,于给药后 0.25、0.5、1、2、3、4、6、8、10、24 h 采用泪液采集器收集泪液;6 只左眼多次给予溶菌酶滴眼液,每天 4 次,间隔 3 h,连续用药 7 天。于 4、5、6 天首次给药后的 0.5 h以及 7 天给药前和首次给药后 0.25、0.5、1、2、3、4、6、8、10、24 h 采用泪液采集器收集泪液。所有泪液样品于 -80 °C 保存待测。
2.2 角膜去上皮处理和眼组织采集
12 只采用 10% 水合氯醛耳缘静脉注射进行全身麻醉,左眼采用 0.5% 丙美卡因滴眼液眼局部麻醉后,将直径为 6 mm 的圆形滤纸片浸润 75% 酒精,立即放于角膜中央 30 s,用尖刀刮除角膜上皮,并采用荧光素钠染色证实角膜上皮缺损,如图 1 所示。
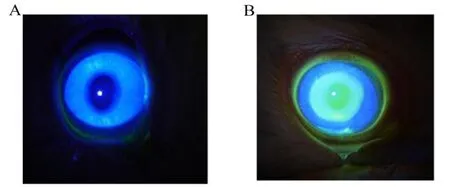
Fig.1 Fluorescein sodium staining of rabbit cornea(A: normal cornea;B: de-epithelized cornea)图1 兔角膜荧光素钠染色检查图(A:正常角膜;B:去上皮角膜)
2.3 生物样品采集和处理
12 只正常和 12 只去角膜上皮兔左眼分别单次给予 50 μL 溶菌酶滴眼液,于给药后 0.5、1、4 和 8 h 取血后处死,分别取角膜、结膜、房水。全血放入无抗凝剂采血管中离心取上清,制备血清;角膜、结膜组织经蒸馏水清洗三遍后,用滤纸吸干并称重,按1∶10(g·mL-1)的比例加入蒸馏水并在 4 °C 条件下进行匀浆处理。
2.4 ELISA 法测定生物样品中溶菌酶浓度的原理和方法
ELISA 试剂盒基于竞争性酶联免疫法定量检测生物样品中溶菌酶的浓度。在预包被抗溶菌酶抗体的 96 孔微孔板上,加入含有溶菌酶的标准溶液或生物样品以及生物素标记的溶菌酶,标准溶液或生物样品中的溶菌酶和生物素标记溶菌酶竞争性结合预包被抗体。洗去未结合物质后,加入亲和素或链霉亲和素标记的辣根过氧化物酶(Horseradish peroxidase,HRP)。洗涤后加入 HRP底物四甲基联苯胺(3,3’,5,5’-tetramethyl benzidine,TMB)显色,终止酶反应后,测定 450 nm处的吸光度。吸光强度与样品中所含溶菌酶的浓度成反比。
2.5 药代动力学参数及数据处理
数据以平均值(Mean)± 标准差(SD)表示,通过 Graph Pad Prism 6.0 软件进行图的处理,采用Winnonlin 软件对检测浓度进行药代参数计算;采用 Excel 2021 软件对数据进行统计分析,双侧t检验比较组间差异,P< 0.05 判定两组数据差异具有统计学意义。
3 结果
3.1 ELISA 法测定兔泪液中溶菌酶浓度的方法学验证
1)选择性
采用 10 个不同来源的兔空白泪液配制最低定量浓度(Lower limit of quantification,LLOQ)和最高定量浓度(Upper limit of quantification,ULOQ)的样品。按照 ELISA 试剂盒方法测定吸光度值,分别考察不同来源的空白样品、LLOQ 和 ULOQ 质控样品,结果见表 1。10 个不同来源的空白样品响应均低于 LLOQ 的响应,LLOQ 和 ULOQ 的准确度在标示值的 ±25% 之内。

Table 1 Selectivity for lysozyme in rabbit tears (n=10)表1 ELISA 法测定泪液中溶菌酶的选择性(n=10)
2)标准曲线和定量下限
采用兔空白泪液配制溶菌酶校正标样,浓度分别为 62.50、125.0、250.0、500.0、1000、2000、4000 ng·mL-1。按照 ELISA 试剂盒方法测定吸光度值,每个浓度双样本,取其平均值。以药物浓度为横坐标,吸光度值为纵坐标,经四参数 Logistic 模型拟合成 Sigmoidal 型曲线,权重为 1/x2,典型的标准曲线如图 2 所示。相关系数r> 0.99,线性范围为 62.50~4 000 ng·mL-1,定量下限为62.50 ng·mL-1。
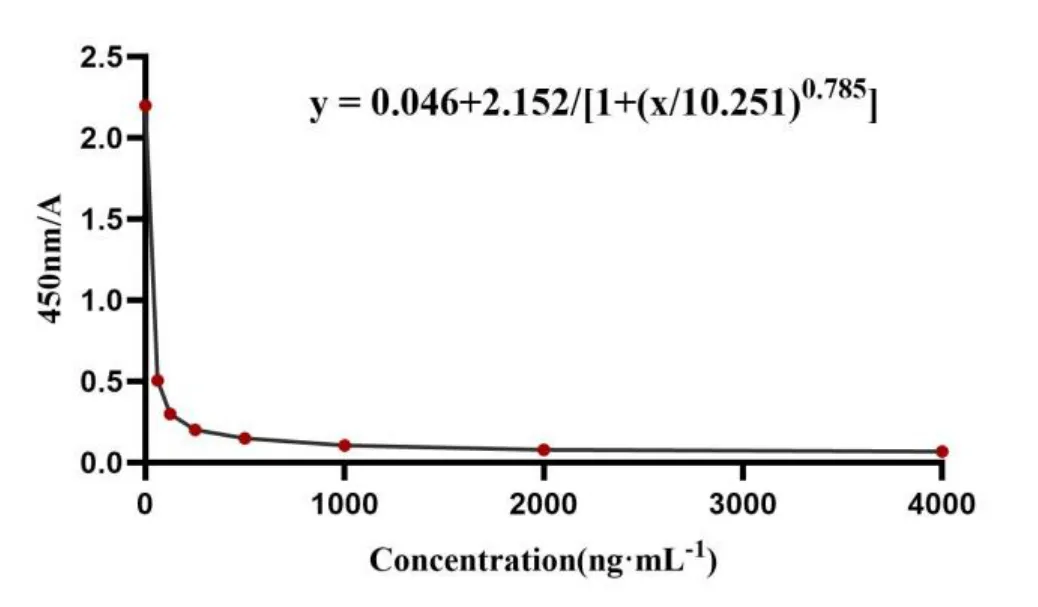
Fig.2 Typical standard curve of lysozyme in tears图2 泪液中溶菌酶的典型标准曲线图
3)精密度和准确度
采用兔空白泪液分别配制定量下限、低、中、高和定量上限浓度的质控(Quality control,QC)样品,即 62.50、160.0、800.0、3 200、4 000 ng·mL-1。每一个质控样品在同一批中重复 3 次测定,考察批内和批间精密度和准确度;以连续 6 个分析批测定每一浓度质控样品的吸光度值,考察批间精密度和准确度,结果见表 2。溶菌酶的各浓度 QC 样品的精密度和准确度均在 ±20% 以内。
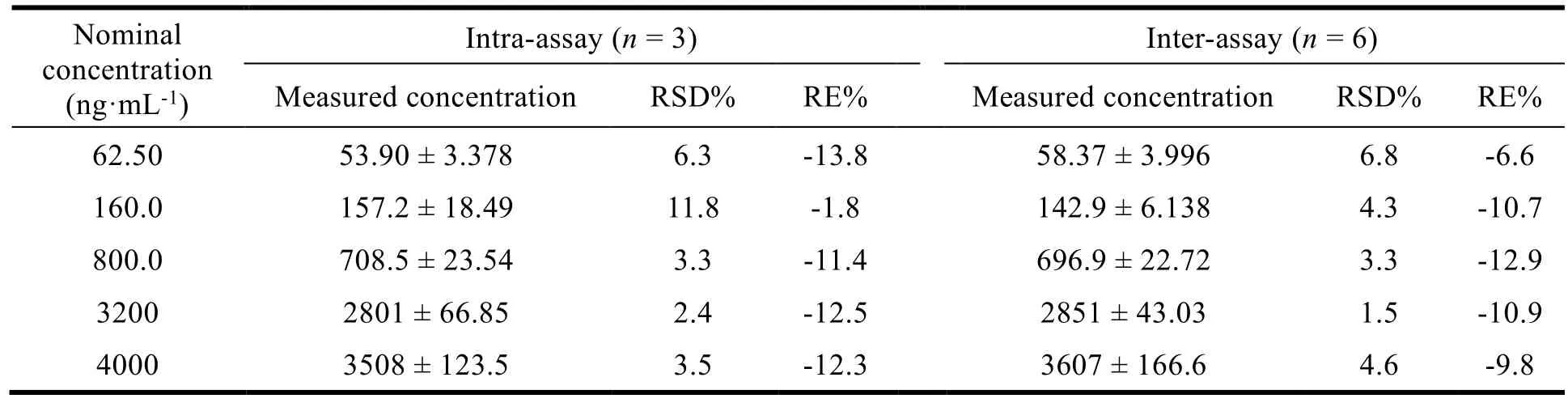
Table 2 Precision and accuracy for lysozyme in rabbit tears表2 ELISA 法测定泪液中溶菌酶的精密度和准确度
4)稳定性试验
采用兔空白泪液分别配制溶菌酶 160、3200 ng·mL-1两个浓度 QC 样品,考察其在室温放置4 h、-80 °C 放置 20 d、4 °C 放置 1 d 和经历三次冻融循环等不同条件下保存稳定性(结果见表3)。溶菌酶在上述 4 种条件下测定的 RE 均在 ±20% 以内,对测定结果均没有明显影响。

Table 3 Stability for lysozyme under various storage conditions in rabbit tears表3 采用 ELISA 法测定不同存放条件下泪液中溶菌酶的稳定性
5)稀释线性试验
制备含溶菌酶高浓度的泪液样品,逐级稀释,计算回算浓度的精密度和准确度。结果表明,当稀释度不大于 1∶2 000 时,样品稀释后再测定对试验结果的准确度影响不大,其 RSD 值均小于 20%,RE 均在 ±20% 以内。
3.2 兔泪液中溶菌酶药代动力学研究
兔眼给予 0.5% 的溶菌酶滴眼液后泪液中不同时间平均浓度—时间曲线见图 3。采用Winnonlin 药动学计算软件进行数据处理,主要药动学参数如表 4。结果表明,单次给药后泪液中溶菌酶浓度迅速达到峰浓度,Cmax为 (219.5 ± 41.72) μg·mL-1。随后缓慢消除,24 h 仍能检测到溶菌酶的浓度为 1.96 μg·mL-1,约为 Cmax的 0.9%,AUC0-24h为 (572.5 ± 100.9) h·μg·mL-1。溶菌酶滴眼液以每天 4 次进行多次给药,比较第 4、5、6 天首次给药后 0.5 h 泪液中溶菌酶的浓度,差异未见统计学意义,提示连续给药 3 天后泪液中溶菌酶达到稳态。与单次给药相比,连续给药后泪液中溶菌酶的含量显著增加,Cmax为 (714.6 ± 191.0) μg·mL-1,约是单次给药的 3.3 倍,AUC0-24h约是单次给药的 6.1 倍,且t1/2也从单次给药的 6.91 h 延长到 10.6 h。
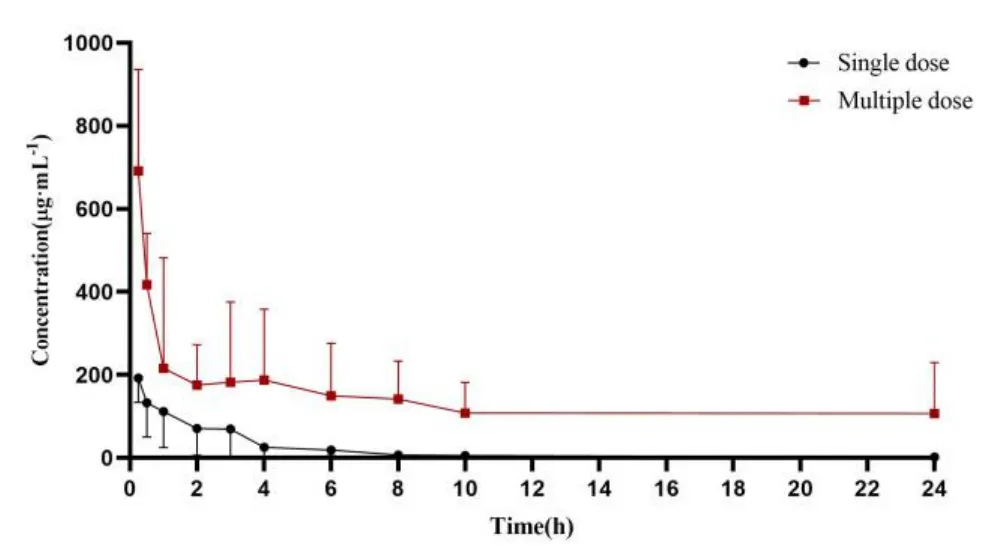
Fig.3 Plots of mean concentration versus time for lysozyme in tears after a single and repeated administration of 0.5% lysozyme eye drops to rabbits (n =6)图3 兔眼单多次给予 0.5% 溶菌酶滴眼液后泪液中溶菌酶的平均药物浓度-时间曲线(n=6)

Table 4 Summary of pharmacokinetic parameters after ocular instillation of lysozyme eye drops to rabbit eyes (n=6)表4 兔眼单多次给予 0.5% 溶菌酶滴眼液泪液中溶菌酶的主要动力学参数(n=6)
3.3 兔眼组织和血清中溶菌酶分布
分别采用兔空白眼组织液(房水和角膜、结膜匀浆液)和空白血清配制溶菌酶校正标样,浓度分别为 62.50、125.0、250.0、500.0、1000、2000、4000 ng·mL-1。按“标准曲线和定量下限”项下操作,所得溶菌酶在各眼组织和血清的标准曲线如表 5 所示,结果表明,所建立的方法线性关系良好。

Table 5 Standard curves of lysozyme in biological matrix表5 生物基质中溶菌酶的标准曲线
正常组和去角膜上皮组兔左眼给予溶菌酶滴眼液后各时间点在眼组织的分布如图 4 所示。结果表明,溶菌酶局部给药后在正常组兔角膜、结膜均有分布,达峰时间均为1 h,含量分别为948.4 ng·g-1和 523.8 ng· g-1,随后缓慢消除,给药后8 h在角膜、结膜中溶菌酶的量分别为 Cmax的 49.8% 和 68.8%;房水中仅有两只兔被检出,其余均低于检测定量下限(62.50 ng·mL-1)。去角膜上皮后溶菌酶在角膜分布的 Cmax为 38 288 ng·g-1,Tmax为 1 h,各时间点溶菌酶的含量与正常组相比均显著增大(P< 0.05),约是 34~56 倍;去角膜上皮后各时间点溶菌酶在房水中均可被检出,且与正常组相比分布亦显著增大,其中 Cmax为 13 030 ng·mL-1,Tmax为 1 h;各时间点溶菌酶在结膜分布与正常组相比,差异无统计学意义;两组动物血清中均未检测到溶菌酶的量。

Fig.4 The concentration of lysozyme in normal and de-epithelized rabbits after a single administration of 0.5%lysozyme eye drops (n=3)(Compared with the control group,*P <0.05,**P <0.01)图4 正常和去上皮角膜兔眼单次给予0.5%溶菌酶滴眼液后各眼组织中溶菌酶的量(n=3)(与正常组相比,*P < 0.05,**P< 0.01)
4 讨论
溶菌酶是一种糖苷水解酶,具有 4 个 S-S 键,分子量约为 14 KD,普遍存在于人和动物的多种组织中,可以溶解革兰氏阳性菌的细胞壁,对其具有杀灭作用。鸡和人溶菌酶的第 56 位和第 67 位两个残基位点在结构上高度保守,与其他动物相比两者结构相似度最高,故目前临床上使用最广泛的是鸡蛋清溶菌酶[19]。本次研究给予的溶菌酶滴眼液也是以鸡蛋清溶菌酶为原料,给予兔眼后采用鸡源溶菌酶 ELISA 试剂盒进行检测分析。该试剂盒的原理是间接竞争法检测生物样品中的溶菌酶,在微孔板上预包被抗溶菌酶抗体,所检测的生物样品或标准品中的溶菌酶、生物素标记溶菌酶在微孔板上竞争抗溶菌酶抗体,导致样本吸光度值与所含溶菌酶的量负相关。本次研究分别用空白房水、血清以及角膜和结膜匀浆液上清制备溶菌酶的标准曲线;由于泪液采集量仅为 2 μL,泪液样品需稀释后测定。为确保样品浓度测定的准确性,本次研究对生物样品中溶菌酶进行方法学验证,验证结果表明所建立的测定方法符合药动学试验要求[20],且该方法的定量下限可达到 62.50 ng·mL-1,并将该方法成功用于溶菌酶滴眼液单、多次给药兔泪液的药动学研究。结果表明溶菌酶滴眼液连续用药的 3 天后达到稳态浓度,多次给药不仅增加眼组织中药物浓度,而且增加药物的作用时间。
眼表相关疾病导致的炎症反应可直接损害眼表上皮细胞。角膜上皮是外界环境与角膜基质间的屏障,其依靠角膜上皮间紧密连接形成较高的抵抗能力[21]。大多数实验动物的角膜是由上皮层、基质层、后弹力层和内皮层构成。本次研究采用去角膜上皮模拟受损角膜,通过与正常角膜对比分析溶菌酶分布差异。溶菌酶属于大分子药物,试验表明局部使用后几乎无法穿过正常的角膜进入房水。但是,当角膜上皮细胞受到破坏后,其在角膜和房水的分布量均显著升高。进一步证明角膜对大分子药物的屏障主要是通过上皮层发挥作用,与文献[22]报道一致。
眼表是一个精细又复杂的体系,不仅包括角膜、结膜、睑板腺、泪腺、神经网络,同时,还有免疫细胞、基质细胞、激素甚至微生物群等共同维持眼表的稳态。长期使用抗生素眼药水,不仅容易产生耐药性,还会导致眼表稳态的失调。溶菌酶主要作用于菌体细胞壁结构的相关化学键,故对人和动物是安全的。它是正常泪液的重要组成成分,不易产生耐药性,不仅对组织无刺激性和毒性,还可为眼表提供额外的抗感染作用。刘慧等人[23]研究溶菌酶对几种菌的抑菌试验表明,溶菌酶浓度在 2.5 μg·mL-1以上对溶壁微球菌具有杀菌作用;浓度在 1~3 mg·mL-1对金黄色葡萄球菌和白色念珠菌有杀菌作用;Yeon 等人[6]研究发现 30 名 Sjögren's syndrome 患者与 30 名非干眼患者相比,泪液中溶菌酶的含量下降约 700 μg·mL-1。依本次研究可知,如以 0.5% 溶菌酶滴眼液每天 4 次连续给药后,泪液中溶菌酶的量可达到 (714.6 ± 191.0) μg·mL-1,可有效补充泪液中溶菌酶的量。近年来,多名学者对溶菌酶的抑菌活性做了深入研究发现,其对革兰氏阳性和部分革兰氏阴性菌及真菌等都有一定的抑菌作用,部分抑菌效果与常用抗生素如青霉素钠及硫酸卡胺那霉素等相同[24-25]。
5 结论
本次研究建立了 ELISA 法测定眼组织中的溶菌酶,并将该方法用于溶菌酶滴眼液单多次给药兔眼组织的药代动力学研究。溶菌酶滴眼液多次给药后在泪液的分布增加,且作用时间延长。鉴于它的天然、安全、高效、广谱,溶菌酶滴眼液有望成为一种眼表保护剂。
