基于Box-Benhnken响应面法对银柴胡继代快繁培养基的优化
2023-05-19李天顺张倩代晓华
李天顺 张倩 代晓华






摘要 [目的]解决银柴胡种苗繁殖周期长、受外界环境影响大等问题。[方法]以银柴胡不定芽为试验材料,采用单因素试验及Box-Benhnken响应面法,对比继代快繁培养基中6-BA、NAA、蔗糖浓度对银柴胡不定芽生长的影响,探究最佳培养基培养配方。[结果]通过回归模型方程的分析并结合实际验证,MS+ 6-BA 2.04 mg/L+ NAA 0.27 mg/L+蔗糖18.54 g/L为银柴胡继代快繁最佳培养基。[结论]以优化后的培养基进行继代快繁,银柴胡不定芽生长评分可达86.70,继代快繁效果较好,可为银柴胡种苗高质量、短周期快繁提供依据。
关键词 银柴胡;组培;繼代培养基;Box-Benhnken响应面法
中图分类号 S 567.7+9 文献标识码 A 文章编号 0517-6611(2023)07-0179-07
doi:10.3969/j.issn.0517-6611.2023.07.041
Optimization of Subculture Medium for Rapid Propagation of Stellaria dichotoma Based on Box-Benhnken Response Surface Method
LI Tian-shun,ZHANG Qian,DAI Xiao-hua
(School of Agriculture,Ningxia University,Yinchuan,Ningxia 750000)
Abstract [Objective]To solve the problems of Stellaria dichotoma seedling with long propagation cycle and great influence from external environment.[Method]Using Stellaria dichotoma adventitious shoots as experimental materials,the single factor test and Box-Benhnken response surface method were designed to compare the effects of 6-BA,NAA and sucrose concentrations in the subculture medium on the growth of Stellaria dichotoma adventitious shoots,and to explore the optimal culture medium formula.[Result]Through the analysis of the regression model equation and the actual verification,the optimal medium for Stellaria dichotoma rapid propagation was MS+ 2.04 mg/L 6-BA + 0.27 mg/L NAA+18.54 g/L sucrose.[Conclusion]With the optimized medium for rapid subculture,the growth score of Stellaria dichotoma adventitious shoots can reach 86.70,and the effect of rapid subculture is good,which can provide a basis for the rapid propagation of Stellaria dichotoma seedlings with high quality and short period.
Key words Stellaria dichotoma;Tissue culture;Subculture medium;Box-Benhnken response surface method
基金项目 宁夏重点研发计划项目(2019BBF02029)。
作者简介 李天顺(1996—),男,湖北应城人,硕士研究生,研究方向:作物栽培学与耕作学。通信作者,教授,硕士,硕士生导师,从事作物栽培学与耕作学研究。
收稿日期 2022-08-28
药材银柴胡为石竹科植物银柴胡(Stellaria dichotoma L.var.lanceolata Bge.)的干燥根[1],药用价值较高,富含甾醇类、环肽类、黄酮类、生物碱类、酚酸类、挥发类等物质[2],其多生长在海拔1 250~3 100 m的石质山坡或石质荒漠草原,在我国主要分布在宁夏、甘肃、陕西、内蒙古、辽宁等省(区)[3]。传统中医认为银柴胡有清虚热、除疳热的功能;现代医学研究发现,银柴胡不仅具有清热凉血功能,还具有抗炎、治疗过敏性疾病、抗癌、扩张血管等作用[4]。随着银柴胡药用功能的进一步开发,国内外的需求量迅速增长,然而由于对野生银柴胡的滥采滥挖以及其生态环境发生改变,使得银柴胡的野生资源明显减少,既满足不了市场需求,又破坏了当地生态的多样性。
银柴胡人工栽培地主要集中在宁夏、内蒙古、陕西等省(区),宁夏银柴胡种植面积约为5 533.3 hm2,仅宁夏同心县的银柴胡人工种植面积就达3 333.3 hm2[5],固原、西吉、海原、平罗、彭阳、隆得等县也有一套较为完整的银柴胡栽培产业,栽培面积较大。宁夏银柴胡的栽培年限一般是3~4年,平均鲜根产量约为5 342 kg/hm2,而内蒙古的锡林郭勒盟、乌兰察布市,陕西的定边县等地区仍处于银柴胡人工栽培的试栽阶段,种植面积较小,管理较为粗放,内蒙古东苏旗5年生银柴胡的产量为9 121 kg/hm2,陕西定边的4年生银柴胡产量为4 253 kg/hm2[6]。马伟宝等[3]利用中药材产地适宜性地理信息分析系统(TCMGIS)对野生银柴胡产地适宜性进行分析,结果发现内蒙古地区适宜种植银柴胡的面积最大,新疆其次,说明这些地区未来银柴胡种苗市场较为广阔。
目前生产上获得银柴胡种苗的方式仍是以种子繁殖为主,但是种子繁殖存在种源混杂、种子质量参差不齐、受环境影响大、繁殖周期长等问题[7]。 植物组织培养可以使用从母体上采集的根、茎、叶等器官作为材料进行大规模快速繁殖,有效地解决了种子繁殖发芽率低、受外界环境影响大等问题,新生植株也可保留母体的优良性状。因此,银柴胡组培快繁体系的建立是满足市场需求,保护银柴胡种质资源,实现规模化高效繁殖,促进人工栽培银柴胡产业可持续、高质量、规模化发展的重要依托。
现阶段国内外关于银柴胡组培快繁研究的报道较少,姚宁等[8]通过器官直接发生型途径成功建立了银柴胡植株再生体系,以银柴胡茎节为材料,通过添加植物生長调节剂直接诱导其分化出不定芽与不定根,最终获得再生植株。吴晓玲等[9-10]基于器官间接发生型途径对银柴胡组培快繁进行研究,结果暂时停滞于外植体诱导愈伤组织、愈伤组织诱导毛状根这一阶段,未见后续由此途径建立植株再生体系成功的报道。此外,体细胞发生型途径的研究仍处于悬浮细胞培养阶段[11-12],尚未有通过此途径成功建立再生植株体系的研究结果。上述研究均以提升初代培养中诱导芽、根等器官的成功率为主,关于其继代快繁培养基配方配比的研究仍尚未涉及,因此该试验以银柴胡初代组织培养中形成的不定芽为材料,采用单因素试验结合Box-Benhnken响应面法优化分析得出最适于银柴胡继代快繁的培养基,以期促进人工栽培银柴胡产业可持续、高质量、规模化的发展,为银柴胡种质资源的保护提供一定的参考。
1 材料与方法
1.1 试验材料
试验所用组培苗材料来源于宁夏大学农学院温棚示范基地内银柴胡种植区的人工栽培3年生银柴胡。试验所用MS培养基(不含琼脂和糖)为杭州百思生物技术有限公司生产;琼脂为北京范德生物科技有限公司生产;蔗糖为天津大茂化学试剂厂生产;6-苄基腺嘌呤(6-BA)为上海麦克林生化科技有限公司生产;萘乙酸(NAA)为上海阿拉丁生化科技有限公司生产。
1.2 试验方法
1.2.1 不定芽的获得。
剪取长势良好、生长健壮、无病虫害的银柴胡幼嫩的茎节为组培外植体,流水冲洗20 min左右,用蒸馏水冲洗干净喷洒75%乙醇后置于洁净工作台中,使用75%乙醇浸泡消毒30 s后,再浸入0.1% HgCl2溶液消毒60 s,消毒完毕后无菌水冲洗3次,剪除叶片,将茎节切为约0.5 cm的小段接种到不定芽诱导培养基(MS+6-BA 1.5 mg/L+NAA 0.2 mg/L)中,光照强度2 500 lx,光照时长12 h/d,温度25 ℃,培养20 d后即可获得[8]。
1.2.2 基础培养基的配制。
精准称量MS培养基4.74 g、琼脂7.0 g、蔗糖30 g,加入100 ℃蒸馏水玻璃棒搅拌至完全溶解,调pH至6.0,定容至1 L。每组培瓶分装50 mL培养基,置入高压蒸汽灭菌器内121 ℃灭菌30 min,灭菌完成后放入洁净工作台中冷却备用。
1.2.3 不定芽的接种与培养条件。
将“1.2.1”中获得的不定芽于洁净工作台上用灭菌水洗净,切除其老叶及过长部分,分割为单独的植株并接种到继代快繁培养基中,每处理接种4瓶,每瓶2苗,重复3次,总计12瓶,24株。培养条件设置为光照强度2 500 lx、光照时长12 h/d、温度25 ℃,培养20 d后统计结果。
1.2.4 不定芽生长情况的评价。
根据银柴胡不定芽继代后的实际生长状况,结合参考同种类型植物组培继代的评价标准[13-14],制定以不定芽继代增殖倍数(增殖倍数=上代单芽体增殖芽数/产生不定芽上代单芽体数)、植株高度、叶片数、叶片颜色、是否褐化等生长性状为标准的评分机制。按照其重要性等级,分别赋分:不定芽继代增殖倍数30%、植株高度20%、叶片数20%、叶片颜色20%、是否褐化10%,满分100分,详情如表1所示。
1.2.5 单因素试验设计。
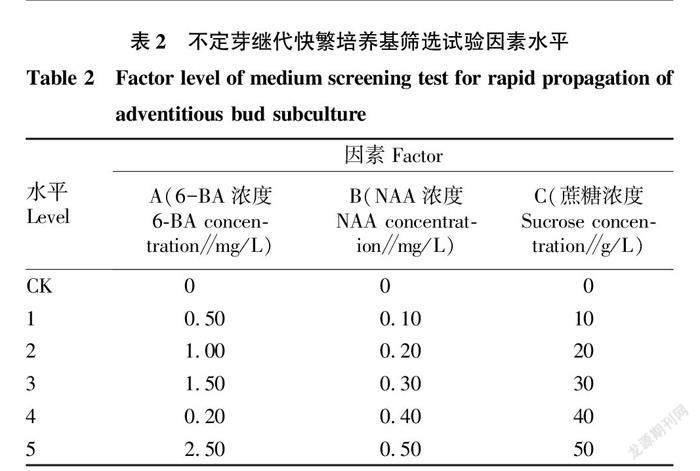
1.2.5.1 6-BA浓度对银柴胡丛生芽继代培养的影响。以MS+琼脂7 g/L+蔗糖30 g/L为基础,分别向基本培养基中添加不同浓度的6-BA(表2),其他成分与处理方式不变。操作方法同“1.2.3”。
1.2.5.2 NAA浓度对银柴胡丛生芽继代培养的影响。以MS+琼脂7 g/L+蔗糖30 g/L为基础,分别向基本培养基中加入不同浓度的NAA(表2),其他成分与处理方式不变。操作方法同“1.2.3”。
1.2.5.3 蔗糖浓度对银柴胡丛生芽继代培养的影响。以MS+琼脂7 g/L为基础,分别向基本培养基中添加不同浓度的蔗糖(表2),其他成分与处理方式不变。操作方法同“1.2.3”。
1.2.6 Box-Benhnken响应面法试验设计。
在以上单因素试验结果的基础上,每因素选取较为优秀的浓度范围,以6-BA浓度、NAA浓度、蔗糖浓度为自变量,银柴胡继代快繁产生不定芽的生长评分为因变量,使用Design-expert 8.0.6软件,基于Box-Benhnken Design(BBD)原理,设计3因素3水平的响应面试验,运用数据分析拟合出的模型精准性,并由此推断出最优培养基的配方配比,最后实际试验印证。
1.3 数据处理与分析 以上试验继代20 d后统计结果并评分,数据使用Microsoft Office Excel 2020进行统计,利用Design-expert 8.0.6进行响应面数据的方差分析及作图。
2 结果与分析
2.1 各单因素最适范围的选择
2.1.1 6-BA浓度的选择。从表3可以看出,银柴胡不定芽的生长评分随着6-BA浓度增加而呈现先上升后下降的趋势。当6-BA浓度达到2.00 mg/L时,银柴胡不定芽的生长评分最高,总分为57.7,其增殖倍数达到最大值(3.67),而植株高度与叶片数也较为合适,叶片颜色为淡绿色,褐化率为33%,生长情况最好;在6-BA浓度小于2.00 mg/L时,表现为细胞分裂不够旺盛,不定芽出芽缓慢,增殖倍数低于3.67,植株高度偏低,叶片发黄,生长评分不高,达不到快繁的要求;在6-BA浓度大于2.00 mg/L时,则表现为细胞分裂素浓度过大,不定芽生长受到抑制,增殖倍数反而下降为2.82,褐化率上升为50%。所以将6-BA浓度2.00 mg/L设置为基础试验浓度,以1.5、2.0、2.5 mg/L 3个浓度梯度作为6-BA的响应面预设值。
2.1.2 NAA浓度的选择。
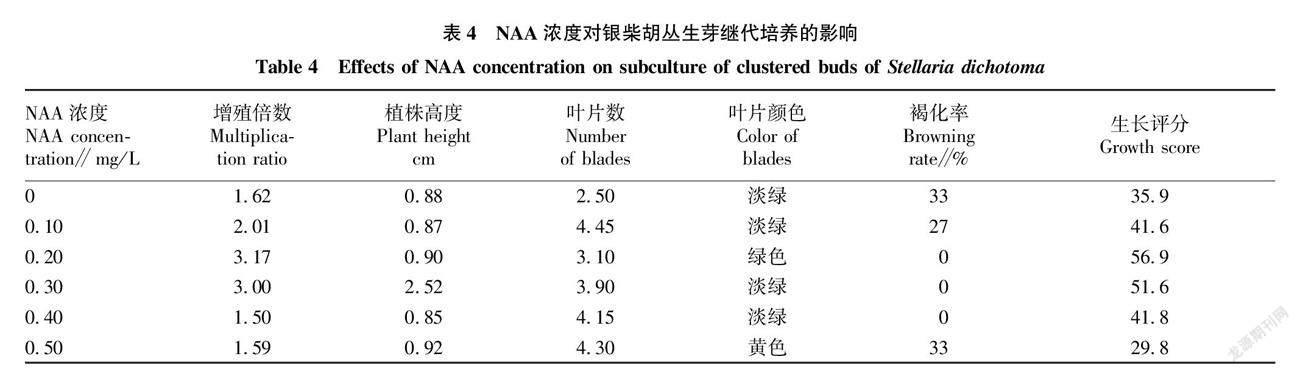
从表4可以看出,银柴胡不定芽的生长评分随着NAA浓度的增加也呈现出先上升后下降的趋势。当NAA浓度达到0.20 mg/L时,银柴胡不定芽的生长评分最高,总分为56.9,增殖倍数达到最大(3.17),植株高度较高、叶片数较多,叶片颜色为绿色,褐化率为0;在NAA浓度小于0.20 mg/L时,表现为植株生长缓慢,增殖倍数小于3.00,不定芽叶片较少、较弱,褐化率较高,生长评分低;当NAA浓度大于0.20 mg/L时,则表现为生长素浓度过大,不定芽生长受限,增殖倍数下降为3.00以下,植株高度与叶片数变化较小,叶片颜色也从绿色变为淡绿色。所以将NAA浓度0.20 mg/L设置为基础试验浓度,以0.10、0.20、0.30 mg/L 3个浓度梯度作为NAA的响应面预设值。
2.1.3 蔗糖浓度的选择。从表5可以看出,蔗糖作为培养基中的碳源,是不定芽生长的能量来源,其浓度也影响着银柴胡不定芽的生长评分。随着蔗糖浓度的增加,银柴胡不定芽的生长评分先上升再下降,最终趋于平缓。在蔗糖浓度达到10 g/L时,银柴胡不定芽的生长评分最高(47.7),增殖倍数较高(1.92),苗壮叶绿,无褐化;蔗糖浓度低于10 g/L时,银柴胡不定芽表现为生长迟缓,增殖倍数仅为1.20,叶少茎细,褐化率达到100%,低于快繁的基本要求;而蔗糖浓度高于10 g/L时,增殖倍数有所提升,最高为2.58,植株高度与叶片数也有提升,但表现为继代前期银柴胡不定芽生长迅速,中后期则出现黄叶褐化甚至死亡的现象。因此以蔗糖浓度10 g/L为基础试验浓度,将0、10、20 g/L 3个浓度梯度作为蔗糖的响应面预设值。
2.2 响应面试验设计结果及可行性分析
根据Box-Benhnken Design(BBD)原理将6-BA浓度(A)、NAA浓度(B)、蔗糖浓度(C)设置为响应因子,使用Design-expert 8.0.6设计3因素3水平试验,试验组合及实际响应值见表6。
对表6中数据进行分析可以得出银柴胡继代快繁培养基中6-BA浓度(A)、NAA浓度(B)、蔗糖浓度(C)与其不定芽生长评分值(Y)的回归方程:Y=-14.54+70.29A+75.27B+2.18C+11.68AB+0.49AC+3.04BC-20.57A2-283.28B2-0.11C2,并对此回归方程进行方差分析及显著性检验,结果如表7所示。
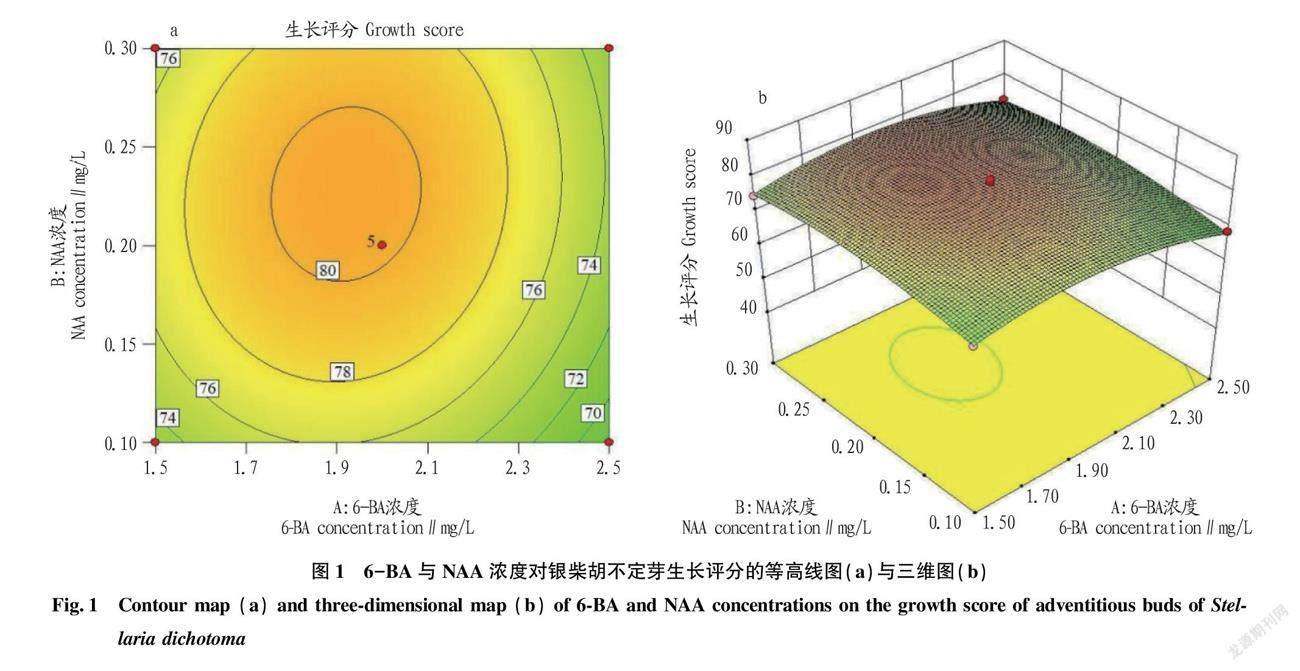
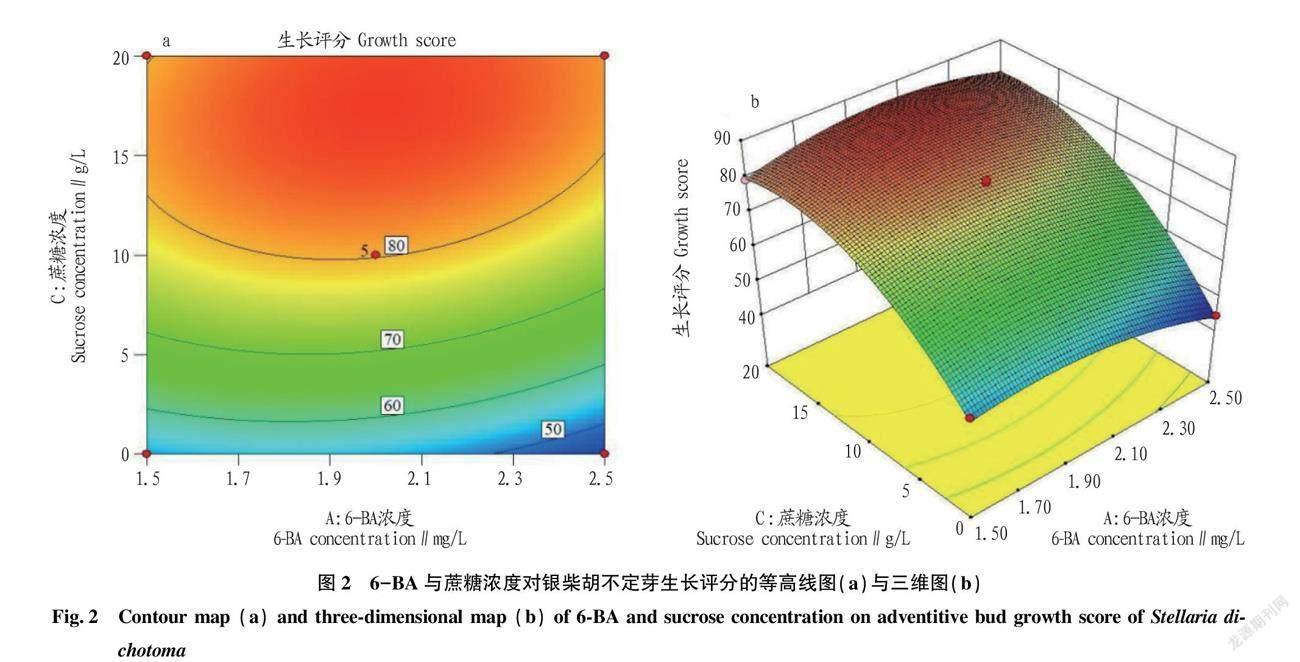
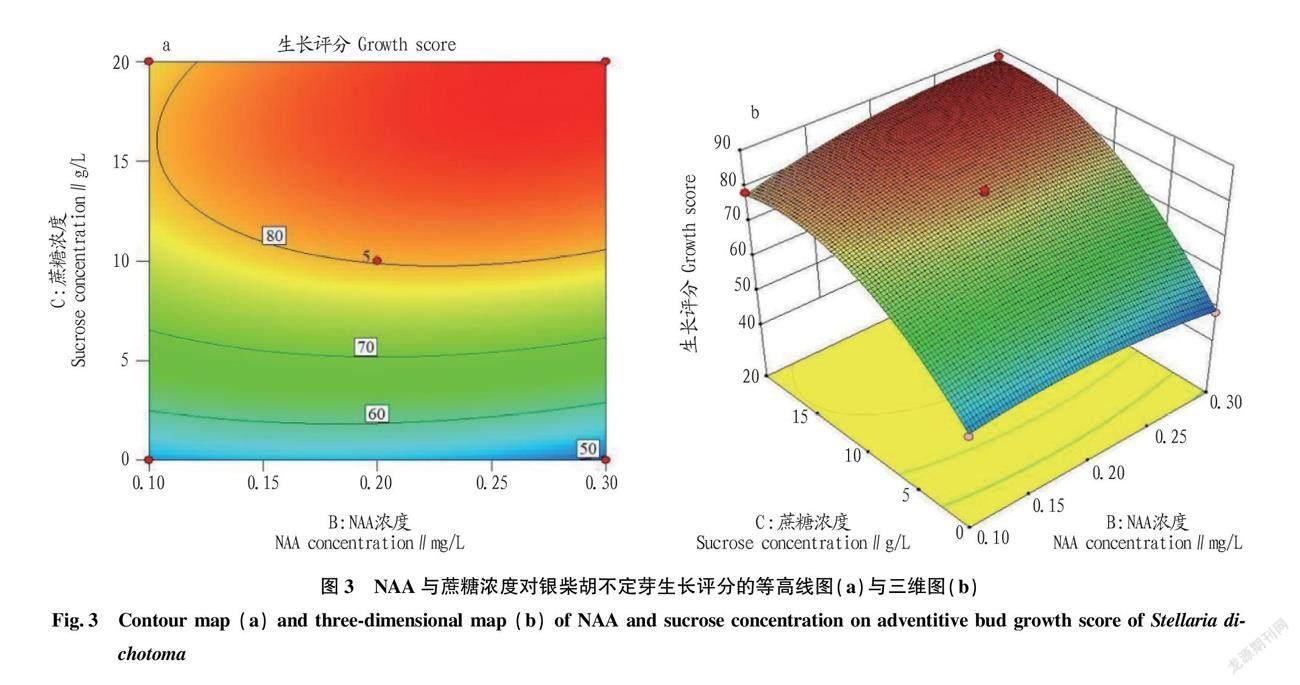
根据表7中的数据可知,模型项的P值小于0.01,说明评分值(Y)与6-BA浓度(A)、NAA浓度(B)、蔗糖浓度(C)回归方程的关系是极显著的,试验设计合理;失拟项平方和(SS=5.36)较小,对应的P值大于0.05,说明所得回归方程与实际拟合中非正常误差所占比例较小;回归方程模型判定系数R2=0.997 0,说明其拟合程度较好,使用该回归方程来预测银柴胡继代不定芽的生长评分的可行性高;校正系数R2Adj=0.993 2,说明该模型方程中变异度仅为0.006 8,而99.32%的数据可用此方程解释,方程可靠性高;各影响因子中6-BA浓度(A)、NAA浓度(B)、蔗糖浓度(C)的P值均小于0.01,说明其对银柴胡不定芽的生长影响均极显著,AB的P值大于0.05,AC、BC的P值均小于0.01,说明AB的交互效应不显著,而AC、BC之间的交互效应极显著;F值各项中FC>FA>FB,说明试验中蔗糖浓度(C)对银柴胡不定芽的生长评分影响最大,6-BA浓度(A)次之,NAA浓度(B)最小。
2.3 响应面图形分析与最佳培养基配方的优化
由于银柴胡不定芽生长评分(Y)与6-BA浓度(A)、NAA浓度(B)、蔗糖浓度(C)回归方程模型可靠性与拟合性较高,具有统计学意义,所以将其制成响应面(RSM)图形,以便于更直观地反映出银柴胡不定芽的生长情况与6-BA浓度、NAA浓度、蔗糖浓度3个因素之间的关系,并由此预测最佳培养基配方。如图1~3所示,三维图中蔗糖浓度(C)的曲线面最陡、6-BA浓度(A)较陡、NAA浓度(B)趋于平缓,表明蔗糖浓度对银柴胡不定芽的生长情况影响最大,6-BA浓度次之,NAA浓度最小;等高线图中的等高线形状表现了两因素之间的交互效应强弱,趋于椭圆则强,趋于圆形则弱[15],图中AB交互趋近于圆形,而AC、BC则趋近于椭圆形,故AB的交互效应弱而AC、BC之间的交互效应强,这也与“2.2”中的方差分析相符。各三维图均为山丘型曲面,存在极点对应的最大值,使用软件分析得出其评分最大值(87.552 4)时的6-BA浓度、NAA浓度、蔗糖浓度分别为2.04 mg/L、0.27 mg/L、18.54 g/L,因此当培养基为MS+6-BA 2.04 mg/L+ NAA 0.27 mg/L+蔗糖18.54 g/L时,银柴胡不定芽生长评分达到最大值(87.552 4)。
2.4 最佳培养基配方的验证
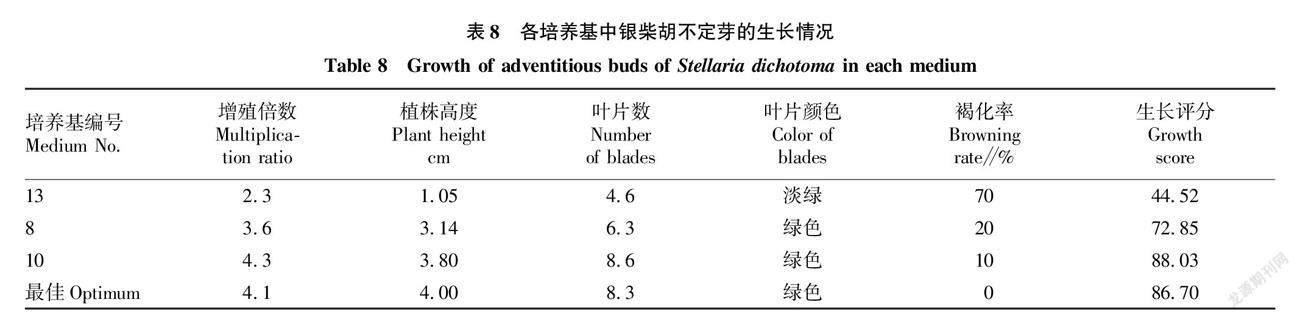
为对预测配方进行验证使其更具实际可行性,用“2.3”中得到的最佳培养基配方(MS+6-BA 2.04 mg/L+ NAA 0.27 mg/L+蔗糖18.54 g/L)进行银柴胡继代快繁验证,操作方式严格按照“1.2.1~1.2.4”方法开展,共接种24瓶,每瓶2苗。20 d后統计其生长评分,该培养基中银柴胡不定芽的实际生长情况如图4D所示,具体数据见表8。
从表8可以看出,最佳培养基配方相较于该试验中实际评分较低的13号(MS+6-BA 2.50 mg/L+ NAA 0.20 mg/L)培养基(图4A),不定芽平均增殖倍数增加78.26%,植株高度提升2.95 cm,叶片数增加3.7片,褐化率降低70百分点,植株颜色绿色;对比实际评分中等的8号(MS+ 6-BA 1.50 mg/L+NAA 0.10 mg/L+蔗糖10 g/L)培养基(图4B),不定芽平均增殖倍数增加13.89%,植株高度提升0.86 cm,叶片数增加2.0片,褐化率降低20百分点,实际快繁效果提升明显;实际评分虽然比评分最高的10号(MS+ 6-BA 2.00 mg/L+ NAA 0.30 mg/L+蔗糖20 g/L)培养基(图4C)低1.51%,但株高高,褐化率低,且最佳培养基的实际生长评分(86.70)与预测值(87.552 4)的误差值只有0.974%,证明该配方较为真实准确,具有实际可行性。
3 结论与讨论
该研究利用单因素试验确定了银柴胡继代快繁培养基中6-BA、NAA、蔗糖的最适浓度范围,而后基于Box-Benhnken Design(BBD)原理,设计3因素3水平的响应面试验,最后优化得出最佳配方为MS+ 6-BA 2.04 mg/L+ NAA 0.27 mg/L+蔗糖18.54 g/L。经过实际验证得出该配方可以使银柴胡继代不定芽的生长评分达到86.70,故该培养基可作为银柴胡继代快繁的继代培养基,规模化生产银柴胡种苗,初步解决了银柴胡种苗繁殖周期长、受外界环境影响大等问题。
该研究中得出的最佳配方与姚宁等[8]研究结果中关于不定芽诱导培养基激素最适水平部分有相似之处,2个试验结果均表明,高浓度的细胞分裂素(6-BA)、低浓度的生长素(NAA)有利于不定芽的诱导与生长;但该试验最佳培养基使用蔗糖为18.54 g/L,姚宁等[8]研究中各部位诱导的最佳培养基均为蔗糖30 g/L,有可能是因为银柴胡属于耐贫瘠植物,培养基中18.54 g/L的蔗糖浓度已经满足其营养需求,再添加过量的蔗糖对其生长意义不大。而对于该研究中关于银柴胡继代快繁培养环境及继代周期的部分仍待完善,下一步应探究其继代快繁最适培养环境及继代周期,为银柴胡产业可持续、高质量、规模化的发展打下良好基础。
参考文献
[1] 国家药典委员会.中华人民共和国药典:2020年版 一部[S].北京:中国医药科技出版社,2020:330-331.
[2] 李振凯,宋乐,雷燕,等.银柴胡生物学、化学成分及药理作用研究进展[J].南京中医药大学学报,2020,36(1):136-140.
[3] 马伟宝,谢彩香,陈君,等.基于野生银柴胡的产地适宜性分析[J].中国现代中药,2017,19(5):684-687.
[4] 王秀芬,由会玲.银柴胡的药理作用与临床应用研究[J].河北中医药学报,2012,27(3):43-44.
[5] 李明,安钰,左忠,等.宁夏中药材栽培现状及对策分析[J].宁夏农林科技,2016,57(3):42-46.
[6] 杨小军,丁永辉.银柴胡资源及其可持续利用的研究[J].中药材,2004,27(1):7-8.
[7] 马玲芳.不同种源银柴胡质量综合评价研究[D].银川:宁夏大学,2020.
[8] 姚宁,马晓蓉,高建中,等.银柴胡组织培养与植株再生体系的建立[J/OL].分子植物育种,2021-09-22[2022-04-04].https://kns.cnki.net/kcms/detail/46.1068.S.20210920.0014.002.html.
[9] 吳晓玲,邓光存,邱智杰.银柴胡愈伤组织诱导技术的研究[J].宁夏大学学报(自然科学版),2005,26(3):271-273.
[10] 胡海英,吴晓玲.银柴胡离体培养与毛状根诱导技术初步研究[J].生物技术进展,2015,5(6):436-440,481.
[11] 吴晓玲,谢亚军,巫鹏举,等.植物生长调节剂对银柴胡细胞生长特性的影响[J].植物研究,2005,25(2):173-176.
[12] 吴晓玲,邓光存.磷酸盐含量对银柴胡细胞培养生长与生理特性的影响[J].江苏农业科学,2008,36(6):66-68.
[13] 杨利平,陈乃明,王鹏良,等.铁线莲Inspiration组培继代培养基的筛选与优化[J].江苏农业科学,2020,48(14):83-86.
[14] 代磊,杨振,简在友,等.丹江口淫羊藿组织培养继代培养基优化[J].北方园艺,2020(8):108-115.
[15] 吴琪,张宇慧,苏荣荣,等.响应面法优化巴西蘑菇液体培养基的研究[J].中国农业科技导报,2019,21(3):152-160.
