由中国主持的抗结核药物临床试验现况分析
2023-05-12高静韬孙玙贤舒薇张立杰谢仕恒刘宇红
高静韬 孙玙贤 舒薇 张立杰 谢仕恒 刘宇红
1 首都医科大学附属北京胸科医院,北京 101149;2 北京市结核病胸部肿瘤研究所,北京 101149
2000 年, 美国国立卫生研究院建立和运营ClinicalTrials.gov 平台[1],2005 年中国临床试验注册中心(Chinese Clinical Trial Register, ChiCTR)建立并运行[2],两大平台均为国际认可的临床试验注册平台。本文收集两大平台中国主持的已注册的抗结核药物临床试验,旨在洞悉我国抗结核药物临床试验进展及发展方向,剖析存在的问题并给出完善建议。
资料与方法
一、纳入与排除标准
纳入标准:(1)中国(包括中国大陆、中国香港、中国澳门和中国台湾)机构作为牵头单位或中国机构资助的、中国研究者负责、在中国人群中开展的临床试验;(2) 研究内容包含抗结核药物治疗;(3)研究对象包含肺结核、肺外结核、肺结核合并其他疾病患者。
排除标准:(1)诊断试剂临床试验;(2)医疗器械临床试验;(3)疫苗临床试验。
二、数据采集
分别以ClinicalTrials.gov 和ChiCTR 为检索对象, 检索起止时间为数据库建库之日至2022 年6月30 日。 以ChiCTR 为检索对象,在检索入口界面注册题目中检索包含 “结核” 的所有注册试验;以ClinicalTrial.gov 为 检 索 对 象, 在 “Condition or Disease” 中 检 索 包 含 “Tuberculosis” 或 “TB”且“Country”中检索包含“China” 的所有临床试验。 根据经济发展水平及地理位置划分东中西三个地区。
三、质量控制
2 名研究人员独立从ClinicalTrials.gov 和ChiCTR 平台检索数据后合并比对,如有不一致进入这两个平台共同检索。 2 名研究人员独立依据纳排标准进行符合条件的临床试验项目的筛选、数据采集后合并比对,如有意见分歧,则由研究团队负责人加入共同充分讨论后决定。 若同一项目分别在ClinicalTrials.gov 和ChiCTR 平台注册则视为2 个项目均纳入本研究。
结 果
一、注册总体情况
从ClinicalTrials.gov 和ChiCTR 平台中分别检索到结核相关的临床试验81 项和208 项, 依照纳排标准最终纳入共计89 项, 其中来源于ClinicalTrials.gov 平台30 项, 来源于ChiCTR 平台59 项, 无同一项目分别在ClinicalTrials.gov 和ChiCTR 平台注册。中国主持的抗结核药物临床试验首次在ClinicalTrials.gov 注册时间为2006 年(建库后6 年),由广西医科大学牵头开展,其研究内容为糖皮质激素辅助抗结核药物治疗对结核性胸膜炎的疗效与安全性。 中国主持的抗结核药物首次在ChiCTR 注册时间为2009 年(建库后4 年),由武汉协和医院(现为华中科技大学同济医学院附属协和医院)牵头开展,研究内容为多中心、随机、双盲、安慰剂平行对照的临床研究以评估糖皮质激素对结核性胸膜炎的临床疗效。
二、注册时间和地区分布情况
1. 注册时间分布
自ClinicalTrials.gov 和ChiCTR 平台首次注册以来至2022 年6 月30 日,两个平台注册数量及总注册数量均呈波动式上升(见图1)。 2012 年之前注册总量较低, 平均年注册量不足1 项;2012—2017年注册总量平缓上升, 平均年注册量提高至3 项;2018 年起注册总量激增, 平均年注册量保持在12项左右,2018—2022 年共计62 项(69.66%,62/89)。在ClinicalTrials.gov 平台注册数高峰值出现在2019年, 注册数量达6 项在ChiCTR 平台注册数高峰值出现在2020 年,注册数量达13项。
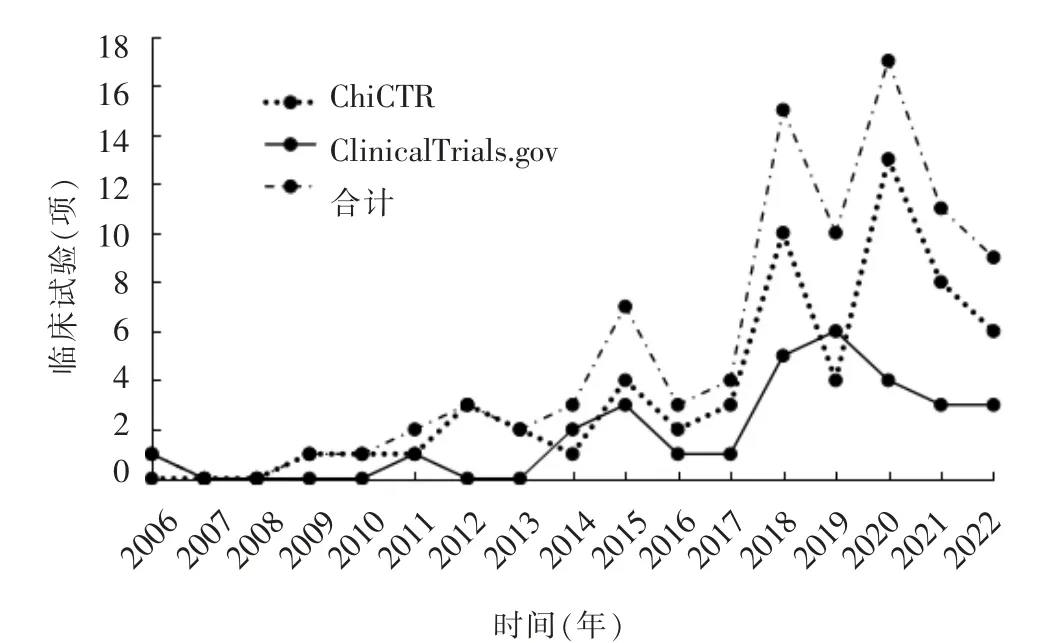
图1 中国主持的抗结核药物临床试验注册情况时间分布
2.注册地区分布
表1 可见,在89 项临床试验研究中,注册单位所在地区共覆盖14 个省、自治区、直辖市,其中北京、 上海、 广东三个地区注册总数达67 项, 占比75.28%;尤其在ClinicalTrials.gov 平台,上述三个地区注册总数为28 项, 占总注册数的93.33%(28/30)。 总体而言,东部地区(包含北京、上海、广东、江苏、山东和浙江)占比最高为86.52%(77/89),其次是西部地区(包含重庆、陕西、四川、新疆和广西)11.24%(10/89),中部地区(包含河南、湖北和江西)占比最低,为2.25%(2/89)。东部地区注册总数为中部和西部地区注册总和的6 倍之多。 东部地区在ChiCTR 平台注册的由中国主持的抗结核药物临床试验是其在ClinicalTrials.gov 平台注册数量的1.66倍,这一比值在西部地区高达9 倍,中部地区无中国主持的抗结核药物临床试验在ClinicalTrials.gov平台注册。

表1 中国主持的抗结核药物临床试验注册地区分布
3.注册机构分布
89 项研究中,由结核病定点医疗机构、由综合医疗机构、由其他机构(包括药企和大学)注册的数量分别为54 项(60.67%,54/89)、27 项(30.34%,27/89)、8 项(8.99%,8/89),其中ChiCTR 平台注册的分别为38、15 和6 项,ClinicalTrials.gov 平台注册的分别为16、12 和2 项。
三、研究类型、研究内容和注册状态
89 项研究中,观察性研究7 项,干预性研究82项(见表2)。按治疗方法划分,评估单一或抗结核药物组合的临床试验57 项(64.04%,57/89),其中针对潜伏感染者的预防性治疗研究3 项;在抗结核药物基础上增加抗炎、抗过敏、化痰等西药对症治疗的研究合计15 项, 且其中14 项研究在ChiCTR 平台注册; 在抗结核药物基础上增加包括生物制剂、免疫细胞治疗等宿主导向的免疫治疗研究合计7 项;在抗结核药物基础上增加中医辩证施治或中药治疗的研究合计10 项, 其中9 项在ChiCTR 平台注册。 按病变部位划分,针对肺结核注册的临床试验合计83 项(93.26%,83/89),其中针对结核性胸膜炎7 项, 针对肺结核合并其他疾病如糖尿病、HIV、矽肺、风湿免疫性疾病、恶性实体肿瘤的临床试验共计10 项;另外6 项为肺外结核研究,分别为针对结核性脑膜炎3 项、 骨结核2 项和淋巴结结核1 项。按研究覆盖面划分, 全国多中心临床试验共计48项,单中心临床试验共计41 项。

表2 ChiCTR 和ClinicalTrials.gov 平台注册由中国主持的抗结核药物临床试验的不同特征[项(%)]
89 项研究根据研究状态可分为5 类,处于尚未纳入、纳入中、纳入完成并继续实施、研究完成和状态未知的项目分别为30 项、26 项、2 项、22 项和9项。 在尚未开始的30 项研究中,18 项为新近注册(≤2 年)研究,其余12 项为注册后3~10 年仍未开始纳入,其中10 项来源于ChiCTR 平台;处于纳入中的26 项研究中,15 项为新近注册研究,7 项为注册后3~10 年仍处于纳入状态; 共2 项研究处于纳入完成并继续实施状态,均来自ClinicalTrials.gov 平台,且在注册2 年内完成了患者纳入;在已完成的22 项研究中,注册至今5 年及以下与注册至今已6年及以上的研究个数比为1∶1; 状态未知的9 项研究均来自ClinicalTrials.gov 平台。注册至今无研究团队报告研究出现研究暂停或中断。
讨 论
公开临床试验信息既增加了对研究的监督力度,还可保证相关利益群体了解自身健康信息的权力,提高对临床研究的信任;同时,公开临床试验及其结果有助于减少不必要的重复研究。 因此,临床试验注册具有伦理和科学意义[3]。 ClinicalTrials.gov与ChiCTR 自建库以来至2022 年6 月30 日, 中国主持的已注册的抗结核药物临床试验共89 项,2018—2022 年注册数量占69.66%(62/89)。 主要原因有二:首先,就药物研发管线而言,历时50 余年在2012 年全球迎来首个抗结核新药贝达喹啉,之后2014 年和2019 年德拉马尼与普托玛尼陆续在国外获批有条件上市,2018 年和2020 年贝达喹啉及德拉马尼分别在我国通过临床试验路径实现了受试者可及[4-5],这一时期迎来了抗结核药物临床试验的春天[6-12];其次,2018—2022 年,我国自主研发的1.1 类抗结核新药吡法齐明 (TBI-166)、 舒达吡啶(WX081) 和OTB-658 先后启动并推进临床试验进程,亦推动了中国主持的抗结核药物临床试验注册高峰。
一、中国主持的注册抗结核药物临床试验地区分布和发起单位属性存在差异
本研究发现,中国主持的注册抗结核药物临床试验呈现东高、中低、西居中的局面,其中东部地区注册量占86.52%(77/89), 西部地区较中部地区注册数量多,考虑与其区域内医学高校及其附属医院在结核学科实力较强有关。 有研究显示,临床试验注册量与经济发展水平、学科科技量值排名及药物临床试验质量管理规范(good clinical practice,GCP)发展活跃度密切相关[13]。 抗结核药物临床试验注册分布极不均衡现象还需要从学科建设、 人员培养、能力提升多个维度进行顶层布局,有望缩短地区间的差异。
从注册抗结核药物临床试验发起单位属性来看,由结核病定点医疗机构发起或主持的临床试验占比最大,为60.67%(54/89)。 注册项目数超过5 个的定点医疗机构按照从高到低排序为首都医科大学附属北京胸科医院、上海市肺科医院、上海市公共卫生临床中心和深圳市第三人民医院,该排序同医院近年结核病学科的学科科技量值排名基本一致。 由综合医疗机构注册的抗结核药物临床试验共27 项,复旦大学附属华山医院及上海中医药大学附属龙华医院注册总数达13 项。 我国历来重视结核病防治工作,近年来先后出台《“健康中国2030”规划纲要》[14]《健康中国行动(2019—2030 年)》[15]和《遏制结核病行动计划(2019—2022 年)》[16]等文件,明确提出加强结核病防治服务体系能力建设、加强多部门联合、全社会动员等顶层设计。 结核病定点医疗机构、综合医疗机构作为结核病防治服务体系实施的重要组成部分, 承担着积极开展科学研究、促进科技创新,加快科技成果转化的职责,共同向早日实现“终止结核病流行”的目标努力。
二、中国主持的抗结核药物临床试验以干预性研究居多
从研究类型来看,中国主持的抗结核药物临床试验中干预性研究占90%以上;覆盖范围上,多中心研究和单中心研究数量相当。 近年,随着全球对抗结核药物临床试验设计的迭代和进步[17],临床试验实施效率与质量的提升,WHO 《结核病整合版指南》推荐周期的缩短[18-19],我国开展创新性、多中心、随机对照临床试验并获得高质量证据是研究成果能被快速临床转化和应用的关键因素。 从研究聚焦的病变部位来看,93.26%(83/89) 以肺结核为主,治疗干预上64.04%(57/89)为探索不同抗结核药物及其组合或疗程的临床试验,其次为抗结核药物联合对症治疗药物的临床试验(15 项),对症治疗药物主要包括乙酰半胱氨酸、糖皮质激素、维生素D 和布洛芬等。 研究干预措施反映了当前中国主持的抗结核药物临床试验研究方向和热点。
三、我国主持的抗结核药物临床试验在注册后更新较慢
本研究显示,89 项研究中已完成的研究22 项,处于纳入中的研究26 项, 尚未开始患者纳入的研究30 项。 临床试验需在首个受试者纳入前向公开开放的注册机构注册,我国主持的抗结核药物临床试验在注册后存在更新较慢的问题,研究是否持续的真实状态从注册平台无法获知,相应研究药物及方案的有效性和安全性结局、结果陈述部分均存在缺失。 注册已5 年以上仍未开始患者纳入或仍处于患者纳入或状态未知的研究合计11 项, 主要集中在2014—2016 年由北京、 上海的结核病定点医疗机构或综合医疗机构牵头开展的初治、复治及耐药患者缩短疗程的研究,经了解,与研究者未及时在ClinicalTrials.gov 和ChiCTR 平台更新注册信息有关。 值得关注的是,由于研究运营及管理存在困难及目标患者有限等原因,50 项研究在注册后5 年内尚未开展患者纳入或处于纳入中,因此,加强对注册临床研究的管理,追踪临床试验进程,透明化临床试验的结果并建立有效激励机制推动注册者、注册机构不断提高试验全周期注册完整性和注册质量才能回归临床试验注册的宗旨。 随着中国抗结核药物临床试验不断增加,亟需提升研究机构及研究者的注册观念, 注重对注册规范与相关培训开展,加大临床试验注册全周期结果的分享与公布,这是未来该领域临床试验注册宣传的关键。
本研究通过横断面分析中国主持的注册抗结核药物临床试验时空分布、研究类型、治疗措施、疾病分类、研究覆盖和实施状态,洞悉了我国抗结核药物临床研究发展方向,剖析了已注册的抗结核药物临床研究存在的问题并给出完善建议。 临床试验注册向着全球化、规范化、共享化发展,作为研究者,应学习临床试验注册知识、提高注册意识与注册质量,保证研究质量,为广大医务工作者、医疗卫生服务消费者和政府卫生政策制定者提供可靠的临床试验证据,从而造福中国及全球健康事业[20]。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明高静韬、孙玙贤:数据整理、统计分析、论文撰写;舒薇:统计分析;张立杰、谢仕恒:数据收集;刘宇红:研究指导
