NPM1促进骨肉瘤细胞迁移、增殖、侵袭的体外研究
2023-05-08刘丰平皮闻森肖运祥赵红卫
刘丰平,皮闻森,肖运祥,赵红卫
三峡大学第一临床医学院脊柱外科,湖北 宜昌 443000
骨肉瘤(osteosarcoma,OS)是最常见的骨与软组织原发性恶性肿瘤,多发生于儿童和青少年。目前,手术治疗、放疗和大剂量化疗是骨肉瘤的主要治疗方法。虽然近年来新辅助化疗药物使得患者生存率有所提高,但是几十年来五年生存率未见提仍未超过60%。其中,OS 患者的死亡原因主要是肺部转移,一旦发生5年生存率低于20%[1]。因此,为了提高患者生存率,更需进一步阐明OS 转移的分子机制,明确OS转移防治的有效的策略及靶点。当前诸多研究已经证实NPM1与肿瘤发生、发展及转移密切相关,是一种在多种恶性肿瘤中高表达的癌基因。本研究采用人源骨肉瘤细胞系(143B、U2-OS 细胞株),探讨沉默和过表达NPM1 对骨肉瘤细胞恶性表型迁移、增殖和侵袭能力的影响。
1 材料与方法
1.1 材料 人源骨肉瘤细胞系143B和人源骨肉瘤细胞系U2-OS 细胞株购自中国科学院细胞库(上海),NPM1 过表达、沉默及阴性对照慢病毒均购于上海吉凯基因。侵袭试验小室购于北京萌状科技公司。凝胶制备试剂盒(AR018)购于Boster 公司。DMEM 培养液、胎牛血清购于美国Gibco 公司。蛋白提取试剂盒(BB-3101)购于BestBio公司。NPM1单克隆抗体(兔抗人)购于美国ABcam公司(美国)。HRP标记山羊抗鼠多克隆抗体、β-actin 单克隆抗体(鼠抗人)和HRP 标记山羊抗兔多克隆抗体均购于中杉金桥公司(北京)。
1.2 实验方法
1.2.1 生物信息学预测 于Oncomine 数据库进行检索,设置类别为骨肉瘤,得到NPM1在骨肉瘤中的表达水平情况(https://www.oncomine.com/resource/login.html)。
1.2.2 细胞培养和慢病毒转染 转染细胞分为Lv/NPM1 组、Lv/ShNPM1 组、NC(Lv/negative)组。试验参照转染手册(吉凯公司),将各组别载体慢病毒颗粒分别转染人源骨肉瘤细胞系143B 和人源骨肉瘤细胞系U2-OS细胞株。
1.2.3 Western blot 实验检测蛋白表达 转染细胞72 h后消化、收集上述各组细胞,提取细胞蛋白,经BCA 蛋白定量法测定蛋白含量。SDS-PAGE 分离蛋白,于冰上湿转,依照Western blotting 实验手册操作,其中抗兔NPM1 单克隆抗体比例为1∶2 000;抗鼠β-actin 抗体比例为1∶2 000;辣根过氧化物酶标记的山羊抗小鼠及山羊抗兔IgG 比例为1∶5 000。洗膜后,加入ECL显色液,暗室内曝光。
1.2.4 CCK-8法检测细胞增殖能力 将转染72 h
后的U2-OS和143B细胞(3 000/孔)用于试验操作,96孔培养板培养,时间为0 h、24 h 和48 h。依照CCK-8 法操作手册,每份实验平行做6次。
1.2.5 Wound healing 法检测细胞迁移能力 转染72 h后各组细胞,用于试验操作,胰蛋白酶消化后接种于6孔培养板内(细胞密度为5×105/mL,500 μL/孔,每种细胞5孔)。依照Wound healing法操作手册,每份实验平行做6次。试验结果采用Image J 1.47H软件分析。
1.2.6 Transwell invasion法检测细胞侵袭能力 转染72 h 后,胰蛋白酶消化各组细胞,用无血清培养基重悬,接种于Transwell 侵袭小室内(细胞密度为1×105个/mL,150 μL/室),依照Transwell invasion 法操作手册进行操作。试验结果采用Image J 1.47H 软件分析
1.3 统计学方法 应用SPSS13.0 统计软件分析数据,统计作图软件为Raphpad6.0,计量数据以均数±标准差(±s)表示,两组比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 生物信息学结果 于Oncomine 数据库进行检索显示,NPM1在骨肉瘤中呈高表达,见图1。
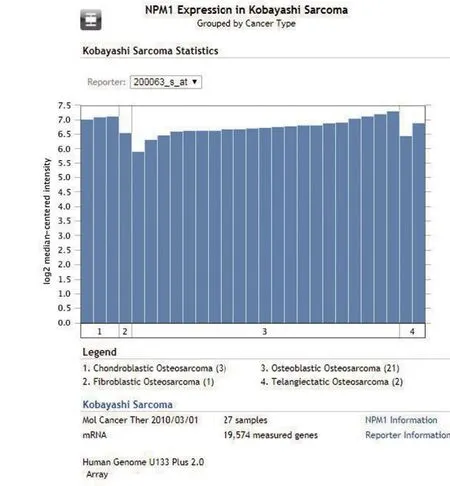
图1 生物信息学分析结果Figure 1 Results of bioinformatics analysis
2.2 NPM1 转染效率的验证 Western blot 实验检测Lv/ShNPM1 组、NC 组和Lv/NPM1 组中NPM1 蛋白表达情况。结果显示:与NC组比较,Lv/ShNPM1组NPM1 蛋白水平明显降低,Lv/NPM1 组NPM1 蛋白水平增高,差异均有统计学意义(P<0.05),见图2。
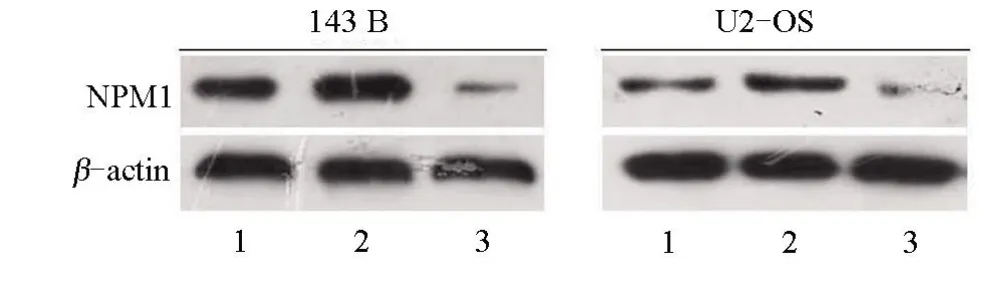
图2 Western blot检测NPM1蛋白的表达Figure 2 Detection of NPM1 protein expression by Western blot
2.3 NPM1增强骨肉瘤细胞的迁移能力 U2-OS细胞中NC组、Lv/NPM1组和Lv/ShNPM1组细胞迁移率分别为(49.7±3.3)%、(64.1±7.4)%、(24.3±6.6)%,143B细胞分别为(63.5±4.3)%、(75±3.7)%、(30.1±5.9)%。两种细胞Lv/ShNPM1 组迁移率明显低于NC 组,差异均有统计学意义(P<0.05),见图3。
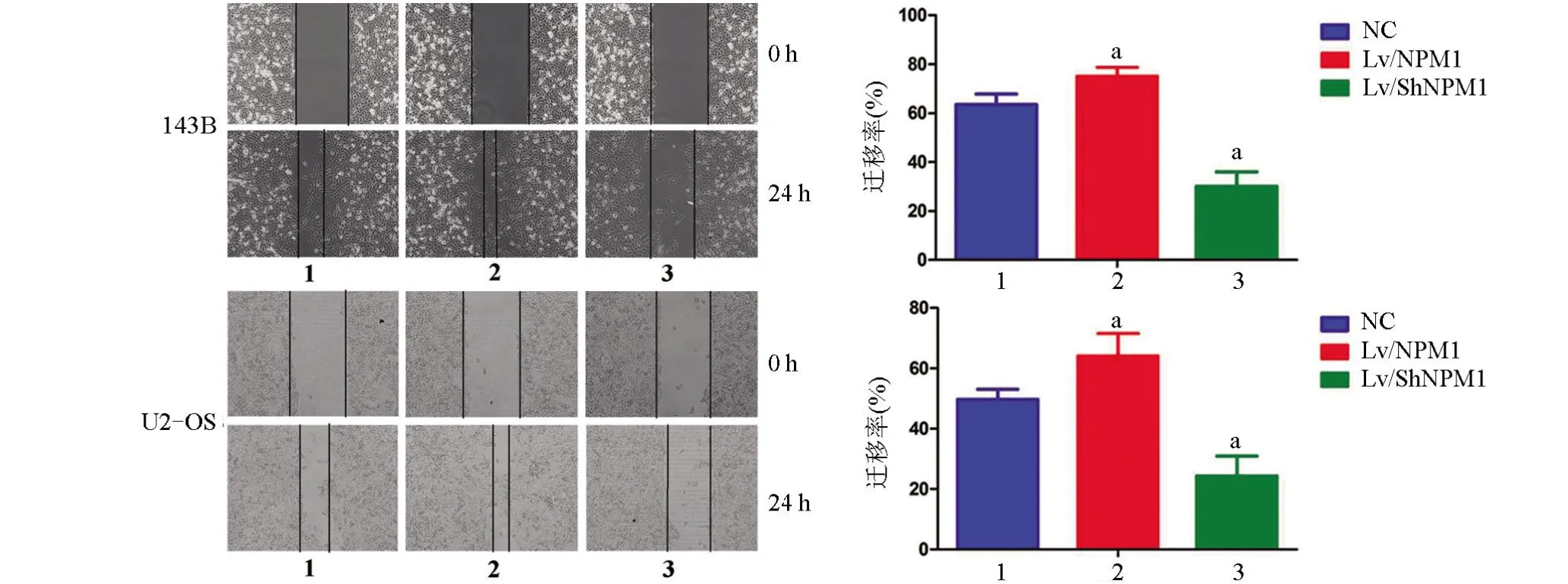
图3 Wound healing 实验检测骨肉瘤细胞的迁徙能力(×200)Figure 3 The migratory ability of osteosarcoma cells was detected by the Wound healing assay(×200)
2.4 NPM1增强骨肉瘤细胞的侵袭能力 U2-OS细胞中NC 组、Lv/NPM1 组、Lv/ShNPM1 组侵袭细胞数分别为98±26.3、164±41、38±14.6,143B细胞分别为104±19.1、191±32.4、41±27.6。两种细胞Lv/ShNPM1组侵袭细胞数明显少于NC组,差异有统计学意义(P<0.05),见图4。

图4 Transwell invasion实验检测U2-OS细胞和143B细胞的侵袭能力(×200)Figure 4 The invasion ability of U2-OS cells and 143B cells was detected by Transwell invasion assay(×200)
2.5 NPM1 增强骨肉瘤细胞的增殖能力 CCK8法检测各组细胞的增殖能力,结果显示143B 和U2-OS 细胞Lv/ShNPM1 组增殖能力明显低于NC组,差异有统计学意义(P<0.05),见图5。
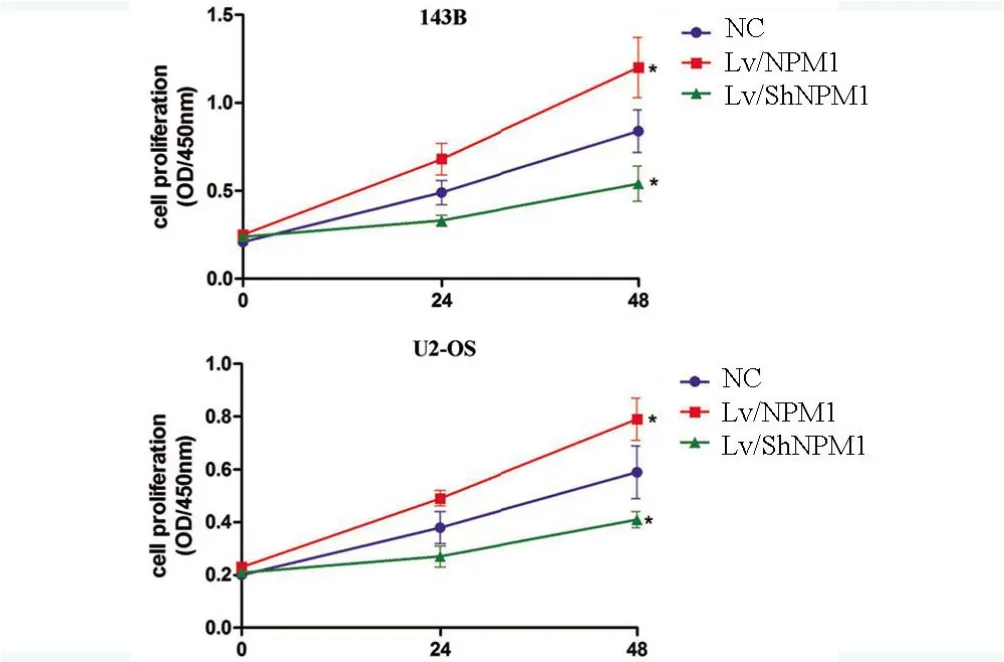
图5 CCK8实验检测U2-OS细胞和143B细胞的增殖能力Figure 5 The proliferation ability of U2-OS cells and 143B cells was detected by CCK8 assay
3 讨论
NPM1(nucleophosmin 1)是一种由294个氨基酸组成的具有高活性的核仁蛋白。其具有多种分子生物学功能,包括核糖体蛋白组装,染色质重塑等[2]。经过磷酸化、乙酰化和泛素化等多种翻译后修饰,NPM1 在细胞核和细胞质之间不断穿梭,所处于的亚细胞区域不同,导致行使的功能也不一样[3]。也有一些研究表明,NPM1 在细胞生长、增殖和转化中起着至关重要的作用,可以调节细胞周期进程和中心体复制[4]。
大量研究已经证实在人血液系统恶性肿瘤中检测到突变的NPM1,特别是急性髓性白血病(AML)。NPM1 可能是AML 的良好预后标志物,甚至是血液系统恶性肿瘤的潜在治疗靶点[5-6]。与AML相反,NPM1的突变在实体瘤中很少被检测到。但是,越来越多的证据表明,NPM1的在多种实体瘤中表达增高与预后不良有关,包括膀胱尿路上皮癌[7]、胃癌[8]。另外,最新的一项纳入了11项研究和997例患者的荟萃分析也表明NPM1的过表达是大多数实体肿瘤预后不良的潜在独立预测因子,包括尤文氏肉瘤、肝细胞癌、胃癌、卵巢浆液性癌、结直肠癌等[9]。Loubeau等[10]报道了沉默NPM1能抑制前列腺癌细胞的生长和MAPK信号的传到。最新的研究报道了NPM1可能是前列腺癌免疫诊断和预后的潜在生物标志物,从而弥补PSA缺乏特异性的缺点[11]。Liu等[12]证实运用siRNA下调NPM1后能够抑制结直肠癌细胞的恶性表型。本研究中通过生物信息学预测显示NPM1在骨肉瘤中高表达。以此推测NPM1在人骨肉瘤侵袭转移中同样扮演着重要角色。为此,进一步通过体外实验发现沉默NPM1降低了骨肉瘤细胞的侵袭、增殖和迁移能力,而过表达NPM1增强了骨肉瘤细胞的侵袭、增殖和迁移能力。但是NPM1在骨肉瘤中发挥作用的内在分子机制仍然不清楚。
NPM1能够调节一些重要的肿瘤抑制因子,如p53和ARF 的活性和稳定性[13],还可以通过与转录因子NF-κB 和c-Myc 相互作用,从而参与转录激活[14-15]。Boudra等[16]报道了mTOR密切参与NPM1基因表达的转录和转录后调节,从而引起NPM1 的高表达。另外一项研究证实RNAi沉默NPM1 基因能下调前列腺癌细胞中ERK1/2 的磷酸化水平[17]。ERK 的磷酸化能够促使NF-κβ从包浆转移至核内[18],从而促使MMP-2、MMP-9 等与肿瘤转移相关的基因表达上调,促进诸多肿瘤转移,其中包括骨肉瘤[19-20]。Shandilya等[21]报道了Aurora-B通过磷酸化NPM1发挥其调节有丝分裂的作用。研究已经证实下调Aurora-B通过NF-κβ信号通路抑制骨肉瘤恶性表型[22]。总之NPM1在骨肉瘤中发挥作用的内在分子机制仍有需更深入的探索研究。
综上所述,本研究证实了NPM1能够在体外促进骨肉瘤细胞的恶性表型。为今后进一步研究NPM1参与骨肉瘤的发生、远处转移及可能机制打下前期基础。
