川芎嗪缓解冠心病大鼠心肌损伤的作用及其机制
2023-05-07程敏菊魏鹏辉
刘 英,程敏菊,魏鹏辉
1.开滦总医院心内科,唐山 063000;2.邢台市人民医院心脏内科,邢台 054000;3.华北医疗集团峰峰总医院心内科,邯郸 056000
冠心病(coronary heart disease, CHD)是冠状动脉粥样硬化性心脏病,也称缺血性心脏病[1]。冠心病主要由心脏自身供血不足或冠状动脉粥样硬化引起的血管管内狭窄,其极易形成斑块或阻塞血管,引发心肌细胞缺血、缺氧、死亡等[2-3]。川芎嗪(tetramethylpyrazine, TMP)是由川芎中分离出的有效成分之一,临床上常用于治疗哮喘、高血压、血栓等疾病[4-5]。本研究旨在通过建立CHD大鼠模型,探讨TMP对CHD大鼠心肌损伤的影响及其可能的作用机制,为TMP药物开发及冠心病临床治疗提供参考依据。
1 仪器与材料
1.1 仪器
多功能酶标仪(SpectraMax M5, 美国Molecular Devices公司)。
1.2 试药
1.3 动物
65只7周龄SPF级雄性SD大鼠,体质量210~230 g。动物来源于河南省实验动物中心,生产许可证号为SCXK(豫)2017-0001。所有实验大鼠购回后先在动物室内适应性饲养1周,饲养环境内所有饲养设备均经过高压、高温灭菌,饲养环境室内温度调节范围为22 ℃~24 ℃,湿度调节范围为45%~55%,每隔8 h进行1次换气,保持空气洁净,环境光暗周期为光照12 h、黑暗12 h,适应期间给予普通饲养且自由饮水,每周更换垫料并消毒3次。
2 方法
2.1 CHD大鼠模型的建立
适应性饲养1周后,随机选取50只大鼠给予高脂饮食(配方各成分质量分数:基础饲料70%,猪油10%,蔗糖10%,胆固醇1.5%,奶粉3.5%,纤维素5%)饲养8周,并在8周后,每天上午同一时段腹腔注射30 μg·kg-1垂体后叶素,连续3 d,建立CHD大鼠模型[6]。末次给药后,采集大鼠尾静脉血液,用全自动生化检测仪测定大鼠各项血脂水平,若大鼠TC、TG水平呈倍数增加,且LDL-C水平明显上升,则视为建模成功[7]。
2.2 分组与给药

2.3 样本检测
2.3.1样本采集 各组大鼠给药4周后,禁食12 h,腹腔注射戊巴比妥钠麻醉,开腹,采集大鼠腹主动脉血液。血液静置4 h,以3 000 r·min-1、离心半径为12 cm高速离心机离心15 min,分离血清,液氮冻存。采血结束后,冰上剥离大鼠心脏组织,生理盐水冲洗后,切取一部分组织,按1∶9的比例加入预冷的生理盐水,充分研磨后置于高速离心机离心15 min,取上清液制备10 g·L-1组织匀浆样品。再剪取左侧冠状面中部的心肌组织,用预冷的生理盐水多次冲洗,再用4 g·mL-1多聚甲醛液固定24 h,备用,其余组织装入无菌冻存管内,-80 ℃保存备用。
2.3.2炎症因子检测 取出分离好的血清和ELISA试剂盒,试剂盒恢复至室温后开始检测,按照TNF-α、IL-1β和IL-6试剂盒说明书操作,加待测样品20 μL于测定孔和空白孔、双蒸水20 μL于对照孔、酶工作液20 μL于对照孔和测定孔、酶稀释液20 μL于空白孔、底物应用液200 μL于各孔,覆膜37 ℃孵育20 min,重复2次。加入终止液50 μL,终止反应。根据对照品梯度质量浓度结果建立标准曲线,计算样本质量浓度。
2.3.3心损标记因子检测 将分离好的血清和ELISA试剂盒从冰箱内取出,将试剂盒放置室内30 min,恢复至室温后开始检测,按照试剂盒说明方法测定血清中Mb、CK和CK-MB的含量。先将板孔分为空白孔、样品孔和标准孔,加入稀释好的待检样品10 μL、稀释液40 μL,封膜37 ℃孵育30 min,弃液清洗,加入酶标液50 μL,封膜37 ℃孵育30 min,弃液清洗,加入显色工作液A与工作液B,至呈现颜色梯度时加入50 μL终止液终止反应。用酶标仪在450 nm处测各孔A值,根据对照品质量浓度曲线计算样品质量浓度。
2.3.4氧化应激因子检测 取制备好的组织匀浆样品,按照MDA、GSH-Px和SOD试剂盒说明书操作,加入0.1 mL裂解液制备上清液。取适量对照品加入蒸馏水分别稀释至1、2、5、10、20、50 μmol·L-1制备检测工作液用于制作标准曲线。再取0.1 mL裂解液加入空白EP管作为对照,其他管内分别加入不同质量浓度的对照品,添加待测样品0.1 mL、检测工作液0.2 mL。待工作液与样品充分混合后,置于水浴锅60 ℃ 15 min,水浴结束后冷却至室温,以12 000 r·min-1离心10 min,离心半径12 cm。取上清液200 μL,加入板孔中,于酶标仪532 nm处检测其吸光度值,根据标准曲线计算样品质量浓度。
2.3.5HE染色观察 取出经甲醛固定24 h的心肌组织,流水冲洗去除固定液,不同梯度乙醇溶液进行脱蜡脱水,浸入软蜡、硬蜡各10 min,包埋完成后放入-20 ℃的冰箱内20 min,取出,恢复至室温,切片厚度为4 μm,置于37 ℃烤箱过夜,60 ℃烤箱内60 min,切片脱蜡脱水,苏木精染色液染色2 min,盐酸乙醇分化5 s,流水返蓝10 min,伊红溶液染色1 min,蒸馏水清洗3次,中性树脂封片。阴凉处晾干,将心肌组织切片置于光学显微镜下观察并拍片。
2.3.6AMPK、Nrf-2和HO-1 mRNA表达 取备用心肌组织加入裂解液1 mL,研磨30 s,用TRIzol沉淀法从心肌组织中分离出总RNA,取1 μL RNA样品测定吸光值和质量浓度进行质量分数检测。用反转录试剂盒合成cDNA,配制PCR反应体系为Tap酶0.4 μL,2×Rrel-time PCR Master Mix 10 μL,上游引物1 μL,下游引物1 μL,cDNA 2 μL,ddH2O 5.6 μL。引物序列为AMPK:上游(5′-GTGGAGT-CCTGAACGGCTAG-3′),下游(5′-GTGCAGGCTTAACGAATTCG-3′);Nrf-2:上游(5′-GCGTAACCTTTCAGGCGTCT-3′),下游(5′-CTTCCGAAGT-CCAGATCGAT-3′);HO-1:上游(5′-AACAGATGTTTCAACAGCAC-3′),下游(5′-GGGTTGATGGCACTGTTGAG-3′);GAPDH:上游(5′-TTGCCTAGAACTGACGGAGA-3′),下游(5′-GAAATACGGTGATTCCATGG-3′)。PCR扩增条件为:95 ℃ 10 min,94 ℃ 15 s,60 ℃ 60 s,进行40个循环,绘制熔解曲线,以ΔCt值和2-△△CT进行数据分析,计算待测样品目的基因相对定量。
2.3.7AMPK、Nrf-2和HO-1蛋白表达 取备用心肌组织与预冷的PBS缓冲液混匀,离心提取总蛋白,用BCA试剂盒测定蛋白质量浓度。取蛋白样品于EP管中,加入5×loding buffer于100 ℃水浴锅5 min,冷却后进行蛋白凝胶电泳,恒压80 V电泳30 min,120 V电泳120 min,至溴酚蓝刚跑出即停。转至PVDF膜,在室温内于牛奶封闭液60 min,TBST洗膜加入1∶2 000稀释一抗,4 ℃孵育过夜,TBST洗膜5 min×3次,加入1∶5 000稀释二抗,孵育2 h,TBST洗膜5 min×3次。配制ECL显色剂,加入ECL显色剂充分浸泡,暗室曝光显影。进行凝胶图像分析,对目的条带光密度值进行分析。
2.4 统计学方法
3 结果
3.1 炎症因子比较
与对照组比较,模型组TNF-α、IL-1β和IL-6水平升高(P<0.05)。与模型组比,3组大鼠3项数值降低(P<0.05)。与TMP低剂量组比,TMP高剂量组和西药组大鼠3项数值降低(P<0.05)。TMP高剂量组大鼠3项数值与西药组比较,差异无统计学意义(P>0.05)。见表1。
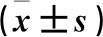
表1 各组大鼠血清炎症因子水平比较
3.2 心损标记因子比较
与对照组比较,模型组Mb、CK和CK-MB水平升高(P<0.05)。与模型组比较,3组大鼠3项数值降低(P<0.05)。与TMP低剂量组比较,TMP高剂量组和西药组大鼠3项数值降低(P<0.05)。TMP高剂量组大鼠3项数值与西药组比较,差异无统计学意义(P>0.05)。见表2。
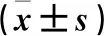
表2 各组大鼠心损标记因子水平比较
3.3 氧化应激因子比较
与对照组比较,模型组大鼠血清MDA水平升高,GSH-Px和SOD水平降低(P<0.05)。与模型组比较,3组大鼠MDA水平降低,GSH-Px和SOD水平升高(P<0.05)。与TMP低剂量组比较,TMP高剂量组和西药组大鼠MDA水平降低,GSH-Px和SOD水平升高(P<0.05)。TMP高剂量组大鼠3项数值与西药组比较,差异无统计学意义(P>0.05)。见表3。
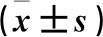
表3 各组大鼠氧化应激因子水平比较
3.4 心肌组织HE染色比较
对照组大鼠心肌细胞排列整齐,细胞边界清晰,染色均匀。心肌纤维结构完整,未见炎性细胞浸润,存在少量间质。模型组大鼠心肌细胞形态异常,细胞边界模糊,染色不均。心肌纤维排列散乱无序,间质出现水肿变性的现象,且存在大量炎性细胞浸润。TMP低剂量、高剂量组和西药组大鼠心肌细胞形态异常现象得到改善,染色均匀,界限清晰,细胞水肿变性现象减少,心肌纤维排列整齐,结构完整,炎性细胞浸润现象显著减少。见图1。
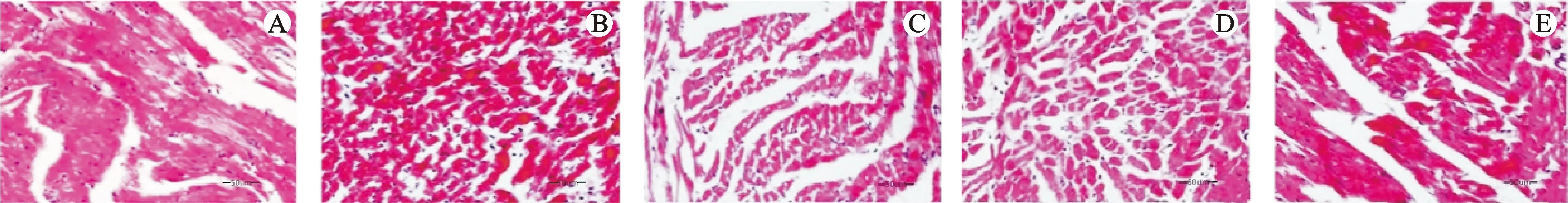
注:A.对照组;B.模型组;C.TMP低剂量组;D.TMP高剂量组;E.西药组。
3.5 AMPK、Nrf-2和HO-1 mRNA比较
与对照组比较,模型组Nrf-2和HO-1 mRNA表达水平降低(P<0.05)。与模型组比较,3组大鼠Nrf-2和HO-1 mRNA表达水平升高(P<0.05)。与TMP低剂量组比较,TMP高剂量组和西药组大鼠Nrf-2和HO-1 mRNA表达水平升高(P<0.05)。TMP高剂量组大鼠3项数值与西药组比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠AMPK、Nrf-2、HO-1 mRNA水平比较
3.6 AMPK、Nrf-2和HO-1蛋白比较
与对照组比较,模型组p-AMPK、Nrf-2和HO-1蛋白表达水平降低(P<0.05)。与模型组比较,3组大鼠3项数值升高(P<0.05)。与TMP低剂量组比较,TMP高剂量组和西药组大鼠3项数值升高(P<0.05)。TMP高剂量组大鼠3项数值与西药组比较,差异无统计学意义(P>0.05)。见表5、图2。
表5 各组大鼠AMPK、Nrf-2、HO-1蛋白水平比较
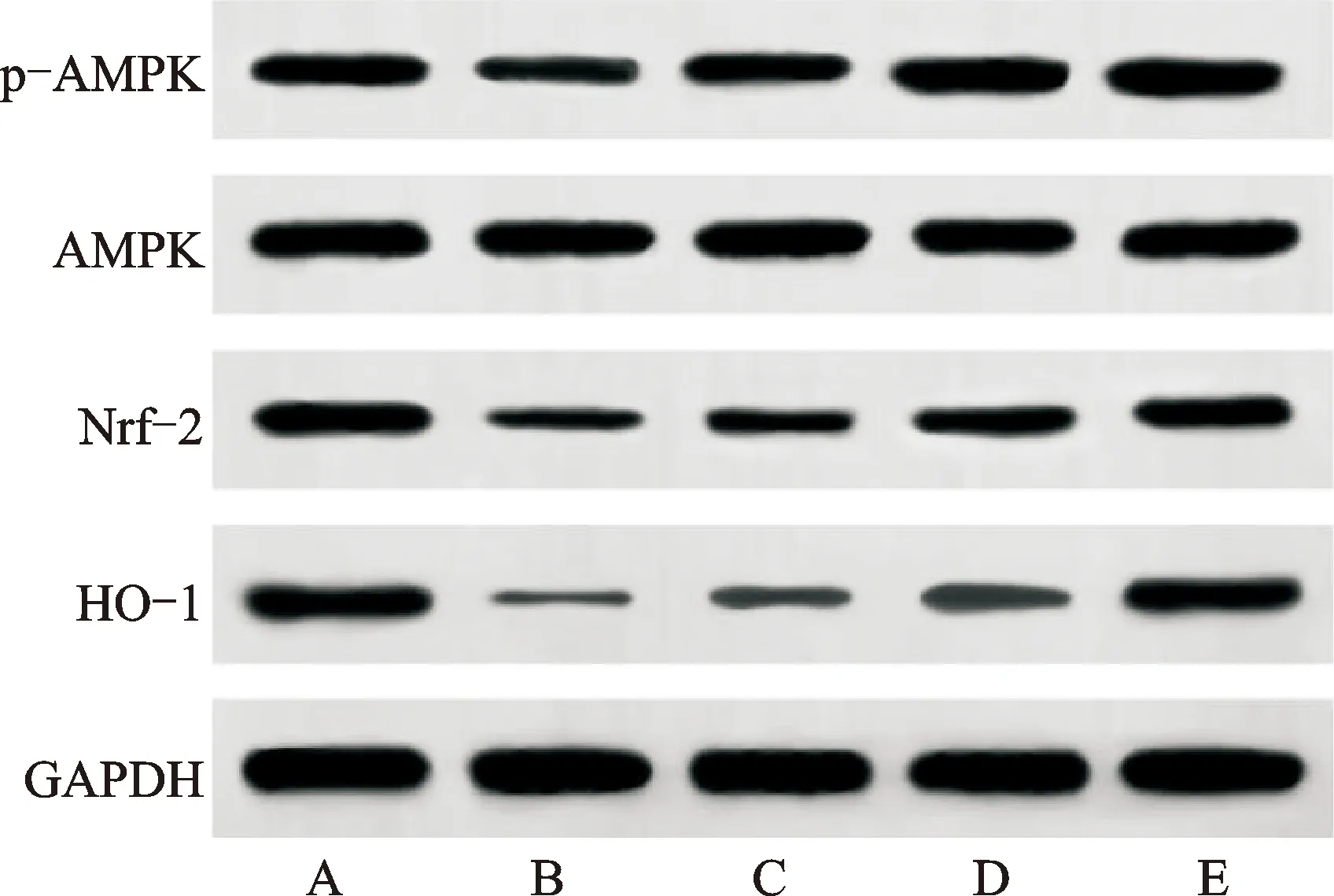
注:A.对照组;B.模型组;C.TMP低剂量组;D.TMP高剂量组;E.西药组。
4 讨论
TMP是一种提取自川芎的生物碱单体,现代药理研究表明,TMP具有广泛的药理活性,如抗炎、抗氧化、降血脂、改善血流流变学以及抑制血小板聚集等作用[10-12]。高脂饮食联合后腔注射垂体后叶素法是近年研究心血管疾病的经典诱导物质,因其操作简单、病理进程与人类心肌缺血疾病类似,被广泛应用于心血管疾病研究以及相应药物开发[13]。故本研究用高脂饮食联合后腔注射垂体后叶素法建立CHD大鼠模型,从分子机制上探讨TMP对大鼠心肌损伤的改善作用,探究其可能的作用机制。结果显示,模型组大鼠血清TNF-α、IL-1β、IL-6、Mb、CK、CK-MB和MDA水平升高,GSH-Px和SOD水平降低,提示模型组大鼠心损严重且伴有炎症和氧化应激反应,在给予TMP和西药的干预下均表现出TNF-α、IL-1β、IL-6、Mb、CK、CK-MB和MDA水平降低,GSH-Px和SOD升高,炎症因子水平降低且抗氧化因子水平升高,心肌损伤标记物水平也随之降低,提示TMP和西药均在一定程度上缓解心肌损伤;此外,心肌组织HE染色结果也表现出形态异常现象得到改善,细胞水肿变性现象减少,炎性细胞浸润现象显著减少。
AMPK是一种在真核生物细胞中广泛表达且高度保守的丝氨酸/苏氨酸蛋白激酶[14],对炎症和氧化应激具有重要调节作用,可提高AMPK活性[15]、降低ROS水平、增加SOD生成[16],增强机体抗氧化能力[17]。研究表明,AMPK/Nrf 2/HO-1信号通路不仅是机体氧化应激反应的重要调节通路之一,还与炎性反应相关[18],激活Nrf 2表达可协调炎症细胞募集,调控抗炎基因表达[19],在氧化还原反应和抗炎反应之间提供一个接口,发挥抗氧化损伤和抗炎反应等作用[20]。在本研究中,TMP各剂量组和西药组AMPK、Nrf-2和HO-1 mRNA和蛋白表达水平较模型组大鼠均显著升高,结合大鼠血清中炎性因子和抗氧化因子水平变化,TMP可激活AMPK/Nrf 2/HO-1信号通路,对CHD大鼠心肌损伤有积极影响。
综上所述,TMP能够调整血清中炎性因子和抗氧化因子水平,改善大鼠心肌损伤,其可能是通过调节AMPK/Nrf 2/HO-1信号通路发挥抗炎抗氧化作用的,可为临床治疗ALD提供实验依据。
