多浪羊PRLR基因克隆测序及不同组织差异表达分析
2023-05-06李孝君隋志远王晨光张永杰张志帅
李孝君,隋志远,王晨光,张永杰,张志帅,邢 凤*
(1. 塔里木大学动物科学学院,新疆 阿拉尔 843300;2. 新疆生产建设兵团塔里木畜牧科重点实验室,新疆 阿拉尔 843300)
初情期是雌性动物初次发情并发生排卵获得生殖能力的时期,这一时期始于下丘脑内GnRH 神经元分泌促性腺激素释放激素(GnRH),这是由表达高水平跨膜催乳素受体的Kisspeptin 神经元调节的。初情期的发生受生殖激素的调控,催乳素对黄体生成素和卵泡刺激素具有协调作用[1]。哺乳期间发现的血清PRL 水平升高,或由慢性催乳素(PRL)输注引起,会降低促性腺激素和Kisspeptin 的分泌,并影响动物的发情周期及排卵,而在试验中发现PRL有助于初情期的启动从而获得生殖能力[2]。
PRL跟其受体(PRLR)作用于靶细胞,调节繁殖相关生殖激素的合成和分泌,PRLR基因的表达[3],研究发现PRL结合其PRLR能产生不同的生理作用[4]。该基因变异对初情期年龄会产生影响[5]。PRLR 基因首先在大鼠上被发现的,随后在小鼠上也被发现,学者们对其他动物的PRLR基因进行了克隆,如在猴、牛、羊、马、兔,鸡、鹅、羊驼、鱼和猪等动物也发现了PRLR基因。
目前PRLR基因在绵羊、山羊、鸽子、乌龟、鸡、鸭、羊驼、小鼠和大鼠等动物的下丘脑、垂体、子宫、卵巢、输卵管和胎儿的一些细胞中均有表达,且不同时期的组织中的表达量存在差异[6-9]。多浪羊是新疆南疆的优良绵羊品种,具有发情早,生长速度快等优点。但国内并没有PRLR基因对绵羊初情期的影响的报道。因此,本试验为多浪羊垂体中PRLR基因克隆测序后,进行生物信息学分析和荧光定量PCR(qPCR)的方法,对多浪羊的PRLR 基因的CDS 序列分析以及测定初情期前后3 个时期垂体、下丘脑、卵巢、子宫和输卵管各组织中的PRLR基因的表达差异,为研究PRLR基因功能和进一步说明PRLR基因在绵羊初情期的启动过程产生的影响提供依据。
1 材料和方法
1.1 材料
1.1.1 试验材料的采集
试验动物是从南疆麦盖提多浪羊种羊繁殖羊场购买,同一饲养条件下的小母羊(2 月龄)15 只饲养于塔里木大学实验站,观察其发情特征,初情期前(90日龄),初情期(初次发情后的4~6 d),初情期后(发情10 d后)在无菌条件下用专门处理过的手术器械快速采集以上羊的下丘脑、垂体、子宫、卵巢和输卵管整个组织,其中同一年龄阶段的5 个组织样本视为生物学重复,采集的组织用酒精消毒剪成1 cm3大小的组织放入冻存管内,储存在液氮中,带回放入-80 ℃的冷冻室备用。
1.2 试验试剂
Trizol 购自Invitrogen;qPCR 试剂盒、反转录试剂盒和DH5α感受态细胞从北京全式金生物技术有限公司进行购买;胶回收试剂盒和DNA Marker2000均在北京天根生化科技有限公司购买;蓝白斑试剂从北京索莱宝科技有限公司购买;PMD19-T购自大连宝生物工程有限公司。
1.3 提取RNA与cDNA合成
使用 Trizol 法提取多浪羊各组织中的RNA,检测其浓度后计算后在同一浓度下(1 000 ng/µL)使用反转录试剂盒进行cDNA合成,将得到的cDNA放到-20 ℃的冷冻室备用。
1.4 引物设计及PRLR基因CDS区的克隆
从GeneBank 上找到的Ovis areas PRLR mRNA登录号为;AF041257.1,根据Primer Premier5.0 设计PRLR基因克隆的引物见表1。PCR 反应体系为25 µL:12.5 µL 2×EasyTaq PCR SuperMix,9.5 µL ddH2O,上下引物各1 µL,1 µL cDNA。反应条件:95 ℃,3 min;95 ℃,30 s;58 ℃,30 s;72 ℃,1 min;重复35个循环;72 ℃,5 min;4 ℃保存。PCR 产物经1.5%琼脂糖凝胶检测后,使用胶回收试剂盒回收的CDA 与PMD19-T 载体连接,将连接好的载体于DH5α 感受态细胞混合不含氨苄青霉素的液体培养基,进行摇床复苏,条件为120 min,37 ℃,225 r/min。将含有大肠杆菌液接种在含有氨苄青霉素的固体培养基上,放置30 min,培养皿倒置在37 ℃恒温培养箱过夜。挑出阳性重组子后进行PCR扩增,将合格菌液送至上海生工生物工程有限公司进行测序。利用测序获得的序列设计qPCR引物,以β-actin为内参基因。上海生工生物工程公司合成引物。

表1 引物设计以及产物长度Table 1 Primer design and product length
1.5 实时荧光定量 PCR
以多浪羊cDNA为模板,利用qPCR检测多浪羊各组织中PRLR的表达量。反应总体系为15 µL:7.5 µL 2Transtant qPCR Mix,5.5 µL ddH2O,上下游引物各0.5 µL(10 nmol/µL),1 µL cDNA。反应条件:95 ℃,2 min;95 ℃,15 s;55 ℃,15 s;68 ℃,20 s,重复反应40次。
1.6 生物信息学分析
用MEGA7.0 软件对PRLR 蛋白系统发育分析图:ExPASy-PrortScale 和ExPASy-ProtParam tool 在线软件分析PRLR 蛋白质理化性质;利用TMHMM2.0分析PRLR 蛋白跨膜区域;利用NetPhos 3.1软件对PRLR蛋白进行磷酸化位点预测;SignalP 5.0 预测蛋白质的信号肽;利用SOPMA 在线软件预测蛋白二级结构;SWISS-MODEL 软件蛋白的三级结构预测。
1.7 统计分析
采用2-ΔΔct法计算得到的CT 值,使用SPSS 26.0单因方差分析差异是否显著。P<0.05 表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 多浪羊PRLR基因PCR扩增结果
以多浪羊下丘脑cDNA 模板,通过RT-PCR 对多浪羊的PRLR基因进行扩增,使用1.2%琼脂糖凝胶电泳检测后(图1)。获得含有目的基因的条带,测序对结果进行了比对后发现,已获得该基因序列。

图1 多浪羊PRLR基因PCR产物Figure 1 PCR product of PRLR gene of Duolang sheep
2.2 PRLR 基因氨基酸序列对比相似性比较及系统发育树
通过NCBI 分别获取绵羊登录号(Ovis aies登录号:KAG5199221.1)、山羊(Capra hircus登录号:NP_001272598.1)、人(Homo sapiens登 录 号:NP_000940.1)、家 鼠(Mus musulus登 录 号:NP_00124071)、马(Equus asinus登 录 号:XP_001500154.1)、猪(Sus scrofa登 录 号:NP_001001868)、鸡(Gallus gallus登 录 号:NP_001384495.1)和马鹿(Cervus elaphus登录号:XP_043743252.1)的蛋白序列。由图2 可得知,多浪羊PRLR基因氨基酸序列与绵羊、人、山羊、家鼠、猪、马、鸡和马鹿的相似性分别为99.7%、70.7%、96.4%、43.5%、75.4%、75.5%、47.0%和49.7%。系统发育树结果显示,多浪羊与绵羊、山羊、马鹿的亲缘关系较近,与人、猪、马和家鼠次之,与鸡的亲缘关系最远(图3)。

图2 多浪羊PRLR蛋白质氨基酸相似性对比分析Figure 2 Comparative analysis of amino acid similarity of PRLR protein of Duolang sheep
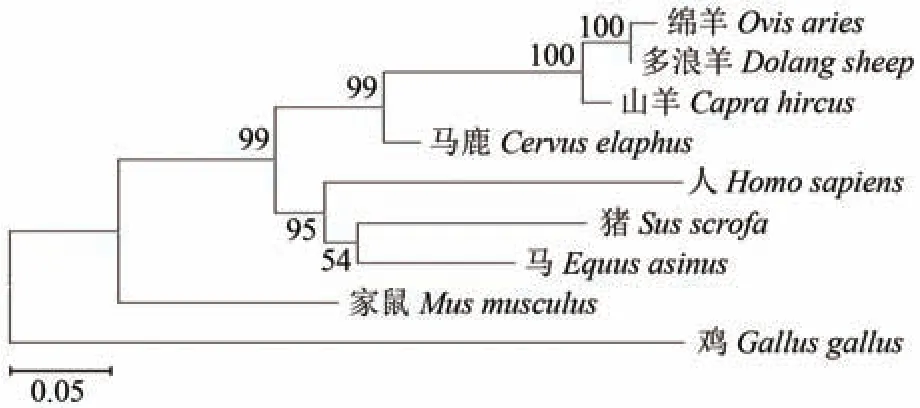
图3 多浪羊PRLR蛋白氨基酸序列的进化分析树Figure 3 Evolutionary analysis tree of PRLR amino acid sequence of Duolang sheep
2.3 PRLR蛋白理化性质预测分析
2.3.1 多浪羊PRLR编码产物的理化性质分析
使用在线软件ProtParam 分析多浪羊PRLR 蛋白物理化性质,结果显示:其分子质量为65 208.33 Ku,其理论等电点为5.12;该蛋白分子式为:C2952H4538N734O883S24;ProtParam预测显示PRLR蛋白序列中亲水性氨基酸区域比疏水性的氨基酸区域多(图4);脂肪族指数:28.24;亲水性的大平均值(GRAVY):-0.432 为亲水蛋白;不稳定指数为49.28,为不稳定蛋白。

图 4 多浪羊 PRLR蛋白疏水性/亲水性预测Figure 4 Hydrophobicity/hydrophilicity prediction of PRLR protein from Duolang sheep
2.4.2 PRLR蛋白磷跨膜区域预测
使用TMHMM2.0 蛋白结构域及跨膜区域预测分析显示PRLR蛋白2含跨膜结构位于25到235,第259 到581。由图5 可知,PRLR 蛋白存在2 个跨膜区域,跨膜区域起始位置与SMART 软件预测序列一致。

图5 多浪羊 PRLR跨膜区域预测Figure 5 PRLR transmembrane region prediction in Duolang sheep
2.3.3 PRLR蛋白磷酸化位点的预测
在线软件NetPhos3.1 分析多浪羊PRLR 蛋白质的磷酸化位点进行预测;结果显示共有73个磷酸化位点见(图6)其中11酪氨基酸、19个苏氨基酸和41个丝氨酸。

图6 多浪羊PRLR蛋白磷酸化位点预测图Figure 6 PRLR Protein phosphorylation site prediction map of Duolang sheep
2.3.4 PRLR 蛋白质信号肽的预测
在线软件SignalP 5.0 预测多浪羊PRLR 蛋白质的信号肽,测到该基因的蛋白信号肽(图7)。

图7 多浪羊PRLR跨膜信号肽的预测分析Figure 7 Predictive analysis of PRLR transmembrane signal peptide
2.3.5 多浪羊PRLR蛋白二级结构和三级结构预测
利用SOPMA 在线软件预测结构可知,PRLR 蛋白二级结构主要由59.21%的无规则卷曲和21.69%的延伸链组成,其余结构为15.83%的β-转角和3.27%的α-螺旋结构。(图8)S WISS-MODEL 软件对PRLR 蛋白的三级结构预测验证了PRLR 蛋白的二级结构,结果显示,GMQE为0.25, PRLR蛋白无配体结构(图9)。
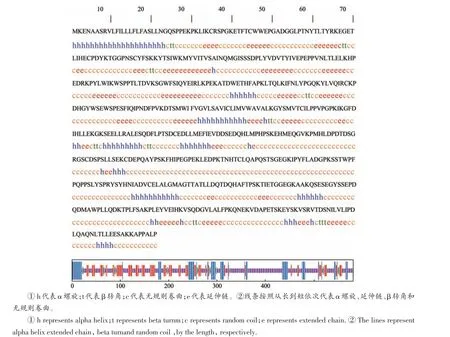
图8 多浪羊PRLR二级蛋白预测分析Figure 8 PRLR secondary protein prediction analysis of Duolang sheep

图9 多浪羊PRLR蛋白三级结构预测Figure 9 Tertiary structure prediction of PRLR protein of Duolang sheep
2.4 PRLR基因不同情期不同组织中的表达差异
通过qPCR方法对PRLR基因在多浪羊垂体、下丘脑、卵巢、子宫和输卵管各组织5种组织中的表达进行检测(图10)。结果显示:PRLR基因在多浪羊初情期前垂体的表达量较高,显著高于其他4 个组织;初情期PRLR基因在垂体的表达量任相对较高,显著高于下丘脑、子宫、卵巢和输卵管;初情期后PRLR基因在垂体和下丘脑的表达量相对较高,显著高于子宫、卵巢和输卵管;初情期PRLR基因在垂体和输卵管有升高的趋势显著高于初情期前和初情期后;初情期到初情期后PRLR基因在下丘脑持续升高的趋势,初情期后显著高于初情期,初情期显著高于初情期前。初情期子宫中的PRLR基因的表达量先降低初情期后上升但差异不显著。卵巢PRLR基因在初情期前先升高初情期后降低但差异不显著。

图10 不同时期不同组织多浪羊PRLR 相对分泌量Figure 10 Relative secretion of PRLR in different tissues of Duolang sheep in different periods
3 讨论
雌性动物发情周期的不同阶段PRLR基因的表达量发生变化,而PRLR基因的表达受生殖的激素调控。此外不同类型的PRL 受体在激素信息传导中的产生的功能可能有所不同[10]。本文RT-RCR技术克隆了从多浪羊垂体提取的PRLR基因的片段共1 763 bp,其中CDS 区编码区的序列长为1 746 bp,编码氨基酸581 个,在其他羊上发现均为581 个氨基酸,在其他哺乳动物氨基酸数为小鼠589个、大鼠591 个、兔子592 个、牛和鹿557 个、人与猴598 个。通过生物学信息分析结果显示,PRLR 蛋白质二级结构主要由59.21%的无规则卷曲和21.69%的延伸链组成,属于不稳定亲水蛋白,有蛋白信号肽,有2个蛋白跨膜结构属于跨膜蛋白[11],PRLR蛋白属于分泌蛋白,合成后会发生转运。对蛋白磷酸化位点的预测发现了73 个蛋白磷酸化位点,其中11 个酪氨基酸(Y)位点、19个苏氨基酸(T)位点和41个丝氨酸(S)位点。PRLR基因在动物之间有较高的保守[11]。试验获得的多浪羊PRLR蛋白氨基酸序列在不同物种分析同源性及构建进化发育树发现多浪羊与绵羊、山羊、马鹿亲缘关系较近,与人、猪、马、家鼠的亲缘关系次之,与鸡的亲缘关系最远,该结果符合动物进化的特征与其他的学者研究结果一致[12-17]。
许多研究证明PRLR基因在哺乳动物的下丘脑、垂体和性腺等组织中均有的广泛表达,并且PRLR在几乎所有的组织和胎儿的一些细胞中均有发现。成年内蒙古绒山羊的下丘脑、垂体和卵巢均有PRLR基因的表达,卵巢是催乳素的靶器官,说明PRLR基因对内蒙古绒山羊的繁殖力具有影响[18]。甘加藏羊发情周期中PRLR基因在垂体和卵巢组织中均有表达,且垂体组织中表达最高,且发情期前PRLR的表达显著高于发情期和发情后。发情期卵巢的表达量高于发情前和发情后,PRLR基因参与了甘加藏羊发情周期的调控[19]。中国软壳龟的所有组织中发现了PRLR基因的表达,且在垂体得表达量最高,其基因在爬行动物参与的调控应该与鸟类中的是一致的[20]。浙江白东鹅在产蛋期和就巢期垂体的表达量显著高于下丘脑、卵巢和输卵管等组织[21]。黑番鸭就巢期子宫中PRLR基因的表达量高于产蛋期前后,卵巢中的表达量高于下丘脑,垂体中的表达量基本没有变化[22]。PRLR基因可能参与了绵羊季节性繁殖的调控,成年的小尾寒羊黄体期的PRLR基因的表达量高于卵泡期[23]。皖西白鹅卵巢的表达显著高于垂体和下丘脑,就巢期PRLR基因的表达量高于产蛋期前和产蛋后[24];肉鸽嗉囊中PRLR基因在孵化期间到哺育第3 天的表达量逐渐增加,公鸽嗉囊中的PRLR的表达量高于母鸽,嗉囊中PRLR基因的表达量高于垂体、下丘脑和卵巢(睾丸)[25]。雌性条纹仓鼠春秋时期PRLR基因在下丘脑,卵巢的表达水平与LH 和FSH 血清浓度呈负相关,由此说明PRLR基因可能对季节生殖活动产生负反馈调节[26]。出生时垂体和卵巢中就有表达但其表达量较低在2~4 月龄时PRLR基因表达显著高于1月龄和5月龄(性成熟),因此PRLR基因参与了前籽鹅的性成熟调控[27]。PRLR基因对未成熟小鼠的卵泡发育,生长及黄体生长及维持发挥着重要作用,随小鼠周龄的增长PRLR基因在小鼠卵巢中的表达量也升高[28]。本研究PRLR基因在多浪羊垂体、卵巢和输卵管等组织在初情期前到初情期的过程中的表达量显著升高初情期后又降低,证明PRLR基因在多浪羊初情期的启动过程中发挥着重要的作用。综上所述,多浪羊PRLR基因在下丘脑、垂体、子宫和输卵管均有表达,在垂体中高表达,初情期垂体和卵巢组织中的PRLR基因显著性升高,而初情期时动物第一次排卵的过程,而卵巢中的PRLR基因可诱导排卵[29]。这为进一步多浪羊PRLR基因的在初情过程启动过程中的调控基础奠定了基础。
4 结论
本研究获得了多浪羊PRLR基因的CDs 区序列,其长度为1 746 bp,PRRL 蛋白在哺乳动物进化过程中具有高度的保守;多浪羊PRLR基因主要在垂体和下丘脑中表达,卵巢和子宫次之,输卵管中表达最低,且PRLR基因在多浪羊垂体表达量显著高于其他组织;多浪羊垂体和卵巢组织中PRLR基因在初情期前、初情期和初情期后表达量先升高再降低,揭示了PRLR基因可能参与了多浪羊初情期的启动过程。
