叶酸与肝癌发生发展的关系
2023-04-29李应雯师丽刘敏袁浩郑亚王玉平郭庆红
李应雯 师丽 刘敏 袁浩 郑亚 王玉平 郭庆红
摘要:迄今为止,肝癌仍是我国高发、恶性程度极高的肿瘤,严重影响我国人民的生命和健康。以往研究发现,肝癌的发生与病毒、吸烟、饮酒及非酒精性脂肪性肝病等诸多因素相关。随着不断探索,越来越多的研究指出,营养因素及生活环境与肝癌的发生发展相关。叶酸作为机体细胞生长和繁殖所必需的营养物质,其在人体内的水平高低均对肿瘤细胞的生长产生影响,与肝癌的关系密不可分。本文对近年来叶酸与肝癌之间关系的研究进展予以综述,以期为肝癌的预防和治疗提供新的参考和依据。
关键词:肝肿瘤; 叶酸; DNA甲基化; 治疗学
基金项目:甘肃省自然科学基金(21JR1RA117, 20JR5RA347); 兰州大学第一医院院内基金(ldyyyn2019-28,ldyyyn2018-54)
Association of folic acid with the development and progression of liver cancer
LI Yingwen1,2a,2b, SHI Li1,2a,2b, LIU Min2a,2b, YUAN Hao2a,2b, ZHENG Ya2a,2b, WANG Yuping2a,2b, GUO Qinghong2a,2b. (1. The First Clinical Medical College of Lanzhou University, Lanzhou 730000, China; 2. a. Department of Gastroenterology, b. Gansu Key Laboratory of Gastroenterology, The First Hospital of Lanzhou University, Lanzhou 730000, China)
Corresponding author:GUO Qinghong, gqh@lzu.edu.cn (ORCID:0000-0002-0438-3948)
Abstract:
So far, liver cancer is still a highly malignant tumor with a high incidence rate in China, and it seriously affects the life and health of Chinese people. Previous studies have shown that the development of liver cancer is associated with various factors such as virus, smoking, drinking, and nonalcoholic fatty liver disease. With continuous exploration, more and more studies have pointed out that nutritional factors and living environment are associated with the development and progression of liver cancer. Folic acid is a necessary nutrient for cell growth and reproduction, and its level in human body has an impact on the growth of tumor cells and is closely associated with liver cancer. This article reviews the research advances in the association between folic acid and liver cancer in recent years, so as to provide new reference and basis for the prevention and treatment of liver cancer.
Key words:
Liver Neoplasms; Folic Acid; DNA Methylation; Therapeutics
Research funding:
Natural Science Foundation of Gansu Province (21JR1RA117, 20JR5RA347); In Hospital Fund of the First Hospital of Lanzhou University (ldyyyn2019-28, ldyyyn2018-54)
在全球范围内,癌症依然是影响人类寿命、导致死亡的主要原因[1]。原发性肝癌是2020年全球第六大最常见癌症,也是第三大癌症死亡原因,新增病例约90.6万例,死亡83万例[2]。原发性肝癌包括肝细胞癌(HCC)(75%~85%)和肝内胆管癌(10%~15%),以及其他罕见类型。肝癌的危险因素主要包括慢性HBV或慢性HCV感染、黄曲霉毒素污染食物、长期过量饮酒、吸烟、肥胖等[3]。随着不断研究和探索发现,饮食也影响着肝癌的发生与发展。在北美和北欧,酗酒是肝癌最重要的危险因素,摄入更多的乳制品、高糖饮料也与肝癌的发展有一定的关联[4]。经常食用新鲜蔬菜、鱼类、咖啡等食物可能降低肝癌的发生风险[5-6]。人体需要微量有机物质来维持正常的生理功能,叶酸就是必不可少的一种重要的维生素。通过动物模型、流行病学、临床干预等多方面的研究,叶酸与癌症之间的联系越來越受到学者们的关注。许多研究[7-9]已经证实,叶酸缺乏在贫血、神经管缺陷、动脉粥样硬化、神经精神障碍以及某些癌症疾病(例如胃癌、结直肠癌症等)中起致病作用。本文将近年来叶酸与肝癌之间关系的研究成果进行综述,以期为肝癌的早期预防、靶向治疗等方面提供参考。
1 叶酸缺乏促进肿瘤发生
人体不能从头合成叶酸,需从食物中获取。长期以来,膳食叶酸都被认为具有抗癌作用,叶酸缺乏将会诱导癌症的发生[10]。多项动物实验[11-12]均表明低叶酸状态导致小鼠发生肝癌的风险增加。越来越多的临床试验也得出了相似的结论。一项病例对照研究[13]指出,血浆叶酸水平与肿瘤分期、肿瘤大小呈负相关,随着叶酸水平增加,肝癌风险逐渐降低。并且指出血浆叶酸水平可作为HCC患者临床特征的预测因子。这一研究成果验证了此前一项研究结论,即大约60%的肝癌患者缺乏叶酸,随着肝癌的进展,叶酸水平急剧下降,由此可以推断低叶酸状态可能是肿瘤进展的危险因素[14]。一项广东省的肝癌队列研究[15]显示诊断时较低的血清叶酸水平与较差的肝癌生存率独立相关。还有研究[16]指出较高的叶酸摄入量将会改善饮酒对肝癌发生发展的影响。基于以上研究,可以认为叶酸缺乏与肝癌的发生密切相关,是肝癌发生发展的危险因素之一。然而,也有研究[8,17]指出,在已经发生肿瘤的情况下,补充叶酸会进一步增加乳腺、结肠和前列腺等肿瘤进展。以上相互矛盾的研究结论表明,叶酸干预剂量及其时间对安全有效的化学预防至关重要[18]。因此,叶酸在恶性肿瘤中起着双重调节作用,它可以抑制肿瘤的发生,然而一旦肿瘤形成,就会促进肿瘤前期和亚临床肿瘤的生长。关于叶酸缺乏和过量补充对HCC进展影响的数据很少,故还需大量基础及临床研究进一步探究叶酸水平对肝癌的影响。
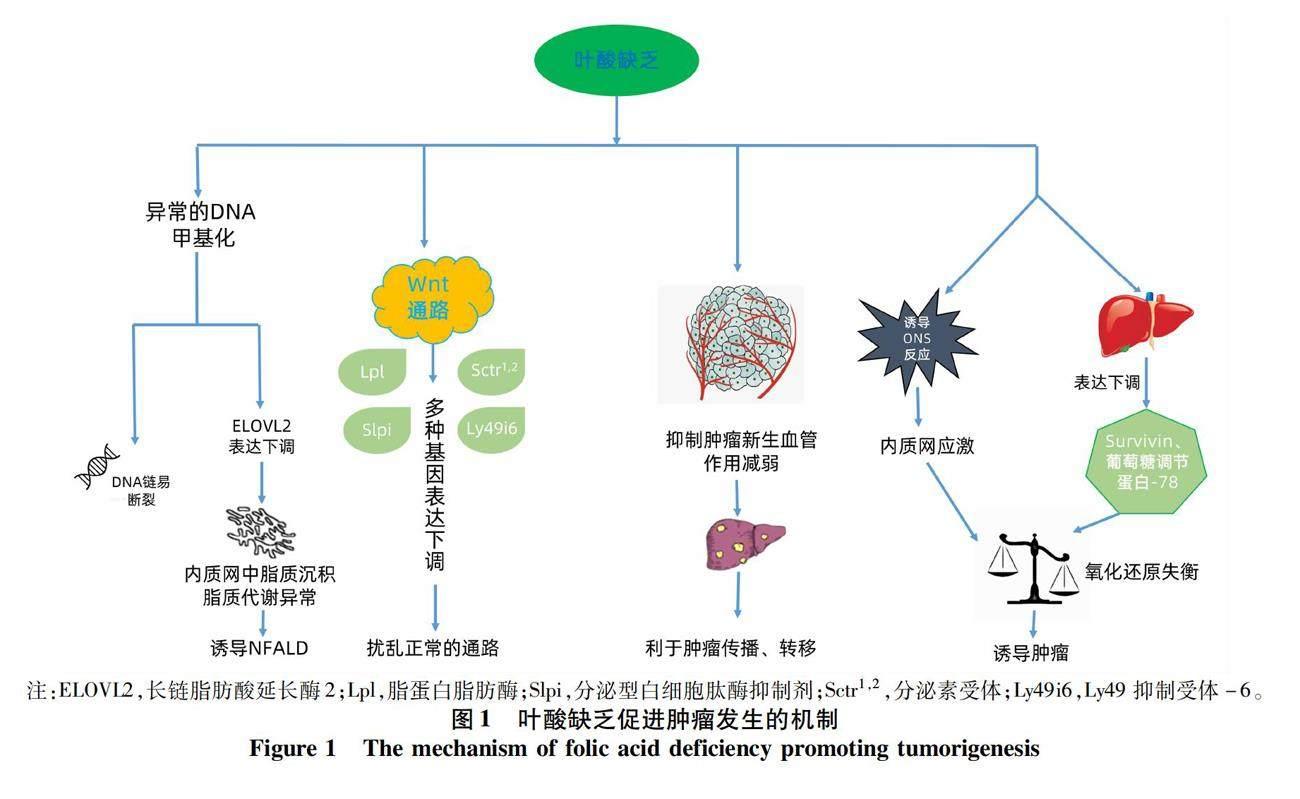
2 叶酸缺乏促进肿瘤发生的机制
叶酸作为天然的抗癌维生素,能够诱导癌细胞凋亡,影响癌细胞的基因表达[19]。叶酸缺乏可通过以下几种机制诱导肝癌的发生。
2.1 叶酸缺乏影响基因甲基化 肝脏是所有维生素合成和代谢的主要场所,作为甲硫氨酸合成的甲基供体,叶酸已被证明能够在生物體内参与DNA甲基化、DNA合成及修复等生物过程[13]。叶酸也因其在生物甲基化和表观遗传学机制中的重要作用而备受关注[20]。叶酸缺乏将会导致甲基化不完全,进而有助于将尿嘧啶并入DNA,从而导致DNA断裂和染色体不稳定。这种断裂、受损的DNA会增加患癌症的风险。除此之外,鉴于叶酸在DNA甲基化和合成中的重要性,慢性叶酸缺乏可能导致全基因组DNA低甲基化。基因启动子的整体DNA低甲基化和异常高甲基化将会干扰基因表达和DNA修复,最终导致肿瘤发生[21-22]。已有动物实验[23]验证了这一机制,该研究表明缺乏叶酸的饮食可显著降低整体DNA甲基化,从而促进癌症的发生。
2.2 叶酸缺乏相关的氧化还原机制 有研究[24-25]指出,当叶酸等营养物质缺乏时,可通过诱导氧化-亚硝化应激(ONS)反应,引起内质网应激,导致细胞谷胱甘肽耗竭,从而致细胞死亡。机体内的细胞氧化还原稳态是通过活性氧(ROS)生成和清除之间的平衡来维持的。增加ROS生成或降低抗氧化能力的外源性药物会打破氧化还原稳态,提高总体ROS水平,最终导致细胞死亡[26]。有研究[27]在肝癌Hep G2细胞中观察到以上现象,Hep G2细胞是一种分化良好、氧化应激最少的亚克隆变体,当暴露于叶酸缺乏诱导的ONS时,其发生凋亡。除此之外,叶酸还可作为HCC的新型氧化还原调节剂发挥作用。研究[28]发现叶酸缺乏可显著下调Survivin和葡萄糖调节蛋白-78这两种显著的抗凋亡效应物。
2.3 叶酸缺乏抑制新生血管生成的作用减弱 已有研究[29]证明用叶酸或三丁酸甘油酯治疗肝癌大鼠模型,能显著抑制致癌过程,这种抑癌活性与增强细胞凋亡和抑制细胞持续增殖有关。后来进一步的研究[30]表明叶酸和三丁酸甘油酯的抑癌作用是通过抑制肝脏血管生成,尤其是抑制新生血管生成来实现的。血管生成是肿瘤的重要特征之一,当机体缺乏叶酸时,抑制血管生成的作用减弱,抑制细胞增殖能力降低,由此会促进肿瘤的发生。
2.4 叶酸缺乏影响癌症相关分子途径 Wnt途径控制胚胎的组织发育和成年生物体的组织维持,是一个基本的发育途径[31]。Wnt通路的异常激活在包括HCC在内的多种癌症的发病机制中起着关键作用,是肝癌发生的早期事件,并与侵袭性HCC表型的形成有关[32]。叶酸治疗肝癌大鼠的实验[32]中基因分析显示Wnt途径基因高度富集。因此可以推断,Wnt通路受叶酸代谢影响,当体内叶酸缺乏时,将会扰乱正常的分子途径,从而诱导肝癌的发生。
2.5 叶酸缺乏影响肝脏脂质代谢 非酒精性脂肪性肝病(NAFLD)是HCC的重要危险因素之一。研究[33]证实,肝脏中的生物甲基化功能对维持肝脏脂质代谢至关重要。动物研究[34-35]表明,叶酸缺乏会影响肝脏脂质储存和代谢,导致NAFLD的发生,而膳食中补充叶酸会增加小鼠模型中的DNA甲基化状态并降低肝脏脂肪含量[36]。另有研究[37]发现,在中国人群中,低血清叶酸水平被确定为NAFLD的独立危险因素。将血清叶酸水平添加到现有的NAFLD预测分数中,将会显著改善NAFLD的预测。因此可以得出结论,叶酸缺乏将会影响肝脏正常脂质代谢过程,导致NAFLD的发生,从而增加了肝癌的发生风险。
综上所述,叶酸缺乏能够通过影响基因甲基化、破坏机体内氧化还原平衡、影响肝脏脂质代谢、影响基因通路等机制诱导肝癌的发生(图1)。因为叶酸代谢通路在提供核苷酸合成前体以及甲基化前体中发挥着重要作用,故叶酸承担着DNA合成和甲基化的双重功能,对机体全基因组影响重大,与肿瘤发生发展紧密关联,这是诱导癌症发生的关键机制。然而还需要更多的基础实验及前瞻性临床研究来进一步探究叶酸与肝癌发生之间的精确分子机制及细胞通路,为肝癌的早期预防、靶向治疗提供依据。3 叶酸在肝癌治疗中的作用
目前对于原发性肝癌的治疗方法主要有肝切除术、肝移植、局部消融治疗、经肝动脉治疗以及放射治疗[38]。随着检验及影像学技术、精准外科、人工智能、免疫治疗以及分子靶向治疗的发展和进步,肝癌的治疗逐渐有了新的机遇。目前叶酸对于肝癌的治疗主要应用于癌症晚期化疗和靶向治疗的患者当中。
3.1 在晚期化疗中的作用 叶酸受体(α亚单位)在包括肝癌在内的多种肿瘤中过度表达。有研究[39]评估了含叶酸的药物载体在HCC模型中的特异性和毒性,结果显示经动脉途径叶酸靶向治疗是一种有效的肝癌治疗策略。一项应用奥沙利铂、氟尿嘧啶和亚叶酸(FOLFOX)的肝动脉灌注化疗(HAIC)与经肝动脉化疗栓塞术(TACE)治疗大肝癌的随机Ⅲ期临床试验[40]指出,与TACE相比,FOLFOX-HAIC显著提高了不能切除的大肝癌患者的总生存率。另有一项关于FOLFOX-HAIC与索拉非尼治疗晚期HCC的比较研究[41]结果显示,FOLFOX-HAIC疗法可以提高晚期肝癌患者的无进展生存率和总生存率。
3.2 联合纳米制剂增强靶向给药作用 纳米医学技术能够在临床上为包括癌症在内的多种疾病的诊断和治疗提供新的策略,近年来发展迅速[42]。纳米医学技术的主要目的之一是研究合成和制造适合人体的靶向抗癌药物输送载体。该技术能够使得靶向药物可以有效地跨越生理屏障,在理想的部位聚集,持续地释放药物,减少总体药物剂量,提高治疗效率,并且能够减少副作用[43]。利用这一技术,研究者们发现,将叶酸的靶向治疗作用与纳米医学技术结合起来,更能增加癌症靶向作用和抗氧化作用[44]。
3.3 化学预防作用 叶酸可以作为肝癌发生的化学预防剂,但其具体作用及机制目前尚不清楚。有研究[30]发现,在大鼠肝癌发生的早期阶段,叶酸的抑瘤活性以及对细胞增殖和凋亡的抑制与抑制新生血管生成有关。基于这一机制可以得出结论,叶酸能够在大鼠肝癌发生中的化学预防方面发挥作用。Zhang等[44]研究揭示了叶酸通过诱导组蛋白H3赖氨酸-9-二甲基化(H3K9Me2)依赖的脂质运载蛋白2转录抑制,在HCC的发生中作为化学预防因子发挥作用。
3.4 增强靶向药物敏感性 有研究[10]表明,亚甲基四氢叶酸脱氢酶-1-样是叶酸循环中的一种酶,有助于NADPH的产生和积累,达到足以对抗癌细胞氧化应激的水平。通过亚甲基四氢叶酸脱氢酶-1-样基因敲除或使用抗叶酸药物甲氨蝶呤来提高氧化应激,能够增加癌细胞对索拉非尼的敏感性。
补充叶酸能够治疗贫血、小儿腹泻、阿尔兹海默症等多种疾病,在多种癌症治疗当中叶酸也起到了不可或缺的作用。综合目前的研究成果,叶酸在肝癌中主要起靶向治疗作用。为提高抗癌效率、减少化疗相关副作用,还需进一步的研究来探索叶酸的治疗作用。希望未来能够以最小的副作用、最低的医疗成本来提高肝癌患者的生存率、改善癌症患者的生命质量。
4 小结与展望
本文叙述了机体必需微量元素叶酸与肝癌发生发展之间的联系,并综合了目前研究成果中叶酸在肝癌治疗方面的作用,有望在肝癌患者治疗中探索疗效更强、副作用更少的治疗策略。然而,鉴于叶酸等微量元素在人体中代谢具有个体差异性,并且肝癌本身存在明显的分子异质性,因此其治疗效果也会不同,更新型、有效、可行的治疗方案必将是今后探索的重点。未来需要不断研究和深入探索,使得包括叶酸在内的更多维生素成为一条崭新的治疗途径,也希望将来能够通过更多临床试验确定正规的治疗剂量、适合的受益人群和配伍药物,旨在获得又一个新的治疗肝癌的方式。
利益沖突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李应雯负责课题设计,资料分析,撰写论文;师丽、刘敏、袁浩参与收集数据,修改论文;郑亚、王玉平、郭庆红负责拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]BRAY F, LAVERSANNE M, WEIDERPASS E, et al. The ever-increasing importance of cancer as a leading cause of premature death worldwide[J]. Cancer, 2021, 127(16): 3029-3030. DOI: 10.1002/cncr.33587.
[2]SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[3]ANWANWAN D, SINGH SK, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873(1): 188314. DOI: 10.1016/j.bbcan.2019.188314.
[4]HEATH AK, CLASEN JL, JAYANTH NP, et al. Soft drink and juice consumption and renal cell carcinoma incidence and mortality in the European prospective investigation into cancer and nutrition[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30(6): 1270-1274. DOI: 10.1158/1055-9965.EPI-20-1726.
[5]KENNEDY OJ, RODERICK P, BUCHANAN R, et al. Coffee, including caffeinated and decaffeinated coffee, and the risk of hepatocellular carcinoma: a systematic review and dose-response meta-analysis[J]. BMJ Open, 2017, 7(5): e013739. DOI: 10.1136/bmjopen-2016-013739.
[6]FARVID MS, SIDAHMED E, SPENCE ND, et al. Consumption of red meat and processed meat and cancer incidence: a systematic review and meta-analysis of prospective studies[J]. Eur J Epidemiol, 2021, 36(9): 937-951. DOI: 10.1007/s10654-021-00741-9.
[7]PARK SH, HOANG T, KIM J. Dietary factors and breast cancer prognosis among breast cancer survivors: A systematic review and meta-analysis of cohort studies[J]. Cancers (Basel), 2021, 13(21): 5329. DOI: 10.3390/cancers13215329.
[8]PIEROTH R, PAVER S, DAY S, et al. Folate and its impact on cancer risk[J]. Curr Nutr Rep, 2018, 7(3): 70-84. DOI: 10.1007/s13668-018-0237-y.
[9]LIU Y, SUN CJ, ZHANG YH, et al. Effect of combined treatment with folic acid and teprenone on the prognosis of precancerous lesion of chronic atrophic antral gastritis after Helicobacter pylori eradication[J]. Clin J Med Offic, 2021, 49(11): 1267-1269, 1272. DOI: 10.16680/j.1671-3826.2021.11.29.
劉燕, 孙陈静, 张月华, 等. 叶酸与替普瑞酮联合治疗对幽门螺杆菌根除后慢性萎缩性胃窦炎癌前病变转归影响[J]. 临床军医杂志, 2021, 49(11): 1267-1269, 1272. DOI: 10.16680/j.1671-3826.2021.11.29.
[10]LEE D, XU IM, CHIU DK, et al. Folate cycle enzyme MTHFD1L confers metabolic advantages in hepatocellular carcinoma[J]. J Clin Invest, 2017, 127(5): 1856-1872. DOI: 10.1172/JCI90253.
[11]SHARMA R, ALI T, NEGI I, et al. Dietary modulations of folic acid affect the development of diethylnitrosamine induced hepatocellular carcinoma in a rat model[J]. J Mol Histol, 2021, 52(2): 335-350. DOI: 10.1007/s10735-020-09955-9.
[12]SHARMA R, ALI T, KAUR J. Tumor suppressor genes are differentially regulated with dietary folate modulations in a rat model of hepatocellular carcinoma[J]. Mol Cell Biochem, 2021, 476(1): 385-399. DOI: 10.1007/s11010-020-03915-3.
[13]CUI LH, QUAN ZY, PIAO JM, et al. Plasma folate and vitamin B12 levels in patients with hepatocellular carcinoma[J]. Int J Mol Sci, 2016, 17(7): 1032. DOI: 10.3390/ijms17071032.
[14]KUO CS, LIN CY, WU MY, et al. Relationship between folate status and tumour progression in patients with hepatocellular carcinoma[J]. Br J Nutr, 2008, 100(3): 596-602. DOI: 10.1017/S0007114508911557.
[15]FANG AP, LIU ZY, LIAO GC, et al. Serum folate concentrations at diagnosis are associated with hepatocellular carcinoma survival in the Guangdong Liver Cancer Cohort study[J]. Br J Nutr, 2019, 121(12): 1376-1388. DOI: 10.1017/S0007114519000734.
[16]PERSSON EC, SCHWARTZ LM, PARK Y, et al. Alcohol consumption, folate intake, hepatocellular carcinoma, and liver disease mortality[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(3): 415-421. DOI: 10.1158/1055-9965.EPI-12-1169.
[17]DEGHAN MANSHADI S, ISHIGURO L, SOHN KJ, et al. Folic acid supplementation promotes mammary tumor progression in a rat model[J]. PLoS One, 2014, 9(1): e84635. DOI: 10.1371/journal.pone.0084635.
[18]REN X, XU P, ZHANG D, et al. Association of folate intake and plasma folate level with the risk of breast cancer: a dose-response meta-analysis of observational studies[J]. Aging (Albany NY), 2020, 12(21): 21355-21375. DOI: 10.18632/aging.103881.
[19]DULMAN RS, WANDLING GM, PANDEY SC. Epigenetic mechanisms underlying pathobiology of alcohol use disorder[J]. Curr Pathobiol Rep, 2020, 8(3): 61-73. DOI: 10.1007/s40139-020-00210-0.
[20]ABBASI I, ABBASI F, WANG L, et al. Folate promotes S-adenosyl methionine reactions and the microbial methylation cycle and boosts ruminants production and reproduction[J]. AMB Express, 2018, 8(1): 65. DOI: 10.1186/s13568-018-0592-5.
[21]LEE TY, CHIANG EP, SHIH YT, et al. Lower serum folate is associated with development and invasiveness of gastric cancer[J]. World J Gastroenterol, 2014, 20(32): 11313-11320. DOI: 10.3748/wjg.v20.i32.11313.
[22]ALKAN A, M1ZRAK D, UTKAN G. Lower folate levels in gastric cancer: is it a cause or a result?[J]. World J Gastroenterol, 2015, 21(13): 4101-4102. DOI: 10.3748/wjg.v21.i13.4101.
[23]LINHART HG, TROEN A, BELL GW, et al. Folate deficiency induces genomic uracil misincorporation and hypomethylation but does not increase DNA point mutations[J]. Gastroenterology, 2009, 136(1): 227-235. DOI: 10.1053/j.gastro.2008.10.016.
[24]TU M, FAN X, SHI J, et al. 2-Fluorofucose attenuates hydrogen peroxide-induced oxidative stress in HepG2 cells via Nrf2/keap1 and NF-κB signaling pathways[J]. Life (Basel), 2022, 12(3): 406. DOI: 10.3390/life12030406.
[25]CUCARULL B, TUTUSAUS A, HERNEZ-ALSINA T, et al. Antioxidants threaten multikinase inhibitor efficacy against liver cancer by blocking mitochondrial reactive oxygen species[J]. Antioxidants (Basel), 2021, 10(9): 1336. DOI: 10.3390/antiox10091336.
[26]BARRERA G, CUCCI MA, GRATTAROLA M, et al. Control of oxidative stress in cancer chemoresistance: spotlight on Nrf2 role[J]. Antioxidants (Basel), 2021, 10(4): 510. DOI: 10.3390/antiox10040510.
[27]CHERN CL, HUANG RF, CHEN YH, et al. Folate deficiency-induced oxidative stress and apoptosis are mediated via homocysteine-dependent overproduction of hydrogen peroxide and enhanced activation of NF-kappaB in human Hep G2 cells[J]. Biomed Pharmacother, 2001, 55(8): 434-442. DOI: 10.1016/s0753-3322(01)00095-6.
[28]LAI KG, CHEN CF, HO CT, et al. Novel roles of folic acid as redox regulator: Modulation of reactive oxygen species sinker protein expression and maintenance of mitochondrial redox homeostasis on hepatocellular carcinoma[J]. Tumour Biol, 2017, 39(6): 1010428317702649. DOI: 10.1177/1010428317702649.
[29]CHAGAS CE, BASSOLI BK, de SOUZA CA, et al. Folic acid supplementation during early hepatocarcinogenesis: cellular and molecular effects[J]. Int J Cancer, 2011, 129(9): 2073-2082. DOI: 10.1002/ijc.25886.
[30]GUARIENTO AH, FURTADO KS, DE CONTI A, et al. Transcriptomic responses provide a new mechanistic basis for the chemopreventive effects of folic acid and tributyrin in rat liver carcinogenesis[J]. Int J Cancer, 2014, 135(1): 7-18. DOI: 10.1002/ijc.28642.
[31]MENCK K, HEINRICHS S, BADEN C, et al. The WNT/ROR pathway in cancer: From signaling to therapeutic intervention[J]. Cells, 2021, 10(1): 142. DOI: 10.3390/cells10010142.
[32]CHEN B, GU Y, SHEN H, et al. Borealin promotes tumor growth and metastasis by activating the Wnt/β-Catenin signaling pathway in hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2022, 9: 171-188. DOI: 10.2147/JHC.S336452.
[33]BRICAMBERT J, ALVES-GUERRA MC, ESTEVES P, et al. The histone demethylase Phf2 acts as a molecular checkpoint to prevent NAFLD progression during obesity[J]. Nat Commun, 2018, 9(1): 2092. DOI: 10.1038/s41467-018-04361-y.
[34]LOMBARDI R, IUCULANO F, PALLINI G, et al. Nutrients, genetic factors, and their interaction in non-alcoholic fatty liver disease and cardiovascular disease[J]. Int J Mol Sci, 2020, 21(22): 8761. DOI: 10.3390/ijms21228761.
[35]CHEW TW, JIANG X, YAN J, et al. Folate intake, MTHFR genotype, and sex modulate choline metabolism in mice[J]. J Nutr, 2011, 141(8): 1475-1481. DOI: 10.3945/jn.111.138859.
[36]GRZDA E, MATUSZEWSKA J, ZIARNIAK K, et al. Animal foetal models of obesity and diabetes - from laboratory to clinical settings[J]. Front Endocrinol (Lausanne), 2022, 13: 785674. DOI: 10.3389/fendo.2022.785674.
[37]XIA MF, BIAN H, ZHU XP, et al. Serum folic acid levels are associated with the presence and severity of liver steatosis in Chinese adults[J]. Clin Nutr, 2018, 37(5): 1752-1758. DOI: 10.1016/j.clnu.2017.06.021.
[38]YUAN SX, ZHOU WP. Progress and hot spots of comprehensive treatment for primary liver cancer[J]. Chin J Dig Surg, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776.
袁聲贤, 周伟平. 原发性肝癌综合治疗的进展和热点[J]. 中华消化外科杂志, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776.
[39]KOIRALA N, DAS D, FAYAZZADEH E, et al. Folic acid conjugated polymeric drug delivery vehicle for targeted cancer detection in hepatocellular carcinoma[J]. J Biomed Mater Res A, 2019, 107(11): 2522-2535. DOI:10.1002/jbm.a.36758.
[40]LI QJ, HE MK, CHEN HW, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: A randomized phase III trial[J]. J Clin Oncol, 2022, 40(2): 150-160. DOI: 10.1200/JCO.21.00608.
[41]LYU N, KONG Y, MU L, et al. Hepatic arterial infusion of oxaliplatin plus fluorouracil/leucovorin vs. sorafenib for advanced hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 60-69. DOI: 10.1016/j.jhep.2018.02.008.
[42]TRACEY SR, SMYTH P, BARELLE CJ, et al. Development of next generation nanomedicine-based approaches for the treatment of cancer: weve barely scratched the surface[J]. Biochem Soc Trans, 2021, 49(5): 2253-2269. DOI: 10.1042/BST20210343.
[43]JAIN P, HASSAN N, IQBAL Z, et al. Mesoporous silica nanoparticles: A versatile platform for biomedical applications[J]. Recent Pat Drug Deliv Formul, 2018, 12(4): 228-237. DOI: 10.2174/1872211313666181203152859.
[44]ZHANG YL, XUE G, MIAO H, et al. Folic acid supplementation acts as a chemopreventive factor in tumorigenesis of hepatocellular carcinoma by inducing H3K9Me2-dependent transcriptional repression of LCN2[J]. Oncotarget, 2021, 12(4): 366-378. DOI: 10.18632/oncotarget.27136.
收稿日期:
2022-09-01;錄用日期:2022-10-20
本文编辑:葛俊
